
- •1. Значение амк:
- •4 . Трансаминирование аминокислот
- •5. Дезаминирование аминокислот
- •Прямое дезаминирование ак
- •6 Вопрос Связывание (обезвреживание) аммиака
- •8. Биологическая роль орнитинового цикла Кребса-Гензелейта
- •9. Пути обмена безазотистого остатка аминокислот
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
11 Вопрос
Обмен серина и глицина
Серин - заменимая аминокислота, синтезируется из промежуточного продукта гликолиза - 3-фосфоглицерата, а аминогруппу получает от глутаминовой кислоты.
Глицин - также заменимая аминокислота, основным источником которой служит серии. Реакцию синтеза глицина из серина катализирует фермент серин-оксиметилтрансфераза, кофермен-том которой является Н4-фолат.

Реакция превращения серина в глицин легко обратима. Основной путь катаболизма глицина у человека и других позвоночных также связан с использованием Н4-фолата.
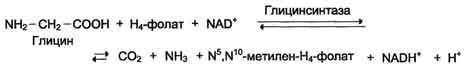
Эта реакция обратима и катализируется глицинсинтазой - ферментным комплексом, похожим на пируватдегидрогеназный комплекс, и локализованным в митохондриях клеток печени.
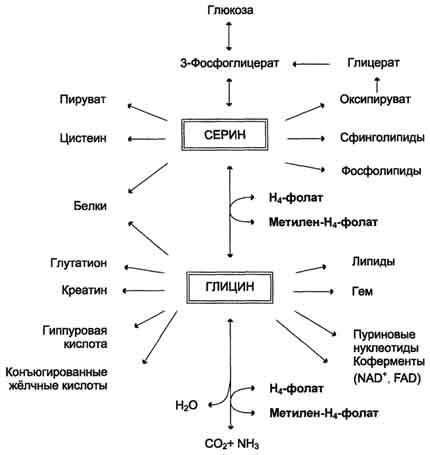
Роль фолиевой кислоты в обмене аминокислот
В превращениях серина и глицина главную роль играют ферменты, коферментами которых служат производные фолиевой кислоты. Этот витамин широко распространён в животных и растительных пищевых продуктах (см. раздел 3). Молекула фолиевой кислоты (фолата) состоит из 3 частей: птеринового производного, парааминобензойной и глутаминовой кислот (см. схему А на с. 496).
Коферментную функцию выполняет восстановленная форма фолата - тетрагидрофолиевая кислота (ТГФК или Н4-фолат).
Фолиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH.
Н4-фолат - акцептор β-углеродного атома серина.
12 Вопрос
Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции. Метальная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение.
Реакция активация метионина
Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ (см. схему А).
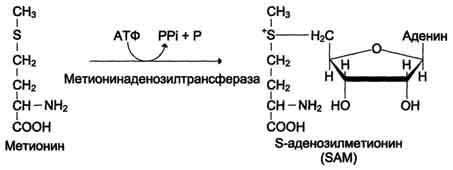
Схема А
Эту реакцию катализирует фермент метионинаденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ.
Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT).
Синтез фосфатидилхолина из фосфатидилэтиноламина
Фосфатидилхолины (лецитины) - наиболее распространённая группа глицерофосфолипидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов.
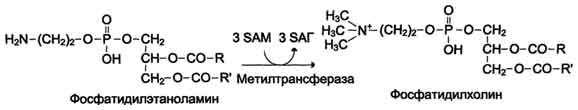
Схема Б
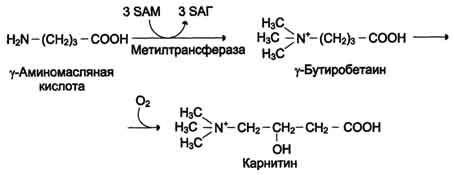
Синтез карнитина
Карнитин - переносчик жирных кислот через мембрану митохондрий.
Синтез креатина
Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы.
Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования.
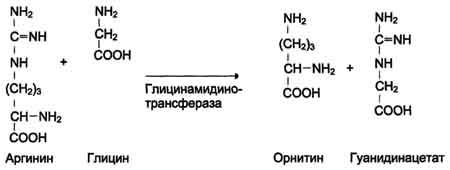
Схема Б


Схема В
Креатин с кровотоком переносится в мышцы и клетки мозга, где из него образуется высокоэнергетическое соединение - креатинфосфат. Эта реакция легко обратима и катализируется ферментом креатинкиназой. Фермент локализован в цитозоле и митохондриях клеток, обладает органоспецифичностью. В норме активность его в крови очень мала. Обнаружено три изоферментные формы креатинкиназы.

Схема A

12. Для синтеза цистеина необходимы 2 аминокислоты:
Серин - источник углеродного скелета;
Метионин - первичный источник атома S (см. схему А).
Синтез цистеина из гомоцистеина происходит в 2 стадии под действием пиридоксальзависимых ферментов цистатионинсинтазы и цис-татионинлиазы.
Окислительная реакция протекает либо с участием кофермента NAD+ под действием фермента цистеинредуктазы, либо неферментативно. Дисульфидные связи стабилизируют пространственную структуру полипептидной цепи или связывают между собой 2 цепи (например, А- и В-цепи гормона инсулина). Очень многие белки и ферменты в активном центре содержат SH-группы, участвующие в катализе. При их окислении ферментативная активность падает. Восстановление SH-групп часто происходит с использованием глутатиона - атипичного трипептида, содержащего γ-глутаминовую кислоту, цистеин и глицин.
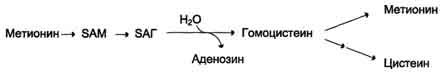
Схема А
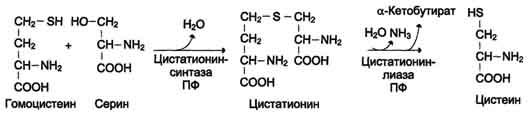
Схема Б
