
- •1. Значение амк:
- •4 . Трансаминирование аминокислот
- •5. Дезаминирование аминокислот
- •Прямое дезаминирование ак
- •6 Вопрос Связывание (обезвреживание) аммиака
- •8. Биологическая роль орнитинового цикла Кребса-Гензелейта
- •9. Пути обмена безазотистого остатка аминокислот
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
8. Биологическая роль орнитинового цикла Кребса-Гензелейта
Орнитиновый цикл в печени выполняет 2 функции:
• превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
• синтез аргинина и пополнение его фонда в организме.
Регуляторные стадии процесса - синтез карбамоилфосфата, синтез цитруллина и заключительная стадия, катализируемая аргиназой. Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Запас мощности необходим для избежания гипераммониемии при изменениях количества белка в пище. Увеличение скорости синтеза мочевины происходит при длительной физической работе или длительном голодании, которое сопровождается распадом тканевых белков. Некоторые патологические состояния,
Взаимосвязь орнитинового цикла и общего пути катаболизма. Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК и дегидрируется с образованием оксалоацетата. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины.
характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла.
При избыточном белковом питании количество ферментов орнитинового цикла в печени увеличивается, что приводит к интенсификации синтеза мочевины.
9. Пути обмена безазотистого остатка аминокислот
В ходе катаболизма аминокислот происходит отщепление аминогруппы и выделение аммиака. Другим продуктом дезаминирования аминокислот служит их безазотистый остаток в виде α-кетокислот. Катаболизм аминокислот происходит практически постоянно. За сутки в норме в организме человека распадается примерно 100 г аминокислот, и такое же количество должно поступать в составе белков пищи.
Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируваткиназы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2 и Н2О с выделением энергии. Такой путь проходят преимущественно аминокислоты пищи.
При недостатке глюкозы в организме фосфоенолпируват включается в глюконеогенез (см. раздел 7). Это происходит при голодании, длительной физической работу при сахарном диабете и других тяжёлых хронических заболеваниях, сопровождающихся распадом собственных белков организма. Скорость глюконеогенеза из аминокислот регулируется гормонами. Так, под действием глюкагона увеличивается активность регуляторных ферментов процесса, а кортизол индуцирует синтез ферментов глюконеогенеза в печени. Активация глюконеогенеза из аминокислот происходит и при преимущественно белковом питании.
А. Гликогенные и кетонные аминокислоты
Таблица 9-5. Классификация аминокислот по судьбе безазотистого остатка
Гликогенные аминокислоты |
Гликокетогенные аминокислоты |
Кетогенные аминокислоты |
Алании |
Тирозин |
Лейцин |
Аспарагин |
Изолейцин |
Лизин |
Аспартат |
Фенилаланин |
|
Глицин |
Триптофан |
|
Глутамат |
|
|
Глутамин |
|
|
Пролин |
|
|
Серии |
|
|
Цистеин |
|
|
Аргинин |
|
|
Гистидин |
|
|
Валин |
|
|
Метионин |
|
|
Треонин |
|
|
Б. Анаплеротические реакции
Безазотистые остатки аминокислот используются для восполнения того количества метаболитов общего пути катаболизма, которое затрачивается на синтез биологически активных веществ. Такие реакции называют анаплеротическими. На рисунке 9-22 выделены пять анаплеротических реакций. Реакции 2, 3 происходят во всех тканях (кроме печени и мышц), где отсутствует пируваткарбоксилаза, а реакции 4 и 5 - в основном в печени. Реакции 1 и 3 (рис. 9-22) - основные анаплеротические реакции.

10. В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Углеродный скелет этих аминокислот образуется из глюкозы. α-Аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования.Универсальным донором α-аминогруппы служит глутамат.
Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты (см. схему А на с. 492).

Глутамат также образуется при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой.
Эти реакции обратимы и играют большую роль как в процессе синтеза аминокислот, так и при их катаболизме. Такие реакции, выполняющие двойную функцию, называют амфиболическими.

Рис. 9-23. Пути биосинтеза заменимых аминокислот.
Амиды глутамин и аспарагин синтезируются из соответствующих дикарбоновых аминокислот Глу и Асп.
Серин образуется из 3-фосфоглицерата - промежуточного продукта гликолиза, который окисляется до 3-фосфопирувата и затем трансаминируется с образованием се-рина
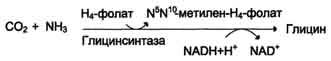
Существует 2 пути синтеза глицина:
1) из серина с участием производного фолиевой кислоты в результате действия се-риноксиметилтрансферазы:
2) в результате действия фермента глицинсинтазы в реакции:
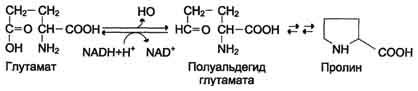
Пролин синтезируется из глутамата в цепи обратимых реакций. Эти же реакции используются и при катаболизме пролита (см. схему В на с. 494).
Кроме восьми перечисленных заменимых аминокислот, в организме человека могут синтезироваться ещё четыре аминокислоты.
Частично заменимые аминокислоты Apr и Гис синтезируются сложным путём в небольших количествах. Большая их часть должна поступать с пищей.
Синтез аргинина происходит в реакциях орнитинового цикла (см. выше подраздел IV);
Гистидин синтезируется из АТФ и рибозы. Часть имидазольного цикла гистидина - N=CH-NH- образуется из пуринового ядра аденина, источником которого служит АТФ, остальная часть молекулы - из атомов рибозы. При этом образуется 5-фосфорибозиламин, который кроме синтеза гистидина необходим для синтеза пуринов.
Для синтеза условно заменимых аминокислот тирозина и цистеина требуются незаменимые аминокислоты фенилаланин и метионин соответственно (см. подразделы VIII и IX).
Образование других аминокислот также возможно при наличии соответствующих α-кетокислот, которые могут трансаминироваться с глутаматом. Таким образом, незаменимой частью молекулы аминокислот является их углеродный скелет. Источником таких незаменимых ос-кетокислот служат только белки пищи. Исключение составляют лизин и треонин, которые не подвергаются трансаминированию, их а-кетоаналоги с пищей практически не поступают и в организме не синтезируются. Единственный источник этих аминокислот - пищевые белки.
