
- •1. Значение амк:
- •4 . Трансаминирование аминокислот
- •5. Дезаминирование аминокислот
- •Прямое дезаминирование ак
- •6 Вопрос Связывание (обезвреживание) аммиака
- •8. Биологическая роль орнитинового цикла Кребса-Гензелейта
- •9. Пути обмена безазотистого остатка аминокислот
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
6 Вопрос Связывание (обезвреживание) аммиака
Для удаления аммиака из организма используются следующие методы: 1. включение его в состав мочевины в печени и выведение ее с мочой, 2. удаление почками в виде аммонийных солей.
Так как аммиак вещество токсичное, то сначала в тканях (!) происходят реакции его обезвреживания (временного связывания) для переноса в печень и почки: синтез глутаминовой кислоты, глутамина, и синтез аспарагина.
Синтез глутаминовой кислоты– взаимодействие α-кетоглутарата с аммиаком. Кофермент - НАДФН. Идёт почти во всех тканях, кроме мышечной

Синтез глутамина – взаимодействие глутамата с аммиаком. Это главный способом связывания аммиака, активно проходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях
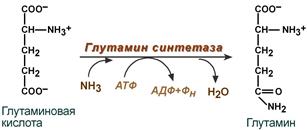
Глутамин проникает через клеточные мембраны путем облегченной диффузии, легко попадает в гепатоциты и в другие клетки, где есть потребность в аминогруппах. Азот, переносимый глутамином, используется клетками для синтеза пуринового кольца и гуанозинмонофосфата (ГМФ), синтеза цитидинтрифосфата (ЦТФ), аспарагина, глюкозамино-6-фосфата (предшественник аминосахаров).
Синтез
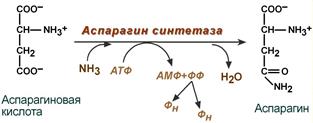
аспарагина – взаимодействие аспартата
с аммиаком. Это второстепенный
способ связывания аммиака,
энергетически
невыгоден, т.к. при этом тратятся 2
макроэргические связи.
Совокупность основных процессов обмена аммиака в организме представлена на рис. 9-14. Доминирующими ферментами в обмене аммиака служат глутаматдегидрогеназа и глутаминсинтетаза.

Рис. 9-14. Обмен аммиака.
Основной источник аммиака — аминокислоты. Большая часть образовавшегося аммиака обезвреживается в орнитиновом цикле в печени и выделяется в виде мочевины. Основной реакцией обезвреживания аммиака в тканях является синтез глутамина, который затем используется в анаболических процессах и для обезвреживания веществ в печени. Ферменты глутаматдегидрогеназа и глутаминсинтетаза являются регуляторными и обусловливают скорость процессов образования и обезвреживания аммиака. Транспортные формы аммиака из тканей в печень глутамин, аланин, в меньшей степени- аспарагин и глутамат, некоторое количество аммиака находится в крови в свободном виде. Доля глутамина и аланина в крови составляет до 50% от всех АК. Большая часть глутамина поступает от мышц и нервной ткани, аланин переносит аминный азот от мышц и стенки кишечника.
ГЛЮКОЗО-АЛАНИНОВЫЙ ЦИКЛ. В мышцах основным акцептором лишнего азота аминокислот является ПВК. При катаболизме белков в мышцах происходят реакции трансаминирования аминокислот c альфа- кетоглутаратом, образуется глутамат, который далее передает азот на ПВК, образуется аланин. Из мышц с кровью аланин переносится в печень, где в обратной реакции передает свою аминогруппу на глутамат. Полученная ПВК используется как субстрат в реакциях синтеза глюкозы, а глутаминовая кислота теряет аммиак, который идёт на мочевины.

Целевыми органами для транспорта аммиака являются печень, почки и кишечник. Практически весь аммиак удаляется из организма: 1. с мочой в виде мочевины, которая синтезируется в печени (Орнитиновый цикл). 2. в виде образующихся в эпителии канальцев почек солей иона аммония. 3. Выведение аммиака кишечником 4. Выведение аммиака с потом и выдыхаемым воздухом.
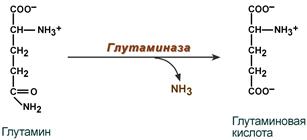
В клетки печени и почек аммиак попадает в составе глутамина и аспарагина, глутаминовой кислоты, аланина и в свободном виде. Аммиак образуется в большом количестве и в самих гепатоцитах. В клетке глутамин и аспарагин дезаминируются соответственно глутаминазой и аспарагиназой с образованием аммиака (точнее, иона аммония).
Аланин вступает в реакцию трансаминирования. Образованный в результате реакции ПВК идет в глюконеогенез или энергетический обмен. Параллельно образуется глутаминовая кислота. Глутаминовая кислота в гепатоците может появляться тремя путями: 1) из крови, 2) при дезаминировании глутамина, 3) при трансаминировании α-кетоглутарата с аспартатом или аланином. Происхождение и дальнейшая ее судьба зависит от конкретных концентраций всех задействованных веществ. Обычно далее глутамат дезаминируется глутаматдегидрогеназой с образованием аммиака.
Токсичность аммиака. 1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из ЦТ К, при этом понижается АТФ и ухудшается деятельность клеток. 2. Аммиак вызывает защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах (гипоксия клеток)
3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов – он конкурирует с ионными насосами для Na+ и K+. 4. глутамин – является осмотически активным веществом, приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть. 5. Использование α-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза γ-аминомасляной кислоты (ГАМК), тормозного медиатора нервной системы.
7. Мочевина - конечный продукт азотистого обмена, в составе которого из организма выводится избыток аммиака. Экскреция мочевины в норме составляет -25 г/сут. Синтез мочевины происходит только в печени (рис. 9.10).
Содержание мочевины в сыворотке крови в норме составляет 2,5-8,4 мМ/л (15-50 мг/дл).
Катаболизм аминокислот и образование аммиака происходит во многих тканях. Азот из тканей транспортируется в печень в составе трех соединений: глутамина, аланина и аммиака.
Полный набор ферментов цикла синтеза мочевины есть только в гепатоцитах. Первые две реакции протекают в митохондриях, а последующие три - в цитозоле.
Молекула мочевины (карбамида, двойного амида угольной кислоты) содержит два атома азота:
• первая аминогруппа (ем. рис. 9.10) включается в цикл в виде аммиака, образующегося в митохондриях гепатоцитов при дезаминировании аминокислот или поступающего из крови. Реакцию катализирует митохондриальная карбамоилфосфатсинтетаза I (цитоплазматическая карбамоилфосфатсинтетаза II участвует в синтезе пиримидиновых нуклеотидов);
|
• вторая аминогруппа (см. рис. 9.10) вводится в молекулу мочевины из аспартата.
2. Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень, главным образом, из кишечника с кровью воротной вены.Роль других источников, в том числе окислительного дезаминирования глутамата и гидролиза глутамина в печени, существенно меньше.
 Рис.
9.10. Орнитиновый цикл Кребса-Гензелейта.
Рис.
9.10. Орнитиновый цикл Кребса-Гензелейта.
Ферменты орнитинового цикла локализованы в митохондриях и цитозоле гепатоцитов. В цикле происходит трансмембранный перенос цитруллина и орнитина. На схеме показаны пути включения двух атомов азота из разных аминокислот в молекулу мочевины:
- азот одной аминогруппы - в виде аммиака в матриксе митохондрии (*N);
- азот второй аминогруппы поставляется в составе аспартата в цитозоле (**N)
Аспартат, необходимый для синтеза аргининосукцината, образуется в печени:
• преимущественно с использованием аминогруппы аланина, который поступает из мышц и клеток кишечника (рис. 9.11); • путем трансаминирования глутамата с оксалоацетатом. Образующийся в орнитиновом цикле фумарат включается в реакции цитратного цикла и превращается в оксалоацетат, который путем трансаминирования снова образует аспартат (см. рис. 9.11). Таким образом, с орнитиновым циклом сопряжен цикл регенерации аспартата из фумарата. Пируват, образующийся в этом цикле, используется в ОПК или для глюконеогенеза.
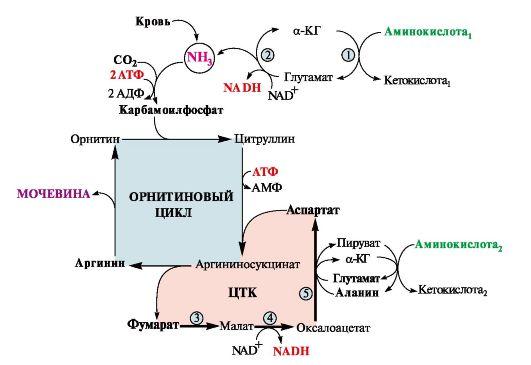 Рис.
9.11. Цикл регенерации аспартата.
Рис.
9.11. Цикл регенерации аспартата.
3. В орнитиновом цикле расходуется энергия четырех макроэргических связей трех молекул АТФ на синтез одной молекулы мочевины. Затраты энергии происходят также при трансмембранном переносе компонентов цикла (цитруллина, орнитина, мочевины) (см. рис. 9.10). В почках перенос мочевины из крови в мочу происходит за счет градиента ионов натрия, создаваемого К, Na-АТФазой, которая потребляет АТФ.
|
Процесс синтеза мочевины имеет возможность компенсации энергозатрат (см. рис. 9.11):
• при регенерации аспартата из фумарата на стадии дегидрирования малата образуется NADH, который может обеспечить синтез трех молекул АТФ; • при окислительном дезаминировании глутамата в разных органах также образуется NADH, соответственно - еще три молекулы АТФ.
4. Орнитиновый цикл в печени выполняет две функции:
• превращение азота аминокислот в мочевину, которая экскретируется и помогает избежать накопления аммиака в организме; • синтез аргинина и пополнение его фонда в организме.
Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Такой запас мощности необходим для предотвращения гипераммониемии при изменениях количества белка в пище.
5. Регуляторными реакциями являются синтез карбамоилфосфата, цитруллина и заключительная реакция, катализируемая аргиназой. Основным регуляторным фактором является содержание субстратов, прежде всего аммиака. Высокий уровень NH3 вызывает повышение уровня образования мочевины. Кроме того, скорость орнитинового цикла регулируется с помощью двух механизмов:
• аллостерическая активация карбамоилфосфатсинтетазы I N-ацетил- глутаматом (N-АГ);
• индукция синтеза ферментов карбамоилфосфатсинтетазы I, орнитинкарбамоилтрансферазы и аргиназы кортизолом.
N-ацетилглутамат является активатором карбамоилфосфатсинтетазы I. Образуется в матриксе митохондрий гепатоцитов из глутамата и ацетил-КоА специфической синтазой (рис. 9.12), которая активируется при повышении содержания аргинина в печени.
 Рис.
9.12. Регуляция карбамоилфосфатсинтетазы
I
Рис.
9.12. Регуляция карбамоилфосфатсинтетазы
I
Индукция синтеза
ферментов орнитинового цикла происходит
в ответ на повышение скорости распада
белков при голодании, длительной
физической работе и при высокобелковой
диете. В этих случаях углерод аминокислот
превращается в глюкозу, а азот включается
в молекулу мочевины. Индукция синтеза
ферментов орнитинового цикла происходит
параллельно с индукцией ферментов
глюконеогенеза, АЛТ и глутаматдегидрогеназы.
Заболевания, характеризующиеся
интенсивным распадом белков тканей
(сахарный диабет и др.), также сопровождаются
активацией орнитинового цикла.

