
4.1. Использование неорганического фосфата в процессе брожения
В процессе спиртового брожения, как и при гликолизе, происходит фосфоролитический распад углеводов и, как следствие, образование фосфорных эфиров гексоз, триоз в качестве промежуточных соединений и АТФ. При фосфорилировании связывается неорганический фосфат, концентрация которого в растворе снижается. О количестве неорганического фосфата судят по реакции образования комплексной фосфорно-молибденовой кислоты, которую затем восстанавливают в молибденовую синь.
Ход работы
1 г тщательно отмытых и высушенных пивных дрожжей растирают в ступке с 1 г тростникового сахара или глюкозы и 5 мл воды. Смесь количественно переносят в пробирку, добавляют 5 мл раствора фосфатов, тщательно перемешивают и сразу отмеривают 1 мл смеси, которую приливают в пробирку с 1 мл 10% раствора ТХУ (проба 1).
Добавление ТХУ приостанавливает брожение вследствие денатурации ферментов. Оставшуюся смесь помещают в термостат при 37С, затем через 30 минут (проба 2), один час (проба 3) и 1,5 часа (проба 4) берут по 1 мл инкубационной смеси и переносят в пронумерованные пробирки, содержащие по 1 мл раствора ТХУ. Каждую пробу фильтруют, в полученных безбелковых фильтратах определяют содержание неорганического фосфата.
Определение неорганического фосфата. Из каждой пробы отмеривают по 0,5 мл безбелкового фильтрата в пронумерованные пробирки, добавляют 1 мл раствора молибдата аммония и 0,5 мл раствора аскорбиновой кислоты, затем приливают 8 мл дистиллированной воды, все перемешивают и оставляют при комнатной температуре для развития синей окраски. Через 15 минут сравнивают интенсивность синей окраски во всех пробах, колориметрируя на ФЭКе с красным светофильтром (длина волны 590-650 нм) в кюветах с толщиной слоя 10 мм против дистиллированной воды.
Оптическую плотность раствора в пробе 1 условно принимают за 100% и рассчитывают процентное содержание фосфата в остальных пробах по отношению к пробе 1. На основании полученных данных строят график, откладывая на оси ординат процентное содержание фосфата в среде, а по оси абсцисс - время инкубации.
4.2. Количественное определение пировиноградной кислоты в моче колориметрическим методом (по Умбрайту)
Пировиноградная кислота (ПВК) – один из центральных метаболитов углеводного обмена. Она образуется в процессе распада гликогена и глюкозы в тканях, при дегидрировании молочной кислоты, а также в результате превращения некоторых аминокислот. Образованная любым из перечисленных способов ПВК может быть использована как один из основных субстратов глюконеогенеза (синтеза глюкозы из неуглеводных компонентов), принимает участие в синтезе N-ацетилнейраминовой кислоты, при окислительном декарбоксилировании ее образуется ацетил-КоА, который может быть использован как субстрат для синтеза жирных кислот, стероидов, ацетилхолина, или вступает в цикл Кребса, где окисляется до СО2 и Н2О, что обеспечивает клетку энергией в форме АТФ. Кроме того, ПВК оказывает большое влияние на протекание процесса обмена веществ в центральной нервной системе.
В норме содержание ПВК в крови составляет 0,4-0,8 мг% (0,031-0,1 ммоль/л); за сутки с мочой выделяется 10-25 мг.
Принцип метода определения пирувата в моче заключается в том, что он с кислым раствором 2,4-динитрофенилгидразина образует окрашенное соединение - 2,4-динитрофенилгидразон, хорошо растворимый в толуоле. При добавлении к толуоловому экстракту спиртового раствора щелочи появляется оранжевое окрашивание, интенсивность которого пропорциональна концентрации пировиноградной кислоты.
Ход работы
К 1,0 мл разведенной в 2 раза мочи добавляют 0,5 мл 0,1% раствора 2,4-динитрофенилгидразина, а через 5 минут - 3,0 мл водонасыщенного толуола. Содержимое пробирки встряхивают в течение 1 минуты и оставляют стоять до расслоения толуола и воды. Из верхнего толуолового слоя отбирают пипеткой 1,5 мл жидкости и переносят в чистую пробирку. К пробе добавляют 3,0 мл 2,5% спиртового раствора едкого калия и оставляют стоять для развития окраски. Через 10 минут ее фотометрируют на ФЭКе с синим светофильтром в кювете с толщиной слоя 10 мм против контрольной пробы, которая содержит 1,0 мл воды вместо исследуемой мочи. Все реактивы в контрольную пробу добавляются в том же количестве, что и в опытную.
Содержание ПВК рассчитывают по калибровочному графику, который строится по стандартному раствору пирувата натрия.
Построение калибровочного графика. Вначале приготовляют из основного стандартного раствора пирувата натрия ряд рабочих разведений, для чего в шесть пробирок вносят соответственно 0,1, 0,2, 0,3, 0,4, 0,5 и 0,6 мл его и доводят дистиллированной водой до 10 мл. Таким образом получают растворы с концентрацией пировиноградной кислоты 20, 40, 60, 80, 100 и 120 мкг в 1 мл. Затем полученные стандартные растворы пирувата обрабатываются так же, как и опытные. На оси ординат графика откладывают значения оптической плотности стандартных растворов пировиноградной кислоты (Е), на оси абсцисс соответствующее им содержание пировиноградной кислоты (мкг/мл).
Для расчета количества выделяемой за сутки пировиноградной кислоты (А), найденное по калибровочному графику ее количество (Б) умножают на суточный диурез (количество суточной мочи), который составляет в среднем 1500 мл. Для пересчета количества пирувата из мкг/сут в мг/сут, вычисленную величину А умножают на 1000: А (мг/ сут) = Б 1500 1000.
Содержание ПВК в крови и выведение ее с мочой увеличиваются при гипоксических состояниях, вызванных тяжелой сердечно-сосудистой, легочной недостаточностью, анемиями; при злокачественных новообразованиях, остром гепатите и других заболеваниях печени (наиболее выражено в терминальных стадиях цирроза печени), токсикозах, сахарном диабете, уремиях, гиперфункции гипофизарно-адреналовой и симпатико-адреналовой системы, при больших физических нагрузках, тетании, судорогах, В1-витаминной недостаточности. Все факторы, обусловливающие подъем концентрации ПВК, обычно приводят и к возрастанию уровня молочной кислоты в крови и моче.
Снижение концентрации ПВК в крови и ее экскреции с мочой обнаруживается редко. Этот симптом сопровождает наследственные заболевания мышечной системы – мышечные формы гликогенозов (болезнь Мак-Ардля, Тэрье и др.).
5. СОСТАВЛЕНИЕ ОТЧЕТА
Отчет составляется с указанием цели, задания, включает уравнения протекания реакций, экспериментальные данные и выводы.
6. ВОПРОСЫ ДЛЯ КОНТРОЛЯ
6.1. В какие метаболические пути может вовлекаться глюкоза в клетке?
6.2. Какие пути катаболизма глюкозы Вы знаете? Какова их биологическая роль?
Что такое дихотомический путь катаболизма глюкозы?
Какие мультиферментные комплексы составляют суть дихотомического пути окисления глюкозы? В какой форме выделяется энергия в этом пути катаболизма глюкозы?
Что такое апотомический путь катаболизма глюкозы? В какой форме выделяется при этом энергия? Какова ее дальнейшая судьба?
Что такое брожение? Какие виды брожения Вы знаете? В чем их отличие друг от друга?
Возможно ли окисление глюкозы в отсутствии кислорода? В чем биологический смысл этого процесса?
Что такое гликолиз и гликогенолиз? В чем их отличие друг от друга?
Возможно ли протекание гликолиза в присутствии кислорода? В чем отличие анаэробного и аэробного гликолиза?
Какова судьба пировиноградной кислоты при: а) анаэробном гликолизе; б) аэробном гликолизе; в) спиртовом брожении?
Что является конечным продуктом спиртового брожения? Какие приемы используются для фиксации интенсивности брожения?
В чем заключается принцип метода определения использования неорганического фосфата в процессе брожения? Как изменяется концентрация неорганических фосфатов при этом?
Каков принцип количественного определения ПВК в сыворотке крови и моче? Клинико-диагностическое значение определения ПВК в моче.
Тема: РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ГЛЮКОЗЫ. ПАТОЛОГИЯ УГЛЕВОДНОГО ОБМЕНА
1. ЦЕЛЬ
Изучить качественные реакции и состав углеводов.
2. ЗАДАЧИ
2.1. Количественное определение сахара в крови по методу Хагедорна-Йенсена
2.2. Сделать выводы и оформить отчет.
3. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Основным углеводом в крови человека является глюкоза. Уровень глюкозы в крови практически здоровых людей поддерживается в относительно постоянных пределах благодаря действию сложных физиологических механизмов нейрогуморальной регуляции, опосредующих свое влияние через ряд органов и тканей, прежде всего печень.
Содержание глюкозы в крови во многом зависит от особенностей ее обмена, складывающегося из процессов поступления углеводов в организм, их метаболизма на уровне клеток и тканей, а также процессов выделения.
Метаболизм глюкозы на уровне клеток и тканей во многом зависит от особенностей гормонального статуса организма человека. Из факторов эндокринной регуляции в поддержании гомеостаза глюкозы в крови основная роль отводится инсулину – гормону поджелудочной железы, который, способствуя проникновению глюкозы через клеточные мембраны миоцитов и адипоцитов, усиливает тем самым поступление глюкозы из крови в ткани, где происходит либо ее окисление, либо отложение в виде гликогена, либо превращение в жиры. Кроме того, инсулин ингибирует все процессы, которые поставляют глюкозу в кровь, а именно гликогенолиз и глюконеогенез в печени. Таким образом, инсулин является единственным гормоном, приводящим к снижению уровня гликемии.
Глюкагон, адреналин, кортизол и его аналоги, тиреоидные гормоны, соматотропин, кортикотропин, тиреотропин являются антагонистами инсулина и поэтому носят название контринсулярных гормонов. Механизм их воздействия на углеводный обмен представлен в таблице 1.
Гормоны, участвующие в гомеостазе глюкозы и механизм их действия Таблица 1.
Гормон |
Основное действие |
Клетки-мишени |
Инсулин |
Увеличивает захват глюкозы клеткой гликогенез Уменьшает глюконеонегез гликогенолиз |
Миоциты, адипоциты Миоциты, гепатоциты Гепатоциты Гепатоциты |
Глюкагон |
Увеличивает гликогенолиз Глюконеогенез |
Гепатоциты Гепатоциты |
Адреналин |
Увеличивает гликогенолиз |
Гепатоциты, миоциты |
Соматотропин |
Увеличивает гликогенолиз |
Гепатоциты |
Кортизол |
Увеличивает глюконеогенез Уменьшает захват глюкозы клеткой |
Гепатоциты Периферические клетки |
Нормальный уровень глюкозы в крови составляет 3,33-5,55 ммоль/л, тогда как другие углеводы, такие как фруктоза, манноза, галактоза, лактоза и мальтоза обнаруживаются в следовых количествах. Помимо углеводов в крови содержится ряд редуцируюших веществ: глютатион, АДФ, мочевая кислота, эрготионин, креатинин, глюкуроновые кислоты, витамин С. Совокупность всех восстанавливающих веществ называется общим сахаром крови. Его колебания в норме составляют 4,44-6,66 ммоль/л.
Существует множество различных методов оценки уровня гликемии. К ним относят редуктометрические методы, основанные на свойстве глюкозы и других редуцирующих веществ восстанавливать ионы металлов в щелочной среде. К этим методам можно причислить и ставший уже «историческим» титриметрический способ Хагедорна-Йенсена, в котором используется способность альдогексозы восстанавливать при кипячении в щелочной среде железосинеродистый калий (красную кровяную соль) в железистосинеродистый калий (желтую кровяную соль). Ввиду того, что в плазме крови присутствует ряд соединений, не относящихся к углеводам, но обладающих восстанавливающими свойствами, определяемая с использованием редуктометрических методов концентрация сахара в крови оказывается значительно выше истинного уровня глюкозы, что относится к недостаткам этих методов детекции концентрации глюкозы. Наиболее специфичными и точными методами количественного определения глюкозы в крови являются колориметрические. В зависимости от химической природы аналитической реакции эти методы могут быть подразделены на ферментативные и неферментативные. Гораздо шире используются энзимные методы (в частности глюкозооксидазный), благодаря применению которых увеличивается специфичность метода. Неферментативные методы определения концентрации глюкозы в крови состоят в образовании окрашенных соединений, вследствие, либо ее способности восстанавливать некоторые химические вещества, либо свойству давать с определенными реактивами цветные комплексы, поглощающие свет в видимой области спектра. К последним относят ортотолуидиновый метод, достаточно точный и быстрый, позволяющий определить содержание истинной глюкозы.
4. ПРАКТИЧЕСКАЯ ЧАСТЬ
4.1. Количественное определение сахара в крови по методу Хагедорна-Йенсена
Принцип метода заключается в том, что в безбелковом фильтрате крови глюкозу окисляют железосинеродистым калием. Избыток последнего, не вступивший в реакцию с глюкозой, восстанавливают йодистым калием до свободного йода, который титруют гипосульфитом натрия. Количество сахара в крови вычисляют по данным титрования с помощью таблицы.
Ход работы
4.1.1. Приготовление гидроокиси цинка для осаждения белков. В 2 пронумерованные пробирки наливают по 5 мл 0,45% раствора сернокислого цинка и по 1 мл 0,1N раствора NaOH. Образуется студенистый осадок гидроокиси цинка.
4.1.2. Осаждение белка. 0,1 мл крови набирают микропипеткой и погружают пипетку до дна первой пробирки с гидроокисью цинка (опытной), осторожно выдувают кровь и промывают пипетку путем втягивания и выдувания жидкости. После чего тщательно перемешивают содержимое пробирки. Во вторую пробирку кровь не добавляют; она служит для контроля чистоты употребляемых реактивов. Обе пробирки ставят в кипящую водяную баню на 3 минуты и по истечении указанного времени их вынимают, охлаждают и фильтруют через небольшие кусочки ваты в пронумерованные сахарные стаканчики. После этого промывают вату 1 мл горячей дистиллированной воды и промывные воды переносят в те же стаканчики. Промывание повторяют три раза. Новую промывную воду наносят на ватный фильтр только после того, как профильтруется предыдущая.
4.1.3. Окисление глюкозы железосинеродистым калием. К фильтрату в каждый стаканчик приливают по 2 мл 0,05N раствора железосинеродистого калия. Стаканчики погружают в кипящую водяную баню на 15 минут для окисления глюкозы, после чего вынимают и охлаждают в бане с холодной водой.
4.1.4. Определение избытка железосинеродистого калия. В стаканчики наливают по 3 мл тройного раствора, содержащего йодистый калий, и по 2 мл 3% раствора уксусной кислоты. Жидкость приобретает желтую окраску вследствие появления свободного йода, который образуется в результате взаимодействия йодистого калия с избытком железосинеродистого калия.
Выделившийся йод титру
ют 0,05N раствором гипосульфита в присутствии 1-2 капель 1% раствора крахмала. Титрование производят медленно до обесцвечивания синей окраски жидкости. Чем больше сахара в крови, чем меньше будет избыток железосинеродистого калия, тем меньше выделится йода и тем меньше гипосульфита будет израсходовано на титрование (обратное титрование). В контрольной пробе, где сахара нет, а возможно только присутствие других редуцирующих веществ, на титрование должно пойти около 2 мл гипосульфита.
Результаты титрования записывают в таблицу 2.
Результаты опыта
Таблица 2.
№ пробы |
Количество гипосульфита, пошедшее на титрование, мл |
Количество сахара по таблице, мг |
Содержание сахара в крови |
|
мг% |
ммоль/л |
|||
1 |
|
|
|
|
2 |
|
|
|
|
При вычислении содержания сахара в исследуемой крови находят число, соответствующее количеству сахара в пробе (т.е. в 0,1 мл крови), выраженное в мг. Из количества сахара, найденного в опытной пробе, вычитают количество редуцирующих веществ, обнаруживаемое в контрольной пробе. Для определения содержания сахара крови в мг % полученный результат умножают на 1000. Для перехода от мг % к ммоль/л найденное значение умножают на 10 и делят на 180 (молекулярный вес глюкозы).
Определение сахара имеет важное клиническое значение, особенно при профессиональных заболеваниях, так как его количество в крови характеризует состояние углеводного обмена, функцию эндокринных желез, ЦНС, печени. Уровень сахара в крови, при котором он появляется во вторичной моче, называется почечным порогом (для глюкозы он равен 8,9 ммоль/л). При изучении концентрации глюкозы в крови или плазме пациента следует иметь в виду, что накануне этой процедуры пациент не должен принимать пищу во избежание пищевой (алиментарной) гипергликемии.
Увеличение концентрации глюкозы в крови (гипергликемия) наблюдается обычно при следующих состояниях:
1) сахарный диабет, острый панкреатит, панкреатические циррозы; эти заболевания обусловливают появление гипергликемии, связанной с недостатком инсулина в организме;
2) токсическое, травматическое и механическое раздражение центральной нервной системы; травмы, опухоли мозга, а также менингит, эпилепсия, отравление окисью углерода, синильной кислотой, эфиром, ртутью обусловливают так называемую центральную (нервную) гипергликемию;
3) усиление гормональной деятельности щитовидной железы, коры и мозгового слоя надпочечников, гипофиза;
4) обильный прием углеводов с пищей (алиментарная гипергликемия);
5) сильные эмоции и психическое возбуждение.
5. СОСТАВЛЕНИЕ ОТЧЕТА
Отчет составляется с указанием цели, задания, включает уравнения протекания реакций, экспериментальные данные и выводы.
Тема: ОБМЕН ЛИПИДОВ
1. ЦЕЛЬ
Изучить качественные реакции на липиды
2. ЗАДАНИЕ
2.1. Качественные реакции на липиды
2.2. Сделать выводы и оформить отчет.
3. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Под общим названием «липиды» объединяют большую группу нейтральных жиров и жироподобных веществ (или липоидов). Свойством, общим для всех этих соединений, является их растворимость в органических растворителях (бензоле, ацетоне, бензине, эфире) и не растворимость в воде.
По химической природе липиды делят на следующие группы: а) нейтральные жиры или триглицериды; б) высокомолекулярные жирные кислоты; в) фосфолипиды; г) цереброзиды; д) стерины и стериды; е) ганглиозиды; ж) воска и воскоподобные вещества.
Жиры – важный энергетический резерв организма (резервный жир). Они входят в состав протоплазмы клеток, являясь ее структурными компонентами. Содержание резервного жира в организме зависит от уровня и характера питания, количество протоплазматического жира не убывает даже при сильном голодании и не увеличивается при патологическом ожирении.
Липоидам принадлежит важная роль в процессах жизнедеятельности. Они встречаются во всех клетках и тканях организма, обычно сопутствуя жирам, особенно, их много в нервной системе. Липоиды концентрируются на периферии клеток, образуя полупроницаемые мембраны, избирательно регулирующие поступление веществ в клетку и их отток. Липиды в организме человека и животных образуют комплексные соединения с белками – липопротеиды.
Стерины входят в состав белого вещества головного мозга, участвуют в образовании ряда биологически активных веществ – витаминов, гормонов, желчных кислот.
Жиры – сложные эфиры глицерина и высокомолекулярных жирных кислот. В состав жиров входят многочисленные предельные (насыщенные) и непредельные (ненасыщенные) жирные кислоты.
Среди предельных кислот чаще всего встречаются стеариновая (С17Н35СООН) и пальмитиновая (С15Н31СООН). Из непредельных жирных кислот основная роль принадлежит олеиновой (С17Н33СООН), линолевой (С17Н31СООН) и линоленовой (С17Н29СООН), большое физиологическое значение имеет также арахидоновая кислота (С19Н31СООН).
Непредельные жирные кислоты характеризуются наличием двойных связей: в молекуле олеиновой кислоты содержится одна двойная связь, в молекуле линолевой - две двойные связи, в молекуле линоленовой кислоты - три двойные связи, в молекуле арахидоновой кислоты – 4 двойные связи.
Благодаря наличию двойных связей непредельные кислоты отличаются высокой реакционной способностью. Линолевая, линоленовая и арахидоновая (так называемые полиненасыщенные) кислоты не синтезируются в организме человека и должны поступать с пищей. Недостаток этих кислот в пище вызывает серьезные нарушения обмена веществ.
4. ПРАКТИЧЕСКАЯ ЧАСТЬ
4.1. Качественные реакции на жиры
Ход работы
Образование масляного пятна. Каплю масла наносят стеклянной палочкой на кусочек бумаги. Образуется пятно, не исчезающее при нагревании.
Растворимость жиров. Ставят 2 ряда пробирок по 4 в каждом.
В пробирки первого ряда вносят по нескольку капель растительного масла, в пробирки второго ряда – по кусочку твердого жира.
В первую пробирку каждого ряда наливают 2 мл дистиллированной воды.
Во вторую – столько же диэтилового эфира.
В третью – ацетона.
В четвертую – спирта.
Все пробирки взбалтывают и наблюдают растворимость жиров в различных растворителях. Пробирки со спиртом рекомендуется подогреть на водяной бане. Записывают результаты опыта.
Эмульгирование жирных масел.
В 4 пробирки вносят по 5 капель масла.
В первую пробирку добавляют 2 мл дистиллированной воды.
Во вторую – 2 мл 2%-ного раствора углекислого натрия (соды).
В третью – столько же 2%-ного раствора мыла.
В четвертую – 2 мл воды и несколько капель желчи.
Все пробирки взбалтывают и наблюдают образование в первой пробирке неустойчивой эмульсии масла в воде, быстро расслаивающейся при стоянии, а в остальных – устойчивой эмульсии благодаря действию добавленных эмульгаторов, которые адсорбируются в наружном слое жировых капель и понижают их поверхностное натяжение.
Акролеиновая
реакция.
С помощью пробы на акролеин определяют
наличие глицерина в жирах. При нагревании
жира с кислым сернокислым калием (KHSO4),
натрием (NaHSO4)
или борной кислотой (H3BO3)
происходит отщепление от молекулы
глицерина двух молекул воды и образование
акрилового альдегида, или акролеина,
обладающего резким раздражающим запахом.
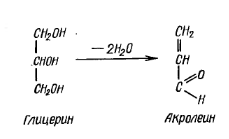
В сухую пробирку вносят несколько капель растительного масла или кусочек животного жира, добавляют немного порошка кислого сернокислого калия (или натрия) или борной кислоты и осторожно подогревают.
Появляются белые пары акролеина, обладающие резким раздражающим запахом. Повторяют реакцию с воском – акролеин не образуется, так как глицерин не входит в состав восков.
Омыление жира. При взаимодействии жиров со щелочами происходит их гидролиз с образованием солей высших жирных кислот (мыла) и глицерина. Натриевые соли представляют собой твердые мыла, калийные – жидкие.

В широкую пробирку вносят 0.5 мл растительного масла или 0.5 г животного жира и добавляют 10 мл спиртового раствора КОН. Пробирку закрывают пробкой с воздушным холодильником и нагревают на кипящей водяной бане в течение 30 минут, после чего в пробирку наливают горячую воду и растворяют в ней мыло.
Выделение свободных жирных кислот. К 5 мл раствора мыла добавляют 1-2 мл раствора соляной кислоты. При взаимодействии соляной кислоты с мылом выделяются свободные жирные кислоты, которые всплывают на поверхности жидкости.
Образование нерастворимых мыл. Кальциевые и магниевые соли жирных кислот не растворимы в воде. К 2-3 мл раствора калийного мыла добавляют 1 мл раствора хлористого кальция. Выпадает не растворимый в воде осадок стеарата кальция.
5. СОСТАВЛЕНИЕ ОТЧЕТА
Отчет составляется с указанием цели, задания, включает уравнения протекания реакций, экспериментальные данные и выводы.
6. ВОПРОСЫ ДЛЯ КОНТРОЛЯ
6.1. Строение липидов и жирных кислот?
6.2. Функции липидов?
6.3. Качественные реакции на липиды?
Тема: КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ГОРМОНЫ
1. ЦЕЛЬ
Изучить качественные реакции на гормоны.
2. ЗАДАНИЕ
2.1. Качественные реакции на инсулин (биуретовая реакция)
2.2. Качественные реакции на адреналин
2.3. Сделать выводы и оформить отчет.
3. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
К гормонам относятся вещества, вырабатываемые железами внутренней секреции, транспортируемые кровью к клеткам-мишеням и влияющие на метаболические, морфогенетические и физиологические процессы. Причем, сами гормоны не участвуют в метаболических реакциях, а являются их специфическими регуляторами. Гормонам присущи: 1) высокая биологическая активность (оказывают физиологическое действие в очень низких концентрациях 10-8-10-11 моль); 2) строгая специфичность; 3) дистантность действия.
В зависимости от химического строения гормоны делятся на три основные группы: белково-пептидные, производные аминокислот и стероидные. К первой группе гормонов относятся пептиды (кортикотропин, вазопрессин, глюкагон, либерины, статины), простые (инсулин, соматотропин, кальцитонин, паратгормон и др.) и сложные (гонадотропины, тиреотропин) белки. Гормонами производными аминокислот являются катехоламины и тиреоидные гормоны, образуемые при метаболизме тирозина, а также мелатонин, синтезируемый из триптофана. Половые гормоны (прогестины, андрогены и эстрогены), кортикоиды (глюко- и минералкортикоиды) и кальцитриол являются производными холестерина и относятся к стероидным гормонам.
Эндокринные железы своими секретами оказывают мощное воздействие на внутренние паренхиматозные органы, а также на другие эндокринные железы и ЦНС. В свою очередь, деятельность эндокринных желез не автономна, а находится под постоянным контролем коры и подкорковых центров регуляции, то есть ЦНС. На этом принципе базируется функционирование гипоталамо-гипофизарной системы.
Установлено, что секреция всех гормонов передней доли гипофиза (тропинов) находится под контролем веществ пептидной природы, образующихся в процессе нейросекреции в гипоталамусе, способных усиливать (либерины или рилизинг-факторы) или уменьшать (статины) образование тропных гормонов. Выброс гипоталамических гормонов осуществляется под влиянием нервного импульса, поступившего из различных отделов головного мозга. Образование и выделение тропинов в кровь приводит к возрастанию секреторной активности периферических желез внутренней секреции: коры надпочечников, щитовидной железы, половых желез. Гормоны, продуцируемые этими железами, оказавшись в крови в повышенном количестве, в свою очередь, воздействуют на гипоталамус, вызывая торможение образования и секреции в кровь тропных гормонов гипофиза. Наоборот, при низком уровне гормонов периферических эндокринных желез в крови этот тормозящий эффект снимается, что приводит к возрастанию секреции тропинов гипофизом («плюс»-«минус» взаимодействие, или отрицательная обратная связь). Кроме того, существует и прямой путь регуляции выработки гормонов нервной системой (например, образование адреналина в мозговом веществе надпочечников регулируется непосредственно нервными импульсами).
Влияние гормонов на процессы обмена веществ осуществляются различными путями, среди которых наиболее важными являются:
1) изменение проницаемости клеточных мембран;
2) повышение или угнетение активности ферментов;
3) регуляция процессов биосинтеза белков-ферментов на уровне транскрипции.
Поэтому различают следующие типы действия внеклеточных регуляторов, в том числе гормонов: мембранный, или локальный, мембранно-внутриклеточный, или косвенный, и внутриклеточный, или прямой.
Мембранный тип действия заключается в том, что гормон в месте связывания с рецептором на клеточной мембране изменяет ее проницаемость для различных соединений (глюкозы, аминокислот и некоторых ионов). В этом случае он выступает как аллостерический эффектор транспортных систем мембран. Поступление глюкозы и аминокислот изменяет биологические процессы в клетке, а изменение распределения ионов по обе стороны мембраны – электрический потенциал и функцию клеток. Мембранный тип действия гормонов редко встречается в изолированном виде. Например, инсулин обладает как мембранным, так и мембранно-внутриклеточным типом действия. Последний характерен для гормонов и других внеклеточных регуляторов, которые не проникают в клетку, и поэтому оказывают действие на обмен веществ через внутриклеточный химический посредник (цАМФ, цГМФ, ионы Са2+, диацилглицерол, инозитолтрифосфат), являющийся своеобразным «полномочным представителем» гормона внутри клетки. Связывание водорастворимых гормонов с рецептором, локализованном в наружной плазматической мембране клеток, приводит к изменению активности некоторых ферментов (аденилатциклазы, гуанилатциклазы, фосфолипазы С). Большая часть молекулярных форм этих ферментов находится в липидном слое мембраны в неактивном состоянии. Активация указанных энзимов способствует образованию вторичных внутриклеточных посредников, под влиянием которых происходит изменение активности протеин киназ, вызывающих фосфорилирование различных белков и ферментов.
Цитозольный или внутриклеточный тип действия свойственен гормонам, способным проникать через липидный бислой плазматической мембраны, т. е. по своим физико-химическим свойствам относящимся к липофильным веществам (стероиды, тиреоидные гормоны). Рецепторы для таких гормонов локализуются в цитоплазме или ядре клетки. Взаимодействуя со специфическим внутриклеточным рецептором, гормон образует комплекс, который проникает в ядро клетки и оказывает влияние на генетическом уровне, усиливая, или наоборот, тормозя процессы транскрипции и трансляции (такие гормон-рецепторные комплексы выступают в качестве корепрессоров или индукторов образования нуклеиновых кислот). Результатом этих воздействий на клетку является глубокая длительная перестройка клеточного метаболизма.
Гормоны являются частью эндокринной системы, в которую помимо них входят эндокринные железы, продуцирующие гормон и соответствующие органы или ткани-мишени, отвечающие на его действие и обеспеченные нормальным рецепторным и пострецепторным аппаратом. Нарушение любого из составляющих эндокринной системы может привести к возникновению эндокринного заболевания. Например, сахарный диабет может вызываться отсутствием или снижением секреции поджелудочной железой гормона инсулина (инсулинзависимый сахарный диабет – ИЗСД), или нарушением клеточного ответа на возрастание его уровня в крови (инсулиннезависимый сахарный диабет – ИНСД).
Нарушение функции эндокринных желез может состоять как в гипопродукции соответствующего гормона, так и в его гиперпродукции. Например, снижение выработки соматотропина сопровождается развитием гипофизарного нанизма (карликовости), тогда как гиперсекреция данного гормона приводит к развитию гигантизма (у детей) или акромегалии (у взрослых).
4. ПРАКТИЧЕСКАЯ ЧАСТЬ
4.1. Качественные реакции на инсулин (биуретовая реакция)
Ход работы
Инсулин является белком, состоящим из 2-х полипептидных цепей А и Б, соединенных между собой дисульфидными мостиками. Разрыв этих дисульфидных мостиков приводит к потере инсулином гормональной активности. Цепь А содержит 21 аминокислотный остаток, цепь Б – 30 аминокислотных остатков. Биосинтез инсулина происходит в β-клетках островков Лангерханса из проинсулина, состоящего из одной полипептидной цепи, содержащей 84 аминокислотных остатка, путем разрыва этой цепи в двух точках с отщеплением соединяющего пептида, включающего 33 остатка аминокислот.
Основные функции инсулина в организме:
увеличивает проницаемость мембран жировых и мышечных клеток по отношению к глюкозе, где она окисляется до СО2 и Н2О с выделением энергии или используется для синтеза гликогена и жиров
активирует синтез гексокиназы (глюкокиназы) печени, фермента, катализирующего фосфорилирование глюкозы
усиливает синтез из глюкозы гликогена и жиров
замедляет окисление жирных кислот
тормозит глюконеогенез (превращение белков в глюкозу) путем подавления синтеза ключевых ферментов этого процесса.
Все эти явления инсулина вызывают понижение сахара в крови – гипогликемию. Напротив, недостаток инсулина, как это наблюдается при заболевании сахарным диабетом, приводит к гипергликемии (повышению концентрации глюкозы в крови), последующей глюкозурии (выделению глюкозы с мочой) и появлению кетоновых тел в моче (образующихся вследствие окисления жирных кислот).
