
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
Федеральное государственное бюджетное образовательное
учреждение высшего профессионального образования
«Национальный исследовательский ядерный университет«МИФИ»
ОБНИНСКИЙ ИНСТИТУТ АТОМНОЙ ЭНЕРГЕТИКИ
Медицинский факультет
Ю.В. МИНКИНА
учебно-методическое пособие для подготовки студентов к практическим занятиям по биологической химии
для студентов II курса специальности «Лечебное дело»
Часть II
Рекомендовано к изданию
Редакционно-издательским советом института
Обнинск 2012
Рецензенты
Минкина Ю.В.
Биохимия. Лабораторный практикум для студентов II курса медицинского факультета специальности 060101 – Лечебное дело / Сост. Ю.В. Минкина – Обнинск. 68 с.
Учебное пособие является руководством по выполнению лабораторных работ по биохимии. Оно включает работы, охватывающие основные разделы теоретического курса как статической, так и динамической биохимии. Перед каждой работой дается краткая теоретическая часть, необходимая для понимания эксперимента, приведены формулы и реакции.
Введение
Практикум по биохимии разработан в соответствии с рабочей программой дисциплины «Биохимия» для студентов II курса медицинского факультета по специальности «лечебное дело» на основе государственных стандартов. Он включает в себя лабораторные работы, которые охватывают основные разделы изучаемого курса статической и динамической биохимии: простые и сложные белки, ферменты, липиды, витамины, углеводы и продукты их расщепления в организме.
Для выполнения лабораторных работ по биологической химии студенты должны обладать определенными экспериментальными навыками: уметь взвешивать на аналитических весах, измерять объемы жидкостей, проводить титрование, работать с приборами, используемыми в физико-химических исследованиях. Студенты должны уметь строить графики и обсчитывать результаты измерения.
Тема: ОБМЕН УГЛЕВОДОВ
1. ЦЕЛЬ
Изучить качественные реакции и состав углеводов.
2. ЗАДАЧИ
2.1. Качественные реакции на моносахариды
2.2. Качественные реакции на дисахариды
2.3. Качественные реакции на полисахариды
2.4. Количественное определение крахмала
2.5. Выделение гликогена из печени. Качественные реакции на гликоген
2.6. Качественные реакции на гликоген
2.7.Сделать выводы и оформить отчет.
3. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Углеводами называют альдегиды и кетоны многоатомных спиртов и их полимеры. В биосфере углеводов больше, чем других органических соединений, вместе взятых. В растительном мире на их долю приходится 80-90% сухой массы.
В животном организме углеводов содержится около 2% массы тела. Функции углеводов разнообразны. Они являются основными поставщиками энергии. Главным источником энергии является глюкоза, которая, окисляясь в процессе дыхания или брожения, выделяет заключенную в ней энергию и обеспечивает значительную часть потребности организма в ней.
Углеводы входят как составная часть в различные структурно-функциональные компоненты клетки. В виде гликозаминогликанов углеводы включаются в состав межклеточного матрикса. Большое число белков (ферменты, белки-транспортеры, белки-рецепторы, гормоны и т. д.) являются гликопротеинами. Углеводы участвуют в построении иммуноглобулинов, используются для синтеза нуклеиновых кислот и входят в состав коферментов. Углеводы выполняют также функции запасных питательных веществ. Они способны откладываться в организме в виде гликогена (у человека и животных) и крахмала (у растений), которые расходуются по мере надобности. В составе гликогена клетки запасают такое количество энергии, которое соответствует примерно 2000 ккал, так как в организме человека синтезируется не менее 500 г этого полисахарида.
Значение углеводов в жизни животных и растений весьма велико. Оно сводится не только к энергетической и структурным функциям.
Углеводы выполняют в живых организмах и ряд специализированных ролей. Так, пентозы рибоза и дезоксирибоза входят в состав важнейших биологически активных веществ – нуклеиновых кислот, нуклеотидов и нуклеозидов. Углеводы являются важными составными частями молекул многих антибиотиков (стрептомицинов, неомицинов, линкомицина, новобиоцина и др.). Они играют важную роль в явлениях иммунитета: многие микробные антигены, вызывающие образование антител, относятся к углеводам (полисахаридам). В качестве антител выступают гликопротеиды – комплексные соединения углеводов с белками.
Наличие групп крови также связано с гликопротеидами, особенно с их углеводными остатками. Наконец, следует подчеркнуть, что вещества, обладающие исключительно важным физиологическим значением, как антикоагулянт гепарин, гиалуроновая кислота, играющая значительную роль в защите от проникновения болезнетворных микроорганизмов, и другие, также относятся к углеводам.
Некоторые производные углеводов обладают витаминным действием, например витамин С (аскорбиновая кислота), витамин В15 (пангамовая кислота).
Углеводы классифицируют по их способности к гидролизу. Простые углеводы – моносахариды или монозы – гидролизу не подвергаются. Сложные углеводы способны гидролитически расщепляться до моносахаридов.
Углеводы делят на три группы: 1) моносахариды, или монозы; 2) олигосахариды, или кристаллические полисахариды, молекулы которых состоят из 2 – 10 остатков моноз; 3) высшие, или коллоидные, полисахариды (полиозы), в состав которых входят более 10 остатков моносахаридов. Моно- и олигосахариды образуют в воде истинные растворы, из которых способны кристаллизоваться. Они обладают сладким вкусом. Высшие полисахариды относятся к высокомолекулярным веществам. В отличие от моно- и олигосахаридов их называют коллоидными или некристаллизующимися углеводами.
Моносахариды – альдегиды или кетоны многоатомных спиртов с числом углеродных атомов от 2 до 9. В соответствии с характером функциональных групп моносахариды делят на альдегидоспирты, или альдозы, и кетоноспирты, или кетозы.
В зависимости от числа углерода в молекуле моносахариды подразделяют на биозы (2 атома углерода), триозы (3), тетрозы (4), пентозы (5), гексозы (6), гептозы (7), октозы (8), нонозы (9).
Из олигосахаридов наибольшее значение имеют дисахариды – сахароза, лактоза и мальтоза. Молекула сахарозы (свекловичный сахар) при гидролизе распадается на молекулу глюкозы и молекулу фруктозы. При расщеплении лактозы (молочного сахара) освобождаются молекула глюкозы и молекула галактозы, а при гидролитическом распаде молекулы мальтозы образуются две молекулы глюкозы.
Функции полисахаридов весьма разнообразны. Некоторые из них (крахмал, гликоген, инулин) являются энергетическими резервами организма, другие же (клетчатка, гемицеллюлоза, хитин) имеют структурные и опорные функции.
Свойства углеводов связаны с их строением. Представления о строении углеводов со временем претерпели ряд изменений. Так, наиболее распространенная формула глюкозы, по Фишеру, не объясняет многообразия ее свойств, прежде всего явления мутаротации, т. е. постепенного изменения угла вращения поляризованного луча света свежеприготовленными растворами, обусловленного наличием двух аномеров – α-глюкозы и β-глюкозы. Более рациональными оказались формулы, отражающие полуацетальную циклическую структуру молекул моносахаридов.
Формулы глюкозы: I – по Фишеру, II – по Колли и Толлинсу, III – по Хэуорсу:

В последнее время уделяется большое внимание изучению конформаций моносахаридов, т. е. тех форм, которые возникают в результате изменения взаимного положения отдельных частей молекулы. При конформациях не нарушаются связи, соединяющие атомы, чем образование конформационных форм отличается от процесса изомеризации.
 В
конформационных формах различают 2 вида
расположения связанных с углеродами
атомов – экваториальные и аксиальные.
Экваториальные атомы располагаются в
одной, усредненной, плоскости шестичленного
углеродного кольца, а аксиальные занимают
перпендикулярное положение к плоскости
молекулы. Преобладание экваториальных
атомов наблюдается у глюкозы, в молекуле
которой все основные объемные группы
занимают экваториальные положения. У
других гексоз не менее одной объемной
группы находится в аксиальном положении.
Вот почему глюкоза является наиболее
стабильным по структуре моносахаридом.
В
конформационных формах различают 2 вида
расположения связанных с углеродами
атомов – экваториальные и аксиальные.
Экваториальные атомы располагаются в
одной, усредненной, плоскости шестичленного
углеродного кольца, а аксиальные занимают
перпендикулярное положение к плоскости
молекулы. Преобладание экваториальных
атомов наблюдается у глюкозы, в молекуле
которой все основные объемные группы
занимают экваториальные положения. У
других гексоз не менее одной объемной
группы находится в аксиальном положении.
Вот почему глюкоза является наиболее
стабильным по структуре моносахаридом.
Общие реакции дисахаридов.
Молекулы дисахаридов состоят из остатков двух молекул моносахаридов, соединенных гликозидной связью. К дисахаридам относятся: сахароза (свекловичный или тростниковый сахар), мальтоза (солодовый сахар), лактоза (молочный сахар), трегалоза (грибной сахар, микоза), целлобиоза (дисахарид, освобождающийся при гидролитическом расщеплении клетчатки), генциобиоза и др.
По типу связи между молекулами моноз дисахариды можно разделить на 2 группы: 1) построенные по типу мальтозы; 2) типа трегалозы. Дисахариды мальтозного типа состоят из двух остатков моноз, соединенных в положении 1,4, т. е. кислородный мостик связывает первый атом углерода одной молекулы моносахарида с четвертым атомом углерода другой.

У мальтозы остается свободным один гликозидный гидроксил (карбонильная группа), поэтому дисахариды, построенные по типу мальтозы, сохраняют все реакции, свойственные карбонильной группе (Троммера, Бенедикта, Ниландера, с фелинговой жидкостью и т. д. ).
По мальтозному типу построены также лактоза и целлобиоза. При гидролизе лактозы освобождаются молекула α-глюкозы и молекула галактозы.

Молекула целлобиозы гидролитически расщепляется на 2 молекулы β-глюкозы. Следовательно, целлобиоза-β-глюкозид-1,4-глюкоза. В молекулах дисахаридов, построенных по типу трегалозы, моносахариды соединены кислородным мостиком между двумя гликозидными гидроксиами (карбонильными группами).
Поэтому дисахариды трегалозного типа лишены восстанавливающих свойств. К дисахаридам указанного типа относятся сахароза и трегалоза. Сахароза легко гидролизуется с образованием смеси равных количеств глюкозы и фруктозы, называемой инвертным сахаром. Инвертный сахар дает все реакции, характерные для моносахаридов.
Высшие полисахариды – полимеры, состоящие из множества структурных звеньев – остатков моносахаридов. По принятой классификации углеводов к высшим полисахаридам относят соединения, в состав молекул которых входит более 10 остатков моноз. Они не обладают сладким вкусом, не кристаллизуются из водных растворов, большинство из них образует коллоидные растворы. При гидролитическом расщеплении, катализируемом кислотами или ферментами, полисахариды распадаются на олиго- и моносахариды. Остатки моноз в молекулах полисахаридов соединены гликозидными связями в длинные, часто разветвленные цепи.
В зависимости от вида моноз, образующих молекулу полисахарида, различают гомо- и гетерополисахариды. Молекулы гомополисахаридов состоят из многочисленных остатков одного моносахарида. В состав молекул гетерополисахаридов входят разнообразные моносахариды, причем они часто связаны с неуглеводными компонентами (липидами, белками, аминокислотами и т. д.).
За основу классификации гомополисахаридов принята природа монозы, остатки которой образуют молекулу полимера. Так, различают: а) глюканы (крахмал, гликоген, клетчатка, декстарн, лихенин), состоящие из глюкозных остатков; б) полифруктозиды или полифруктозаны (инулин, фруктозаны злаковых трав), в состав которых входят остатки фруктозы; в) маннаны, состоящие из остатков маннозы; г) галактаны, в состав которых входят остатки галактозы; д) арабаны, ксиланы и т. д.
Гетерополисахариды также делятся на ряд групп: гемицеллюлозы, мукополисасахариды, камеди, слизи.
Крахмал - это основной резервный углевод высших растений. Является первым видимым продуктом фотосинтеза. В клетках растений находится в виде зерен, форма и размеры которых специфичны для каждого рода растений (картофеля, пшеницы, риса, овса, ячменя и т. д.).
Растения, богатые крахмалом, представляют собой ценные продукты питания и сырье для производства пищевых продуктов.
Крахмальные зерна состоят из двух компонентов – амилозы и амилопектина. Амилоза растворяется в горячей воде, амилопектин же образует в ней клейстер. Амилоза дает с йодом синее окрашивание, амилопектин – красно-фиолетовое. В состав амилозы входят остатки α-D-глюкозы, соединенные 1,4-гликозидной связью в неразветвленную цепь. Амилопектин состоит из тех же остатков α-D-глюкозы, но они образуют сильно разветвленные цепи. Остатки глюкозы в цепи амилопектина также соединены в положении 1,4, но в местах ветвления наблюдается другой тип связи – 1,6.
В крахмальных зернах количественно преобладает амилопектин, среднее содержание которого составляет 70-80% и более.
Под действием кислот или фермента амилазы крахмал расщепляется, давая в конечном итоге α-D-глюкозу
(C6H10O5)n+nH2O→nC6H12O6
Промежуточными продуктами гидролиза являются декстрины. При кислотном гидролизе крахмала процесс идет до образования глюкозы, при ферментативном же расщеплении конечным продуктом является дисахарид мальтоза, которая уже при участии фермента α-глюкозидазы (мальтазы) гидролитически распадается с освобождением двух молекул глюкозы.
Крахмал восстанавливающими свойствами не обладает, они появляются лишь у декстринов.
4. ПРАКТИЧЕСКАЯ ЧАСТЬ
4.1. Качественные реакции на моносахариды
Реакция с α-нафтолом или тимолом является одной из наиболее чувствительных общих реакций на углеводы и углеводные компоненты в сложных соединениях. Углеводы при взаимодействии с концентрированной кислотой разлагаются с образованием фурфурола и 5-оксметилфурфурола, которые конденсируются с α-нафтолом или тимолом, образуя триарилметановый хромоген, последний, окисляясь в серной кислоте, дает окрашенное хиноидное соединение.

Ход работы
В 2 пробирки наливают по 2 мл раствора глюкозы и добавляют:
в первую 3-4 капли раствора тимола,
во вторую – столько же раствора α-нафтола и встряхивают.
После чего осторожно наслаивают в обе пробирки по 1-2 мл концентрированной серной кислоты. Жидкость в первой пробирке принимает красное, а во второй – фиолетово-красное окрашивание, более выраженное на границе слоев.
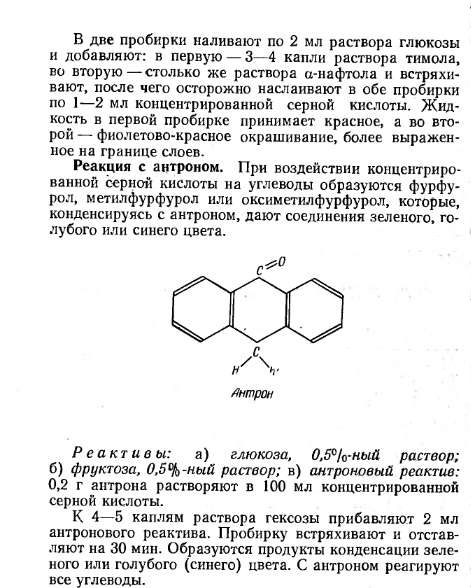
Реакция с антроном. При воздействии концентрированной серной кислоты на углеводы образуются фурфурол и метилфурфурол, которые конденсируясь с антроном, дают соединения зеленого, голубого или синего цвета.
Ход работы
К 4-5 каплям раствора гексозы прибавляют 2 мл антронового реактива. Пробирку встряхивают и оставляют на 30 минут. Образуются продукты конденсации зеленого или голубого (синего) цвета. C антроном реагируют все углеводы.
Реакции восстановления металлов. Моносахариды, окисляясь в щелочной среде, восстанавливают соли металлов до металлов. Эти реакции используются для количественного определения так называемых восстанавливающих (или редуцирующих) моносахаридов, молекула которых содержит карбонильную группу. Восстанавливающими свойствами обладают также некоторые дисахариды – мальтоза, лактоза и целлобиоза, молекулы которых имеют по одной свободной карбонильной группе.
Реакция Троммера. Используется для определения восстанавливающих моносахаридов. Моносахариды в щелочной среде восстанавливают оксид (II) в оксид меди (I) при этом образуется осадок красно-бурого цвета.
В пробирке к 3 -4 мл раствора глюкозы прибавляют 1 – 2 мл 5%-ного раствора едкого натра и по каплям 5%-ный раствор сернокислой меди.

Раствор окрашивается в синий цвет. Пробирку осторожно (на малом огне) нагревают до кипения. Выпадает вначале желтый осадок гидрата оксида меди CuOH, который затем переходит в красный осадок оксида меди (I) Cu2O.
Реакция с реактивом Бенедикта является наиболее чувствительной реакцией на восстанавливающие сахара.
Отдельно готовят два раствора: 1 – в 600 мл теплой воды растворяют 100 г безводного лимоннокислого натрия и 90 г безводного углекислого натрия.
Нагревают до полного растворения солей; 2 – в 100 мл воды растворяют 17 г сернокислой меди (CuSO4·5H2O). Оба раствора сливают вместе и доливают водой до 1 л. Реактив весьма устойчив.
К 5 мл раствора Бенедикта добавляют 7 – 8 капель раствора глюкозы. Пробирку ставят в кипящую водяную баню на 5 мин, после чего охлаждают под краном. Раствор приобретает зеленое, желтое, апельсиновое или красное окрашивание, в дальнейшем выпадает зеленовато-желтый или желтовато-красный осадок.
Реакция с гидратом окиси висмута (Ниландера). Глюкоза в щелочной среде восстанавливает гидрат оксида висмута до металлического Bi.

Реактив Ниландера: в 100 мл 10%-ного раствора едкого натра растворяют 2 г основного азотнокислого висмута и 4 г сегнетовой соли (калия-натрия виннокислого). Для улучшения растворимости соли висмута рекомендуется подогреть на кипящей водяной бане. После охлаждения раствор фильтруют.
К 2 мл раствора глюкозы приливают 1 мл реактива Ниландера, нагревают до кипения и кипятят 1 – 2 мин. Жидкость в пробирке окрашивается сначала в коричневый, а затем в черный цвет. При стоянии выпадает черный осадок металлического висмута.
Реакция неприменима в присутствии белков, в состав которых входят серосодержащие аминокислоты. При кипячении со щелочью происходит отрыв слабо связанных сульфгидрильных (тиоловых) групп, которые с реактивом Ниландера дают буровато-черный осадок сернистого висмута.
Реакция с реактивом Фелинга. Реактив Фелинга является медным алкоголятом сегнетовой соли. Моносахариды при кипячении с фелинговым реактивом восстанавливают его до закиси меди, окисляясь до глюконовой кислоты.
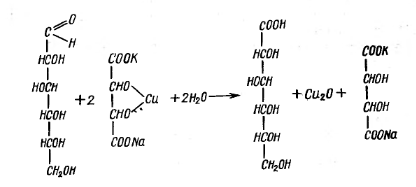
Готовят два раствора: 1 - в мерной колбе емкостью 500 мл растворяют 34,64 г сернокислой меди (CuSO4·5H2O) и доводят водой до метки; 2 – в 200 – 250 мл воды растворяют 173 г сегнетовой соли (COOK – CHOH – CHOH - COONA·4H2O). Раствор количественно переносят в мерную колбу на 500 мл. Сюда же вливают раствор 50 г едкого натра в 100 мл воды и доводят водой до метки. Растворы хранят раздельно.
Непосредственно в момент употребления смешивают равные объемы первого и второго растворов.
К 3 – 4 мл 1%-ного раствора глюкозы (или фруктозы) добавляют равный объем реактива (2 мл 1-го раствора и 2 мл 2-го раствора) и нагревают до начала кипения. Выпадает красный осадок закиси меди.
Реакция с реактивом Фелинга широко используется при количественном определении содержания редуцирующих сахаров в животных и растительных тканях.
Реакция восстановления окиси серебра (реакция «серебряного зеркала»). Карбонильные группы моносахаридов восстанавливают аммиачный раствор окиси серебра до металлического Ag:

В пробирку наливают 1 мл 5%-ного раствора азотнокислого серебра и добавляют по каплям раствор аммиака. Вначале образуется серый осадок, который растворяется в избытке аммиака. К аммиачному раствору окиси серебра прибавляют 2 – 3 мл раствора глюкозы (или фруктозы).
Пробирку ставят в горячую (800С) воду на 5 – 10 мин. На стенках пробирки образуется зеркальный налет металлического серебра.
Реакции на пентозы. Пентозы содержатся в тканях растительных и животных организмов. Рибоза и дезоксирибоза являются составными частями нуклеиновых кислот и важнейших коферментов (НАД, НАДФ, ФАД). Ксилоза и арабиноза входят в состав полисахаридов, которые содержатся в оболочках растительных клеток. Обычно пентозы в отличие от гексоз находятся в связанном состоянии, но при исследовании процесса фотосинтеза были найдены и свободные пентозы.

Характерные реакции на пентозы основаны на их способности превращаться в фурфурол при нагревании с соляной или серной кислотой. Фурфурол дает с анилином и флороглюцином продукты конденсации красного, с орцином - зеленого цвета.
Ход работы
Реакция с анилином. В пробирку наливают 2 мл раствора пентозы, прибавляют равный объем концентрированной соляной кислоты и нагревают до кипения. Содержимому пробирки дают остыть и к нему добавляют по 1 мл анилина и уксусной кислоты. Жидкость окрашивается в интенсивно красный цвет.
Реакция с флороглюцином. К 1 мл раствора флороглюцина прибавляют 4 – 5 капель раствора пентозы и нагревают до кипения. Появляется вишнево-красное окрашивание.
Реакция с орцином. Орциновый реактив: 0,25 г орцина растворяют в 125 мл 30%-ной соляной кислоты. К раствору добавляют 1 мл 10%-ного раствора хлорного железа. Хранят в склянке оранжевого стекла, плотно укупоренной.

1 -2 мл орцинового реактива нагревают до кипения. К горячему реактиву добавляют 4 -5 капель раствора пентозы. Появляется зеленое окрашивание.
Реакция альдопентоз с β-нафтолом и серной кислотой. К 3 – 4 мл раствора β-нафтола в серной кислоте осторожно (по стенке пробирки) добавляют 1 мл раствора альдопентозы так, чтобы слои не смешивались. На границе раздела появляется темно-синее кольцо. Гексозы дают желто-зеленое или коричневое окрашивание.
4.2. Качественные реакции на дисахариды
Реакция Троммера. Благодаря наличию свободной альдегидной группы в молекуле лактозы (в остатке глюкозы) и мальтозы (у второго остатка глюкозы) эти дисахариды обладают восстанавливающими свойствами.
В пробирке к 3 - 4 мл раствора 5%-ного раствора лактозы (мальтозы) прибавляют 1 – 2 мл 5%-ного раствора едкого натра и по каплям 5%-ный раствор сернокислой меди. Содержимое пробирки перемешивают и осторожно нагревают в пламени горелки до изменения цвета раствора.
4.3. Качественные реакции на полисахариды
Реакция крахмала с йодом. Наиболее специфическая реакция на крахмал – появление синего окрашивания с йодом. Окраска обусловлена амилозой. Хотя содержание амилопектина в зернах крахмала в несколько раз в несколько раз превышает количество амилозы, тем не менее синее окрашивание, возникающее при действии йода на амилозу, перекрывает красно-фиолетовую окраску амилопектина. Окраска исчезает при нагревании и восстанавливается при охлаждении крахмального клейстера.
В пробирку наливают 1 – 2 мл раствора крахмала и добавляют 1 – 2 капли раствора Люголя. Появляется насыщенное синее окрашивание. При нагревании синяя окраска исчезает, при охлаждении – восстанавливается.
Проверка восстанавливающих свойств крахмала. В 2 пробирки наливают по 4-5 мл раствора крахмала. В одну пробирку добавляют 3 капли концентрированной соляной кислоты, во вторую – столько же дистиллированной воды (контроль). Обе пробирки ставят на 10-15 минут в кипящую водяную баню. После охлаждения производят реакцию Троммера.
В первой пробирке выпадает красный осадок закиси меди, что свидетельствует о гидролитическом расщеплении крахмала и освобождением веществ, обладающих восстанавливающими свойствами, во второй пробирке – реакция отрицательная.
4.4. Количественное определение крахмала
Содержание крахмала в растениях варьирует, составляя, например, в зернах злаков до 80%, в клубнях картофеля – до 20 – 25% (на сырое вещество).
Крахмал – один из основных продуктов фотосинтеза. Процесс биосинтеза крахмала зависит от многих факторов: вида растения, условий выращивания, стадии зрелости семян и др. Форма и размеры крахмальных зерен характерны для каждого вида растений.
Крахмал представляет собой полимерную систему, структурными звеньями которой являются остатки α-глюкозы. В состав крахмального зерна входят 2 компонента – амилоза и амилопектин, различающиеся по форме и степени ветвления цепей, молекулярному весу, растворимости в горячей воде, окрашиванию с йодом и некоторым другим показателям.
Молекула амилозы состоит из линейной неразветвленной цепи, в состав которой входят 200 – 300 остатков α-глюкозы. Амилопектин состоит из разветвленных полимерных цепей α-глюкозы. У большинства растений амилопектин преобладает над амилозой, составляя в среднем 70 – 80% крахмала. Методы количественного определения крахмала основаны на его гидролитическом расщеплении до глюкозы, содержание которой устанавливают с помощью описанных методов. Для перевода в крахмал найденное количество глюкозы умножают на коэффициент 0,9.
В зависимости от предполагаемого содержания крахмала в исследуемом материале навеска должна составлять 2 – 10 г.
Продукт (например, клубни картофеля, зерна злаков) предварительно измельчают и тщательно перемешивают, после чего берут навеску. Навеску переносят в стакан, добавляют 100 мл дистиллированной воды комнатной температуры и, часто помешивая, оставляют на 45 – 60 минут, при этом редуцирующие сахара переходят в раствор. Содержимое стакана фильтруют через бумажный фильтр, остаток на фильтре промывают 8 – 10 раз холодной водой, которую берут каждый раз по 20 – 30 мл.
Воронку с фильтром, на котором находится отмытый остаток, ставят в коническую колбу на 500 мл. Тонкой стеклянной палочкой делают отверстие в бумаге и отмытый остаток смывают водой в колбу. Водой смывают также с кончика палочки приставшие кусочки навески. В колбу наливают 25 мл 25%-ного соляной кислоты, закрывают ее пробкой с обратным холодильником и ставят в кипящую баню на 2,5 – 3 часа, периодически встряхивая.
После окончания гидролиза колбу охлаждают, содержимое ее нейтрализуют 10%-ным раствором едкого натра (по лакмусу), стараясь не давать избытка щелочи. К нейтрализованному содержимому колбы добавляют 1 – 2 капли 25%-ной соляной кислоты до слабокислой реакции и количественно переводят в мерную колбу на 500 мл, доливая водой до метки, затем перемешивают и фильтруют. В 20 – 50 мл фильтрата определяют содержание глюкозы.
Содержание крахмала (в %) х рассчитывают по формуле
х=Г·0,9,
где Г – количество глюкозы, образовавшееся в результате гидролиза крахмала (в %), 0,9 – коэффициент пересчета глюкозы на крахмал.
4.5. Выделение гликогена из печени. Качественные реакции на гликоген
Гликоген представляет собой главный энергетический и углеводный резерв тканей человека и животных. Особенно велико его содержание в печени (до 10%) и мышцах (до 4%). Гликоген – разветвленный полимер, образованный остатками D-глюкопиранозы, которая в линейных участках соединена -1,4-гликозидными связями, а в точках ветвления - -1,6-гликозидными связями. В отличие от амилопектина, где число остатков глюкозы на одну точку ветвления в среднем равно 20, у гликогена одна связь -1,6-типа приходится на 8-12 остатков D-глюкопиранозы. Большая степень ветвления молекул гликогена придает им большую компактность и легкость мобилизации вследствие быстрого высвобождения большого количества концевых мономеров при распаде гликогена.
Гликоген представляет собой белый порошок, хорошо растворяющийся в холодной воде с образованием коллоидного раствора. Подобно белкам, гликоген обладает резко выраженными гидрофильными свойствами, поэтому его легко можно выделить из растворов при высаливании солями щелочных, щелочно-земельных, тяжелых металлов и спиртом. При кислотном гидролизе гликогена образуется глюкоза, при ферментативном гидролизе (-амилазой) - мальтоза. По отношению к щелочам гликоген обладает большой устойчивостью.
В печени человека при нормальном питании создается депо из 80-120 г гликогена. При голодании почти весь запас гликогена расходуется в течение суток и его не удается обнаружить при помощи обычных качественных реакций.
Метод выделения гликогена основан на экстракции его из печени щелочью, в присутствии которой все другие высокомолекулярные соединения (белки, нуклеиновые кислоты и др.) денатурируют, и дальнейшем осаждении гликогена спиртом.
Ход работы
2 г свежезамороженной или взятой от только что забитого животного печени помещают в пробирку и заливают 4 мл 35% щелочи. Пробирку с содержимым ставят в кипящую водяную баню до полного растворения кусочков печени (10-20 минут).
Затем охлаждают и добавляют 1,5 объема (6 мл) 95% спирта. Смесь осторожно нагревают при помешивании стеклянной палочкой, поместив пробирку в заранее нагретую до 70-75С водяную баню (горелка под баней должна быть погашена).
При этом гликоген выпадает в хлопьевидный осадок. Пробирку с содержимым оставляют на столе в штативе до полного охлаждения и оседания осадка на дно пробирки. Затем жидкость осторожно сливают, осадок отделяют от оставшейся жидкости при фильтровании и промывают его трижды (по 1 мл) 95% спиртом. Фильтрат отбрасывают, а промытый осадок гликогена растворяют примерно в 5 мл воды.
С полученным раствором гликогена проводят описанные ниже качественные реакции, предварительно нейтрализовав его по лакмусу 10% уксусной кислотой.
4.6. Качественные реакции на гликоген
Ход работы
4.6.1. К 1 мл раствора гликогена добавляют 1 каплю раствора Люголя и наблюдают за появлением красно-бурого окрашивания; окраска исчезает при нагревании (как и синяя окраска крахмала с раствором йода) и вновь появляется при охлаждении.
4.6.2. К 10 каплям раствора гликогена прибавляют двойной объем спирта, наблюдают за образованием мути, оседающей в виде хлопьев при стоянии жидкости. При недостатке солей в разбавленных растворах гликогена осадок может не образоваться; в этом случае нужно добавить (по каплям) насыщенный раствор хлористого натрия.
4.6.3. К 5 каплям раствора гликогена добавляют 5 капель 10% раствора уксуснокислого свинца и наблюдают за образованием осадка.
4.6.4. К 10 каплям раствора гликогена добавляют порошок сернокислого аммония до полного насыщения жидкости и наблюдают за образованием осадка.
4.6.5. К 10 каплям раствора гликогена добавляют равный объем 10% раствора щелочи и по каплям 1% раствор медного купороса до образования не исчезающей при взбалтывании мути, затем нагревают полученный раствор до кипения (проба Троммера). Раствор гликогена, если он не содержит примеси редуцирующих сахаров и декстринов, не восстанавливает ионы меди при проведении пробы Троммера;
4.6.6. К 1 мл раствора гликогена добавляют равный объем 25% раствора серной кислоты и кипятят 4-5 минут, затем охлаждают и проводят пробу Троммера. Наблюдают за восстановлением гидрата окиси меди в закись, указывающим на образование свободных гликозидных гидроксилов (альдегидных групп) при гидролизе гликогена.
5. СОСТАВЛЕНИЕ ОТЧЕТА
Отчет составляется с указанием цели, задания, включает уравнения протекания реакций, экспериментальные данные и выводы.
6. ВОПРОСЫ ДЛЯ КОНТРОЛЯ
6.1. Какие соединения относят к группе моносахаридов? К каким группам моносахаридов относится фруктоза, рибоза, глицериновый альдегид?
6.2. Какие свойства характерны для моносахаридов? Что такое мутаротация? Чем можно объяснить явление мутаротации?
6.3. Качественные реакции на моносахариды.
6.4. Что такое эпимеры? Являются ли эпимерами следующие пары моносахаридов: 1) фруктоза и глюкоза; 2) рибоза и глюкоза; 3) глюкоза и манноза?
6.5.Что такое олигосахариды? Какие соединения относятся к олигосахаридам?
6.6. Что такое полисахариды? Как их можно классифицировать?
6.7. Качественные реакции на полисахариды.
6.8. Количественное определение крахмала.
К какой группе полисахаридов относится гликоген? Какова его химическая структура и биологическая роль?
Какие ферменты участвуют в гидролизе гликозидных связей пищевых углеводов? Где они вырабатываются? Что образуется при совместном их действии на экзогенные углеводы?
Что такое гликогенез и гликогенолиз? В чем их отличие друг от друга?
В чем заключается основное отличие гликогенолиза в печени и мышцах? Какие конечные продукты при этом образуются?
Какие физико-химические свойства гликогена лежат в основе его выделения?
Какие органы или ткани целесообразно использовать для экстракции гликогена? Почему?
Какие качественные реакции свойственны растворам гликогена? Чем они обусловлены?
При проведении качественных реакций с раствором гликогена, полученного при его экстракции из печени: а) голодающей в течение двух суток крысы; б) сытой крысы, были обнаружены различные результаты. В одном случае реакции не показали присутствия гликогена в экстракте, в другом – они были положительны. Как можно объяснить полученные результаты? Являются ли данные этого опыта вариантами нормы или патологии?
Тема: ОБМЕН ГЛЮКОЗЫ В ТКАНЯХ. АНАЭРОБНОЕ И АЭРОБНОЕ ОКИСЛЕНИЕ ГЛЮКОЗЫ
1. ЦЕЛЬ
Изучить качественные реакции и состав углеводов.
2. ЗАДАЧИ
