
- •2.Характеристика белковых веществ. Элементарный состав белка. Значение белков для организма: белки – ферменты, белки – гормоны, структурные белки, белки – рецепторы, транспортные белки, антитела.
- •3. Аминокислоты как структурные элементы белка. Классификация аминокислот. Физико-химические свойства аминокислот. Общность строения, оптическая изомерия, амфотерность, сродство радикалов к воде.
- •4. Структурная организация белков. Типы связей, участвующие в формировании первичной, вторичной, третичной и четвертичной структур.
- •5. Физико-химические свойства белков. Денатурация белка. Использование процесса денатурации в медицине.
- •1)Белки –коллоидные растворы.
- •2) Суммарный заряд белка.
- •3)Растворимость
- •4)Амфотерность (за счёт аминокислот, см. 2 вопрос)
- •6. Белки как амфотерные электролиты. Поведение белков в электрическом поле. Электрофорез. Применение его во врачебной практике. Изометрическая точка белков. Определение суммарного заряда белка.
- •7. Классификация белков. Важнейшие представители протеинов и протеидов. Биологические функции белков.
- •8. Нуклеопротеиды. Химический состав белковой и простетической группы. Структурные компоненты нуклеиновых кислот. Номенклатура нуклеотидов, нуклеозидов, азотистых оснований. Их химическое строение.
- •9. Гемоглобин. Строение и свойства. Окси-, карбокси-,карб- метгемоглобин. Вариации первичной структуры и свойства гемоглобина. Гемоглобинопатии.
- •10. Хромопротеиды. Гемоглобин, миоглобин, каталаза, цитохромоксидаза, цитохромы. Их химическая природа и значение для организма.
- •12. Фосфопротеиды. Способ связи простетической группы с белковым компонентом. Значение в обмене веществ. Металлопротеиды и их биологическая роль в тканевом дыхании.
- •13. Липопротеиды. Химическое строение, представители, роль в обмене веществ. Состав и строение транспортных липопротеидов крови.
- •15. Роль и значение ферментов в процессе жизнедеятельности. Ферменты как биологические катализаторы. Химическая природа ферментов. Ферменты простые и сложные. Апофермент и кофермент.
- •Особенности ферментов как биологических катализаторов
- •16. Понятие об изоферментах. Лактатдегидрогеназа. Определение изоферментов с целью диагностики болезней.
- •17. Ингибиторы ферментов. Типы ингибирования. Конкурентное, неконкурентное,аллостерическое ингибирование. Использование ингибиторов ферментов в качестве лекарств.
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Смешанное ингибирование
- •1)Действие многих лекарственных средств
- •18. Изменение активности ферментов при заболеваниях. Наследственные энзимопатии. Определение активности ферментов в плазме с целью диагностики болезней.
- •19. Ферменты пищеварительной системы, гидролизующие углеводы, липиды, белки.
- •20. Особенности ферментативного катализа. Специфичность действия ферментов. Особенности ферментативного катализа.
- •21. Кинетика ферментативных реакций. Факторы, определяющие скорость ферментативных реакций. Кинетика ферментативных реакций –
- •22. Активный центр и механизм действия ферментов, специфичность.
- •23. Кофакторы ферментов и их роль в катализе. Витамины - как предшественники коферментов. Гиповитаминозы, их причины и проявления.
- •24. Современная классификация ферментов. Номенклатура. Тип катализируемых реакций. Примеры.
- •Изменение активности фермента при фосфорилировании-дефосфорилировании
- •26. Регуляция активности ферментов путем ассоциации/диссоциации протомеров.
- •27. Применение ферментов в медицине. Энзимодиагностика и энзимотерапия.
- •29. Биосинтез днк (репликация). Принцип комплементарности азотистых оснований. Биологический генетический код.
- •30. Биосинтез рнк (транскрипция), рнк-полимеразы. Типы рнк и их биологическая роль.
- •31. Современные представления о синтезе белка. Регуляция биосинтеза белка.
- •32. Витамины. Понятие о гипо- и гипервитаминозах. Механизм действия витаминов. Классификация витаминов. Важнейшие представители витаминов. Их биологическое значение.
- •33. Жирорастворимые витамины. Витамин а. Химическая природа, свойства, распространение, потребность, роль в обмене веществ. Авитаминозы.
- •34. Витамины группы д. Химическая природа и свойства. Роль в обмене веществ. Биохимическая характеристика патогенеза рахита.
- •35. Витамин е. Химическое строение, свойства, роль в обмене веществ.
- •36. Витамин к. Химическое строение, свойства, роль в обмене веществ.
- •37. Водорастворимые витамины. Витамин в1 . Химическая природа нарушений в обмене веществ при в1 -авитаминозе. Распространение, потребность.
- •38. Витамин в2 . Химическое строение, распространение, суточная потребность, участие в построении флавиновых ферментов. Авитаминоз.
- •39. Витамин в6 , его производные. Химическое строение, распространение, суточная потребность, симптомы авитаминозов. Коферментная роль витамина в6 .
- •41. Пантотеновая кислота. П-аминобензойная кислота. Химическая природа, свойства, роль в обмене веществ. Авитаминозы.
- •42. Витамин н (биотин). Биологическая роль, участие в обмене веществ. Химическая природа, авитаминоз.
- •43. Фолиевая кислота. Тетрагидрофолиевая кислота. Синтез одноуглеродистых радикалов. Химическая природа, биологическая роль. Авитаминозы. Участие в обмене веществ.
- •44. Витамин с. Авитаминоз. Химическая природа, содержание в пищевых продуктах, потребность, роль в обмене веществ.
- •45. Гомоны. Химическая природа,механизм действия,их роль в регуляции обмена веществ.
- •47. Гормоны панкреатической(поджелудочной) железы.
- •48. Гормоны мозгового вещества надпочечников.
- •49. Гормоны коры надпочесников.
- •50. Гормоны передней доли гипофиза.
- •51. Гормоны задней доли гипофиза.
- •52. Механизм действия гормонов.Мембранный и внутриклеточный типы гормоныльной регуляции.
- •53. Аденилатциклазная система передачи сигналов,роль g-белков в трансдукции сигнала.
- •55. Окислительное декарбоксилирование пирувата.
- •56. Окисление ацетил-КоА в цикле Кребса. Связь между общими путями катаболизма и цепью переноса электронов и протонов. Цикл трикарбоновых кислот
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •57. Механизм образования атф. Окислительное фосфорилирование. Отличие от субстратного фосфорилирования.
- •58. Углеводы пищи: строение, переваривание. Механизмы трансмембранного переноса глюкозы. Примеры нарушения переваривания углеводов.
- •59. Метаболизм глюкозы в клетках.
- •61. Аэробное окисление углеводов. Ферменты, участвующие в этих процессах.
- •62. Анаэробное расщепление глюкозы в тканях. Гликолиз и гликогенолиз. Ферменты, роль этого процесса.
- •63. Глюконеогенез. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори).
- •64. Апотомический распад углеводов. Биологическое значение пентозофосфатного цикла.
- •Значение пентозофосфатного пути
- •65. Энергетический выход окисления одной молекулы глюкозы при гликолизе, аэробном окислении и прямом окислении. Регуляция углеводного обмена
- •67.Значение белков в питании. Азотистый баланс и азотистое равновесие. Заменимые и незаменимые аминокислоты.
- •69. Катаболизм аминокислот (реакция дезаминирования).
- •71. Обмен аммиака. Механизм токсического действия аммиака. Связывание (обезвреживание) аммиака.
- •72. Орнитиновый цикл (цикл мочевины). Наследственные нарушения орнитинового цикла и их основные проявления.
- •73. Заменимые и незаменимые а/к. Биосинтез заменимых.
- •74. Обмен серина и глицина. Роль фолиевой кислоты в обмене аминокислот. Участие глицина в синтезе креатина и глутатиона.
- •75. Особенности обмена метионина. Синтез фосфатидилхолина. Синтез карнитина. Синтез креатина и креатинфосфата.Образование цистеина из метионина.
- •79. Структура, классификация и свойства основных липидов организма человека. Химическое строение и биологическая роль. Фосфолипиды, сфинголипиды, цереброзиды, гликолипиды
- •80. Переваривание и всасывание липидов в жкт. Роль желчных кислот. Механизм всасывания жиров. Нарушения в переваривании липидов. Транспорт жиров из кишечника.
- •81. Современная теория окисления жирных кислот с четным и нечетным числом углеродных атомов. Общий выход энергии при окислении жирных кислот до со2 и н2о.
- •82. Пути образования и использования ацетоуксусной кислоты в организме. Нарушение и регуляция липидного обмена.
- •83. Биосинтез триацилглицеридов и фосфолипидов. Функции фосфолипидов. Регуляция и патология липидного обмена.
- •84. Обмен стероидов. Биосинтез холестерина. Холестерин как предшественник ряда других стероидов. Нарушение обмена холестерина.
- •85. Биосинтез жирных кислот. Регуляция синтеза жирных кислот. Источники цитоплазматического ацетил-КоА. Роль биотина, надфн2, апб в синтезе жирных кислот.
- •86. Синтез желчных кислот, регуляция процесса. Их роль в переваривании и всасывании липидов. Желчно-каменная болезнь.
- •87. Гиперхолестеролемия. Механизм развития атеросклероза и основные подходы к лечению.
- •88. Регуляция обмена углеводов, липидов и аминокислот.
- •89. Биохимические представления о сахарном диабете: важнейшие изменения гормонального статуса и метаболизма при сахарном диабете.
- •90. Регуляция водно-солевого обмена гормонами. Вазопрессин и альдостерон: строение и механизм действия.
- •91. Ренин-альдостерон-ангиотензиновая система. Биохимические механизмы развития почечной гипертонии. Нарушения водно-солевого обмена.
- •92. Паратгормон и кальцитонин: химическая природа, механизм действия, влияние на обмен кальция и фосфатов. Гипо- и гиперкальциемия.
- •95. Механизмы обезвреживания токсических веществ в печени. Микросомальное окисление. Реакции конъюгации.
- •96. Биотрансформация лекарств в печени.
- •98. Ферменты крови их диагностическое значение.
- •99. Структурная организация и основные компоненты мембран. Строение и функции липидов мембран
- •Характеристика мембранных белков
- •Липидный состав мембран
- •100. Избирательная проницаемость мембран. Механизмы переноса веществ через мембраны (примеры).
12. Фосфопротеиды. Способ связи простетической группы с белковым компонентом. Значение в обмене веществ. Металлопротеиды и их биологическая роль в тканевом дыхании.
Фосфопротеиды. Белок + остаток фосфорной кислоты.
Фосфорная
кислота связывается сложноэфирной
связью с белковой молекулой через
гидроксильные группы β-гидроксиаминокислот
(серин, треонин). Представители
фосфопротеидов: казеин молока, овальбумин
– белок яичного белка, ихтулин – икра
рыб. Много фосфопротеидов в ЦНС.
Фосфопротеиды синтезируются в клетке в результате посттрансляционной модификации белков – белки подвергаются фосфорилированию.
Биологическая роль фосфопротеидов.
Ценные источники энергетического и пластического материала в процессе эмбриогенеза, постнатального роста и развития организма.
Казеин молока – содержит все незаменимые аминокислоты и
фосфорную кислоту – до 1%.Казеин молока представлен кальциевой солью, т.е. молоко содержит кальций и фосфор.
Металлопротеины содержат металлы
Если в белке содержатся ионы одного или нескольких металлов, то такие белки называются металлопротеины. Катионы металлов соединены координационными связями непосредственно с функциональными группами аминокислот белка.
Металлопротеины часто являются ферментами. Ионы металлов входят в состав активного центра фермента и здесь:
участвуют в ориентации субстрата,
формируют ковалентные связи с интермедиатами реакции,
являются донорами или акцепторами электронов при взаимодействии фермента с субстратами.
К ферментативным металлопротеинам относятся белки, содержащие например:
медь – цитохромоксидаза, в комплексе с другими ферментами дыхательной цепи митохондрий участвует в синтезе АТФ,
железо – ферритин, депонирующий железо в клетке, трансферрин, переносящий железо в крови, сукцинатдегидрогеназа (фермент цикла трикарбоновых кислот), лактоферрин (белок молока),
цинк – алкогольдегидрогеназа, обеспечивающая метаболизм этанола и других спиртов, лактатдегидрогеназа, участвующая в метаболизме молочной кислоты, карбоангидраза, образующая угольную кислоту из CO2 и H2O, щелочная фосфатаза, гидролизующая фосфорные эфиры различных соединений, α2-макроглобулин, антипротеазный белок крови, фермент кишечника карбоксипептидаза,
селен – тиреопероксидаза, участвующая в синтезе гормонов щитовидной железы, антиоксидантный фермент глутатионпероксидаза,
кальций – α-амилаза слюны и панкреатического сока, гидролизующая крахмал,
молибден – ксантиноксидаза, отвечающая за последние реакции катаболизма пуриновых оснований,
магний – гексокиназа, отвечающая за реакцию фосфорилирования глюкозы,
марганец – супероксиддисмутаза, отвечающая за реакцию нейтрализации кислородного радикала супероксид-аниона О2•¯,
никель – уреаза, отвечающая за распад мочевины.
13. Липопротеиды. Химическое строение, представители, роль в обмене веществ. Состав и строение транспортных липопротеидов крови.
Липопротеиды = белок + липид, связанный ковалентной связью. Традиционно к липопротеинам относят надмолекулярные образования, переносящие липиды в плазме крови, включающие белки и молекулы всех классов липидов.
Такие транспортные липопротеины можно сравнить с орехом, который имеет скорлупу и ядро. Поверхность липопротеиновой частицы ("скорлупа") гидрофильна и сформирована белками, фосфолипидами и свободным холестеролом. Триацилглицеролы и эфиры холестерола составляют гидрофобное ядро.
Белки в липопротеинах называются апобелками. В каждом типе липопротеинов преобладают соответствующие ему апобелки, которые несут либо структурную функцию, либо являются ферментами метаболизма липопротеинов.
Различают четыре основных класса лиипопротеинов:
1)липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП),
2)липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП),
3)липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП),
4)хиломикроны (ХМ).
Хиломикроны и ЛПОНП ответственны, в первую очередь, за перенос жирных кислот в составе триацилглицеролов. Липопротеины высокой и низкой плотности – за транспорт свободного холестерола и жирных кислот в составе его эфиров
Че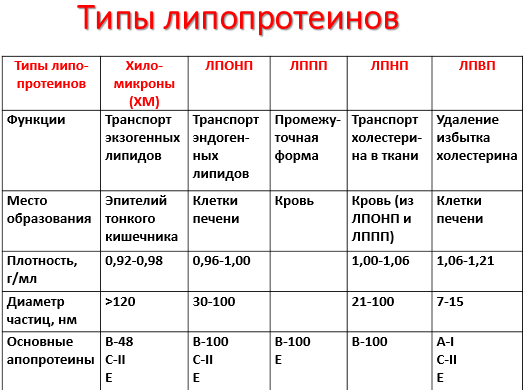 м
ниже плотность липопротеинов, из-за
меньшей концентрации липопротеинов,
тем опасней для организма, т.к. они
способствуют образованию атеросклеротических
бляшке.
м
ниже плотность липопротеинов, из-за
меньшей концентрации липопротеинов,
тем опасней для организма, т.к. они
способствуют образованию атеросклеротических
бляшке.
В результате действия ЛП-липазы на жиры ХМ образуются жирные кислоты и глицерол. Основная масса жирных кислот проникает в ткани. В жировой ткани в абсорбтивный период жирные кислоты депонируются в виде триацилглицеролов, в сердечной мышце и работающих скелетных мышцах используются как источник энергии. Другой продукт гидролиза жиров, глицерол, растворим в крови, транспортируется в печень, где в абсорбтивный период может быть использован для синтеза жиров.
В результате действия ЛП-липазы на ХМ количество жиров в них снижается на 90%, уменьшаются размеры частиц, апопротеин C-II переносится обратно на ЛПВП. Образовавшиеся частицы называются остаточными ХМ. Они содержат в себе фосфолипиды, холестерол, жирорастворимые витамины и апопротеины В-48 и Е. Остаточные ХМ захватываются гепатоцитами, которые имеют рецепторы, взаимодействующие с этими апопротеинами. Путём эндоцитоза остаточные ХМ попадают внутрь клеток, и ферментами лизосом белки и липиды гидролизуются, а затем утилизируются. Жирорастворимые витамины и экзогенный холестерол используются в печени или транспортируются в другие ткани.
Хиломикроны образуются в стенке кишечника, содержат до 80% ТАГ пищевого происхождения, которые транспортируются кровью в периферические ткани. В кровеносных капиллярах ТАГ подвергаются гидролизу липопротеинлипазой; образующиеся жирные кислоты поступают в ткани, а «остатки» хиломикронов поглощаются клетками печени.
ЛПОНП - образуются в печени, являются транспортной формой эндогенных ТАГ. Как и хиломикроны, являются субстратами липопротеинлипазы эндотелия капилляров. После гидролиза ТАГ, ЛПОНП превращаются в ЛПНП.
ЛПНП - образуются в крови из ЛПОНП под действием липопротеинлипазы. Богаты холестеролом, транспортируют его во внепечёночные ткани. В результате взаимодействия ЛПНП с рецепторами на поверхности мембран холестерол из ЛПНП проникает внутрь клеток, где участвует в образовании клеточных структур и реакциях биосинтеза веществ .
ЛПВП – образуются в печени, первоначально состоят преимущественно из белков и фосфолипидов и имеют форму дисков. При помощи фермента ЛХАТ липопротеины этого класса извлекают избыток холестерола из внепечёночных клеток и в форме эфиров доставляют его в печень.
Увеличение содержания в крови ЛПНП и ЛПОНП и уменьшение содержания ЛПВП способствует развитию атеросклероза. Следовательно, ЛПОНП и ЛПНП – атерогенные липопротеины, ЛПВП –антиатерогенные липопротеины.
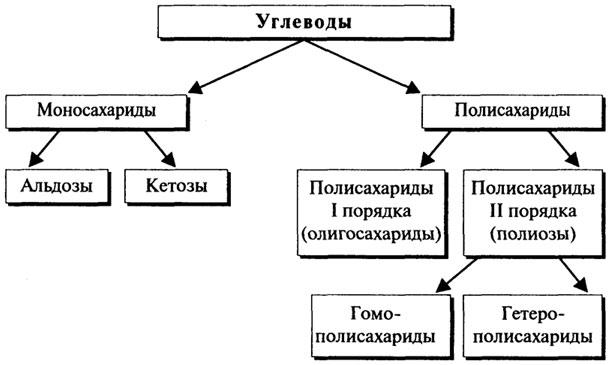
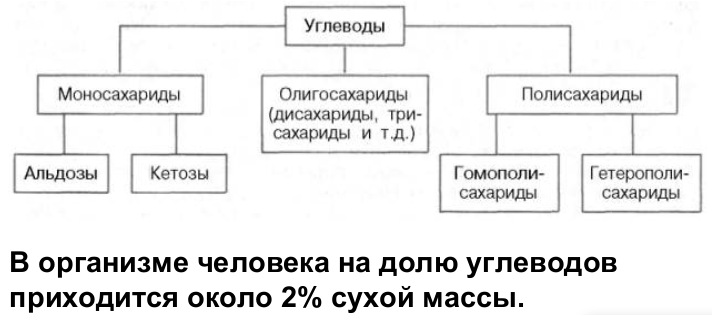
14. Общая характеристика углеводов и их биологическая роль. Моносахариды. Важнейшие представители и их свойства. Наследственные нарушения обмена галактозы. Глюкоза как важнейший метаболит углеводного обмена.
Общая формула всех углеводов Cm(H2O)n.
Углеводы можно разделить на 3 основные группы в зависимости от количества составляющих их мономеров:
3.2. Физиологическое значение углеводов
Углеводам в питании человека принадлежит чрезвычайно важная роль. Они являются главным источником энергии для человеческого организма, необходимой для жизнедеятельности всех клеток, тканей и органов, особенно мозга, сердца, мышц. В результате биологического окисления углеводов (а также жиров и, в меньшей степени, белков) в организме освобождается энергия, которая аккумулируется в виде богатого энергией соединения – аденозинтрифосфорной кислоты. При окислении 1 г углеводов в организме образуется 16,7 кДж (4 ккал) энергии.
Роль углеводов в организме человека не ограничивается их значением как источника энергии. Эта группа веществ и их производные входят в состав разнообразных тканей и жидкостей, являясь пластическими материалами. Так, соединительная ткань содержит мукополисахариды, в состав которых входят углеводы и их производные.
Регуляторная функция углеводов разнообразна. Они противодействуют накоплению кетоновых тел при окислении жиров. Так, при нарушении обмена углеводов, например, при сахарном диабете, развивается ацидоз.
Ощущение сладкого, воспринимаемое рецепторами языка, тонизирует центральную нервную систему.
Некоторые углеводы и их производные обладают биологической активностью, выполняя в организме специализированные функции. Например, гепарин предотвращает свертывание крови в сосудах, гиалуроновая кислота препятствует проникновению бактерий через клеточную оболочку и др.
Следует отметить важную роль углеводов в защитных реакциях организма, особенно протекающих в печени. Так, глюкуроновая кислота соединяется с некоторыми токсическими веществами, образуя нетоксические сложные эфиры, которые, благодаря растворимости в воде, удаляются из организма с мочой.
+Углеводные запасы человека очень ограничены, содержание их не превышает 1 % массы тела. При интенсивной работе они быстро истощаются, поэтому углеводы должны поступать с пищей ежедневно. Суточная потребность человека в углеводах составляет 400–500 г, при этом примерно 80% приходится на крахмал.
Моносахариды
Моносахариды обычно содержат от 3 до 9 атомов углерода, причем наиболее распространены пентозы и гексозы. По функциональной группе они делятся на альдозы и кетозы.
Моносахариды находятся обычно в таутомерном равновесии со своей циклической формой. Таутомерные циклические формы сахаров представляют собой внутренние полуацетали. В результате циклизации появляется новый асимметрический атом углерода, который называют гликозидным (или аномерным). Изомеры относительно аномерного центра называются α- и β-аномерами.
Среди моносахаридов широко известны глюкоза, фруктоза, галактоза, арабиноза, ксилоза и D-рибоза.
Глюкоза (виноградный сахар) в свободном виде содержится в ягодах и фруктах (в винограде до 8%; в сливе, черешне 5–6%; в меде 36%). Из молекул глюкозы построены крахмал, гликоген, мальтоза; глюкоза является составной частью сахарозы, лактозы.
Фруктоза (плодовый сахар) содержится в чистом виде в пчелином меде (до 37%), винограде (7,7%), яблоках (5,5%); является составной частью сахарозы.
Галактоза – составная часть молочного сахара (лактозы), которая содержится в молоке млекопитающих, растительных тканях, семенах.
Арабиноза содержится в хвойных растениях, в свекловичном жоме, входит в пектиновые вещества, слизи, гумми (камеди), гемицеллюлозы.
Ксилоза (древесный сахар) содержится в хлопковой шелухе, кукурузных кочерыжках. Ксилоза входит в состав пентозанов. Соединяясь с фосфором, ксилоза переходит в активные соединения, играющие важную роль во взаимопревращениях сахаров.
В ряду моносахаридов особое место занимает D-рибоза. Почему природа всем сахарам предпочла рибозу – пока не ясно, но именно она служит универсальным компонентом главных биологически активных молекул, ответственных за передачу наследственной информации, – рибонуклеиновой (РНК) и дезоксирибонуклеиновой (ДНК) кислот; входит она и в состав АТФ и АДФ, с помощью которых в любом живом организме запасается и переносится химическая энергия. Замена в АТФ одного из фосфатных остатков на пиридиновый фрагмент приводит к образованию еще одного важного агента НАД – вещества, принимающего непосредственное участие в протекании жизненно важных окислительно-восстановительных процессов. Еще один ключевой агент – рибулозо-1,5-дифосфат. Это соединение участвует в процессах ассимиляции углекислого газа растениями.
Наследственные нарушения обмена галактозы.
Галактоземия, вызванная недостаточностью галактозо-1-фосфатуридилтрансферазы (ГАЛТ), наиболее хорошо изучена. Это заболевание проявляется очень рано, и особенно опасно для детей, так как основным источником углеводов для них служит материнское молоко, содержащее лактозу. Ранние симптомы дефекта ГАЛТ: рвота, диарея, дегидратация, уменьшение массы тела, желтуха. Они появляются вскоре после рождения, как только ребёнок начинает получать молоко. В крови, моче и тканях повышается концентрация галактозы и галактозо-1-фосфата. В тканях глаза (в хрусталике) галактоза восстанавливается альдоредуктазой с образованием галактитола (дульцита). В этой реакции в качестве донора водорода используется NADPH. Восстановление галактозы происходит и в ходе нормального метаболизма, но протекает с небольшой скоростью. При галактоземии галактитол накапливается в стекловидном теле и связывает большое количество воды. Вследствие этого нарушается баланс электролитов, а чрезмерная гидратация хрусталика приводит к развитию катаракты, которая наблюдается уже через несколько дней после рождения.
Тяжёлые последствия дефекта ГАЛТ наблюдают в печени. Это связано с накоплением галактозо-1-фосфата и его токсическим действием на гепатоциты. В результате возникают нарушения функции печени: гепатомегалия, жировая дистрофия. В почках таких больных также повышена концентрация галактитола и галактозо-1-фосфата, что влияет на их функции. Отмечают нарушения в клетках полушарий головного мозга и мозжечка, в тяжёлых случаях - отёк мозга, задержку умственного развития, возможен летальный исход. Для галактоземии, вызванной дефектом галактокиназы, тоже характерна катаракта, но при этом заболевании, в отличие от дефекта ГАЛТ, не отмечают нарушений функций печени, почек, мозга. Наиболее тяжёлые последствия снижения активности ГАЛТ связывают с влиянием галактозо-1-фосфата на активность других ферментов, участвующих в углеводном обмене (фосфоглюкомутазы, глюкозо-6-фосфатдегидрогеназы). Известно несколько форм галактоземии, причиной которой является недостаточность ГАЛТ Некоторые дефекты в строении ГАЛТ приводят лишь к частичной потере активности фермента. Поскольку в норме ГАЛТ присутствует в организме в избытке, то снижение его активности до 50%, а иногда и ниже может клинически не проявляться. При диагностике галактоземии исследуют мочу на содержание галактозы, собранную после нескольких кормлений молоком. При обнаружении у ребёнка катаракты его обследуют на недостаточность галактокиназы и ГАЛТ. Наличие галактозы в моче при отсутствии нарушений функции печени указывает на дефект галактокиназы. При обследовании проведение теста с нагрузкой галактозой не рекомендуется, так как этот тест опасен для больных. Лечение заключается в удалении галактозы из рациона.
Глюкоза как важнейший метаболит углеводного обмена. Общая схема источников и путей расходования глюкозы в организме.
Глюкоза является альдогексозой. Она может существовать в линейной и циклической формах. Циклическая форма глюкозы, предпочтительная в термодинамическом отношении, обусловливает химические свойства глюкозы. Как и все гексозы, глюкоза имеет 4 асимметричных углеродных атома, обусловливающих наличие стереоизомеров. Возможно образование 16 стереоизомеров, наиболее важные из которых D- и L-глюкоза. Эти типы изомеров зеркально отображают друг друга. Расположение Н- и ОН-групп относительно пятого углеродного атома определяет принадлежность глюкозы к D- или L-ряду. В организме млекопитающих моносахариды находятся в D-конфигурации, так как к этой форме глюкозы специфичны ферменты, катализирующие её превращения. В растворе при образовании циклической формы моносахарида образуются ещё 2 изомера (α- и β-изомеры), называемые аномерами, обозначающие определённую конформацию Н- и ОН-групп относительно С, У α-D-глюкозы ОН-группа располагается ниже плоскости кольца, а у β-D-глюкозы, наоборот, над плоскостью кольца. Поскольку в составе основных углеводов пищи преобладает глюкоза, её можно считать основным продуктом переваривания углеводов. Другие моносахариды, поступающие из кишечника в процессе метаболизма, могут превращаться в глюкозу или продукты её метаболизма. Часть глюкозы в печени депонируется в виде гликогена, а другая часть через общий кровоток доставляется и используется разными тканями и органами. При нормальном рационе питания концентрация глюкозы в крови поддерживается на уровне -3,3-5,5 ммоль/л (60-100 мг/дл). А в период пищеварения её концентрация может повышаться примерно до 150 мг/дл (8 ммоль/л).
Фософорилирование глюкозы. В дальнейших превращениях в клетках глюкоза и другие моносахариды участвуют только в виде фосфорных эфиров. Фосфорилирование свободных моносахаридов - обязательная реакция на пути их использования, она приводит к образованию более реакционно-способных соединений и поэтому может рассматриваться как реакция активации. Глюкоза, поступающая в клетки органов и тканей, сразу же подвергается фосфорилированию с использованием АТФ. Эту реакцию во многих тканях катализирует фермент гексокиназа, а в печени и поджелудочной железе - фермент глюкокиназа. Фосфорилирование глюкозы - практически необратимая реакция, так как она протекает с использованием значительного количества энергии. Образование глюкозо-6-фосфата в клетке - своеобразная "ловушка" для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы (нет соответствующих транспортных белков). Кроме того, Фосфорилирование уменьшает концентрацию свободной глюкозы в цитоплазме. В результате создаются благоприятные условия для облегчённой диффузии глюкозы в клетки из крови.
Глюкокиназа. Фосфорилирование глюкозы в гепатоцитах в период пищеварения обеспечивается свойствами глюкокиназы, которая имеет высокое значение Кm - 10 ммоль/л. В этот период концентрация глюкозы в воротной вене больше, чем в других отделах кровяного русла и может превышать 10 ммоль/л, а следовательно, активность глюкокиназы в гепатоцитах повышается. Следует отметить, что активность глюкокиназы, в отличие от гексокиназы, не ингибируется продуктом катализируемой реакции - глюкозо-6-фосфатом. Это обстоятельство обеспечивает повышение концентрации глюкозы в клетке в фосфорилированной форме, соответственно её уровню в крови. Как уже упоминалось, глюкоза проникает в гепатоциты путём облегчённой диффузии при участии транспортёра ГЛЮТ-2 (независимого от инсулина). ГЛЮТ-2, так же, как глюкокиназа, имеет высокую Кm, что способствует повышению скорости поступления глюкозы в гепатоциты в период пищеварения, следовательно, ускоряет её фосфорилирование и дальнейшее использование для депонирования. Хотя инсулин и не влияет на транспорт глюкозы, он усиливает приток глюкозы в гепатоциты в период пищеварения косвенным путём, индуцируя синтез глюкокиназы и ускоряя тем самым Фосфорилирование глюкозы. Преимущественное потребление глюкозы гепатоцитами, обусловленное свойствами глюкокиназы, предотвращает чрезмерное повышение её концентрации в крови в абсорбтивном периоде. Это, в свою очередь, снижает последствия протекания нежелательных реакций с участием глюкозы, например гликозилирования белков.
Гексокиназа отличается от глюкокиназы высоким сродством к глюкозе (Кm <0,1 ммоль/л). Следовательно, этот фермент, в отличие от глюкокиназы, активен при низкой концентрации глюкозы в крови, что характерно для постабсорбтивного состояния. Печень в этот период поглощает гораздо меньше глюкозы, так как скорость её внутриклеточного фосфорилирования глюкокиназой резко снижается. Тогда как потребление глюкозы мозгом, эритроцитами и другими тканями обеспечивается активной в этих условиях гексокиназой. Фермент гексокиназа может катализировать фосфорилирование не только D-глюкозы, но и других гексоз, хотя и с меньшей скоростью. Активность гексокиназы изменяется в зависимости от потребностей клетки в энергии. В качестве регуляторов выступают соотношение АТФ/АДФ и внутриклеточный уровень глюкозо-6-фосфата (продукта катализируемой реакции). При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфата. В этом случае активность гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку. Следует отметить, что в разных тканях гексокиназа присутствует в различных изоформах, отличающихся величиной Кm. Глюкокиназа печени (и почек) является изоформой IV (гексокиназа IV). В клетках мышц содержится гексокиназа II, а в клетках опухолевых тканей преобладает гексокиназа III, с более высоким, чем у гексокиназы II, сродством к глюкозе.
Дефосфорилирование глюкозо-6-фосфата Превращение глюкозо-6-фосфата в глюкозу возможно в печени, почках и клетках эпителия кишечника. В клетках этих органов имеется фермент глюкозо-6-фосфатаза, катализирующая отщепление фосфатной группы гидролитическим путём:
Глюкозо-6-фосфат +Н2О → Глюкоза + Н3РО4
Образовавшаяся свободная глюкоза способна диффундировать из этих органов в кровь. В других органах и тканях глюкозо-6-фосфатазы нет, и поэтому дефосфорилирование глюкозо-6-фосфата невозможно. Пример подобного необратимого проникновения глюкозы в клетку - мышцы, где глюкозо-6-фосфат может использоваться только в метаболизме этой клетки.
Метаболизм глюкозо-6-фосфата Глюкозо-6-фосфат может использоваться в клетке в различных превращениях, основными из которых являются: синтез гликогена, катаболизм с образованием СО2 и Н2О или лактата, синтез пентоз. Распад глюкозы до конечных продуктов служит источником энергии для организма. Вместе с тем в процессе метаболизма глюкозо-6-фосфата образуются промежуточные продукты, используемые в дальнейшем для синтеза аминокислот, нуклеотидов, глицерина и жирных кислот. Таким образом, глюкозо-6-фосфат - не только субстрат для окисления, но и строительный материал для синтеза новых соединений.
