
- •2.Характеристика белковых веществ. Элементарный состав белка. Значение белков для организма: белки – ферменты, белки – гормоны, структурные белки, белки – рецепторы, транспортные белки, антитела.
- •3. Аминокислоты как структурные элементы белка. Классификация аминокислот. Физико-химические свойства аминокислот. Общность строения, оптическая изомерия, амфотерность, сродство радикалов к воде.
- •4. Структурная организация белков. Типы связей, участвующие в формировании первичной, вторичной, третичной и четвертичной структур.
- •5. Физико-химические свойства белков. Денатурация белка. Использование процесса денатурации в медицине.
- •1)Белки –коллоидные растворы.
- •2) Суммарный заряд белка.
- •3)Растворимость
- •4)Амфотерность (за счёт аминокислот, см. 2 вопрос)
- •6. Белки как амфотерные электролиты. Поведение белков в электрическом поле. Электрофорез. Применение его во врачебной практике. Изометрическая точка белков. Определение суммарного заряда белка.
- •7. Классификация белков. Важнейшие представители протеинов и протеидов. Биологические функции белков.
- •8. Нуклеопротеиды. Химический состав белковой и простетической группы. Структурные компоненты нуклеиновых кислот. Номенклатура нуклеотидов, нуклеозидов, азотистых оснований. Их химическое строение.
- •9. Гемоглобин. Строение и свойства. Окси-, карбокси-,карб- метгемоглобин. Вариации первичной структуры и свойства гемоглобина. Гемоглобинопатии.
- •10. Хромопротеиды. Гемоглобин, миоглобин, каталаза, цитохромоксидаза, цитохромы. Их химическая природа и значение для организма.
- •12. Фосфопротеиды. Способ связи простетической группы с белковым компонентом. Значение в обмене веществ. Металлопротеиды и их биологическая роль в тканевом дыхании.
- •13. Липопротеиды. Химическое строение, представители, роль в обмене веществ. Состав и строение транспортных липопротеидов крови.
- •15. Роль и значение ферментов в процессе жизнедеятельности. Ферменты как биологические катализаторы. Химическая природа ферментов. Ферменты простые и сложные. Апофермент и кофермент.
- •Особенности ферментов как биологических катализаторов
- •16. Понятие об изоферментах. Лактатдегидрогеназа. Определение изоферментов с целью диагностики болезней.
- •17. Ингибиторы ферментов. Типы ингибирования. Конкурентное, неконкурентное,аллостерическое ингибирование. Использование ингибиторов ферментов в качестве лекарств.
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Смешанное ингибирование
- •1)Действие многих лекарственных средств
- •18. Изменение активности ферментов при заболеваниях. Наследственные энзимопатии. Определение активности ферментов в плазме с целью диагностики болезней.
- •19. Ферменты пищеварительной системы, гидролизующие углеводы, липиды, белки.
- •20. Особенности ферментативного катализа. Специфичность действия ферментов. Особенности ферментативного катализа.
- •21. Кинетика ферментативных реакций. Факторы, определяющие скорость ферментативных реакций. Кинетика ферментативных реакций –
- •22. Активный центр и механизм действия ферментов, специфичность.
- •23. Кофакторы ферментов и их роль в катализе. Витамины - как предшественники коферментов. Гиповитаминозы, их причины и проявления.
- •24. Современная классификация ферментов. Номенклатура. Тип катализируемых реакций. Примеры.
- •Изменение активности фермента при фосфорилировании-дефосфорилировании
- •26. Регуляция активности ферментов путем ассоциации/диссоциации протомеров.
- •27. Применение ферментов в медицине. Энзимодиагностика и энзимотерапия.
- •29. Биосинтез днк (репликация). Принцип комплементарности азотистых оснований. Биологический генетический код.
- •30. Биосинтез рнк (транскрипция), рнк-полимеразы. Типы рнк и их биологическая роль.
- •31. Современные представления о синтезе белка. Регуляция биосинтеза белка.
- •32. Витамины. Понятие о гипо- и гипервитаминозах. Механизм действия витаминов. Классификация витаминов. Важнейшие представители витаминов. Их биологическое значение.
- •33. Жирорастворимые витамины. Витамин а. Химическая природа, свойства, распространение, потребность, роль в обмене веществ. Авитаминозы.
- •34. Витамины группы д. Химическая природа и свойства. Роль в обмене веществ. Биохимическая характеристика патогенеза рахита.
- •35. Витамин е. Химическое строение, свойства, роль в обмене веществ.
- •36. Витамин к. Химическое строение, свойства, роль в обмене веществ.
- •37. Водорастворимые витамины. Витамин в1 . Химическая природа нарушений в обмене веществ при в1 -авитаминозе. Распространение, потребность.
- •38. Витамин в2 . Химическое строение, распространение, суточная потребность, участие в построении флавиновых ферментов. Авитаминоз.
- •39. Витамин в6 , его производные. Химическое строение, распространение, суточная потребность, симптомы авитаминозов. Коферментная роль витамина в6 .
- •41. Пантотеновая кислота. П-аминобензойная кислота. Химическая природа, свойства, роль в обмене веществ. Авитаминозы.
- •42. Витамин н (биотин). Биологическая роль, участие в обмене веществ. Химическая природа, авитаминоз.
- •43. Фолиевая кислота. Тетрагидрофолиевая кислота. Синтез одноуглеродистых радикалов. Химическая природа, биологическая роль. Авитаминозы. Участие в обмене веществ.
- •44. Витамин с. Авитаминоз. Химическая природа, содержание в пищевых продуктах, потребность, роль в обмене веществ.
- •45. Гомоны. Химическая природа,механизм действия,их роль в регуляции обмена веществ.
- •47. Гормоны панкреатической(поджелудочной) железы.
- •48. Гормоны мозгового вещества надпочечников.
- •49. Гормоны коры надпочесников.
- •50. Гормоны передней доли гипофиза.
- •51. Гормоны задней доли гипофиза.
- •52. Механизм действия гормонов.Мембранный и внутриклеточный типы гормоныльной регуляции.
- •53. Аденилатциклазная система передачи сигналов,роль g-белков в трансдукции сигнала.
- •55. Окислительное декарбоксилирование пирувата.
- •56. Окисление ацетил-КоА в цикле Кребса. Связь между общими путями катаболизма и цепью переноса электронов и протонов. Цикл трикарбоновых кислот
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •57. Механизм образования атф. Окислительное фосфорилирование. Отличие от субстратного фосфорилирования.
- •58. Углеводы пищи: строение, переваривание. Механизмы трансмембранного переноса глюкозы. Примеры нарушения переваривания углеводов.
- •59. Метаболизм глюкозы в клетках.
- •61. Аэробное окисление углеводов. Ферменты, участвующие в этих процессах.
- •62. Анаэробное расщепление глюкозы в тканях. Гликолиз и гликогенолиз. Ферменты, роль этого процесса.
- •63. Глюконеогенез. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори).
- •64. Апотомический распад углеводов. Биологическое значение пентозофосфатного цикла.
- •Значение пентозофосфатного пути
- •65. Энергетический выход окисления одной молекулы глюкозы при гликолизе, аэробном окислении и прямом окислении. Регуляция углеводного обмена
- •67.Значение белков в питании. Азотистый баланс и азотистое равновесие. Заменимые и незаменимые аминокислоты.
- •69. Катаболизм аминокислот (реакция дезаминирования).
- •71. Обмен аммиака. Механизм токсического действия аммиака. Связывание (обезвреживание) аммиака.
- •72. Орнитиновый цикл (цикл мочевины). Наследственные нарушения орнитинового цикла и их основные проявления.
- •73. Заменимые и незаменимые а/к. Биосинтез заменимых.
- •74. Обмен серина и глицина. Роль фолиевой кислоты в обмене аминокислот. Участие глицина в синтезе креатина и глутатиона.
- •75. Особенности обмена метионина. Синтез фосфатидилхолина. Синтез карнитина. Синтез креатина и креатинфосфата.Образование цистеина из метионина.
- •79. Структура, классификация и свойства основных липидов организма человека. Химическое строение и биологическая роль. Фосфолипиды, сфинголипиды, цереброзиды, гликолипиды
- •80. Переваривание и всасывание липидов в жкт. Роль желчных кислот. Механизм всасывания жиров. Нарушения в переваривании липидов. Транспорт жиров из кишечника.
- •81. Современная теория окисления жирных кислот с четным и нечетным числом углеродных атомов. Общий выход энергии при окислении жирных кислот до со2 и н2о.
- •82. Пути образования и использования ацетоуксусной кислоты в организме. Нарушение и регуляция липидного обмена.
- •83. Биосинтез триацилглицеридов и фосфолипидов. Функции фосфолипидов. Регуляция и патология липидного обмена.
- •84. Обмен стероидов. Биосинтез холестерина. Холестерин как предшественник ряда других стероидов. Нарушение обмена холестерина.
- •85. Биосинтез жирных кислот. Регуляция синтеза жирных кислот. Источники цитоплазматического ацетил-КоА. Роль биотина, надфн2, апб в синтезе жирных кислот.
- •86. Синтез желчных кислот, регуляция процесса. Их роль в переваривании и всасывании липидов. Желчно-каменная болезнь.
- •87. Гиперхолестеролемия. Механизм развития атеросклероза и основные подходы к лечению.
- •88. Регуляция обмена углеводов, липидов и аминокислот.
- •89. Биохимические представления о сахарном диабете: важнейшие изменения гормонального статуса и метаболизма при сахарном диабете.
- •90. Регуляция водно-солевого обмена гормонами. Вазопрессин и альдостерон: строение и механизм действия.
- •91. Ренин-альдостерон-ангиотензиновая система. Биохимические механизмы развития почечной гипертонии. Нарушения водно-солевого обмена.
- •92. Паратгормон и кальцитонин: химическая природа, механизм действия, влияние на обмен кальция и фосфатов. Гипо- и гиперкальциемия.
- •95. Механизмы обезвреживания токсических веществ в печени. Микросомальное окисление. Реакции конъюгации.
- •96. Биотрансформация лекарств в печени.
- •98. Ферменты крови их диагностическое значение.
- •99. Структурная организация и основные компоненты мембран. Строение и функции липидов мембран
- •Характеристика мембранных белков
- •Липидный состав мембран
- •100. Избирательная проницаемость мембран. Механизмы переноса веществ через мембраны (примеры).
8. Нуклеопротеиды. Химический состав белковой и простетической группы. Структурные компоненты нуклеиновых кислот. Номенклатура нуклеотидов, нуклеозидов, азотистых оснований. Их химическое строение.
Нуклеопротеиды – это сложные белки, содержащие в качестве небелковой части нуклеиновые кислоты (до 65%).
НП состоят из 2-х частей: белковой (содержит гистоны и протамины, которые являясь основными белками, придают основные свойства) и простетической, представленной НК, сообщающими кислотные свойства. Взаимодействие между этими частями по ион-ионному механизму.
Все НП по составу НК можно разделить на 2 группы: рибонуклеопротеиды (РНП) и дезоксирибонуклеопротеиды (ДНП).
Состав нк:
НК – высокомолекулярные органические вещества, полинуклеотиды. Мономерами являются мононуклеотиды. Каждый мононуклеотид состоит из: углевода, азотистого основания и фосфорной кислоты. Так, РНК содержит -D-рибофуранозу (рибозу), одно из 4-х возможных азотистых оснований (А, Г, Ц или У) и остаток фосфорной кислоты. ДНК содержит -D-дезоксирибофуранозу (дезоксирибозу), одно из 4-х возможных азотистых оснований (А, Г, Ц или Т) и остаток фосфорной кислоты.
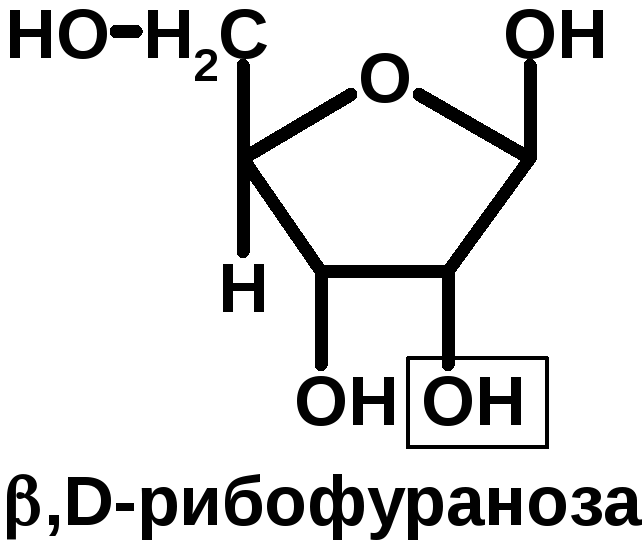
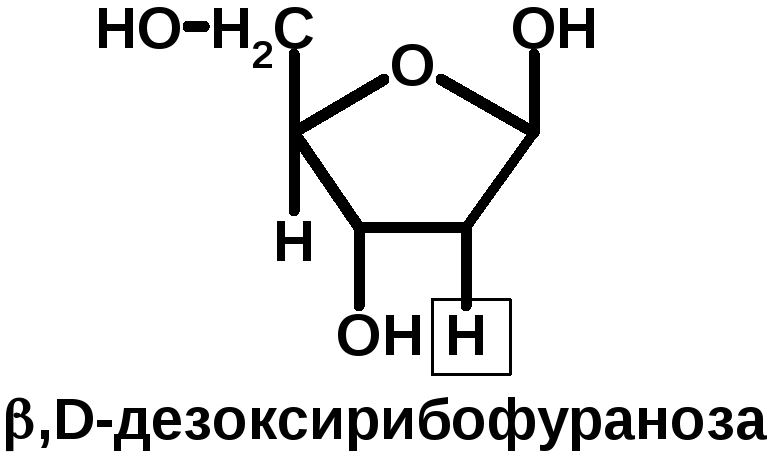
Строение азотистых оснований:
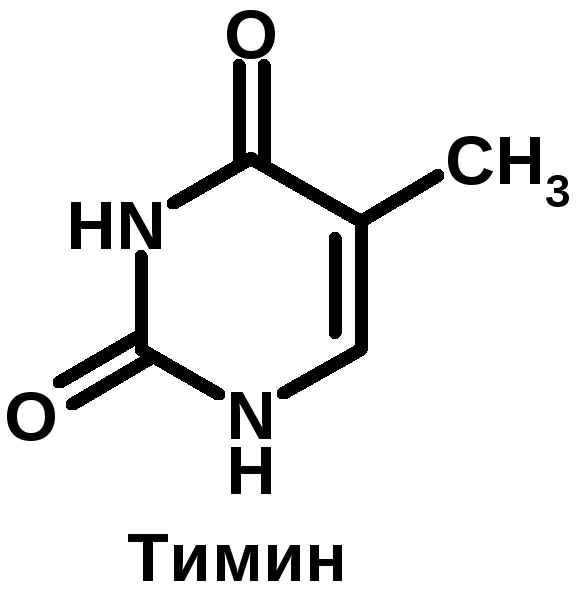
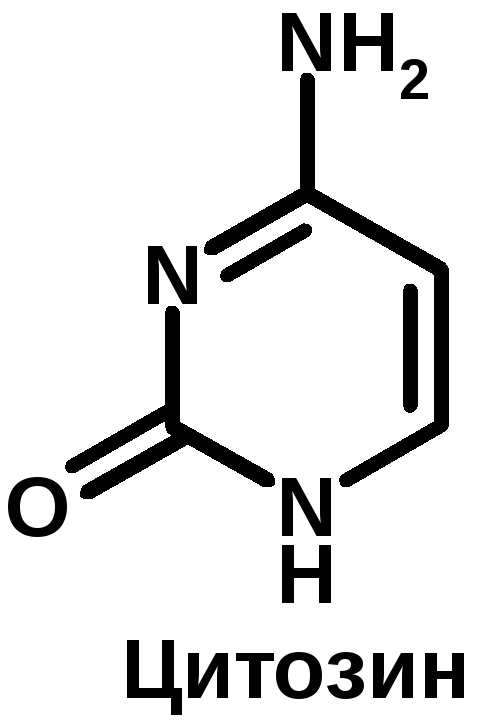
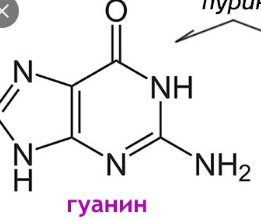
К группе пуриновых относятся аденин (6-аминопурин) и гуанин (2-амино-6-оксипурин). К группе пиримидиновых – урацил (2,4-диоксипиримидин), тимин (5-метилурацил) и цитозин (2-окси-4-аминопиримидин).
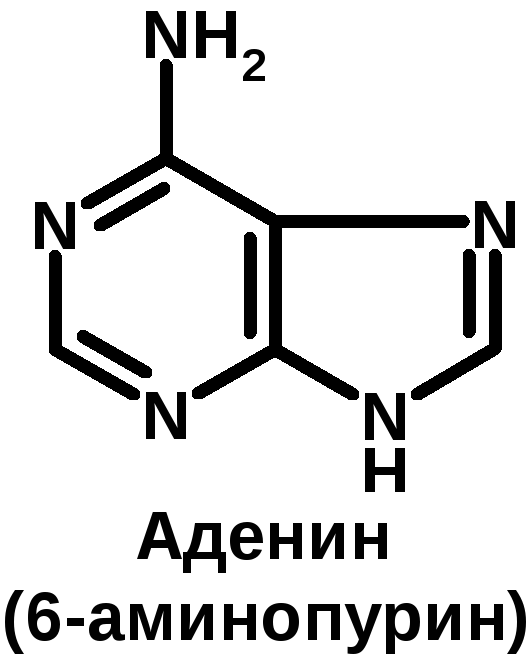
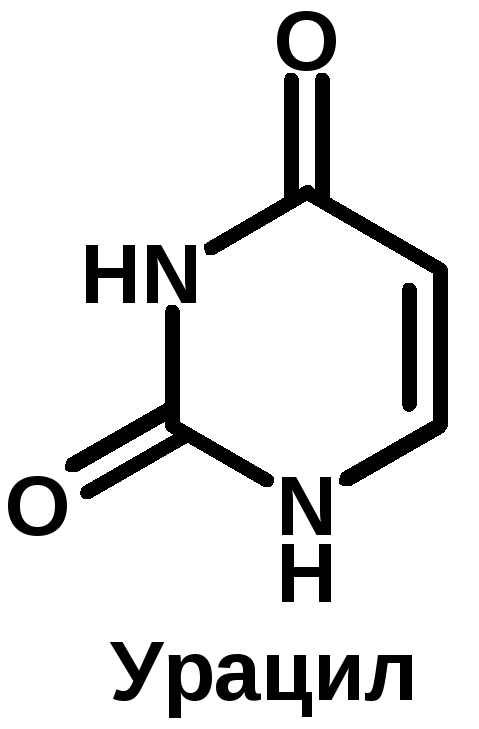
Структура нуклеиновых кислот:
Имеют несколько уровней структурной организации.
1. первичная структура. РНК и ДНК построены однотипно – представлены полинуклеотидной цепью, состоящей из отдельных мононуклеотодов, соединённых между собой 3’→5’-фосфодиэфирными связями. Эта связь образуется между фосфорным остатком одного мононуклеотида и 3’-ОН-группой пентозного остатка другого мононуклеотида. [рис. образования такой связи] Разные НК отличаются числом, порядком чередования и составом НК.
2. вторичная структура. По рентгеноструктурному анализу ДНК в 1953г Уотсон и Крик предложили модель строения ДНК, которая объясняла самовоспроизведение организмов, наследственную изменчивость. Вторичная структура представляет собой двойную спираль, состоящую из 2 полинуклеотидных цепей, закрученных вокруг одной общей оси. Эти цепи антипараллельны, т.е. одна идет в направлении 5’→3’, а другая 3’→5’. Пуриновому основанию одной цепи соответствует пиримидиновое основание другой цепи – эти основания комплиментарны друг другу, т.е. дополняют одно другое до целого. Между А и Т две водородные связи (А=Т), а между Г и Ц – 3 (ГЦ).
Молекула спирализована на всем протяжении, гидрофобные участки внутри спирали, их плоскости перпендикулярны основаниям и параллельны друг другу. В вертикальном направлении возникают гидрофобные взаимодействия. Вторичная структура стабилизируется водородными связями и гидрофобными взаимодействиями.
Вторичная структура РНК более простая, представляет собой одну полинуклеотидную цепь, в которой спирализованы лишь некоторые участки. Вторичная структура РНК представлена в виде клеверного листа. Для тРНК известна третичная структура в форме буквы Г. [рис. РНК в виде клеверного листа]
9. Гемоглобин. Строение и свойства. Окси-, карбокси-,карб- метгемоглобин. Вариации первичной структуры и свойства гемоглобина. Гемоглобинопатии.
Гемоглобин (Hb)- состоит из белка – глобина и железосодержащего гема. Глобин - белковый компонент, гем – небелковый. Гемоглобин относится к хромопротеидам. (Красный цвет придаёт железо). Видовые различия обусловлены глобином. Гем одинаков у всех видов Hb.
Гем- комплекс железа с порфирином. В основе структуры порфиринов лежит порфириновое кольцо, состоящее из 4-х пирольных колец. В природе порфирины входят в состав хлорофилла. Порфирины способны к флуоресценции.
Структура гемоглобина. Каждая молекула Hb состоит из 4-х субъединиц (протомеров), включающих гем и глобин. Протомеры соединены гидрофобными, ионными, водородными связями. Структура Hb обеспечивает наиболее удобное связывание кислорода.
Биологическая роль Hb . Hb находится в эритроцитах, переносит кислород от лёгких к тканям и углекислый газ от тканей к лёгким. Способен связывать углекислый газ, угарный газ, цианиды. Связывая протоны Н+, поддерживает постоянство РН в эритроцитах, выступая в роли внутриклеточного буфера. В 1 эритроците содержится 340 000 000 молекул Hb.

Гемоглобин, присоединяя некоторые молекулы или ионы образует несколько форм:
HbО2 (Fe2+) – окисленный (оксигемоглобин). Основная форма гемоглобина в артериальной крови -96-98%.
НHb (Fe2+) – восстановленный (дезоксигемоглобин). Содержится в венозной крови.
HbСО - карбоксигемоглобин. Образуется путём присоединения к Hb окиси углерода (СО угарного газа). Не способен переносить кислород . У здоровых – 0,25-2%, у новорожденных – 10-12%. Уровень СО Hb зависит от экологических факторов, вредных привычек, характера работы… У курильщиков – 7-10%, у таксистов – до 20%, при эпилепсии, коме, смерти – более 50%.
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
HbОН – метгемоглобин (Met Hb), содержит Fe 3+. Не способен переносить кислород. Появляется в крови при отравлении оксидами азота, нитробензолом, анилиновыми красителями. Концентрация в крови более 70% - смерть. Помощь – вдыхание чистого кислорода.
Вариации первичной структуры:
Hb взрослого организма состоит, как упомянуто выше, из двух α- и двух β-цепей (α2β2). Наряду с этой основной формой (HbA1) в крови присутствуют незначительные количества второй формы с более высоким сродством к O2, у второй β-цепи заменены δ-цепя-ми (HbA2, α2δ2). Две другие формы Hb встречаются только в эмбриональном периоде развития. В первые три месяца образуются эмбриональные гемоглобины состава α2ε2-P и α2γ2-F. Затем вплоть до рождения доминирует фетальный гемоглобин (HbF), который постепенно заменяется на первом месяце жизни на HbА. Эмбриональный и фетальный гемоглобины обладают более высоким сродством к О2 по сравнению с HbА, так как они должны переносить кислород из системы материнского кровообращения.
Гемоглобинопатии (от гемоглобин и греч. páthos — страдание, болезнь), гемоглобинозы, состояния, обусловленные присутствием в красных кровяных тельцах (эритроцитах) одного или нескольких аномальных (патологических) гемоглобинов. Выделено свыше 50 патологических разновидностей гемоглобина, возникших в результате врождённого, передаваемого по наследству дефекта образования белковой части гемоглобина — глобина. При аномалиях гемоглобина нарушаются физико-химические свойства эритроцитов, обменные процессы в них; эритроциты становятся менее устойчивыми к различным гемолизирующим факторам. Наиболее распространены и отличаются тяжестью проявлений серповидноклеточная (дрепаноцитарная) анемия и талассемия. Серповидноклеточная анемия (HbS) связана с наличием в эритроцитах патологического гемоглобина S (первая буква англицская side — серп). При этой форме Г. эритроциты в условиях снижения парциального давления кислорода в окружающей среде приобретают форму серпа. При увеличении в крови количества серповидных эритроцитов нарастает вязкость крови, замедляется кровоток, происходит разрушение серповидных эритроцитов, развиваются тромбозы в различных органах. У практически здоровых носителей HbS серповидность эритроцитов и появление признаков заболевания могут наступить лишь в условиях гипоксии. Поэтому всем носителям HbS противопоказаны служба в авиации, а также полёты на самолётах без достаточного кислородного обеспечения. Талассемия — заболевание, распространённое в средиземноморских странах. Характеризуется значительным повышением содержания HbF в крови. Полагают, что при этом образование нормального гемоглобина HbA подавлено. Нарушено также образование железосодержащей части гемоглобина (гема). Различают большую, малую и минимальную талассемию. Для всех форм талассемии характерно наличие в крови "мишеневидных" эритроцитов, в которых гемоглобин расположен в центре клетки в виде мишени.
