- •2.Характеристика белковых веществ. Элементарный состав белка. Значение белков для организма: белки – ферменты, белки – гормоны, структурные белки, белки – рецепторы, транспортные белки, антитела.
- •3. Аминокислоты как структурные элементы белка. Классификация аминокислот. Физико-химические свойства аминокислот. Общность строения, оптическая изомерия, амфотерность, сродство радикалов к воде.
- •4. Структурная организация белков. Типы связей, участвующие в формировании первичной, вторичной, третичной и четвертичной структур.
- •5. Физико-химические свойства белков. Денатурация белка. Использование процесса денатурации в медицине.
- •1)Белки –коллоидные растворы.
- •2) Суммарный заряд белка.
- •3)Растворимость
- •4)Амфотерность (за счёт аминокислот, см. 2 вопрос)
- •6. Белки как амфотерные электролиты. Поведение белков в электрическом поле. Электрофорез. Применение его во врачебной практике. Изометрическая точка белков. Определение суммарного заряда белка.
- •7. Классификация белков. Важнейшие представители протеинов и протеидов. Биологические функции белков.
- •8. Нуклеопротеиды. Химический состав белковой и простетической группы. Структурные компоненты нуклеиновых кислот. Номенклатура нуклеотидов, нуклеозидов, азотистых оснований. Их химическое строение.
- •9. Гемоглобин. Строение и свойства. Окси-, карбокси-,карб- метгемоглобин. Вариации первичной структуры и свойства гемоглобина. Гемоглобинопатии.
- •10. Хромопротеиды. Гемоглобин, миоглобин, каталаза, цитохромоксидаза, цитохромы. Их химическая природа и значение для организма.
- •12. Фосфопротеиды. Способ связи простетической группы с белковым компонентом. Значение в обмене веществ. Металлопротеиды и их биологическая роль в тканевом дыхании.
- •13. Липопротеиды. Химическое строение, представители, роль в обмене веществ. Состав и строение транспортных липопротеидов крови.
- •15. Роль и значение ферментов в процессе жизнедеятельности. Ферменты как биологические катализаторы. Химическая природа ферментов. Ферменты простые и сложные. Апофермент и кофермент.
- •Особенности ферментов как биологических катализаторов
- •16. Понятие об изоферментах. Лактатдегидрогеназа. Определение изоферментов с целью диагностики болезней.
- •17. Ингибиторы ферментов. Типы ингибирования. Конкурентное, неконкурентное,аллостерическое ингибирование. Использование ингибиторов ферментов в качестве лекарств.
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Смешанное ингибирование
- •1)Действие многих лекарственных средств
- •18. Изменение активности ферментов при заболеваниях. Наследственные энзимопатии. Определение активности ферментов в плазме с целью диагностики болезней.
- •19. Ферменты пищеварительной системы, гидролизующие углеводы, липиды, белки.
- •20. Особенности ферментативного катализа. Специфичность действия ферментов. Особенности ферментативного катализа.
- •21. Кинетика ферментативных реакций. Факторы, определяющие скорость ферментативных реакций. Кинетика ферментативных реакций –
- •22. Активный центр и механизм действия ферментов, специфичность.
- •23. Кофакторы ферментов и их роль в катализе. Витамины - как предшественники коферментов. Гиповитаминозы, их причины и проявления.
- •24. Современная классификация ферментов. Номенклатура. Тип катализируемых реакций. Примеры.
- •Изменение активности фермента при фосфорилировании-дефосфорилировании
- •26. Регуляция активности ферментов путем ассоциации/диссоциации протомеров.
- •27. Применение ферментов в медицине. Энзимодиагностика и энзимотерапия.
- •29. Биосинтез днк (репликация). Принцип комплементарности азотистых оснований. Биологический генетический код.
- •30. Биосинтез рнк (транскрипция), рнк-полимеразы. Типы рнк и их биологическая роль.
- •31. Современные представления о синтезе белка. Регуляция биосинтеза белка.
- •32. Витамины. Понятие о гипо- и гипервитаминозах. Механизм действия витаминов. Классификация витаминов. Важнейшие представители витаминов. Их биологическое значение.
- •33. Жирорастворимые витамины. Витамин а. Химическая природа, свойства, распространение, потребность, роль в обмене веществ. Авитаминозы.
- •34. Витамины группы д. Химическая природа и свойства. Роль в обмене веществ. Биохимическая характеристика патогенеза рахита.
- •35. Витамин е. Химическое строение, свойства, роль в обмене веществ.
- •36. Витамин к. Химическое строение, свойства, роль в обмене веществ.
- •37. Водорастворимые витамины. Витамин в1 . Химическая природа нарушений в обмене веществ при в1 -авитаминозе. Распространение, потребность.
- •38. Витамин в2 . Химическое строение, распространение, суточная потребность, участие в построении флавиновых ферментов. Авитаминоз.
- •39. Витамин в6 , его производные. Химическое строение, распространение, суточная потребность, симптомы авитаминозов. Коферментная роль витамина в6 .
- •41. Пантотеновая кислота. П-аминобензойная кислота. Химическая природа, свойства, роль в обмене веществ. Авитаминозы.
- •42. Витамин н (биотин). Биологическая роль, участие в обмене веществ. Химическая природа, авитаминоз.
- •43. Фолиевая кислота. Тетрагидрофолиевая кислота. Синтез одноуглеродистых радикалов. Химическая природа, биологическая роль. Авитаминозы. Участие в обмене веществ.
- •44. Витамин с. Авитаминоз. Химическая природа, содержание в пищевых продуктах, потребность, роль в обмене веществ.
- •45. Гомоны. Химическая природа,механизм действия,их роль в регуляции обмена веществ.
- •47. Гормоны панкреатической(поджелудочной) железы.
- •48. Гормоны мозгового вещества надпочечников.
- •49. Гормоны коры надпочесников.
- •50. Гормоны передней доли гипофиза.
- •51. Гормоны задней доли гипофиза.
- •52. Механизм действия гормонов.Мембранный и внутриклеточный типы гормоныльной регуляции.
- •53. Аденилатциклазная система передачи сигналов,роль g-белков в трансдукции сигнала.
- •55. Окислительное декарбоксилирование пирувата.
- •56. Окисление ацетил-КоА в цикле Кребса. Связь между общими путями катаболизма и цепью переноса электронов и протонов. Цикл трикарбоновых кислот
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •57. Механизм образования атф. Окислительное фосфорилирование. Отличие от субстратного фосфорилирования.
- •58. Углеводы пищи: строение, переваривание. Механизмы трансмембранного переноса глюкозы. Примеры нарушения переваривания углеводов.
- •59. Метаболизм глюкозы в клетках.
- •61. Аэробное окисление углеводов. Ферменты, участвующие в этих процессах.
- •62. Анаэробное расщепление глюкозы в тканях. Гликолиз и гликогенолиз. Ферменты, роль этого процесса.
- •63. Глюконеогенез. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори).
- •64. Апотомический распад углеводов. Биологическое значение пентозофосфатного цикла.
- •Значение пентозофосфатного пути
- •65. Энергетический выход окисления одной молекулы глюкозы при гликолизе, аэробном окислении и прямом окислении. Регуляция углеводного обмена
- •67.Значение белков в питании. Азотистый баланс и азотистое равновесие. Заменимые и незаменимые аминокислоты.
- •69. Катаболизм аминокислот (реакция дезаминирования).
- •71. Обмен аммиака. Механизм токсического действия аммиака. Связывание (обезвреживание) аммиака.
- •72. Орнитиновый цикл (цикл мочевины). Наследственные нарушения орнитинового цикла и их основные проявления.
- •73. Заменимые и незаменимые а/к. Биосинтез заменимых.
- •74. Обмен серина и глицина. Роль фолиевой кислоты в обмене аминокислот. Участие глицина в синтезе креатина и глутатиона.
- •75. Особенности обмена метионина. Синтез фосфатидилхолина. Синтез карнитина. Синтез креатина и креатинфосфата.Образование цистеина из метионина.
- •79. Структура, классификация и свойства основных липидов организма человека. Химическое строение и биологическая роль. Фосфолипиды, сфинголипиды, цереброзиды, гликолипиды
- •80. Переваривание и всасывание липидов в жкт. Роль желчных кислот. Механизм всасывания жиров. Нарушения в переваривании липидов. Транспорт жиров из кишечника.
- •81. Современная теория окисления жирных кислот с четным и нечетным числом углеродных атомов. Общий выход энергии при окислении жирных кислот до со2 и н2о.
- •82. Пути образования и использования ацетоуксусной кислоты в организме. Нарушение и регуляция липидного обмена.
- •83. Биосинтез триацилглицеридов и фосфолипидов. Функции фосфолипидов. Регуляция и патология липидного обмена.
- •84. Обмен стероидов. Биосинтез холестерина. Холестерин как предшественник ряда других стероидов. Нарушение обмена холестерина.
- •85. Биосинтез жирных кислот. Регуляция синтеза жирных кислот. Источники цитоплазматического ацетил-КоА. Роль биотина, надфн2, апб в синтезе жирных кислот.
- •86. Синтез желчных кислот, регуляция процесса. Их роль в переваривании и всасывании липидов. Желчно-каменная болезнь.
- •87. Гиперхолестеролемия. Механизм развития атеросклероза и основные подходы к лечению.
- •88. Регуляция обмена углеводов, липидов и аминокислот.
- •89. Биохимические представления о сахарном диабете: важнейшие изменения гормонального статуса и метаболизма при сахарном диабете.
- •90. Регуляция водно-солевого обмена гормонами. Вазопрессин и альдостерон: строение и механизм действия.
- •91. Ренин-альдостерон-ангиотензиновая система. Биохимические механизмы развития почечной гипертонии. Нарушения водно-солевого обмена.
- •92. Паратгормон и кальцитонин: химическая природа, механизм действия, влияние на обмен кальция и фосфатов. Гипо- и гиперкальциемия.
- •95. Механизмы обезвреживания токсических веществ в печени. Микросомальное окисление. Реакции конъюгации.
- •96. Биотрансформация лекарств в печени.
- •98. Ферменты крови их диагностическое значение.
- •99. Структурная организация и основные компоненты мембран. Строение и функции липидов мембран
- •Характеристика мембранных белков
- •Липидный состав мембран
- •100. Избирательная проницаемость мембран. Механизмы переноса веществ через мембраны (примеры).
71. Обмен аммиака. Механизм токсического действия аммиака. Связывание (обезвреживание) аммиака.
В основном аммиак образуется в результате дезаминирования аминокислот. Так же в результате гниения под действием бактерий микрофлоры кишечника.
Аммиак – очень токсичное вещество, особенно для нервной системы. При физиологических значениях рН молекула NН3 легко превращается в ион аммония NН4+, который не способен проникать через биологические мембраны и задерживается в клетке. Накопление NН4+ вызывает торможение заключительных этапов цикла трикарбоновых кислот и снижение продукции АТФ. Поэтому в организме существует ряд механизмов связывания (обезвреживания) аммиака.
Аммиак, образующийся в тканях, сначала превращается в нетоксичное соединение и в таком виде переносится кровью к печени или почкам. Такими транспортными формами являются аминокислоты глутамин, аспарагин и аланин.
Глутамин - нейтральное нетоксичное соединение, способное легко проходить через клеточные мембраны. В виде этой аминокислоты аммиак транспортируется в крови. В крови здоровых людей содержание глутамина существенно превышает содержание других аминокислот. Глутамин, помимо участия в синтезе белка, служит источником азота в биосинтезе гистидина, глюкозамина, пуриновых и пиримидиновых нуклеотидов. С кровью глутамин поступает в печень и почки. Здесь он под действием фермента глутаминазы превращается в глутамат и аммиак. При участии аспарагиназы также происходит образование аммиака из аспарагина.
Аланин является транспортной формой аммиака, которая образуется преимущественно в мышцах. При интенсивной физической нагрузке источниками аммиака служат реакции дезаминирования аминокислот и аденозинмонофосфата (АМФ). Сначала аммиак превращается в аминогруппу глутамата в реакции восстановительного аминирования, катализируемой глутаматдегидрогеназой при взаимодействии с альфа-кетоглуторатом
NH3+ альфа-кетоглуторат + глутаматдегидрогиназа= глутамат.
Образовавшийся глутамат переносит затем свою α-аминогруппу на пируват, всегда имеющийся в достаточном количестве, поскольку это продукт протекающего в мышцах гликолиза. Реакция катализируется аланинаминотрансферазой.
Глутамат
+ Пируват  α-Кетоглутарат
+ Аланин
α-Кетоглутарат
+ Аланин
Аланин (нейтральная аминокислота, не несущая суммарного заряда при значениях рН, близких к 7) выходит из клеток и доставляется кровью к печени. Здесь он под действием аланинаминотрансферазы передаёт свою аминогруппу α-кетоглутарату, в результате чего образуется глутамат.
α-Кетоглутарат + Аланин Глутамат + Пируват
Далее в реакции, катализируемой глутаматдегидрогеназой, глутамат дезаминируется с образованием α-кетоглутарата и аммиака, который в печени превращается в мочевину.
72. Орнитиновый цикл (цикл мочевины). Наследственные нарушения орнитинового цикла и их основные проявления.
Для удаления аммиака есть два способа
Практически весь аммиак удаляется из организма:
с мочой в виде мочевины, которая синтезируется в печени,
в виде образующихся в эпителии канальцев почек солей иона аммония.
В клетки печени и почек аммиак попадает в составе глутамина и аспарагина, глутаминовой кислоты, аланина и в свободном виде. Кроме этого, при метаболизме он образуется в большом количестве и в самих гепатоцитах.
В клетке глутамин и аспарагин дезаминируются соответственно глутаминазой и аспарагиназой с образованием аммиака (точнее, иона аммония).
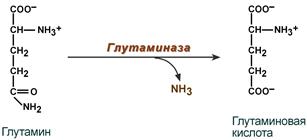
Реакция дезаминирования глутамина
Аланин вступает в реакцию трансаминирования. Образованный в результате реакции пируват идет в глюконеогенез или энергетический обмен. Параллельно образуется глутаминовая кислота.
В целом глутаминовая кислота в гепатоците может появляться тремя путями: 1) из крови, 2) при дезаминировании глутамина, 3) при трансаминировании α-кетоглутарата с аспартатом или аланином. Происхождение и дальнейшая ее судьба зависит от конкретных концентраций всех задействованных веществ. Обычно далее глутамат дезаминируется глутаматдегидрогеназой с образованием аммиака.
Синтез мочевины
В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма. Определение концентрации мочевины в крови является ценным диагностическим показателем.
Реакции синтеза мочевины являются циклическим процессом и получили название орнитиновый цикл. Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.
В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ.
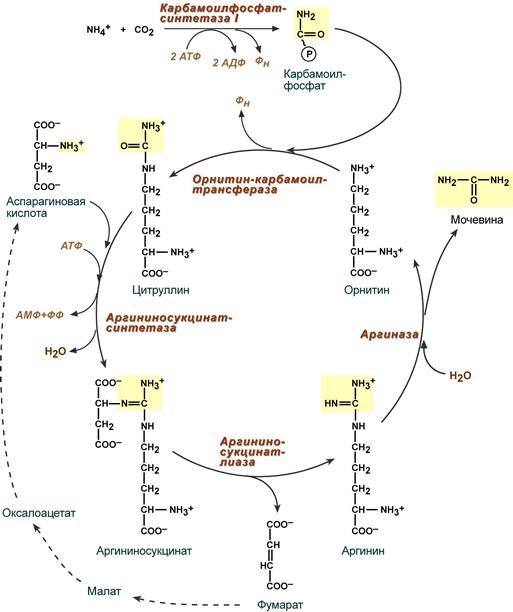
Реакция синтеза карбамоилфосфата и орнитиновый цикл
Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
В противоположность аммиаку мочевина является нетоксичным и нейтральным соединением. При хронической почечной недостаточности, когда продукты азотистого обмена не выводятся из организма, токсичное действие на организм оказывает совсем не мочевина, а совокупность более чем 200 других веществ.
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови — гипераммониемию, что оказывает токсическое действие на организм.
Причинами гипераммониемии могут быть:
1. генетические дефекты ферментов орнитинового цикла в печени;
2. вторичное поражение печени в результате цирроза, гепатита или других заболеваний.
Известны пять наследственных заболеваний, обусловленные дефектом пяти ферментов орнитинового цикла.
Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников.
При гипераммониемиях I и II типа происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой.
Тяжесть течения заболевания зависит также от степени снижения активности ферментов.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака (до 6000 мкмоль/л), глутамина и аланина.

Гипераммониемия сопровождается появлением следующих симптомов:
· тошнота, повторяющаяся рвота;
· головокружение, тремор, судорожные припадки;
· нечленораздельная речь;
· потеря сознания, отёк мозга (в тяжёлых случаях);
· отставание умственного развития (при хронической врождённой форме).
· В тяжёлых случаях развивается кома с летальным исходом.
Все симптомы гипераммониемии — проявление действия аммиака на ЦНС.
Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени.
Орнитиновый цикл в печени выполняет 2 функции:
превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
синтез аргинина и пополнение его фонда в организме.
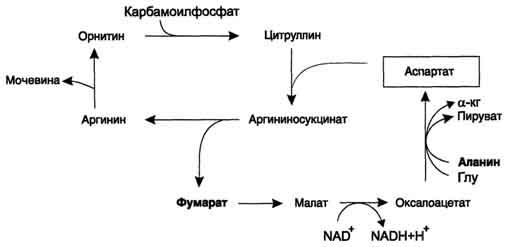
Взаимосвязь орнитинового цикла и общего пути катаболизма:
Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК(кребса) и дегидрируется с образованием оксалоацетата. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины.
С регеном аспартата:
Аспартат, необходимый для синтеза аргининосукцината, образуется в печени путём трансаминирования аланина с оксалоацетатом. Аланин поступает главным образом из мышц и клеток кишечника. Источником оксалоацетата, необходимого для этой реакции, можно считать превращение фумарата, образующегося в реакциях орнитинового цикла. Фумарат в результате двух реакций цитратного цикла превращается в оксалоацетат, из которого путём трансаминирования образуется аспартат (рис. 9-17). Таким образом, с орнитиновым циклом сопряжён цикл регенерации аспартата из фумарата. Пируват, образующийся в этом цикле из аланина, используется для глюконеогенеза.
Ещё одним источником аспартата для орнитинового цикла является трансаминирование глутамата с оксалоацетатом.