
- •2.Характеристика белковых веществ. Элементарный состав белка. Значение белков для организма: белки – ферменты, белки – гормоны, структурные белки, белки – рецепторы, транспортные белки, антитела.
- •3. Аминокислоты как структурные элементы белка. Классификация аминокислот. Физико-химические свойства аминокислот. Общность строения, оптическая изомерия, амфотерность, сродство радикалов к воде.
- •4. Структурная организация белков. Типы связей, участвующие в формировании первичной, вторичной, третичной и четвертичной структур.
- •5. Физико-химические свойства белков. Денатурация белка. Использование процесса денатурации в медицине.
- •1)Белки –коллоидные растворы.
- •2) Суммарный заряд белка.
- •3)Растворимость
- •4)Амфотерность (за счёт аминокислот, см. 2 вопрос)
- •6. Белки как амфотерные электролиты. Поведение белков в электрическом поле. Электрофорез. Применение его во врачебной практике. Изометрическая точка белков. Определение суммарного заряда белка.
- •7. Классификация белков. Важнейшие представители протеинов и протеидов. Биологические функции белков.
- •8. Нуклеопротеиды. Химический состав белковой и простетической группы. Структурные компоненты нуклеиновых кислот. Номенклатура нуклеотидов, нуклеозидов, азотистых оснований. Их химическое строение.
- •9. Гемоглобин. Строение и свойства. Окси-, карбокси-,карб- метгемоглобин. Вариации первичной структуры и свойства гемоглобина. Гемоглобинопатии.
- •10. Хромопротеиды. Гемоглобин, миоглобин, каталаза, цитохромоксидаза, цитохромы. Их химическая природа и значение для организма.
- •12. Фосфопротеиды. Способ связи простетической группы с белковым компонентом. Значение в обмене веществ. Металлопротеиды и их биологическая роль в тканевом дыхании.
- •13. Липопротеиды. Химическое строение, представители, роль в обмене веществ. Состав и строение транспортных липопротеидов крови.
- •15. Роль и значение ферментов в процессе жизнедеятельности. Ферменты как биологические катализаторы. Химическая природа ферментов. Ферменты простые и сложные. Апофермент и кофермент.
- •Особенности ферментов как биологических катализаторов
- •16. Понятие об изоферментах. Лактатдегидрогеназа. Определение изоферментов с целью диагностики болезней.
- •17. Ингибиторы ферментов. Типы ингибирования. Конкурентное, неконкурентное,аллостерическое ингибирование. Использование ингибиторов ферментов в качестве лекарств.
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Смешанное ингибирование
- •1)Действие многих лекарственных средств
- •18. Изменение активности ферментов при заболеваниях. Наследственные энзимопатии. Определение активности ферментов в плазме с целью диагностики болезней.
- •19. Ферменты пищеварительной системы, гидролизующие углеводы, липиды, белки.
- •20. Особенности ферментативного катализа. Специфичность действия ферментов. Особенности ферментативного катализа.
- •21. Кинетика ферментативных реакций. Факторы, определяющие скорость ферментативных реакций. Кинетика ферментативных реакций –
- •22. Активный центр и механизм действия ферментов, специфичность.
- •23. Кофакторы ферментов и их роль в катализе. Витамины - как предшественники коферментов. Гиповитаминозы, их причины и проявления.
- •24. Современная классификация ферментов. Номенклатура. Тип катализируемых реакций. Примеры.
- •Изменение активности фермента при фосфорилировании-дефосфорилировании
- •26. Регуляция активности ферментов путем ассоциации/диссоциации протомеров.
- •27. Применение ферментов в медицине. Энзимодиагностика и энзимотерапия.
- •29. Биосинтез днк (репликация). Принцип комплементарности азотистых оснований. Биологический генетический код.
- •30. Биосинтез рнк (транскрипция), рнк-полимеразы. Типы рнк и их биологическая роль.
- •31. Современные представления о синтезе белка. Регуляция биосинтеза белка.
- •32. Витамины. Понятие о гипо- и гипервитаминозах. Механизм действия витаминов. Классификация витаминов. Важнейшие представители витаминов. Их биологическое значение.
- •33. Жирорастворимые витамины. Витамин а. Химическая природа, свойства, распространение, потребность, роль в обмене веществ. Авитаминозы.
- •34. Витамины группы д. Химическая природа и свойства. Роль в обмене веществ. Биохимическая характеристика патогенеза рахита.
- •35. Витамин е. Химическое строение, свойства, роль в обмене веществ.
- •36. Витамин к. Химическое строение, свойства, роль в обмене веществ.
- •37. Водорастворимые витамины. Витамин в1 . Химическая природа нарушений в обмене веществ при в1 -авитаминозе. Распространение, потребность.
- •38. Витамин в2 . Химическое строение, распространение, суточная потребность, участие в построении флавиновых ферментов. Авитаминоз.
- •39. Витамин в6 , его производные. Химическое строение, распространение, суточная потребность, симптомы авитаминозов. Коферментная роль витамина в6 .
- •41. Пантотеновая кислота. П-аминобензойная кислота. Химическая природа, свойства, роль в обмене веществ. Авитаминозы.
- •42. Витамин н (биотин). Биологическая роль, участие в обмене веществ. Химическая природа, авитаминоз.
- •43. Фолиевая кислота. Тетрагидрофолиевая кислота. Синтез одноуглеродистых радикалов. Химическая природа, биологическая роль. Авитаминозы. Участие в обмене веществ.
- •44. Витамин с. Авитаминоз. Химическая природа, содержание в пищевых продуктах, потребность, роль в обмене веществ.
- •45. Гомоны. Химическая природа,механизм действия,их роль в регуляции обмена веществ.
- •47. Гормоны панкреатической(поджелудочной) железы.
- •48. Гормоны мозгового вещества надпочечников.
- •49. Гормоны коры надпочесников.
- •50. Гормоны передней доли гипофиза.
- •51. Гормоны задней доли гипофиза.
- •52. Механизм действия гормонов.Мембранный и внутриклеточный типы гормоныльной регуляции.
- •53. Аденилатциклазная система передачи сигналов,роль g-белков в трансдукции сигнала.
- •55. Окислительное декарбоксилирование пирувата.
- •56. Окисление ацетил-КоА в цикле Кребса. Связь между общими путями катаболизма и цепью переноса электронов и протонов. Цикл трикарбоновых кислот
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •57. Механизм образования атф. Окислительное фосфорилирование. Отличие от субстратного фосфорилирования.
- •58. Углеводы пищи: строение, переваривание. Механизмы трансмембранного переноса глюкозы. Примеры нарушения переваривания углеводов.
- •59. Метаболизм глюкозы в клетках.
- •61. Аэробное окисление углеводов. Ферменты, участвующие в этих процессах.
- •62. Анаэробное расщепление глюкозы в тканях. Гликолиз и гликогенолиз. Ферменты, роль этого процесса.
- •63. Глюконеогенез. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори).
- •64. Апотомический распад углеводов. Биологическое значение пентозофосфатного цикла.
- •Значение пентозофосфатного пути
- •65. Энергетический выход окисления одной молекулы глюкозы при гликолизе, аэробном окислении и прямом окислении. Регуляция углеводного обмена
- •67.Значение белков в питании. Азотистый баланс и азотистое равновесие. Заменимые и незаменимые аминокислоты.
- •69. Катаболизм аминокислот (реакция дезаминирования).
- •71. Обмен аммиака. Механизм токсического действия аммиака. Связывание (обезвреживание) аммиака.
- •72. Орнитиновый цикл (цикл мочевины). Наследственные нарушения орнитинового цикла и их основные проявления.
- •73. Заменимые и незаменимые а/к. Биосинтез заменимых.
- •74. Обмен серина и глицина. Роль фолиевой кислоты в обмене аминокислот. Участие глицина в синтезе креатина и глутатиона.
- •75. Особенности обмена метионина. Синтез фосфатидилхолина. Синтез карнитина. Синтез креатина и креатинфосфата.Образование цистеина из метионина.
- •79. Структура, классификация и свойства основных липидов организма человека. Химическое строение и биологическая роль. Фосфолипиды, сфинголипиды, цереброзиды, гликолипиды
- •80. Переваривание и всасывание липидов в жкт. Роль желчных кислот. Механизм всасывания жиров. Нарушения в переваривании липидов. Транспорт жиров из кишечника.
- •81. Современная теория окисления жирных кислот с четным и нечетным числом углеродных атомов. Общий выход энергии при окислении жирных кислот до со2 и н2о.
- •82. Пути образования и использования ацетоуксусной кислоты в организме. Нарушение и регуляция липидного обмена.
- •83. Биосинтез триацилглицеридов и фосфолипидов. Функции фосфолипидов. Регуляция и патология липидного обмена.
- •84. Обмен стероидов. Биосинтез холестерина. Холестерин как предшественник ряда других стероидов. Нарушение обмена холестерина.
- •85. Биосинтез жирных кислот. Регуляция синтеза жирных кислот. Источники цитоплазматического ацетил-КоА. Роль биотина, надфн2, апб в синтезе жирных кислот.
- •86. Синтез желчных кислот, регуляция процесса. Их роль в переваривании и всасывании липидов. Желчно-каменная болезнь.
- •87. Гиперхолестеролемия. Механизм развития атеросклероза и основные подходы к лечению.
- •88. Регуляция обмена углеводов, липидов и аминокислот.
- •89. Биохимические представления о сахарном диабете: важнейшие изменения гормонального статуса и метаболизма при сахарном диабете.
- •90. Регуляция водно-солевого обмена гормонами. Вазопрессин и альдостерон: строение и механизм действия.
- •91. Ренин-альдостерон-ангиотензиновая система. Биохимические механизмы развития почечной гипертонии. Нарушения водно-солевого обмена.
- •92. Паратгормон и кальцитонин: химическая природа, механизм действия, влияние на обмен кальция и фосфатов. Гипо- и гиперкальциемия.
- •95. Механизмы обезвреживания токсических веществ в печени. Микросомальное окисление. Реакции конъюгации.
- •96. Биотрансформация лекарств в печени.
- •98. Ферменты крови их диагностическое значение.
- •99. Структурная организация и основные компоненты мембран. Строение и функции липидов мембран
- •Характеристика мембранных белков
- •Липидный состав мембран
- •100. Избирательная проницаемость мембран. Механизмы переноса веществ через мембраны (примеры).
64. Апотомический распад углеводов. Биологическое значение пентозофосфатного цикла.
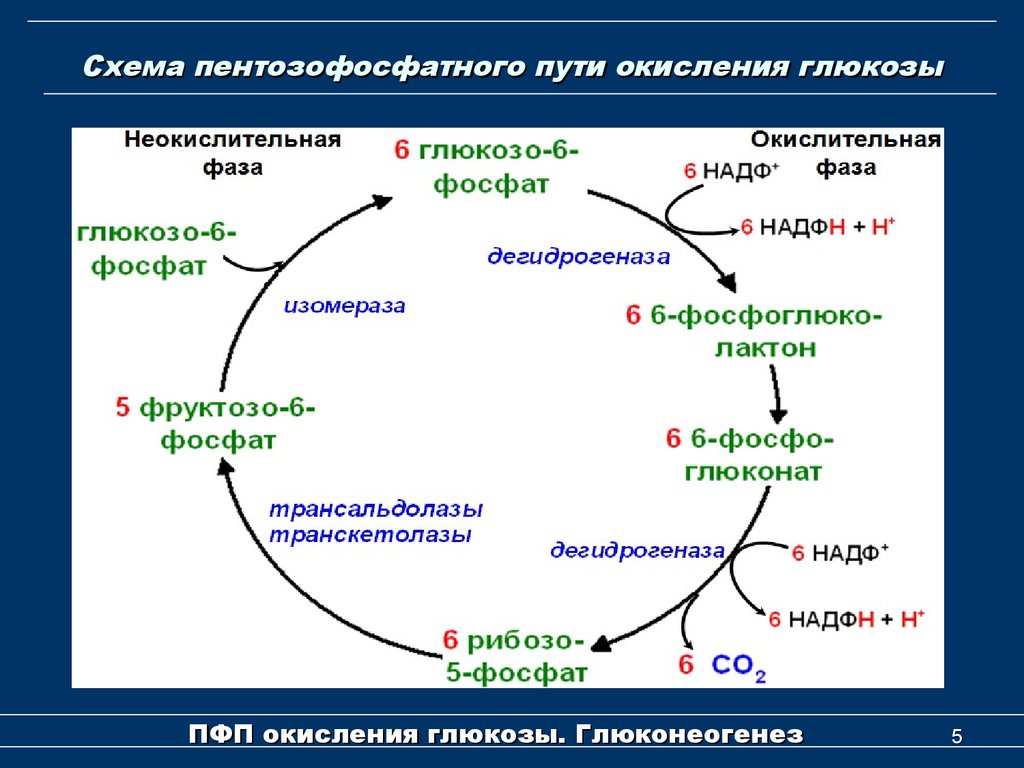 Пентозофосфатный
путь (ПФП)
Наиболее активно реакции ПФП идут в
цитозоле клеток печени, жировой ткани,
эритроцитах, коре надпочечников, молочной
железе при лактации, в гораздо меньшей
степени в скелетных мышцах. Этот путь
окисления глюкозы не связан с образованием
энергии, а обеспечивает анаболизм
клеток. (у детей первых лет жизни
активность ПФП высокая).
Пентозофосфатный
путь (ПФП)
Наиболее активно реакции ПФП идут в
цитозоле клеток печени, жировой ткани,
эритроцитах, коре надпочечников, молочной
железе при лактации, в гораздо меньшей
степени в скелетных мышцах. Этот путь
окисления глюкозы не связан с образованием
энергии, а обеспечивает анаболизм
клеток. (у детей первых лет жизни
активность ПФП высокая).
Пентозофосфатный путь включает два этапа – окислительный и этап структурных перестроек (неокислительный).
На первом этапе (окислительном) глюкозо-6- фосфат превращается в рибулозо-5-фосфат, реакции сопровождаются восстановлением двух молекул НАДФ до НАДФН. На этом этапе происходит регуляция процесса: инсулин повышает активность глюкозо-6- фосфатдегидрогеназы и фосфоглюконат-дегидрогеназы.
Первая реакция. Катализатор — глюкозо-6-фосфатдегидрогеназа. Кофермент реакции НАДФ. В ходе этой реакции от молекулы глюкозо-6-фосфата отщепляется два водорода. При этом НАДФ присоединяет к себе гидрид ион. Гидрид ион состоит из протона водорода и двух электронов. Образуется глюконолактон-6-фосфат и НАДФH. Один протон отправляется в цитоплазму.Вторая реакция. Фермент — глюконолактон-гидратаза. У неё есть название попроще — лактоназа. Лактоназа присоединяет молекулу воды по нестабильной связи, что приводит к её разрушению. В ходе этой реакции образуется 6-фосфоглюконат. Третья реакция. Катализирует реакцию 6-фосфоглюконатдегидрогеназа, а её кофермент — НАДФ. В этой реакции происходят два важных момента: глюконат теряет карбоксильную группу, и от пентозы отщепляются два водорода. Продукты реакции — рибулозо-5-фосфат и НАДФH.
Второй этап – этап структурных перестроек, Молекулы рибулозо-5- фосфата изомеризуются до рибозо-5- фосфата и ксилулозо-5- фосфата. Конечные продукты реакций : фруктозо-6- фосфат и глицеральдегидфосфат ( реакции гликолиза) (пентозофосфатный путь называют шунт , или обходной путь окисления глюкозы). Глицеральдегид-3-фосфат в зависимости от условий и вида клеток может уйти во 2-й этап гликолиза.
Значение пентозофосфатного пути
Значение первого этапа пентозофосфатного пути заключается в синтезе НАДФН и рибозо-5-фосфата.
Образованный НАДФН используется:
для синтеза жирных кислот
1.холестерола и других стероидов,
2.для синтеза глутаминовой кислоты из α-кетоглутаровой кислоты (реакция восстановительного аминирования),
3.для синтеза дезоксирибонуклеотидов,
4.для систем защиты клетки от свободно-радикального окисления (антиоксидантная защита).
Рибозо-5-фосфат абсолютно необходим для синтеза пуриновых и пиримидиновых нуклеотидов и нуклеиновых кислот.
При определенных условиях клетка может подключать второй неокислительный этап. Благодаря этому рибозо-5-фосфат не будет накапливаться и его углероды перейдут в состав фруктозо-6-фосфата (например, в эритроците) и уйдут в гликолиз. Либо глицеральдегид-3-фосфат восстановится до глицерол- 3-фосфата и будет использован для синтеза триацилглицеролов.
65. Энергетический выход окисления одной молекулы глюкозы при гликолизе, аэробном окислении и прямом окислении. Регуляция углеводного обмена
При гликолизе 1 молекулы глюкозы образуются 2 молекулы пирувата и 2 молекулы АТФ.
В аэробных условиях глюкоза окисляется до СО2 и Н2О. Суммарное уравнение:
С6Н12О6 + 6О2 → 6СО2+ 6Н2О + 2880 кДж/моль.
Этот процесс включает несколько стадий:
1.Аэробный гликолиз. В нем происходит окисления 1 глюкозы до 2 ПВК, с образованием 2 АТФ (сначала 2 АТФ затрачиваются, затем 4 образуются) и 2 НАДН2;
2.Превращение 2 ПВК в 2 ацетил-КоА с выделением 2 СО2 и образованием 2 НАДН2;
3.ЦТК. В нем происходит окисление 2 ацетил-КоА с выделением 4 СО2, образованием 2 ГТФ (дают 2 АТФ), 6 НАДН2 и 2 ФАДН2;
4.Цепь окислительного фосфорилирования. В ней происходит окисления 10 (8) НАДН2, 2 (4) ФАДН2 с участием 6 О2, при этом выделяется 6 Н2О и синтезируется 34 (32) АТФ.
+В результате аэробного окисления глюкозы образуется 38 (36) АТФ, из них: 4 АТФ в реакциях субстратного фосфорилирования, 34 (32) АТФ в реакциях окислительного фосфорилирования. КПД аэробного окисления составит 65%.
Прямое окисление (пфп)

Регуляция
К гормонам, которые влияют на углеводный обмен, принадлежат пептиды инсулин и глюкагон, глюкокортикоид кортизол и катехоламин адреналин. Инсулин индуцирует синтез de novo гликоген-синтазы, а также некоторых ферментов гликолиза. Одновременно инсулин подавляет синтез ключевых ферментов глюконеогенеза (репрессия). Глюкагон как антагонист инсулина действует в противоположном направлении: индуцирует ферменты глюконеогенеза и репрессирует пируваткиназу, ключевой фермент гликолиза. Другие аффекты глюкагона основаны на взаимопревращении ферментов и опосредованы вторичным мессенджером цАМФ. По этому механизму тормозится синтез гликогена и активируется расщепление гликогена. Подобным образом действует и адреналин. Торможение пируваткиназы глюкагоном также обусловлено взаимопревращением ферментов.
Глюкокортикоиды, прежде всего кортизол, индуцируют все ключевые ферменты глюконеогенеза. Одновременно они индуцируют ферменты деградации аминокислот и обеспечивают тем самым глюконеогенез исходными соединениями.
Метаболиты. Высокие концентрации АТФ (АТР) и цитрата тормозят гликолиз путем аллостерической регуляции фосфофруктокиназы. Кроме того, АТФ тормозит пируваткиназу. Ингибитором пируваткиназы является ацетил-КоА. Все эти метаболиты образуются при распаде глюкозы (торможение конечным продуктом). АМФ (AMP), сигнал дефицита АТФ, активирует расщепление гликогена и тормозит глюконеогенез.
Б. Фруктозо-2,6-дифосфат
Важную роль в обмене веществ в печени играет фруктозо-2,6-дифосфат. Это сигнальное вещество образуется в незначительных количествах из фруктозо-6-фосфата и выполняет чисто регуляторную функцию: стимулирует гликолиз путем активации фосфофруктокиназы и подавляет глюконеогенез с помощью торможения фруктозо-1,5-дифосфатазы.
Образование и распад фруктозо-2,6-дифосфата катализируются одним и тем же белком. В нефосфорилированной форме этот белок вызывает образование фруктозо-2,6-дифосфата . После фосфорилирования цАМФ-зависимой киназой он действует как фосфатаза и катализирует превращение фруктозо-2,6-дифосфата в фруктозо-6-фосфат. В присутствии адреналина и глюкагона в клетках печени повышается уровень цАМФ, т.е. оба гормона воздействуют как на гликолиз, так и на глюконеогенез. Суммарным результатом является быстрое повышение уровня глюкозы в крови.
66. Переваривание и всасывание белков в жкт.
Механизм действия протеолитических ферментов.Гниение белков в кишечнике под влиянием микроорганизмов.Обезвреживание продуктов гниения.
В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их количество входит в состав белков, которые гидролизуются в ЖКТ под действием ферментов протеаз. Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей. В ротовой полости переваривания и всасывания белков не происходит.Желудочный сок - продукт нескольких типов клеток. Обкладочные (париетальные) клетки стенок желудка образуют соляную кислоту, главные клетки секретируют пепсиноген. Добавочные и другие клетки эпителия желудка выделяют муцинсодержащую слизь. Париетальные клетки секретируют в полость желудка также гликопротеин, который называют "внутренним фактором" (фактором Касла). Этот белок связывает "внешний фактор" - витамин В12, предотвращает его разрушение и способствует всасыванию. В тонком кишечнике полипептиды подвергаются дальнейшему расщеплению проте- азами, имеющимися в соке поджелудочной железы и на поверхности микроворсинок энтероцитов. Различные панкреатические ферменты атакуют белковую молекулу в разных участках. Ферменты, гидролизирующие белки, подразделяют на эндопептидазы (трипсин, химотрипсин, эластаза) и экзопептидазы (карбопептидазы А и В). Эндопептидазы гидролизуют внутренние связи пептидов, а экзопептидазы отщепляют только концевые группы преимущественно нейтральных и основных аминокислот. В тонком отделе кишечника происходит дальнейший гидролиз пептидов до аминокислот. Туда поступает панкреатический сок,который содержит неактивные предшественники протеаз: трипсиноген, химотрипсиноген, прокарбоксипептидазу, проэластазу. Слизистой кишечника вырабатывается фермент энтеропептидаза, который активирует трипсиноген до трипсина, а последний уже все остальные ферменты. Протеолитические ферменты содержатся также в клетках слизистой кишечника, поэтому гидролиз небольших пептидов происходит после их всасывания. Конечный результат действия ферментов желудка и кишечника – расщепление почти всей массы пищевых белков до свободных аминокислот. Протеолиз — процесс ферментативного гидролиза белков, катализирующийся протеолитическими ферментами (протеазами). Действие протеолитических ферментов может быть разделено на две различные категории:
-ограниченный протеолиз, в котором протеаза специфически расщепляет одну или несколько пептидных связей в белке-мишени, что обычно приводит к изменению функционального состояния последнего: ферменты, например, при этом становятся активными, а прогормоны превращаются в гормоны;
-неограниченный или тотальный протеолиз, при котором белки распадаются до своих аминокислот.
Образование токсичных продуктов из аминокислот под действием микроорганизмов кишечника называют гниением белков в кишечнике. Ферменты бактерий расщепляют аминокислоты и превращают их в амины, фенолы, индол, скатол, сероводород и другие ядовитые для организма соединения. Под действием ферментов бактерий из аминокислоты тирозина могут образовываться фенол и крезол путём разрушения боковых цепей аминокислот микробами. Эти вещества всасываются клетками кишечника, транспортируются кровью по воротной вене в печень, где обезвреживание фенола и крезола может происходить путём конъюгации с остатком серной или с глюкуроновой кислотой в составе УДФ-глюкуроната. Конъюгация глюкуроновых кислот с фенолом и крезолом происходит при участии фермента УДФ-глюкуронилтрансферазы. Продукты конъюгации хорошо растворимы в воде и выводятся с мочой через почки. В кишечнике из аминокислоты триптофана микроорганизмы образуют индол и скатол. Бактерии разрушают боковую цепь триптофана, оставляя нетронутой кольцевую структуру.Индол образуется в результате отщепления бактериями боковой цепи, в виде серина или аланина. Скатол и индол обезвреживаются в печени в 2 этапа. Сначала в результате микросомального окисления они приобретают гидроксильную группу. Так, индол переходит в индоксил, а затем вступает в реакцию конъюгации с ФАФС, образуя индоксилсерную кислоту, калиевая соль которой получила название животного индикана. Синтез гиппуровой кислоты из бензойной кислоты и глицина протекает у человека и большинства животных преимущественно в печени.
.Значение белков в питании.Баланс азота,азотистое равновесие,заменимые и незаменимые аминокислоты.
+Белки выполняют функцию основного строительного материала для роста и обновления клеток. Они входят в состав гормонов, ферментов и антител. Важнейшей функцией пищевых белков является обеспечение организма пластическим материалом. Основным источником, восполняющим фонд аминокислот организма, являются белки пищи. Аминокислоты (свободные и в составе белков) содержат почти 95% всего азота, поэтому баланс азота в организме является показателем состояния белкового и аминокислотного обмена. Азотистый баланс определяют как разницу между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей). Азотистый баланс может быть равным нулю (азотистое равновесие)- у здорового человека при сбалансированном питании количество поступающего азота в сутки равно количеству выделяемого.Незмаменимые аминокислоты- те аминокислоты, синтез которых сложен и неэкономичен для организма, которые выгоднее получать с пищей. К ним относят фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин. Две аминокислоты - аргинин и гистидин - у взрослых образуются в достаточных количествах, однако детям для нормального роста организма необходимо дополнительное поступление этих аминокислот с пищей. Поэтому их называют частично заменимыми. Две другие аминокислоты - тирозин и цистеин - условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты. Тирозин синтезируется из фенилаланина, а для образования цистеина необходим атом серы метионина. Остальные аминокислоты легко синтезируются в клетках и называются заменимыми. К ним относят глицин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, серии, пролин, аланин. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеаз, то биологическая ценность такого белка условно принимается за 100, и он считается полноценным. К таким относят белки яиц и молока.
