- •2.Характеристика белковых веществ. Элементарный состав белка. Значение белков для организма: белки – ферменты, белки – гормоны, структурные белки, белки – рецепторы, транспортные белки, антитела.
- •3. Аминокислоты как структурные элементы белка. Классификация аминокислот. Физико-химические свойства аминокислот. Общность строения, оптическая изомерия, амфотерность, сродство радикалов к воде.
- •4. Структурная организация белков. Типы связей, участвующие в формировании первичной, вторичной, третичной и четвертичной структур.
- •5. Физико-химические свойства белков. Денатурация белка. Использование процесса денатурации в медицине.
- •1)Белки –коллоидные растворы.
- •2) Суммарный заряд белка.
- •3)Растворимость
- •4)Амфотерность (за счёт аминокислот, см. 2 вопрос)
- •6. Белки как амфотерные электролиты. Поведение белков в электрическом поле. Электрофорез. Применение его во врачебной практике. Изометрическая точка белков. Определение суммарного заряда белка.
- •7. Классификация белков. Важнейшие представители протеинов и протеидов. Биологические функции белков.
- •8. Нуклеопротеиды. Химический состав белковой и простетической группы. Структурные компоненты нуклеиновых кислот. Номенклатура нуклеотидов, нуклеозидов, азотистых оснований. Их химическое строение.
- •9. Гемоглобин. Строение и свойства. Окси-, карбокси-,карб- метгемоглобин. Вариации первичной структуры и свойства гемоглобина. Гемоглобинопатии.
- •10. Хромопротеиды. Гемоглобин, миоглобин, каталаза, цитохромоксидаза, цитохромы. Их химическая природа и значение для организма.
- •12. Фосфопротеиды. Способ связи простетической группы с белковым компонентом. Значение в обмене веществ. Металлопротеиды и их биологическая роль в тканевом дыхании.
- •13. Липопротеиды. Химическое строение, представители, роль в обмене веществ. Состав и строение транспортных липопротеидов крови.
- •15. Роль и значение ферментов в процессе жизнедеятельности. Ферменты как биологические катализаторы. Химическая природа ферментов. Ферменты простые и сложные. Апофермент и кофермент.
- •Особенности ферментов как биологических катализаторов
- •16. Понятие об изоферментах. Лактатдегидрогеназа. Определение изоферментов с целью диагностики болезней.
- •17. Ингибиторы ферментов. Типы ингибирования. Конкурентное, неконкурентное,аллостерическое ингибирование. Использование ингибиторов ферментов в качестве лекарств.
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Смешанное ингибирование
- •1)Действие многих лекарственных средств
- •18. Изменение активности ферментов при заболеваниях. Наследственные энзимопатии. Определение активности ферментов в плазме с целью диагностики болезней.
- •19. Ферменты пищеварительной системы, гидролизующие углеводы, липиды, белки.
- •20. Особенности ферментативного катализа. Специфичность действия ферментов. Особенности ферментативного катализа.
- •21. Кинетика ферментативных реакций. Факторы, определяющие скорость ферментативных реакций. Кинетика ферментативных реакций –
- •22. Активный центр и механизм действия ферментов, специфичность.
- •23. Кофакторы ферментов и их роль в катализе. Витамины - как предшественники коферментов. Гиповитаминозы, их причины и проявления.
- •24. Современная классификация ферментов. Номенклатура. Тип катализируемых реакций. Примеры.
- •Изменение активности фермента при фосфорилировании-дефосфорилировании
- •26. Регуляция активности ферментов путем ассоциации/диссоциации протомеров.
- •27. Применение ферментов в медицине. Энзимодиагностика и энзимотерапия.
- •29. Биосинтез днк (репликация). Принцип комплементарности азотистых оснований. Биологический генетический код.
- •30. Биосинтез рнк (транскрипция), рнк-полимеразы. Типы рнк и их биологическая роль.
- •31. Современные представления о синтезе белка. Регуляция биосинтеза белка.
- •32. Витамины. Понятие о гипо- и гипервитаминозах. Механизм действия витаминов. Классификация витаминов. Важнейшие представители витаминов. Их биологическое значение.
- •33. Жирорастворимые витамины. Витамин а. Химическая природа, свойства, распространение, потребность, роль в обмене веществ. Авитаминозы.
- •34. Витамины группы д. Химическая природа и свойства. Роль в обмене веществ. Биохимическая характеристика патогенеза рахита.
- •35. Витамин е. Химическое строение, свойства, роль в обмене веществ.
- •36. Витамин к. Химическое строение, свойства, роль в обмене веществ.
- •37. Водорастворимые витамины. Витамин в1 . Химическая природа нарушений в обмене веществ при в1 -авитаминозе. Распространение, потребность.
- •38. Витамин в2 . Химическое строение, распространение, суточная потребность, участие в построении флавиновых ферментов. Авитаминоз.
- •39. Витамин в6 , его производные. Химическое строение, распространение, суточная потребность, симптомы авитаминозов. Коферментная роль витамина в6 .
- •41. Пантотеновая кислота. П-аминобензойная кислота. Химическая природа, свойства, роль в обмене веществ. Авитаминозы.
- •42. Витамин н (биотин). Биологическая роль, участие в обмене веществ. Химическая природа, авитаминоз.
- •43. Фолиевая кислота. Тетрагидрофолиевая кислота. Синтез одноуглеродистых радикалов. Химическая природа, биологическая роль. Авитаминозы. Участие в обмене веществ.
- •44. Витамин с. Авитаминоз. Химическая природа, содержание в пищевых продуктах, потребность, роль в обмене веществ.
- •45. Гомоны. Химическая природа,механизм действия,их роль в регуляции обмена веществ.
- •47. Гормоны панкреатической(поджелудочной) железы.
- •48. Гормоны мозгового вещества надпочечников.
- •49. Гормоны коры надпочесников.
- •50. Гормоны передней доли гипофиза.
- •51. Гормоны задней доли гипофиза.
- •52. Механизм действия гормонов.Мембранный и внутриклеточный типы гормоныльной регуляции.
- •53. Аденилатциклазная система передачи сигналов,роль g-белков в трансдукции сигнала.
- •55. Окислительное декарбоксилирование пирувата.
- •56. Окисление ацетил-КоА в цикле Кребса. Связь между общими путями катаболизма и цепью переноса электронов и протонов. Цикл трикарбоновых кислот
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •57. Механизм образования атф. Окислительное фосфорилирование. Отличие от субстратного фосфорилирования.
- •58. Углеводы пищи: строение, переваривание. Механизмы трансмембранного переноса глюкозы. Примеры нарушения переваривания углеводов.
- •59. Метаболизм глюкозы в клетках.
- •61. Аэробное окисление углеводов. Ферменты, участвующие в этих процессах.
- •62. Анаэробное расщепление глюкозы в тканях. Гликолиз и гликогенолиз. Ферменты, роль этого процесса.
- •63. Глюконеогенез. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори).
- •64. Апотомический распад углеводов. Биологическое значение пентозофосфатного цикла.
- •Значение пентозофосфатного пути
- •65. Энергетический выход окисления одной молекулы глюкозы при гликолизе, аэробном окислении и прямом окислении. Регуляция углеводного обмена
- •67.Значение белков в питании. Азотистый баланс и азотистое равновесие. Заменимые и незаменимые аминокислоты.
- •69. Катаболизм аминокислот (реакция дезаминирования).
- •71. Обмен аммиака. Механизм токсического действия аммиака. Связывание (обезвреживание) аммиака.
- •72. Орнитиновый цикл (цикл мочевины). Наследственные нарушения орнитинового цикла и их основные проявления.
- •73. Заменимые и незаменимые а/к. Биосинтез заменимых.
- •74. Обмен серина и глицина. Роль фолиевой кислоты в обмене аминокислот. Участие глицина в синтезе креатина и глутатиона.
- •75. Особенности обмена метионина. Синтез фосфатидилхолина. Синтез карнитина. Синтез креатина и креатинфосфата.Образование цистеина из метионина.
- •79. Структура, классификация и свойства основных липидов организма человека. Химическое строение и биологическая роль. Фосфолипиды, сфинголипиды, цереброзиды, гликолипиды
- •80. Переваривание и всасывание липидов в жкт. Роль желчных кислот. Механизм всасывания жиров. Нарушения в переваривании липидов. Транспорт жиров из кишечника.
- •81. Современная теория окисления жирных кислот с четным и нечетным числом углеродных атомов. Общий выход энергии при окислении жирных кислот до со2 и н2о.
- •82. Пути образования и использования ацетоуксусной кислоты в организме. Нарушение и регуляция липидного обмена.
- •83. Биосинтез триацилглицеридов и фосфолипидов. Функции фосфолипидов. Регуляция и патология липидного обмена.
- •84. Обмен стероидов. Биосинтез холестерина. Холестерин как предшественник ряда других стероидов. Нарушение обмена холестерина.
- •85. Биосинтез жирных кислот. Регуляция синтеза жирных кислот. Источники цитоплазматического ацетил-КоА. Роль биотина, надфн2, апб в синтезе жирных кислот.
- •86. Синтез желчных кислот, регуляция процесса. Их роль в переваривании и всасывании липидов. Желчно-каменная болезнь.
- •87. Гиперхолестеролемия. Механизм развития атеросклероза и основные подходы к лечению.
- •88. Регуляция обмена углеводов, липидов и аминокислот.
- •89. Биохимические представления о сахарном диабете: важнейшие изменения гормонального статуса и метаболизма при сахарном диабете.
- •90. Регуляция водно-солевого обмена гормонами. Вазопрессин и альдостерон: строение и механизм действия.
- •91. Ренин-альдостерон-ангиотензиновая система. Биохимические механизмы развития почечной гипертонии. Нарушения водно-солевого обмена.
- •92. Паратгормон и кальцитонин: химическая природа, механизм действия, влияние на обмен кальция и фосфатов. Гипо- и гиперкальциемия.
- •95. Механизмы обезвреживания токсических веществ в печени. Микросомальное окисление. Реакции конъюгации.
- •96. Биотрансформация лекарств в печени.
- •98. Ферменты крови их диагностическое значение.
- •99. Структурная организация и основные компоненты мембран. Строение и функции липидов мембран
- •Характеристика мембранных белков
- •Липидный состав мембран
- •100. Избирательная проницаемость мембран. Механизмы переноса веществ через мембраны (примеры).
3)Растворимость
Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется:
наличием заряда и взаимоотталкиванием заряженных молекул белка,
наличием гидратной оболочки – окружение молекулы диполями воды и взаимодействие их с полярными и заряженными группами на поверхности глобулы белка. Чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка.
4)Амфотерность (за счёт аминокислот, см. 2 вопрос)
Денатурация – необратимое осаждение белков из-за разрыва связей вторичной, третичной и четвертичной структуры белка. Сохраняется первичная структура белка и последовательность АК. Нарушается пространственная структура белка. Белок не способен выполнять свою функцию. Виды денатурации: физическая и химическая.
Физическая – сопровождается разрывом связей в молекуле белка. (повышение t, рентгеновские лучи, СВЧ, УФ – лучи)
Химическая. Действие кислот и щелочей уменьшает число ионных связей. Ионы тяжелых металлов образуют комплексные соединения с молекулой белка, происходит разрыв ионных и водородных связей. Органические растворители образуют водородные связи и вызывают дегидратацию.
Большинство белков денатурирует и выпадает в осадок при t + 50-70 гр.С, или при подкислении раствора до РН = 5. Ренатурация – восстановление физико- химических свойств белка (если вовремя удалить денатурирующий агент). Обусловлена сохранением первичной структуры белка.
Значение в медицине: Большинство белков теряют биологическую активность в присутствии кислот или оснований, мочевины, тяжелых металлов (Ag, Pb, Hg), органических растворителей, при нагревании, при интенсивном встряхивании раствора. Денатурированные белки плохо растворимы в воде , способны выпадать в осадок. Это свойство широко используется в клинической лаборатории. Пробы крови или сыворотки, взятые для анализа на содержание в них малых молекул (глюкозы, мочевой кислоты, лекарственных препаратов), сначала обрабатывают трихлоруксусной кислотой для осаждения белка. Осадок удаляют центрифугированием, а свободную от белка надосадочную жидкость анализируют.
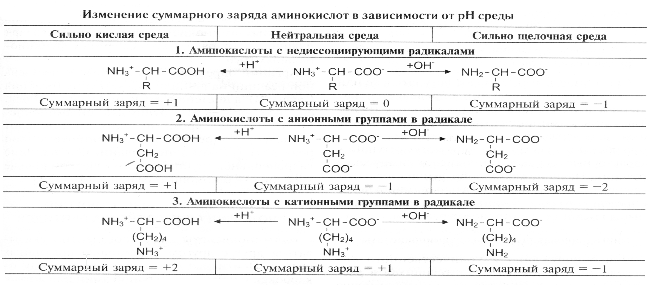
6. Белки как амфотерные электролиты. Поведение белков в электрическом поле. Электрофорез. Применение его во врачебной практике. Изометрическая точка белков. Определение суммарного заряда белка.
При изучении химического состава белка было установлено, что в его молекуле имеются свободные аминные (NH2) и карбоксильные (СООН) группы, которые в растворе находятся в виде NH3 и СООН. Следовательно, белки в растворе обладают амфотерными свойствами (амфолит, амфион). При пропускании электрического тока белки будут передвигаться в зависимости от заряда белковой молекулы к катоду или аноду (рис. 10).

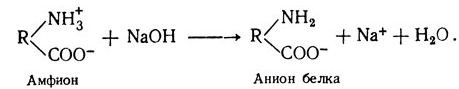
В щелочных растворах белок играет роль аниона: например, при действии едкого натра происходит потеря Н+ из NH+3:
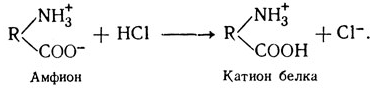
В кислых растворах, наоборот, белок играет роль катиона, как в случае с соляной кислотой:
Таким образом, фактором, определяющим поведение белка как аниона или катиона, является концентрация водородных ионов, или значение рН среды. При повышении концентрации водородных ионов (среда кислая - рН 0-7) белок становится катионом, при ее понижении (среда щелочная- рН 7 -14), наоборот, белковые частицы становятся анионами. Такая способность белка проявлять или кислотные, или щелочные свойства характеризует его как амфотерное соединение.
Однако при определенных значениях рН число положительных зарядов белка будет равно числу отрицательных и заряд молекулы в целом будет практически равен нулю. Белковая молекула не будет перемещаться в электрическом поле. При этих условиях белок находится в изоэлектрическом состоянии; рН раствора, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой. Изоэлектрическая точка большинства природных белков лежит в слабокислой среде (рН 4,8-5,4). Молекула таких белков содержит больше карбоксильных групп, чем аминных. Это свидетельствует о том, что в их составе содержится больше дикарбоновых аминокислот (см. Аминокислоты). В изоэлектрической точке белок находится в наименее устойчивом состоянии и при незначительных изменениях рН среды в кислую или щелочную сторону он легко выпадает в осадок.
Амфотерность белков лежит в основе белковой буферной системы, которая участвует в поддержании определенной реакции среды крови. Амфотерные свойства белков используются для разделения их на отдельные фракции (метод электрофореза) с целью диагностики различных заболеваний и контроля за состоянием больного.
Электрофорез белков - способ разделения смеси белков на фракции или индивидуальные белки. Электрофорез применяют как для анализа компонентов смеси белков, так и для получения гомогенного белка.Наиболее распространенным вариантом электрофоретического анализа белков, является электрофорез белков в полиакриламидном геле.
Метод электрофореза основан на различии в скорости движения ( подвижности ) белков в электрическом поле, которая определяется величиной заряда белка при определенных значениях рН и ионной силы раствора. В последнее время более широкое распространение получили методы зонального электрофореза белков на различных носителях, в частности на твердых поддерживающих средах: гелях крахмала и полиакриламида, целлюлозе. Преимущества их по сравнению с методом свободного электрофореза состоят в том, что исключается размывание границы белок-растворитель в результате диффузии и конвекции, не требуется налаживания сложной аппаратуры для определения положения границы, а для анализа необходимо небольшое количество белка.