- •2.Характеристика белковых веществ. Элементарный состав белка. Значение белков для организма: белки – ферменты, белки – гормоны, структурные белки, белки – рецепторы, транспортные белки, антитела.
- •3. Аминокислоты как структурные элементы белка. Классификация аминокислот. Физико-химические свойства аминокислот. Общность строения, оптическая изомерия, амфотерность, сродство радикалов к воде.
- •4. Структурная организация белков. Типы связей, участвующие в формировании первичной, вторичной, третичной и четвертичной структур.
- •5. Физико-химические свойства белков. Денатурация белка. Использование процесса денатурации в медицине.
- •1)Белки –коллоидные растворы.
- •2) Суммарный заряд белка.
- •3)Растворимость
- •4)Амфотерность (за счёт аминокислот, см. 2 вопрос)
- •6. Белки как амфотерные электролиты. Поведение белков в электрическом поле. Электрофорез. Применение его во врачебной практике. Изометрическая точка белков. Определение суммарного заряда белка.
- •7. Классификация белков. Важнейшие представители протеинов и протеидов. Биологические функции белков.
- •8. Нуклеопротеиды. Химический состав белковой и простетической группы. Структурные компоненты нуклеиновых кислот. Номенклатура нуклеотидов, нуклеозидов, азотистых оснований. Их химическое строение.
- •9. Гемоглобин. Строение и свойства. Окси-, карбокси-,карб- метгемоглобин. Вариации первичной структуры и свойства гемоглобина. Гемоглобинопатии.
- •10. Хромопротеиды. Гемоглобин, миоглобин, каталаза, цитохромоксидаза, цитохромы. Их химическая природа и значение для организма.
- •12. Фосфопротеиды. Способ связи простетической группы с белковым компонентом. Значение в обмене веществ. Металлопротеиды и их биологическая роль в тканевом дыхании.
- •13. Липопротеиды. Химическое строение, представители, роль в обмене веществ. Состав и строение транспортных липопротеидов крови.
- •15. Роль и значение ферментов в процессе жизнедеятельности. Ферменты как биологические катализаторы. Химическая природа ферментов. Ферменты простые и сложные. Апофермент и кофермент.
- •Особенности ферментов как биологических катализаторов
- •16. Понятие об изоферментах. Лактатдегидрогеназа. Определение изоферментов с целью диагностики болезней.
- •17. Ингибиторы ферментов. Типы ингибирования. Конкурентное, неконкурентное,аллостерическое ингибирование. Использование ингибиторов ферментов в качестве лекарств.
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Смешанное ингибирование
- •1)Действие многих лекарственных средств
- •18. Изменение активности ферментов при заболеваниях. Наследственные энзимопатии. Определение активности ферментов в плазме с целью диагностики болезней.
- •19. Ферменты пищеварительной системы, гидролизующие углеводы, липиды, белки.
- •20. Особенности ферментативного катализа. Специфичность действия ферментов. Особенности ферментативного катализа.
- •21. Кинетика ферментативных реакций. Факторы, определяющие скорость ферментативных реакций. Кинетика ферментативных реакций –
- •22. Активный центр и механизм действия ферментов, специфичность.
- •23. Кофакторы ферментов и их роль в катализе. Витамины - как предшественники коферментов. Гиповитаминозы, их причины и проявления.
- •24. Современная классификация ферментов. Номенклатура. Тип катализируемых реакций. Примеры.
- •Изменение активности фермента при фосфорилировании-дефосфорилировании
- •26. Регуляция активности ферментов путем ассоциации/диссоциации протомеров.
- •27. Применение ферментов в медицине. Энзимодиагностика и энзимотерапия.
- •29. Биосинтез днк (репликация). Принцип комплементарности азотистых оснований. Биологический генетический код.
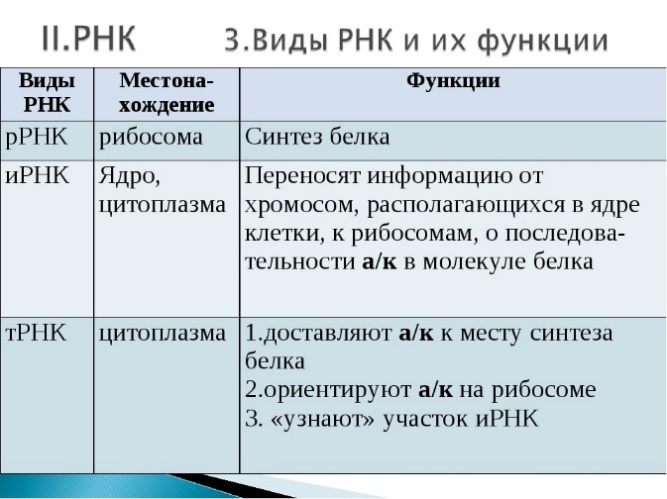
- •30. Биосинтез рнк (транскрипция), рнк-полимеразы. Типы рнк и их биологическая роль.
- •31. Современные представления о синтезе белка. Регуляция биосинтеза белка.
- •32. Витамины. Понятие о гипо- и гипервитаминозах. Механизм действия витаминов. Классификация витаминов. Важнейшие представители витаминов. Их биологическое значение.
- •33. Жирорастворимые витамины. Витамин а. Химическая природа, свойства, распространение, потребность, роль в обмене веществ. Авитаминозы.
- •34. Витамины группы д. Химическая природа и свойства. Роль в обмене веществ. Биохимическая характеристика патогенеза рахита.
- •35. Витамин е. Химическое строение, свойства, роль в обмене веществ.
- •36. Витамин к. Химическое строение, свойства, роль в обмене веществ.
- •37. Водорастворимые витамины. Витамин в1 . Химическая природа нарушений в обмене веществ при в1 -авитаминозе. Распространение, потребность.
- •38. Витамин в2 . Химическое строение, распространение, суточная потребность, участие в построении флавиновых ферментов. Авитаминоз.
- •39. Витамин в6 , его производные. Химическое строение, распространение, суточная потребность, симптомы авитаминозов. Коферментная роль витамина в6 .
- •41. Пантотеновая кислота. П-аминобензойная кислота. Химическая природа, свойства, роль в обмене веществ. Авитаминозы.
- •42. Витамин н (биотин). Биологическая роль, участие в обмене веществ. Химическая природа, авитаминоз.
- •43. Фолиевая кислота. Тетрагидрофолиевая кислота. Синтез одноуглеродистых радикалов. Химическая природа, биологическая роль. Авитаминозы. Участие в обмене веществ.
- •44. Витамин с. Авитаминоз. Химическая природа, содержание в пищевых продуктах, потребность, роль в обмене веществ.
- •45. Гомоны. Химическая природа,механизм действия,их роль в регуляции обмена веществ.
- •47. Гормоны панкреатической(поджелудочной) железы.
- •48. Гормоны мозгового вещества надпочечников.
- •49. Гормоны коры надпочесников.
- •50. Гормоны передней доли гипофиза.
- •51. Гормоны задней доли гипофиза.
- •52. Механизм действия гормонов.Мембранный и внутриклеточный типы гормоныльной регуляции.
- •53. Аденилатциклазная система передачи сигналов,роль g-белков в трансдукции сигнала.
- •55. Окислительное декарбоксилирование пирувата.
- •56. Окисление ацетил-КоА в цикле Кребса. Связь между общими путями катаболизма и цепью переноса электронов и протонов. Цикл трикарбоновых кислот
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •57. Механизм образования атф. Окислительное фосфорилирование. Отличие от субстратного фосфорилирования.
- •58. Углеводы пищи: строение, переваривание. Механизмы трансмембранного переноса глюкозы. Примеры нарушения переваривания углеводов.
- •59. Метаболизм глюкозы в клетках.
- •61. Аэробное окисление углеводов. Ферменты, участвующие в этих процессах.
- •62. Анаэробное расщепление глюкозы в тканях. Гликолиз и гликогенолиз. Ферменты, роль этого процесса.
- •63. Глюконеогенез. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори).
- •64. Апотомический распад углеводов. Биологическое значение пентозофосфатного цикла.
- •Значение пентозофосфатного пути
- •65. Энергетический выход окисления одной молекулы глюкозы при гликолизе, аэробном окислении и прямом окислении. Регуляция углеводного обмена
- •67.Значение белков в питании. Азотистый баланс и азотистое равновесие. Заменимые и незаменимые аминокислоты.
- •69. Катаболизм аминокислот (реакция дезаминирования).
- •71. Обмен аммиака. Механизм токсического действия аммиака. Связывание (обезвреживание) аммиака.
- •72. Орнитиновый цикл (цикл мочевины). Наследственные нарушения орнитинового цикла и их основные проявления.
- •73. Заменимые и незаменимые а/к. Биосинтез заменимых.
- •74. Обмен серина и глицина. Роль фолиевой кислоты в обмене аминокислот. Участие глицина в синтезе креатина и глутатиона.
- •75. Особенности обмена метионина. Синтез фосфатидилхолина. Синтез карнитина. Синтез креатина и креатинфосфата.Образование цистеина из метионина.
- •79. Структура, классификация и свойства основных липидов организма человека. Химическое строение и биологическая роль. Фосфолипиды, сфинголипиды, цереброзиды, гликолипиды
- •80. Переваривание и всасывание липидов в жкт. Роль желчных кислот. Механизм всасывания жиров. Нарушения в переваривании липидов. Транспорт жиров из кишечника.
- •81. Современная теория окисления жирных кислот с четным и нечетным числом углеродных атомов. Общий выход энергии при окислении жирных кислот до со2 и н2о.
- •82. Пути образования и использования ацетоуксусной кислоты в организме. Нарушение и регуляция липидного обмена.
- •83. Биосинтез триацилглицеридов и фосфолипидов. Функции фосфолипидов. Регуляция и патология липидного обмена.
- •84. Обмен стероидов. Биосинтез холестерина. Холестерин как предшественник ряда других стероидов. Нарушение обмена холестерина.
- •85. Биосинтез жирных кислот. Регуляция синтеза жирных кислот. Источники цитоплазматического ацетил-КоА. Роль биотина, надфн2, апб в синтезе жирных кислот.
- •86. Синтез желчных кислот, регуляция процесса. Их роль в переваривании и всасывании липидов. Желчно-каменная болезнь.
- •87. Гиперхолестеролемия. Механизм развития атеросклероза и основные подходы к лечению.
- •88. Регуляция обмена углеводов, липидов и аминокислот.
- •89. Биохимические представления о сахарном диабете: важнейшие изменения гормонального статуса и метаболизма при сахарном диабете.
- •90. Регуляция водно-солевого обмена гормонами. Вазопрессин и альдостерон: строение и механизм действия.
- •91. Ренин-альдостерон-ангиотензиновая система. Биохимические механизмы развития почечной гипертонии. Нарушения водно-солевого обмена.
- •92. Паратгормон и кальцитонин: химическая природа, механизм действия, влияние на обмен кальция и фосфатов. Гипо- и гиперкальциемия.
- •95. Механизмы обезвреживания токсических веществ в печени. Микросомальное окисление. Реакции конъюгации.
- •96. Биотрансформация лекарств в печени.
- •98. Ферменты крови их диагностическое значение.
- •99. Структурная организация и основные компоненты мембран. Строение и функции липидов мембран
- •Характеристика мембранных белков
- •Липидный состав мембран
- •100. Избирательная проницаемость мембран. Механизмы переноса веществ через мембраны (примеры).
30. Биосинтез рнк (транскрипция), рнк-полимеразы. Типы рнк и их биологическая роль.
Транскрипция – синтез молекулы РНК на матрице ДНК. Другими словами, это перенос генетической информации с ДНК на РНК(ядро).
Транскрипция (синтез РНК)
Прежде чем начнут синтезироваться белки, информацию об их строении необходимо "достать" из ДНК и доставить ее к месту синтеза белков. Этим занимаются информационные или матричные РНК. Одновременно клетке нужны транспортеры аминокислот – транспортные РНК и структурные компоненты органелл, синтезирующих белок, – рибосомальные РНК. Вся информация о строении транспортных и рибосомальных РНК также находится в ДНК.
Поэтому существует процесс переписывания или транскрипции данных с ДНК на РНК (англ. transcription – переписывание) – биосинтез РНК на матрице ДНК.
Как в любом матричном биосинтезе в транскрипции выделяют 5 необходимых элементов:
матрица – одна из цепей ДНК,
растущая цепь – РНК,
субстрат для синтеза – рибонуклеотиды (УТФ, ГТФ, ЦТФ, АТФ),
источник энергии – УТФ, ГТФ, ЦТФ, АТФ.
ферменты РНК-полимеразы и белковые факторы транскрипции.
Биосинтез РНК происходит в участке ДНК, который называется транскриптон, с одного края он ограничен промотором (начало), с другого – терминатором (конец).
РНК-полимеразы эукариот имеют по две больших субъединицы и несколько малых субъединиц.
Стадии транскрипции
Выделяют три стадии транскрипции: инициация, элонгация и терминация.
Инициация
Промотор содержит стартовый сигнал транскрипции – ТАТА-бокс. Так называется определенная последовательность нуклеотидов ДНК, связывающая первый фактор инициации ТАТА-фактор. Этот ТАТА-фактор обеспечивает присоединение РНК-полимеразы к той нити ДНК, которая будет использоваться в качестве шаблона для транскрипции (матричная нить ДНК). Так как промотор ассиметричен ("ТАТА"), то он связывает РНК-полимеразу только в одной ориентации, что определяет направление транскрипции от 5'-конца к 3'-концу (5'→3'). Для связывания РНК-полимеразы с промотором необходим еще один фактор инициации – σ-фактор (греч. σ – "сигма"), но сразу после синтеза затравочного фрагмента РНК (длиной 8-10 рибонуклеотидов) σ-фактор отрывается от фермента.
Другие факторы инициации раскручивают спираль ДНК перед РНК-полимеразой.
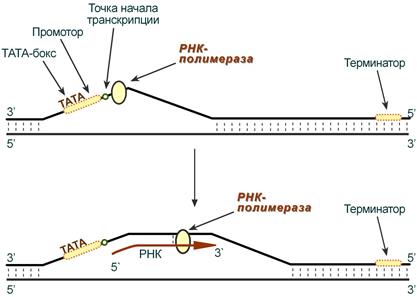
Схема процесса транскрипции
Элонгация
Белковые факторы элонгации обеспечивают продвижение РНК-полимеразы вдоль ДНК и расплетают молекулу ДНК на протяжении примерно 17 нуклеотидных пар. РНК-полимераза продвигается со скоростью 40-50 нуклеотидов в секунду в направлении 5'→3'. Фермент использует АТФ, ГТФ, ЦТФ, УТФ одновременно в качестве субстрата и в качестве источника энергии.
Терминация
РНК-полимераза остановится, когда достигнет терминирующих кодонов. С помощью белкового фактора терминации, так называемого ρ-фактора (греч. ρ – "ро"), от матрицы ДНК отделяются фермент и синтезированная молекула РНК, которая является первичным транскриптом, предшественником мРНК или тРНК или рРНК.
Транскрипция – процесс синтеза РНК на матрице ДНК, первая стадия экспрессии генетического материала. Процесс транскрипции ДНК в клетках всех организмов осуществляется ДНК-зависимыми РНК-полимеразами. Существует два основных типа РНК-полимераз – односубъединичные и многосубъединичные.