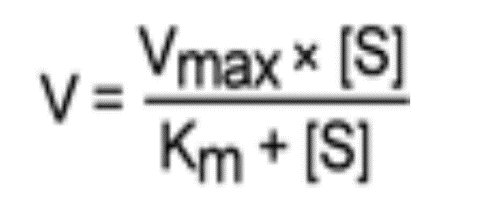- •2.Характеристика белковых веществ. Элементарный состав белка. Значение белков для организма: белки – ферменты, белки – гормоны, структурные белки, белки – рецепторы, транспортные белки, антитела.
- •3. Аминокислоты как структурные элементы белка. Классификация аминокислот. Физико-химические свойства аминокислот. Общность строения, оптическая изомерия, амфотерность, сродство радикалов к воде.
- •4. Структурная организация белков. Типы связей, участвующие в формировании первичной, вторичной, третичной и четвертичной структур.
- •5. Физико-химические свойства белков. Денатурация белка. Использование процесса денатурации в медицине.
- •1)Белки –коллоидные растворы.
- •2) Суммарный заряд белка.
- •3)Растворимость
- •4)Амфотерность (за счёт аминокислот, см. 2 вопрос)
- •6. Белки как амфотерные электролиты. Поведение белков в электрическом поле. Электрофорез. Применение его во врачебной практике. Изометрическая точка белков. Определение суммарного заряда белка.
- •7. Классификация белков. Важнейшие представители протеинов и протеидов. Биологические функции белков.
- •8. Нуклеопротеиды. Химический состав белковой и простетической группы. Структурные компоненты нуклеиновых кислот. Номенклатура нуклеотидов, нуклеозидов, азотистых оснований. Их химическое строение.
- •9. Гемоглобин. Строение и свойства. Окси-, карбокси-,карб- метгемоглобин. Вариации первичной структуры и свойства гемоглобина. Гемоглобинопатии.
- •10. Хромопротеиды. Гемоглобин, миоглобин, каталаза, цитохромоксидаза, цитохромы. Их химическая природа и значение для организма.
- •12. Фосфопротеиды. Способ связи простетической группы с белковым компонентом. Значение в обмене веществ. Металлопротеиды и их биологическая роль в тканевом дыхании.
- •13. Липопротеиды. Химическое строение, представители, роль в обмене веществ. Состав и строение транспортных липопротеидов крови.
- •15. Роль и значение ферментов в процессе жизнедеятельности. Ферменты как биологические катализаторы. Химическая природа ферментов. Ферменты простые и сложные. Апофермент и кофермент.
- •Особенности ферментов как биологических катализаторов
- •16. Понятие об изоферментах. Лактатдегидрогеназа. Определение изоферментов с целью диагностики болезней.
- •17. Ингибиторы ферментов. Типы ингибирования. Конкурентное, неконкурентное,аллостерическое ингибирование. Использование ингибиторов ферментов в качестве лекарств.
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Смешанное ингибирование
- •1)Действие многих лекарственных средств
- •18. Изменение активности ферментов при заболеваниях. Наследственные энзимопатии. Определение активности ферментов в плазме с целью диагностики болезней.
- •19. Ферменты пищеварительной системы, гидролизующие углеводы, липиды, белки.
- •20. Особенности ферментативного катализа. Специфичность действия ферментов. Особенности ферментативного катализа.
- •21. Кинетика ферментативных реакций. Факторы, определяющие скорость ферментативных реакций. Кинетика ферментативных реакций –
- •22. Активный центр и механизм действия ферментов, специфичность.
- •23. Кофакторы ферментов и их роль в катализе. Витамины - как предшественники коферментов. Гиповитаминозы, их причины и проявления.
- •24. Современная классификация ферментов. Номенклатура. Тип катализируемых реакций. Примеры.
- •Изменение активности фермента при фосфорилировании-дефосфорилировании
- •26. Регуляция активности ферментов путем ассоциации/диссоциации протомеров.
- •27. Применение ферментов в медицине. Энзимодиагностика и энзимотерапия.
- •29. Биосинтез днк (репликация). Принцип комплементарности азотистых оснований. Биологический генетический код.
- •30. Биосинтез рнк (транскрипция), рнк-полимеразы. Типы рнк и их биологическая роль.
- •31. Современные представления о синтезе белка. Регуляция биосинтеза белка.
- •32. Витамины. Понятие о гипо- и гипервитаминозах. Механизм действия витаминов. Классификация витаминов. Важнейшие представители витаминов. Их биологическое значение.
- •33. Жирорастворимые витамины. Витамин а. Химическая природа, свойства, распространение, потребность, роль в обмене веществ. Авитаминозы.
- •34. Витамины группы д. Химическая природа и свойства. Роль в обмене веществ. Биохимическая характеристика патогенеза рахита.
- •35. Витамин е. Химическое строение, свойства, роль в обмене веществ.
- •36. Витамин к. Химическое строение, свойства, роль в обмене веществ.
- •37. Водорастворимые витамины. Витамин в1 . Химическая природа нарушений в обмене веществ при в1 -авитаминозе. Распространение, потребность.
- •38. Витамин в2 . Химическое строение, распространение, суточная потребность, участие в построении флавиновых ферментов. Авитаминоз.
- •39. Витамин в6 , его производные. Химическое строение, распространение, суточная потребность, симптомы авитаминозов. Коферментная роль витамина в6 .
- •41. Пантотеновая кислота. П-аминобензойная кислота. Химическая природа, свойства, роль в обмене веществ. Авитаминозы.
- •42. Витамин н (биотин). Биологическая роль, участие в обмене веществ. Химическая природа, авитаминоз.
- •43. Фолиевая кислота. Тетрагидрофолиевая кислота. Синтез одноуглеродистых радикалов. Химическая природа, биологическая роль. Авитаминозы. Участие в обмене веществ.
- •44. Витамин с. Авитаминоз. Химическая природа, содержание в пищевых продуктах, потребность, роль в обмене веществ.
- •45. Гомоны. Химическая природа,механизм действия,их роль в регуляции обмена веществ.
- •47. Гормоны панкреатической(поджелудочной) железы.
- •48. Гормоны мозгового вещества надпочечников.
- •49. Гормоны коры надпочесников.
- •50. Гормоны передней доли гипофиза.
- •51. Гормоны задней доли гипофиза.
- •52. Механизм действия гормонов.Мембранный и внутриклеточный типы гормоныльной регуляции.
- •53. Аденилатциклазная система передачи сигналов,роль g-белков в трансдукции сигнала.
- •55. Окислительное декарбоксилирование пирувата.
- •56. Окисление ацетил-КоА в цикле Кребса. Связь между общими путями катаболизма и цепью переноса электронов и протонов. Цикл трикарбоновых кислот
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •57. Механизм образования атф. Окислительное фосфорилирование. Отличие от субстратного фосфорилирования.
- •58. Углеводы пищи: строение, переваривание. Механизмы трансмембранного переноса глюкозы. Примеры нарушения переваривания углеводов.
- •59. Метаболизм глюкозы в клетках.
- •61. Аэробное окисление углеводов. Ферменты, участвующие в этих процессах.
- •62. Анаэробное расщепление глюкозы в тканях. Гликолиз и гликогенолиз. Ферменты, роль этого процесса.
- •63. Глюконеогенез. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори).
- •64. Апотомический распад углеводов. Биологическое значение пентозофосфатного цикла.
- •Значение пентозофосфатного пути
- •65. Энергетический выход окисления одной молекулы глюкозы при гликолизе, аэробном окислении и прямом окислении. Регуляция углеводного обмена
- •67.Значение белков в питании. Азотистый баланс и азотистое равновесие. Заменимые и незаменимые аминокислоты.
- •69. Катаболизм аминокислот (реакция дезаминирования).
- •71. Обмен аммиака. Механизм токсического действия аммиака. Связывание (обезвреживание) аммиака.
- •72. Орнитиновый цикл (цикл мочевины). Наследственные нарушения орнитинового цикла и их основные проявления.
- •73. Заменимые и незаменимые а/к. Биосинтез заменимых.
- •74. Обмен серина и глицина. Роль фолиевой кислоты в обмене аминокислот. Участие глицина в синтезе креатина и глутатиона.
- •75. Особенности обмена метионина. Синтез фосфатидилхолина. Синтез карнитина. Синтез креатина и креатинфосфата.Образование цистеина из метионина.
- •79. Структура, классификация и свойства основных липидов организма человека. Химическое строение и биологическая роль. Фосфолипиды, сфинголипиды, цереброзиды, гликолипиды
- •80. Переваривание и всасывание липидов в жкт. Роль желчных кислот. Механизм всасывания жиров. Нарушения в переваривании липидов. Транспорт жиров из кишечника.
- •81. Современная теория окисления жирных кислот с четным и нечетным числом углеродных атомов. Общий выход энергии при окислении жирных кислот до со2 и н2о.
- •82. Пути образования и использования ацетоуксусной кислоты в организме. Нарушение и регуляция липидного обмена.
- •83. Биосинтез триацилглицеридов и фосфолипидов. Функции фосфолипидов. Регуляция и патология липидного обмена.
- •84. Обмен стероидов. Биосинтез холестерина. Холестерин как предшественник ряда других стероидов. Нарушение обмена холестерина.
- •85. Биосинтез жирных кислот. Регуляция синтеза жирных кислот. Источники цитоплазматического ацетил-КоА. Роль биотина, надфн2, апб в синтезе жирных кислот.
- •86. Синтез желчных кислот, регуляция процесса. Их роль в переваривании и всасывании липидов. Желчно-каменная болезнь.
- •87. Гиперхолестеролемия. Механизм развития атеросклероза и основные подходы к лечению.
- •88. Регуляция обмена углеводов, липидов и аминокислот.
- •89. Биохимические представления о сахарном диабете: важнейшие изменения гормонального статуса и метаболизма при сахарном диабете.
- •90. Регуляция водно-солевого обмена гормонами. Вазопрессин и альдостерон: строение и механизм действия.
- •91. Ренин-альдостерон-ангиотензиновая система. Биохимические механизмы развития почечной гипертонии. Нарушения водно-солевого обмена.
- •92. Паратгормон и кальцитонин: химическая природа, механизм действия, влияние на обмен кальция и фосфатов. Гипо- и гиперкальциемия.
- •95. Механизмы обезвреживания токсических веществ в печени. Микросомальное окисление. Реакции конъюгации.
- •96. Биотрансформация лекарств в печени.
- •98. Ферменты крови их диагностическое значение.
- •99. Структурная организация и основные компоненты мембран. Строение и функции липидов мембран
- •Характеристика мембранных белков
- •Липидный состав мембран
- •100. Избирательная проницаемость мембран. Механизмы переноса веществ через мембраны (примеры).
20. Особенности ферментативного катализа. Специфичность действия ферментов. Особенности ферментативного катализа.
1. Белковая природа катализатора
2. Исключительно высокая эффективность. Эффективность биологического катализа превышает эффективность неорганического в 109 - 1012
3. Исключительно высокая специфичность:
а) абсолютная, когда фермент работает только со своим субстратом (фумараза с транс-изомерами фумаровой кислоты и не будет с цис-изомерами);
б) групповая - специфичен для узкой группы родственнных субстратов (ферменты ЖКТ).
4. Работает в мягких условиях (t=37, рН 7.0, определенные осмолярность и солевой состав).
5. Многоуровневая регуляция: регуляция активности на уровне условий среды, на уровне метаболона, на генетическом уровне, тканевом, клеточном, с помощью гормонов и медиаторов, а также с помощью субстратов и продуктов той реакции, которую они катализируют.
6. Кооперативность: ферменты способны организовывать ассоциации - продукт 1-го фермента, является субстратом для 2-го; продукт 2-го - субстратом для 3-го и т.д.
Кроме того, ферменты обладают адаптивностью, т. е. могут изменять свою активность и образовывать новые ассоциации.
7. Способны катализировать как прямую так и обратную реакцию. Направление реакции для многих ферментов определяется соотношением действующих масс.
8. Катализ жестко расписан, т. е. происходит поэтапно.
Специфичность, т.е. высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного центра фермента.
1. Стереоспецифичность – катализ только одного из стереоизомеров, например:
• специфичность к L- или D-аминокислотам – например, почти все ферменты человека взаимодействуют с L-аминокислотами,
• специфичность к цис- и транс-изомерам. Например, аспартаза реагирует только с транс-изомером – фумаровой кислотой, но не с малеиновой кислотой (цис-изомер).
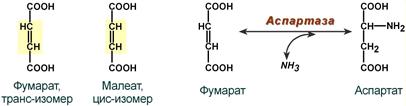
Стереоспецифичность аспартазы к транс-изомеру субстрата
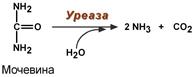
2. Абсолютная специфичность – фермент производит катализ только одного вещества. Например, каталаза разрушает перекись водорода, аргиназа расщепляет только аргинин, уреаза расщепляет только мочевину, глюкокиназа фосфорилирует только D-глюкозу.
3. Относительная групповая специфичность – превращение субстратов с некоторыми общими признаками. Например, цитохром Р450 окисляет только гидрофобные вещества, которых насчитывается около 7000. (альфа-амилаза – крахмал и его производные)
21. Кинетика ферментативных реакций. Факторы, определяющие скорость ферментативных реакций. Кинетика ферментативных реакций –
это раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ и факторов окружающей среды.
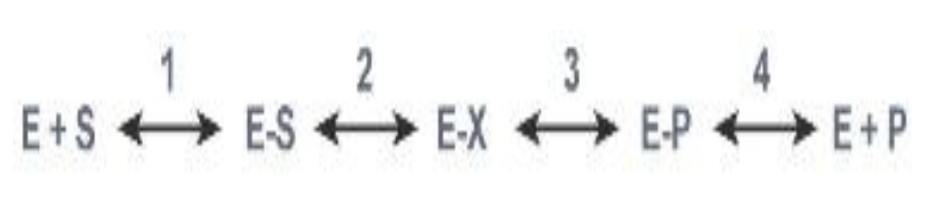
Этапы катализа
1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S).
2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий.
3. Превращение переходного комплекса в комплекс фермент-продукт (E-P).
4. Отделение конечных продуктов от фермента.
Ферментативная активность зависит от: концентрации фермента, концентрации субстрата, концентрации кофактора, температуры, РН, присутствия ингибиторов
Для измерения каталитической активности ферментов используют такие показатели, как скорость реакции или активность фермента. Скорость ферментативной реакции определяется уменьшением количества молекул субстрата или увеличением количества молекул продукта за единицу времени. Скорость ферментативной реакции является мерой каталитической активности фермента.
На практике пользуются условными величинами, характеризующими активность фермента: 1 международная единица активности ( 1МЕ) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 минуту при оптимальных условиях (температура 37°С, оптимальное значение рН раствора). Эти единицы используют в медицинской и фармацевтической практике для оценки активности ферментов:
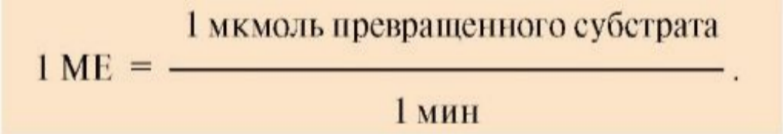
В системе СИ единица активности фермента – 1 Катал (Кат) –это количество фермента, катализирующее превращение 1 Моля субстрата за 1 секунду. (1 кат = моль / с)
Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (Уд.Ак.) фермента, численно равную количеству превращенного субстрата (в мкмолях) за единицу времени одним миллиграммом (мг) белка (фермента, выделенного из ткани). По удельной активности судят о степени очистки фермента: чем меньше посторонних белков, тем выше удельная активность.

Кинетику исследуют в оптимальных условиях проведения энзиматической реакции. Оптимальные условия индивидуальны для каждого фермента и определяются в первую очередь температурой, при которой проводится реакция, и значением рН раствора.
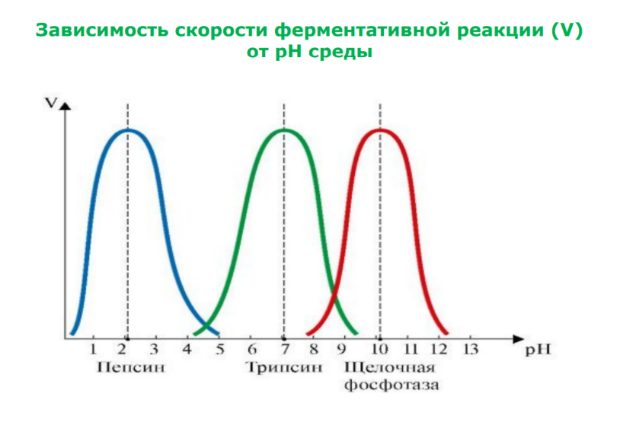
Зависимость скорости ферментативной реакции (V) от температуры . При увеличении температуры до + 40 С скорость ферментативной реакции возрастает. Выше +40 С скорость замедляется, т. к. начинается денатурация фермента. Возрастание скорости реакции при повышении температуры используется организмом как защитный механизм.
Понижение температуры (гипотермия организма и его отдельных тканей) используется в медицине для замедления ферментативных реакций при выполнении хирургических операций, при консервировании тканей и органов. При повышении t на 1 градус активность ферментов возрастает на 10%.
(Правило Вант-Гофа: при повышении t на каждые 10 градусов скорость реакции увеличивается примерно вдвое). Правило Вант-Гофа для ферментативных реакций справедливо лишь до +50-60 С.
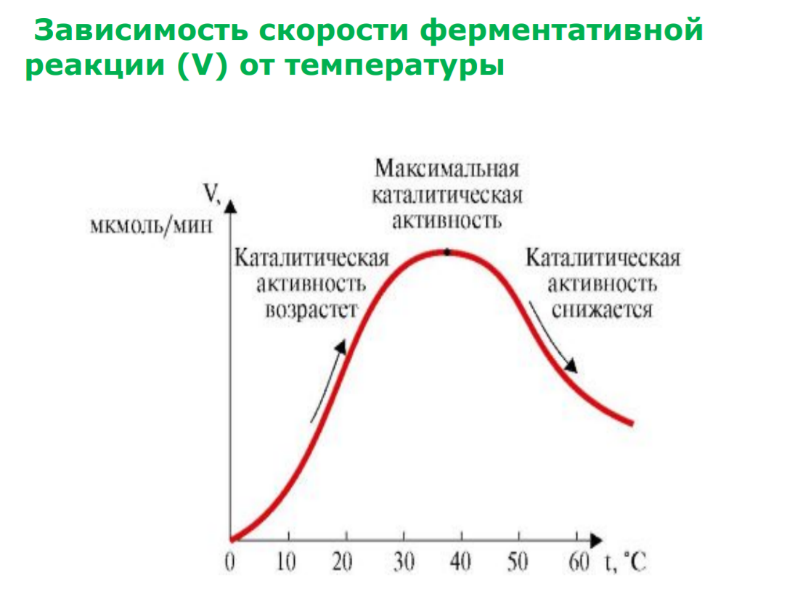
Зависимость скорости ферментативной реакции (V) от рН среды. Для каждого фермента существует оптимальное значение рН, при котором наблюдается его максимальная активность. Оптимум РН для многих ферментов лежит в нейтральной среде. Исключения : пепсин РН = 1,5-2, щелочная фосфатаза (ЩФ) РН= 9-10.
Изменение РН в организме при патологии нарушает функцию ферментов (изменяется степень ионизации функциональных групп активного и аллостерического центров и их архитектоника).
Влияние количества фермента: Зависимость прямо пропорциональна – чем больше фермента в клетке, тем выше скорость реакции. Количество фермента в клетке зависит от её потребности в ферменте.
В
покое в клетке функционирует лишь
небольшая часть ферментов. В ситуации
стресса в кинетике химической реакции
участвует максимальное количество
ферментов, что обеспечивает адаптацию
клетки к экстремальным условиям. 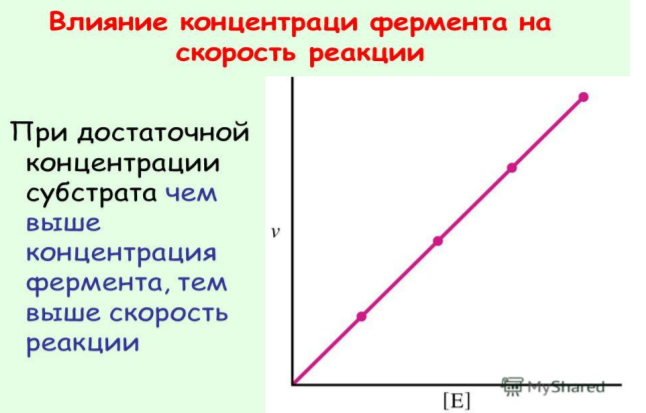
Скорость ферментативной реакции измеряют сразу после начала реакции (начальная скорость). График зависимости скорости ферментативной реакции от концентрации субстрата имеет вид гиперболы (насыщение миоглобина кислородом).
Основной кинетической характеристикой эффективности фермента является константа Михаэлиса - Km . Km – это концентрация субстрата, при которой скорость химической реакции равна 1/2 от максимально возможной. Km -величина постоянная, характеризует сродство данного фермента к субстрату .
Зависимость скорости ферментативных реакций от концентрации субстрата: чем меньше Km , тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции.
В математическом смысле Km соответствует концентрации субстрата при которой скорость реакции равна половине максимальной. Ее биологический смысл заключается в характеристике сродства фермента к субстрату: увеличение величины Кm означает снижение сродства фермента к субстрату.