- •2.Характеристика белковых веществ. Элементарный состав белка. Значение белков для организма: белки – ферменты, белки – гормоны, структурные белки, белки – рецепторы, транспортные белки, антитела.
- •3. Аминокислоты как структурные элементы белка. Классификация аминокислот. Физико-химические свойства аминокислот. Общность строения, оптическая изомерия, амфотерность, сродство радикалов к воде.
- •4. Структурная организация белков. Типы связей, участвующие в формировании первичной, вторичной, третичной и четвертичной структур.
- •5. Физико-химические свойства белков. Денатурация белка. Использование процесса денатурации в медицине.
- •1)Белки –коллоидные растворы.
- •2) Суммарный заряд белка.
- •3)Растворимость
- •4)Амфотерность (за счёт аминокислот, см. 2 вопрос)
- •6. Белки как амфотерные электролиты. Поведение белков в электрическом поле. Электрофорез. Применение его во врачебной практике. Изометрическая точка белков. Определение суммарного заряда белка.
- •7. Классификация белков. Важнейшие представители протеинов и протеидов. Биологические функции белков.
- •8. Нуклеопротеиды. Химический состав белковой и простетической группы. Структурные компоненты нуклеиновых кислот. Номенклатура нуклеотидов, нуклеозидов, азотистых оснований. Их химическое строение.
- •9. Гемоглобин. Строение и свойства. Окси-, карбокси-,карб- метгемоглобин. Вариации первичной структуры и свойства гемоглобина. Гемоглобинопатии.
- •10. Хромопротеиды. Гемоглобин, миоглобин, каталаза, цитохромоксидаза, цитохромы. Их химическая природа и значение для организма.
- •12. Фосфопротеиды. Способ связи простетической группы с белковым компонентом. Значение в обмене веществ. Металлопротеиды и их биологическая роль в тканевом дыхании.
- •13. Липопротеиды. Химическое строение, представители, роль в обмене веществ. Состав и строение транспортных липопротеидов крови.
- •15. Роль и значение ферментов в процессе жизнедеятельности. Ферменты как биологические катализаторы. Химическая природа ферментов. Ферменты простые и сложные. Апофермент и кофермент.
- •Особенности ферментов как биологических катализаторов
- •16. Понятие об изоферментах. Лактатдегидрогеназа. Определение изоферментов с целью диагностики болезней.
- •17. Ингибиторы ферментов. Типы ингибирования. Конкурентное, неконкурентное,аллостерическое ингибирование. Использование ингибиторов ферментов в качестве лекарств.
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Смешанное ингибирование
- •1)Действие многих лекарственных средств
- •18. Изменение активности ферментов при заболеваниях. Наследственные энзимопатии. Определение активности ферментов в плазме с целью диагностики болезней.
- •19. Ферменты пищеварительной системы, гидролизующие углеводы, липиды, белки.
- •20. Особенности ферментативного катализа. Специфичность действия ферментов. Особенности ферментативного катализа.
- •21. Кинетика ферментативных реакций. Факторы, определяющие скорость ферментативных реакций. Кинетика ферментативных реакций –
- •22. Активный центр и механизм действия ферментов, специфичность.
- •23. Кофакторы ферментов и их роль в катализе. Витамины - как предшественники коферментов. Гиповитаминозы, их причины и проявления.
- •24. Современная классификация ферментов. Номенклатура. Тип катализируемых реакций. Примеры.
- •Изменение активности фермента при фосфорилировании-дефосфорилировании
- •26. Регуляция активности ферментов путем ассоциации/диссоциации протомеров.
- •27. Применение ферментов в медицине. Энзимодиагностика и энзимотерапия.
- •29. Биосинтез днк (репликация). Принцип комплементарности азотистых оснований. Биологический генетический код.
- •30. Биосинтез рнк (транскрипция), рнк-полимеразы. Типы рнк и их биологическая роль.
- •31. Современные представления о синтезе белка. Регуляция биосинтеза белка.
- •32. Витамины. Понятие о гипо- и гипервитаминозах. Механизм действия витаминов. Классификация витаминов. Важнейшие представители витаминов. Их биологическое значение.
- •33. Жирорастворимые витамины. Витамин а. Химическая природа, свойства, распространение, потребность, роль в обмене веществ. Авитаминозы.
- •34. Витамины группы д. Химическая природа и свойства. Роль в обмене веществ. Биохимическая характеристика патогенеза рахита.
- •35. Витамин е. Химическое строение, свойства, роль в обмене веществ.
- •36. Витамин к. Химическое строение, свойства, роль в обмене веществ.
- •37. Водорастворимые витамины. Витамин в1 . Химическая природа нарушений в обмене веществ при в1 -авитаминозе. Распространение, потребность.
- •38. Витамин в2 . Химическое строение, распространение, суточная потребность, участие в построении флавиновых ферментов. Авитаминоз.
- •39. Витамин в6 , его производные. Химическое строение, распространение, суточная потребность, симптомы авитаминозов. Коферментная роль витамина в6 .
- •41. Пантотеновая кислота. П-аминобензойная кислота. Химическая природа, свойства, роль в обмене веществ. Авитаминозы.
- •42. Витамин н (биотин). Биологическая роль, участие в обмене веществ. Химическая природа, авитаминоз.
- •43. Фолиевая кислота. Тетрагидрофолиевая кислота. Синтез одноуглеродистых радикалов. Химическая природа, биологическая роль. Авитаминозы. Участие в обмене веществ.
- •44. Витамин с. Авитаминоз. Химическая природа, содержание в пищевых продуктах, потребность, роль в обмене веществ.
- •45. Гомоны. Химическая природа,механизм действия,их роль в регуляции обмена веществ.
- •47. Гормоны панкреатической(поджелудочной) железы.
- •48. Гормоны мозгового вещества надпочечников.
- •49. Гормоны коры надпочесников.
- •50. Гормоны передней доли гипофиза.
- •51. Гормоны задней доли гипофиза.
- •52. Механизм действия гормонов.Мембранный и внутриклеточный типы гормоныльной регуляции.
- •53. Аденилатциклазная система передачи сигналов,роль g-белков в трансдукции сигнала.
- •55. Окислительное декарбоксилирование пирувата.
- •56. Окисление ацетил-КоА в цикле Кребса. Связь между общими путями катаболизма и цепью переноса электронов и протонов. Цикл трикарбоновых кислот
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •57. Механизм образования атф. Окислительное фосфорилирование. Отличие от субстратного фосфорилирования.
- •58. Углеводы пищи: строение, переваривание. Механизмы трансмембранного переноса глюкозы. Примеры нарушения переваривания углеводов.
- •59. Метаболизм глюкозы в клетках.
- •61. Аэробное окисление углеводов. Ферменты, участвующие в этих процессах.
- •62. Анаэробное расщепление глюкозы в тканях. Гликолиз и гликогенолиз. Ферменты, роль этого процесса.
- •63. Глюконеогенез. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори).
- •64. Апотомический распад углеводов. Биологическое значение пентозофосфатного цикла.
- •Значение пентозофосфатного пути
- •65. Энергетический выход окисления одной молекулы глюкозы при гликолизе, аэробном окислении и прямом окислении. Регуляция углеводного обмена
- •67.Значение белков в питании. Азотистый баланс и азотистое равновесие. Заменимые и незаменимые аминокислоты.
- •69. Катаболизм аминокислот (реакция дезаминирования).
- •71. Обмен аммиака. Механизм токсического действия аммиака. Связывание (обезвреживание) аммиака.
- •72. Орнитиновый цикл (цикл мочевины). Наследственные нарушения орнитинового цикла и их основные проявления.
- •73. Заменимые и незаменимые а/к. Биосинтез заменимых.
- •74. Обмен серина и глицина. Роль фолиевой кислоты в обмене аминокислот. Участие глицина в синтезе креатина и глутатиона.
- •75. Особенности обмена метионина. Синтез фосфатидилхолина. Синтез карнитина. Синтез креатина и креатинфосфата.Образование цистеина из метионина.
- •79. Структура, классификация и свойства основных липидов организма человека. Химическое строение и биологическая роль. Фосфолипиды, сфинголипиды, цереброзиды, гликолипиды
- •80. Переваривание и всасывание липидов в жкт. Роль желчных кислот. Механизм всасывания жиров. Нарушения в переваривании липидов. Транспорт жиров из кишечника.
- •81. Современная теория окисления жирных кислот с четным и нечетным числом углеродных атомов. Общий выход энергии при окислении жирных кислот до со2 и н2о.
- •82. Пути образования и использования ацетоуксусной кислоты в организме. Нарушение и регуляция липидного обмена.
- •83. Биосинтез триацилглицеридов и фосфолипидов. Функции фосфолипидов. Регуляция и патология липидного обмена.
- •84. Обмен стероидов. Биосинтез холестерина. Холестерин как предшественник ряда других стероидов. Нарушение обмена холестерина.
- •85. Биосинтез жирных кислот. Регуляция синтеза жирных кислот. Источники цитоплазматического ацетил-КоА. Роль биотина, надфн2, апб в синтезе жирных кислот.
- •86. Синтез желчных кислот, регуляция процесса. Их роль в переваривании и всасывании липидов. Желчно-каменная болезнь.
- •87. Гиперхолестеролемия. Механизм развития атеросклероза и основные подходы к лечению.
- •88. Регуляция обмена углеводов, липидов и аминокислот.
- •89. Биохимические представления о сахарном диабете: важнейшие изменения гормонального статуса и метаболизма при сахарном диабете.
- •90. Регуляция водно-солевого обмена гормонами. Вазопрессин и альдостерон: строение и механизм действия.
- •91. Ренин-альдостерон-ангиотензиновая система. Биохимические механизмы развития почечной гипертонии. Нарушения водно-солевого обмена.
- •92. Паратгормон и кальцитонин: химическая природа, механизм действия, влияние на обмен кальция и фосфатов. Гипо- и гиперкальциемия.
- •95. Механизмы обезвреживания токсических веществ в печени. Микросомальное окисление. Реакции конъюгации.
- •96. Биотрансформация лекарств в печени.
- •98. Ферменты крови их диагностическое значение.
- •99. Структурная организация и основные компоненты мембран. Строение и функции липидов мембран
- •Характеристика мембранных белков
- •Липидный состав мембран
- •100. Избирательная проницаемость мембран. Механизмы переноса веществ через мембраны (примеры).
Оглавление
1.Предмет биохимии. Важн. этапы развития. Обмен веществ и энергии. Гетеро- и аутотрофы (различия по питанию, ист-м энергии). Катаболизм, анаболизм. Осн-е разделы и направления в биохимии. Значение биохимии для биологии и медицины. Проблемы биохимии. 6
2.Характеристика белковых веществ. Элементарный состав белка. Значение белков для организма: белки – ферменты, белки – гормоны, структурные белки, белки – рецепторы, транспортные белки, антитела. 6
3. Аминокислоты как структурные элементы белка. Классификация аминокислот. Физико-химические свойства аминокислот. Общность строения, оптическая изомерия, амфотерность, сродство радикалов к воде. 7
4. Структурная организация белков. Типы связей, участвующие в формировании первичной, вторичной, третичной и четвертичной структур. 10
5. Физико-химические свойства белков. Денатурация белка. Использование процесса денатурации в медицине. 11
6. Белки как амфотерные электролиты. Поведение белков в электрическом поле. Электрофорез. Применение его во врачебной практике. Изометрическая точка белков. Определение суммарного заряда белка. 12
7. Классификация белков. Важнейшие представители протеинов и протеидов. Биологические функции белков. 14
Классификация по функции 14
Классификация по строению 14
Структурная функция 15
Ферментативная функция 15
Гормональная функция 15
Рецепторная функция 15
Транспортная функция 15
Резервная функция 15
Сократительная функция 15
Защитная функция 15
8. Нуклеопротеиды. Химический состав белковой и простетической группы. Структурные компоненты нуклеиновых кислот. Номенклатура нуклеотидов, нуклеозидов, азотистых оснований. Их химическое строение. 16
9. Гемоглобин. Строение и свойства. Окси-, карбокси-,карб- метгемоглобин. Вариации первичной структуры и свойства гемоглобина. Гемоглобинопатии. 17
10. Хромопротеиды. Гемоглобин, миоглобин, каталаза, цитохромоксидаза, цитохромы. Их химическая природа и значение для организма. 19
11. Гликопротеиды. Строение и функции углеводной части гликопротеидов. Гликозаминогликаны и протеогликаны. Сиаловые кислоты, гепарин, гиалуроновая кислота, хондроитинсерная кислота: строение, распространение и функции. Применения в медицине. 20
12. Фосфопротеиды. Способ связи простетической группы с белковым компонентом. Значение в обмене веществ. Металлопротеиды и их биологическая роль в тканевом дыхании. 22
13. Липопротеиды. Химическое строение, представители, роль в обмене веществ. Состав и строение транспортных липопротеидов крови. 23
14. Общая характеристика углеводов и их биологическая роль. Моносахариды. Важнейшие представители и их свойства. Наследственные нарушения обмена галактозы. Глюкоза как важнейший метаболит углеводного обмена. 24
15. Роль и значение ферментов в процессе жизнедеятельности. Ферменты как биологические катализаторы. Химическая природа ферментов. Ферменты простые и сложные. Апофермент и кофермент. 28
Особенности ферментов как биологических катализаторов 29
16. Понятие об изоферментах. Лактатдегидрогеназа. Определение изоферментов с целью диагностики болезней. 29
17. Ингибиторы ферментов. Типы ингибирования. Конкурентное, неконкурентное,аллостерическое ингибирование. Использование ингибиторов ферментов в качестве лекарств. 30
Необратимое ингибирование 30
Обратимое ингибирование 31
Конкурентное ингибирование 31
Смешанное ингибирование 32
Аллостерическое ингибирование Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности. Аллостерические эффекты встречаются практически только в случае олигомерных ферментов 32
1)действие многих лекарственных средств 32
18. Изменение активности ферментов при заболеваниях. Наследственные энзимопатии. Определение активности ферментов в плазме с целью диагностики болезней. 33
19. Ферменты пищеварительной системы, гидролизующие углеводы, липиды, белки. 35
Переваривание белков 37
Механизм переваривания сложных белков 38
20. Особенности ферментативного катализа. Специфичность действия ферментов. 39
Особенности ферментативного катализа. 39
21. Кинетика ферментативных реакций. Факторы, определяющие скорость ферментативных реакций. 40
Кинетика ферментативных реакций – 40
22. Активный центр и механизм действия ферментов, специфичность. 42
23. Кофакторы ферментов и их роль в катализе. Витамины - как предшественники коферментов. Гиповитаминозы, их причины и проявления. 42
24. Современная классификация ферментов. Номенклатура. Тип катализируемых реакций. Примеры. 44
25. Регуляция активности ферментов: фосфорилирование - дефосфорилирование, роль протеинкиназ и протеинфосфатаз в клетке. Примеры метаболических путей, регулируемых такими способами. 45
Ковалентная (химическая) модификация 45
26. Регуляция активности ферментов путем ассоциации/диссоциации протомеров. 46
27. Применение ферментов в медицине. Энзимодиагностика и энзимотерапия. 46
Энзимотерапия 47
28. Современные представления о химическом строении ДНК (Уотсон, Крик). Комплементарность оснований. Правила Чаргаффа. Видовая специфичность, коэффициент специфичности ДНК. Участие белков в компактизации ДНК. Биологическая роль ДНК. 47
29. Биосинтез ДНК (репликация). Принцип комплементарности азотистых оснований. Биологический генетический код. 50
30. Биосинтез РНК (транскрипция), РНК-полимеразы. Типы РНК и их биологическая роль. 51
31. Современные представления о синтезе белка. Регуляция биосинтеза белка. 52
32. Витамины. Понятие о гипо- и гипервитаминозах. Механизм действия витаминов. Классификация витаминов. Важнейшие представители витаминов. Их биологическое значение. 54
34. Витамины группы Д. Химическая природа и свойства. Роль в обмене веществ. Биохимическая характеристика патогенеза рахита. 56
35. Витамин Е. Химическое строение, свойства, роль в обмене веществ. 58
36. Витамин К. Химическое строение, свойства, роль в обмене веществ. 58
37. Водорастворимые витамины. Витамин В1 . Химическая природа нарушений в обмене веществ при В1 -авитаминозе. Распространение, потребность. 59
38. Витамин В2 . Химическое строение, распространение, суточная потребность, участие в построении флавиновых ферментов. Авитаминоз. 59
39. Витамин В6 , его производные. Химическое строение, распространение, суточная потребность, симптомы авитаминозов. Коферментная роль витамина В6 . 61
40. Витамин PP. Химическая природа, роль в обмене веществ, суточная потребность, распространение, участие в построении коферментов дегидрогеназ. Симптомы авитаминозов. Нарушение окислительно-восстановительных процессов при недостатке витамина PP. 61
41. Пантотеновая кислота. П-аминобензойная кислота. Химическая природа, свойства, роль в обмене веществ. Авитаминозы. 62
42. Витамин Н (биотин). Биологическая роль, участие в обмене веществ. Химическая природа, авитаминоз. 63
44. Витамин С. Авитаминоз. Химическая природа, содержание в пищевых продуктах, потребность, роль в обмене веществ. 64
45. Гомоны. Химическая природа,механизм действия,их роль в регуляции обмена веществ. 65
47. Гормоны панкреатической(поджелудочной) железы. 68
48. Гормоны мозгового вещества надпочечников. 70
49. Гормоны коры надпочесников. 70
50. Гормоны передней доли гипофиза. 72
51. Гормоны задней доли гипофиза. 73
52. Механизм действия гормонов.Мембранный и внутриклеточный типы гормоныльной регуляции. 73
53. Аденилатциклазная система передачи сигналов,роль G-белков в трансдукции сигнала. 74
55. Окислительное декарбоксилирование пирувата. 77
56. Окисление ацетил-КоА в цикле Кребса. Связь между общими путями катаболизма и цепью переноса электронов и протонов. 80
Цикл трикарбоновых кислот 80
57. Механизм образования АТФ. Окислительное фосфорилирование. Отличие от субстратного фосфорилирования. 83
58. Углеводы пищи: строение, переваривание. Механизмы трансмембранного переноса глюкозы. Примеры нарушения переваривания углеводов. 84
59. Метаболизм глюкозы в клетках. 86
60. Биосинтез и мобилизация гликогена в тканях. Активная и неактивная форма гликогенфосфорилазы и гликогенсинтетазы, механизм их взаимодействия, физиологическое значение резервирования и мобилизации гликогена. Гликогенозы и агликогенозы. 87
61. Аэробное окисление углеводов. Ферменты, участвующие в этих процессах. 89
62. Анаэробное расщепление глюкозы в тканях. Гликолиз и гликогенолиз. Ферменты, роль этого процесса. 90
63. Глюконеогенез. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори). 91
Значение пентозофосфатного пути 93
65. Энергетический выход окисления одной молекулы глюкозы при гликолизе, аэробном окислении и прямом окислении. Регуляция углеводного обмена 94
67.Значение белков в питании. Азотистый баланс и азотистое равновесие. Заменимые и незаменимые аминокислоты. 97
69. Катаболизм аминокислот (реакция дезаминирования). 100
71. Обмен аммиака. Механизм токсического действия аммиака. Связывание (обезвреживание) аммиака. 102
72. Орнитиновый цикл (цикл мочевины). Наследственные нарушения орнитинового цикла и их основные проявления. 102
73. Заменимые и незаменимые а/к. Биосинтез заменимых. 107
74. Обмен серина и глицина. Роль фолиевой кислоты в обмене аминокислот. Участие глицина в синтезе креатина и глутатиона. 107
75. Особенности обмена метионина. Синтез фосфатидилхолина. Синтез карнитина. Синтез креатина и креатинфосфата.Образование цистеина из метионина. 109
79. Структура, классификация и свойства основных липидов организма человека. Химическое строение и биологическая роль. Фосфолипиды, сфинголипиды, цереброзиды, гликолипиды 116
80. Переваривание и всасывание липидов в ЖКТ. Роль желчных кислот. Механизм всасывания жиров. Нарушения в переваривании липидов. Транспорт жиров из кишечника. 118
81. Современная теория окисления жирных кислот с четным и нечетным числом углеродных атомов. Общий выход энергии при окислении жирных кислот до СО2 и Н2О. 122
82. Пути образования и использования ацетоуксусной кислоты в организме. Нарушение и регуляция липидного обмена. 122
83. Биосинтез триацилглицеридов и фосфолипидов. Функции фосфолипидов. Регуляция и патология липидного обмена. 123
84. Обмен стероидов. Биосинтез холестерина. Холестерин как предшественник ряда других стероидов. Нарушение обмена холестерина. 125
85. Биосинтез жирных кислот. Регуляция синтеза жирных кислот. Источники цитоплазматического ацетил-КоА. Роль биотина, НАДФН2, АПБ в синтезе жирных кислот. 126
86. Синтез желчных кислот, регуляция процесса. Их роль в переваривании и всасывании липидов. Желчно-каменная болезнь. 127
87. Гиперхолестеролемия. Механизм развития атеросклероза и основные подходы к лечению. 128
88. Регуляция обмена углеводов, липидов и аминокислот. 129
89. Биохимические представления о сахарном диабете: важнейшие изменения гормонального статуса и метаболизма при сахарном диабете. 129
90. Регуляция водно-солевого обмена гормонами. Вазопрессин и альдостерон: строение и механизм действия. 130
91. Ренин-альдостерон-ангиотензиновая система. Биохимические механизмы развития почечной гипертонии. Нарушения водно-солевого обмена. 131
92. Паратгормон и кальцитонин: химическая природа, механизм действия, влияние на обмен кальция и фосфатов. Гипо- и гиперкальциемия. 132
95. Механизмы обезвреживания токсических веществ в печени. Микросомальное окисление. Реакции конъюгации. 135
96. Биотрансформация лекарств в печени. 137
98. Ферменты крови их диагностическое значение. 139
99. Структурная организация и основные компоненты мембран. Строение и функции липидов мембран 143
Характеристика мембранных белков 143
Липидный состав мембран 144
100. Избирательная проницаемость мембран. Механизмы переноса веществ через мембраны (примеры). 145
1.Предмет биохимии. Важн. этапы развития. Обмен веществ и энергии. Гетеро- и аутотрофы (различия по питанию, ист-м энергии). Катаболизм, анаболизм. Осн-е разделы и направления в биохимии. Значение биохимии для биологии и медицины. Проблемы биохимии.
Биохимия - это наука, занимающаяся изучением различных молекул, химических реакций и процессов, протекающих в живых клетках и организмах. Структурной единицей живых систем является клетка, поэтому можно дать и другое определение: биохимия как наука изучает химические компоненты живых клеток, а также реакции и процессы, в которых они участвуют. Согласно этому определению, биохимия охватывает широкие области клеточной биологии и всю молекулярную биологию.
Главная задача биохимии состоит в том, чтобы достичь полного понимания на молекулярном уровне природы всех химических процессов, связанных с жизнедеятельностью клеток.
Основательное знание биохимии совершенно необходимо для успешного развития двух главных направлений биомедицинских наук: 1) решение проблем сохранения здоровья человека; 2) выяснение причин различных болезней и изыскание путей их эффективного лечения. Со строго биохимической точки зрения организм можно считать здоровым, если многие тысячи реакций, протекающих внутри клеток и во внеклеточной среде, идут в таких условиях и с такими скоростями, которые обеспечивают максимальную жизнеспособность организма и поддерживают физиологически нормальное состояние.Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. Обмен веществ состоит из 3 этапов: поступление веществ в организм, метаболизм и выделение конечных продуктов из организма.Поступление веществ в организм происходит в результате дыхания (кислород) и питания. Источником энергии для человека служит распад органических веществ пищи. С питательными веществами поступают преимущественно белки, полисахариды, жиры, которые в процессе пищеварения расщепляются на более мелкие молекулы (глюкоза, аминокислоты, жирные кислоты, глицерол). В клетках эти вещества подвергаются превращениям, включаясь в метаболизм (обмен веществ). Они могут использоваться для синтеза более сложных молекул (анаболизм) либо распадаются до конечных продуктов в процессах катаболизма. Катаболизм - процесс расщепления органических молекул до конечных продуктов. Конечные продукты превращений органических веществ у животных и человека - СО2, Н2О и мочевина. Анаболизм объединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма. В анаболических реакциях используется энергия, освобождающаяся при катаболизме.Биохимия включает в себя клеточную и молекулярную биологию..,биохимию растений,человека,микроорганизмов.
2.Характеристика белковых веществ. Элементарный состав белка. Значение белков для организма: белки – ферменты, белки – гормоны, структурные белки, белки – рецепторы, транспортные белки, антитела.
Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот, соединённых пептидной связью.
Состав: углерод – 50-55%; водород – 6,5-7,3%; азот – 15-18%; кислород – 21-24%; сера – 2,4%.
1) белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ.
2) Белки-гормоны (и другие белки, участвующие в межклеточной сигнализации) оказывают влияние на обмен веществ и другие физиологические процессы. Гормоны — это вещества, которые образуются в железах внутренней секреции, переносятся кровью и несут информационный сигнал.
3) Белки создают и определяют форму (структуру) многих клеточных органелл. В основном из белков состоят такие органеллы, как рибосомы, протеасомы, ядерные поры и др. Гистоны необходимы для сборки и упаковки нитей ДНК в хромосомы.
4) Рецепторные белки формируют внутри клетки сигнал в ответ на появление снаружи гормонов и сигнальных молекул. К ним относится, например, рецептор инсулина, отвечающий за поступление в клетку глюкозы.
5) Транспортная функция белков — участие белков в переносе веществ в клетки и из клеток, в их перемещениях внутри клеток, а также в их транспорте кровью и другими жидкостями по организму.
6) Антитела́, иммуноглобулины — крупные глобулярные белки плазмы крови, выделяющиеся плазматическими клетками иммунной системы и предназначенные для нейтрализации клеток патогенов (бактерий, грибов, многоклеточных паразитов) и вирусов, а также белковых ядов и некоторых других чужеродных веществ.
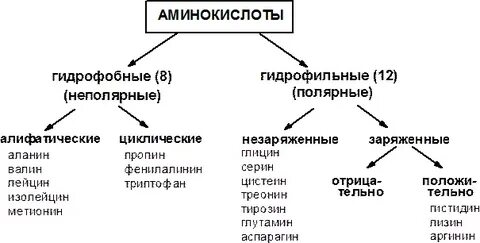
3. Аминокислоты как структурные элементы белка. Классификация аминокислот. Физико-химические свойства аминокислот. Общность строения, оптическая изомерия, амфотерность, сродство радикалов к воде.
Аминокислоты – это строительные блоки макромолекул белков. По строению они являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу.
Классификация аминокислот по биологическому и физиологическому значению:
- незаменимые — не могут синтезироваться организмом из других соединений и целиком поступают с пищей (валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин, триптофан);
- полузаменимые — образуются в недостаточном количестве в организме, поэтому частично поступают с пищей (аргинин, тирозин, гистидин);
- заменимые — синтезируются в организме (все остальные);
По функциональной принадлежности:
- алифатические монокарбоновые кислоты: глицин, аланин, валин, лейцин, изолейцин;
- алифатические оксиаминокислоты: серин, треонин;
- серосодержащие: цистеин, метионин;
- диаминомонокарбоновые: лизин, аргинин;
- моноаминодикарбоновые: глутаминовая кислота, глутамин;
- ароматические: фенилаланин, тирозин;
- гетероциклические: гистидин, триптофан;
- аминокислота: пролин.
По химическому строению: ациклические (моноаминомонокарбоновые, моно-аминодикарбоновые, диаминомонокарбоновые) и циклические (гомоциклические и ге-тероциклические).
Отрицательно заряженные аминокислоты. Сюда относятся аспарагиновая и глутаминовая кислоты. Имеют дополнительную СООН-группу в радикале - в нейтральной среде приобретают отрицательный заряд. Положительно заряженные аминокислоты: аргинин, лизин и гистидин. Имеют дополнительную NH2-группу (или имидазольное кольцо, как гистидин) в радикале - в нейтральной среде приобретают положительный заряд
Физико-химические свойства:
1. Являются амфотерными электролитами. Аминокислоты сочетают в себе свойства и кислот и оснований. Соответственно, в водном растворе аминокислоты ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов. Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим. Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты: o pI большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин), o pI кислых аминокислот – рI глутамата 3,2, рI аспартата 2,8, o pI основных аминокислот – pI гистидина 7,6, pI аргинина 10,8, pI лизина 9,7.
2. Заряд аминокислот зависит от величины рН среды. Отправным пунктом для понимания причин появления заряда у аминокислот является величина изоэлектрической точки. Ситуация различается для нейтральных, кислых и основных аминокислот.
3. Хорошо растворимы в воде и полярных растворителях (р-ция диссоциации)
4.Плавятся при температуре выше 200оС, кристаллические , бесцветные

 Общность
строения:
Общность
строения:

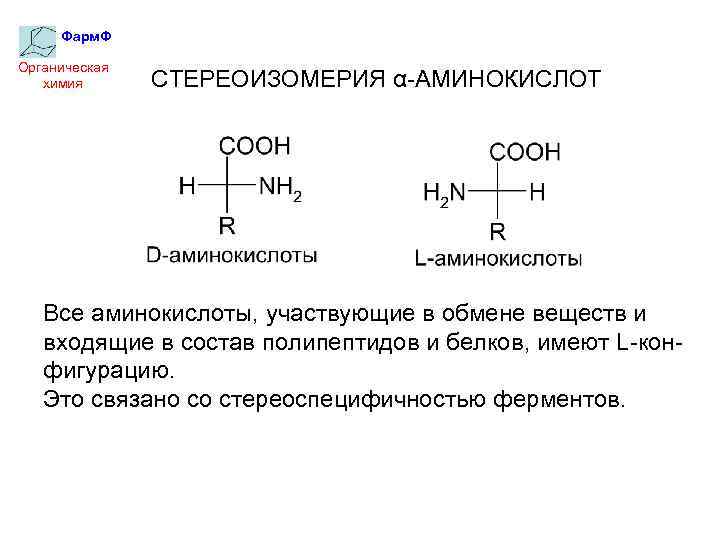
Оптическая изомерия:
По оптической активности аминокислоты делятся на право- и левовращающие. Наличие ассиметричного атома углерода (хирального центра) делает возможным только два расположения химических групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризации поляризованного света, проходящего через раствор. Величину угла поворота определяют при помощи поляриметра. В соответствии с углом поворота выделяют правовращающие (+) и левовращающие (–) изомеры. Деление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L-формы (или D-формы) являются правовращающими, для других – левовращающими. Например, L-аланин – правовращающий, а L-фенилаланин – левовращающий. При смешивании L- и D-форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активностью.
Индекс гидрофобности указывает на сродство радикала к воде, т.е. на его растворимость в водных растворителях. Положительные значения индекса имеют аминокислоты, которые плохо растворимы в воде – гидрофобные, а отрицательный – которые хорошо растворимы, т.е. гидрофильные.