
- •1.Ответ:
- •8. Закон гесса:
- •12. Ответ:
- •14. Ответ:
- •15. Можно ли судить о направлении процесса в неизолированной системе по изменению энтропии?
- •17.Ответ:
- •20. Ответ:
- •22. Ответ:
- •27. Ответ:
- •33. Ответ:
- •36. Ответ:
- •Основы теории строения вещества
- •1. Смотри другой файл
- •2. Смотри другой файл
- •3. Смотри другой файл
- •6. Ответ:
- •Виды спектров:
- •9. Ответ:
- •Электрохимические системы
- •2. Ответ:
- •4. Ответ:
- •5. Ответ:
- •6. Ответ:
- •Химическая кинетика и катализ
- •2. Ответ:
- •3. Ответ:
- •4. Методы определения порядка реакции
- •5. Сложные реакции
- •Обратимые (двусторонние) реакции
- •6. Параллельные реакции
- •Уравнение Аррениуса
- •12. Во всяком гетерогенном химическом процессе можно выделить следующие стадии:
- •19. Константы скорости реакции первого, второго и третьего порядков, кинетические уравнения для них. Период полупревращения.
- •22. Сложные реакции: последовательные. Стадийное протекание реакций. Метод квазистационарных концентраций.
- •23. Механизм мономолекулярных реакций, протекание их по 1-ому и 2-ому порядку.
- •24. Зависимость скорости реакции от температуры, уравнение Аррениуса. Энергия активации. Уравнение Вант-Гоффа.
- •25. Теория активных соударений. Выражение для константы скорости по теории активных соударений. Стерический фактор
- •26. Теория переходного состояния (активированного комплекса). Выражение для константы скорости по методу переходного состояния.
- •27. Ответ:
- •28. Влияние растворителя на скорость реакций в растворах. Гомо- и гетеролитические реакции. Роль сольватации и диэлектрической проницаемости.
- •29. Влияние ионной силы раствора на скорость реакции в растворах, солевые эффекты.
- •30. Цепные реакции. Особенности цепных реакций. Возникновение, развитие и обрыв цепи.
- •31. Кинетика реакций с неразветвленными и разветвленными цепями. Тепловой и цепной механизмы воспламенения.
- •32. Фотохимические реакции, Закон фотохимической эквивалентности Эйнштейна. Квантовый выход. Кинетика фотохимических реакций.
19. Константы скорости реакции первого, второго и третьего порядков, кинетические уравнения для них. Период полупревращения.

20. Способы определения порядка реакции
Метод подстановки, при котором по опытным значениям концентрации в различные моменты времени рассматривают константу скорости реакции по уравнениям первого, второго и третьего порядка. Если полученные по нему значения констант колеблются около некоторой средней величины, а отклонения от неё лежат в пределах ошибок определения, то выбранное уравнение описывает данный процесс.
Метод определения времени половинного превращения предложен А.В. Раковским. В основе метода лежит следующая зависимость периода полураспада от начальной концентрации реагентов для реакций.
Графическим методом определяют такую функцию концентрации, которая на графике зависимости её от времени даёт прямую линию
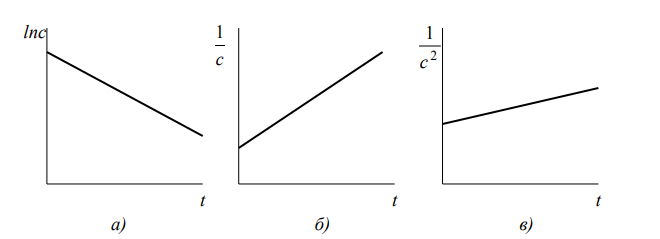
Дифференциальный метод, основанный на анализе логарифмической формы кинетического уравнения, был предложен Вант-Гоффом.
21. Сложные реакции: двухсторонние (обратимые), параллельные.
21.


22. Сложные реакции: последовательные. Стадийное протекание реакций. Метод квазистационарных концентраций.

В отличие от простых (одностадийных) реакций, механизм которых совпадает со стехиометрическим уравнением реакции, подавляющее большинство химических реакций является сложными, т.е. протекает через ряд последовательных и (или) параллельных стадий, при этом некоторые стадии протекают с участием промежуточных веществ, не являющихся ни исходными веществами, ни продуктами реакции. То есть в случае сложных реакций в системе протекают две или большее количество реакций.
В основе описание кинетики сложных реакций лежат: а) принцип независимости протекания реакций, б) принцип лимитирующей стадии.
Согласно принципу независимости протекания реакций “если в системе одновременно протекает несколько реакций, то каждая из них независима от остальных и скорость ее прямо пропорциональна произведению концентраций реагирующих веществ”.
Принцип лимитирующей стадии - скорость последовательной реакции определяется скоростью наиболее медленной стадии, суммарная скорость параллельных реакций определяется скоростью наиболее быстрой стадии.
Метод квазистационарных концентраций (Боденштейна) представляет собой способ анализа кинетических схем сложных химических реакций, использующий условия равенства (приближенного) скоростей образования и расходования промежуточных веществ. Исходя из кинетической схемы, для каждого активного промежуточного вещества записывают равенство скоростей образования и расходования. Или, что то же самое, записывают, чему равна производная концентрации промежуточного вещества по времени, и приравнивают это выражение к нулю. В результате, дифференциальные уравнения для концентраций активных промежуточных веществ превращаются в алгебраические. Решая систему алгебраических уравнений, концентрации промежуточных веществ выражают через концентрации устойчивых участников реакции. Их подставляют в формулы для скоростей образования продуктов или расходования исходных веществ, и в итоге получают выражения этих скоростей, не содержащие концентраций промежуточных веществ.
