
- •1.Ответ:
- •8. Закон гесса:
- •12. Ответ:
- •14. Ответ:
- •15. Можно ли судить о направлении процесса в неизолированной системе по изменению энтропии?
- •17.Ответ:
- •20. Ответ:
- •22. Ответ:
- •27. Ответ:
- •33. Ответ:
- •36. Ответ:
- •Основы теории строения вещества
- •1. Смотри другой файл
- •2. Смотри другой файл
- •3. Смотри другой файл
- •6. Ответ:
- •Виды спектров:
- •9. Ответ:
- •Электрохимические системы
- •2. Ответ:
- •4. Ответ:
- •5. Ответ:
- •6. Ответ:
- •Химическая кинетика и катализ
- •2. Ответ:
- •3. Ответ:
- •4. Методы определения порядка реакции
- •5. Сложные реакции
- •Обратимые (двусторонние) реакции
- •6. Параллельные реакции
- •Уравнение Аррениуса
- •12. Во всяком гетерогенном химическом процессе можно выделить следующие стадии:
- •19. Константы скорости реакции первого, второго и третьего порядков, кинетические уравнения для них. Период полупревращения.
- •22. Сложные реакции: последовательные. Стадийное протекание реакций. Метод квазистационарных концентраций.
- •23. Механизм мономолекулярных реакций, протекание их по 1-ому и 2-ому порядку.
- •24. Зависимость скорости реакции от температуры, уравнение Аррениуса. Энергия активации. Уравнение Вант-Гоффа.
- •25. Теория активных соударений. Выражение для константы скорости по теории активных соударений. Стерический фактор
- •26. Теория переходного состояния (активированного комплекса). Выражение для константы скорости по методу переходного состояния.
- •27. Ответ:
- •28. Влияние растворителя на скорость реакций в растворах. Гомо- и гетеролитические реакции. Роль сольватации и диэлектрической проницаемости.
- •29. Влияние ионной силы раствора на скорость реакции в растворах, солевые эффекты.
- •30. Цепные реакции. Особенности цепных реакций. Возникновение, развитие и обрыв цепи.
- •31. Кинетика реакций с неразветвленными и разветвленными цепями. Тепловой и цепной механизмы воспламенения.
- •32. Фотохимические реакции, Закон фотохимической эквивалентности Эйнштейна. Квантовый выход. Кинетика фотохимических реакций.
12. Во всяком гетерогенном химическом процессе можно выделить следующие стадии:
1. Диффузия реагентов к реакционной зоне, находящейся на поверхности раздела фаз.
2. Активированная адсорбция частиц реагентов на поверхности.
3. Химическое превращение адсорбированных частиц.
4. Десорбция образовавшихся продуктов реакции.
5. Диффузия продуктов реакции из реакционной зоны.
Стадии 1 и 5 называются диффузионными, стадии 2, 3 и 4 – кинетическими. Универсального выражения для скорости гетерогенных химических реакций не существует, поскольку каждая из выделенных стадий может являться лимитирующей. Как правило, при низких температурах скорость гетерогенной реакции определяют кинетические стадии (т.н. кинетическая область гетерогенного процесса; скорость реакции в этом случае сильно зависит от температуры и величины площади поверхности раздела фаз; порядок реакции при этом может быть любым). При высоких температурах скорость процесса будет определяться скоростью диффузии (диффузионная область гетерогенной реакции, характеризующаяся, как правило, первым порядком реакции и слабой зависимостью скорости процесса от температуры и площади поверхности раздела фаз).
Диффузия в газах происходит быстрее всего, она занимает всего несколько секунд или минут.
Диффузия в жидкостях может занимать от нескольких минут до нескольких часов.
Диффузия в твердых телах протекает с течением нескольких лет. Но эти процессы можно ускорять с помощью повышения температуры или при внешнем воздействии.

![]()
13. Соотношение диффузионных и кинетических факторов в гетерогенной кинетике. Влияние температуры и перемешивания на режим гетерогенного процесса.
13. https://chem21.info/info/1644202/
![]()
![]()
где коэффициент D – называется коэффициентом диффузии. Он зависит от природы диффундирующего вещества и среды, а также от температуры.
Из-за перемешивания или повышения температуры гетерогенный процесс ускоряется.
14. Гомогенный катализ, механизм. Кислотно-основной, окислительно-восстановительный, ферментативный катализ.
14. Гомогенный катализ, механизм. Кислотно-основной, окислительно-восстановительный, ферментированный катализ.
Гомогенный катализ – все взаимодействующие вещества, вещества и катализатор находятся в одной фазе
Механизм кислотно-основного катализа заключается в предварительном взаимодействии реагента с кислотой или основанием, что приводит к образованию более рационально способного соединения


Механизм окислительно-восстановительного катализа заключается в обмене электронами между катализатором и реагентом, который облегчает электронные переходы в реагирующих молекулах. (обычного ионного, заключается в обмене ионами или протонами между катализатором и реагирующими молекулами)
Ферментативный катализ обусловлен специфическим действием белковых веществ – ферментов. Данный вид катализа проявляется во множестве процессов, протекающих в живых организмах.
15. Адсорбция и гетерогенный катализ. Физическая и химическая адсорбция. Изотерма и изобара адсорбции.
15. Адсорбция – это процесс сорбции, поглощения, которое происходит в поверхностном слое вещества, обычно – твердого микроскопического вещества
Гетерогенный катализ – изменение скорости или инициирование химической реакции за счет взаимодействия (контакта) реагентов с катализаторами, которые образуют самостоятельную фазу отдельную от рациональной среды поверхностью раздела
Физическая адсорбция – молекулы газа связаны с атомами поверхности твердого тела слабыми ван-дер-вальсовыми силами (дисперсионными, индукционными и ориентационными). Физическая адсорбция – обратимый процесс.
Химическая адсорбция. Активированная или хемо-сорбция, обусловлена химическими, валентными силами между адсорбированными молекулами и атомами поверхности твердого тела. Необратима и сопровождается большими тепловыми эффектами
Изотерма адсорбции – зависимость равновесного количества адесорбата на поверхности твердого тела от давления газа (или от концентрации вещества в р-ре) при постоянной температуре
Изобара адсорбции – выражает изменение количества адсорбированного вещества в зависимости от температуры при постоянном давлении
16. Стадии и теории гетерогенного катализа.
Стадии: 1) Дифракция из объема к внешней поверхности катализатора
2) Дифракция к внутренней поверхности катализатора
3) Адсорбция или/и хемсорбция
4) Химическая реакция на активных центрах
5)Десорбция продуктов реакции
6) Дифракция из внутренних пор катализатора продуктов реакции на поверхность
7) Дифракция в объем от поверхности катализатора
Теоремы: 1. Теория Тейлора – Активные центры – участки поверхности, которые по каким-либо причинам оказываются выше среднего уровня поверхности (выступы, кристаллические пики). По Тейлору эти пики имеют свободные связи, которые способствуют образованию промежуточных соединений
2. Мультиплетная теория Баландика - предполагает, что в образовании поверхностного соединения участвуют группы активных атомов поверхности-мультиплеты, обладающие определенными геометрическими и энергетическими свойствами
3. Теория активных ансамблей Кобозева – предполагается, что активными центрами служат атомы, беспорядочно расположенные на поверхности кристаллического тела
4. Электронная теория Писаржевского: катализ идет под влиянием электронного обмена. В результате этого на поверхности возникают ненасыщенные валентности и реакционноспособные атомы и радикалы
17. Общие и специфические закономерности катализа. Промоторы, коактиваторы, отравление катализаторов.
Общие характеристики:
Не влияет на положение термодинамического равновесия, а только ускоряет наступление равновесия
Принимает участие в химической реакции
Скорость пропорциональна концентрации катализатора в гомогенном катализе или площади поверхности катализатора в гетерогенном катализе
Увеличивает скорость одной из возможных реакций и не влияет заметно на скорость других реакций
Специфические :
Реакции данного тела ускоряются катализаторами определенного химического состава
Кислотно-основные реакции ускоряются кислотами или основаниями
Окислительно-восстановительные реакции ускоряются переходными металлами и их соединениями
Отравление катализатора - это частичная или полная потеря активности в результате воздействия веществ - контактных ядов (вещества, под действием которых катализатор полностью или частично теряет свою активность
Промоторы - не имеют каталитические свойства, но повышают каталитическую активность катализатора
Коактиватор - белок, который увеличивает экспрессию генов путем связывания с активатором, который содержит ДНК-связывающий домен
18. Скорость реакции. кинетические кривые кинетические уравнение. Константа скорости химической реакции, молекулярность и порядок реакции.
Скорость реакции при постоянном объёме
системы численно равна изменению
концентрации одного из реагирующих
веществ в единицу времени:
![]()
Производная
![]() положительна, если рассматривается
изменение концентрации одного из
продуктов реакции, и отрицательна, если
рассматривается исходное вещество.
положительна, если рассматривается
изменение концентрации одного из
продуктов реакции, и отрицательна, если
рассматривается исходное вещество.
Кривые и уравнения
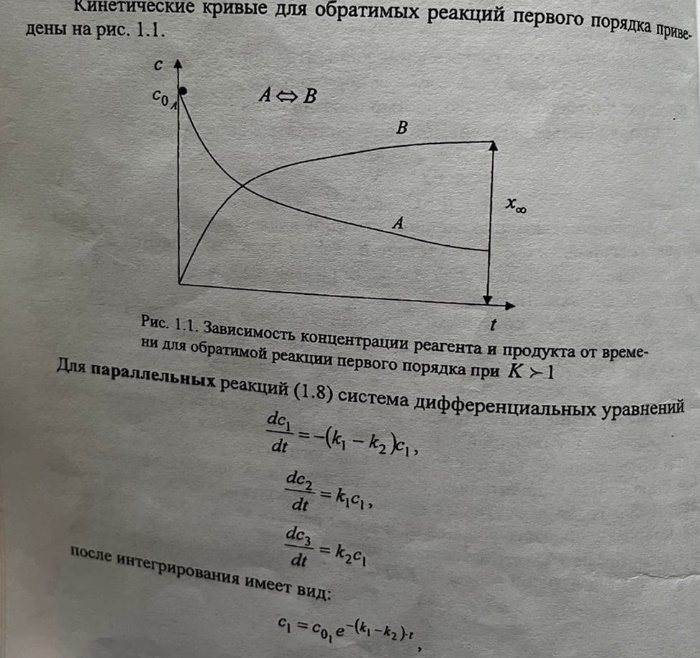

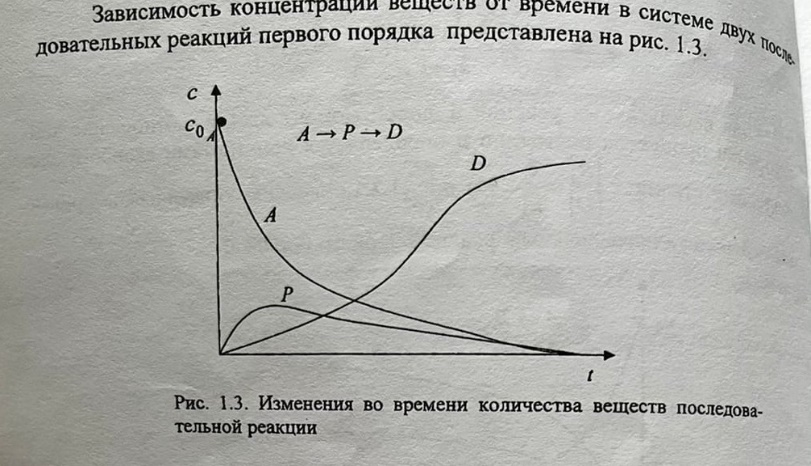
Константа скорости реакции k численно равна скорости реакции, если концентрации всех участников реакции равны единице. По физическому смыслу константа скорости – это удельная скорость реакции (при сi 1 ), поэтому её величина зависит от всех факторов, которые влияют на скорость реакции за исключением концентрации реагирующих веществ. Единицы её измерения определяются видом кинетического уравнения; Молекулярность химической реакции равна числу молекул (или других частиц), принимающих участие в элементарном акте этой реакции. 96 В зависимости от числа таких молекул различают мономолекулярные, бимолекулярные и тримолекулярные реакции. Порядок реакции определяется величиной показателя степени в кинетическом уравнении реакции. Каждый из показателей степени при концентрациях выражает частный порядок реакции (n1 и n2) по данному компоненту. Он может принимать целые, дробные, положительные, отрицательные, а также нулевые значения. Только для простых реакций уравнение скорости соответствует стехиометрическому уравнению. Чаще всего молекулярность и порядок реакции различны из–за сложного механизма протекания реакции.
