- •7. Биосинтез пиримидиновых мононуклеотидов.
- •8. Биосинтез нуклеозидтрифосфатов.
- •9. Биосинтез дезоксирибонуклеотидов.
- •10. Синтез нуклеиновых кислот.
- •11. Структура и биологическая роль нуклеотидов и нуклеиновых кислот.
- •12. Биосинтез днк (репликация); условия, этапы, репарация.
- •13. Биосинтез рнк (транскрипция); условия, этапы, обратная транскрипция.
- •3 Этапа процесса:
- •14. Созревание и синтез транскрипта.
- •15. Процессинг тРнк и р рнк.
- •16. Биосинтез белка (трансляция); этапы, регуляция , и генетический код.
- •17. Нарушение процесса трансляции.
- •18. Факторы, определяющие состояние белкового обмена. Синтез аммонийных солей.
- •19. Общие пути обмена аминокислот. Биосинтез аминокислот.
- •20. Реакции трансаминирования, Дезаминирование. Синтез мочевины.
- •21. Метаболизм глюкозы.
- •22. Расчет выхода атф при анаэробном окислении глюкозы.
- •23. Расчет выхода атф при аэробном окислении.
- •24. Биологическое значение и классификация липидов.
- •26. Биосинтез жирных кислот, химизм, ферменты.
- •27. Биосинтез жирных кислот с длинной цепью углеродных атомов и непредельных.
- •28. Биосинтез триглицеридов, фосфолипидов и холестерина.
- •29. Синтез и распад кетоновых тел.
- •30. Этапы энергетического обмена.
- •31. Цикл Кребса.
- •32. Энергетический баланс одного оборота цтк.
- •33. Тканевое дыхание и окислительное фосфорилирование.
- •3 4. Компоненты системы синтеза атф в митохондриях
- •35. Хемиосмотическая теория окислительного фосфорилирования.
- •36. Механизм окислительного фосфорилирования. Короткий вариант 36 вопроса
- •Подробный вариант 36 вопроса
- •37. Регуляция энергетического обмена.
- •38. Другие пути использования кислорода.
- •39. Пути использования кислорода в реакциях биологического окисления.
- •40. Сравнительная характеристика путей синтеза пуриновых и пиримидиновых нуклеотидов.
20. Реакции трансаминирования, Дезаминирование. Синтез мочевины.
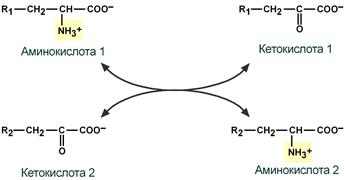
Трансаминирование – реакции переноса -аминогруппы с аминокислоты на -кетокислоту, в результате чего образуются новая кетокислота и новая аминонокислота.
Катализируют ферменты аминотрансферазы - сложные ферменты, коферментом которых является производное витамина В6 – пиридоксальфосфат, который обратимо может переходить в пиридоксаминфосфат.
Реакции трансаминирования обратимы, и могут проходить как в цитоплазме, так и в митохондриях клеток.
В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности.
Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина.
Реакции трансаминирования протекают в 2 стадии.
На первой стадии: к пиридоксальфосфату в активном центре фермента присоединяется аминогруппа от первого субстрата – аминокислоты. Образуется комплекс фермент-пиридоксаминфосфат и кетокислота – первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований (альдимин и кетимин).
На второй стадии: пиридоксаминфосфат соединяется с новой кетокислотой (второй субстрат) и снова через промежуточное образование 2 шиффовых оснований передает аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота – второй продукт реакции.
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных – глутамат, аланин, аспартат. Наиболее распространенными в большинстве тканей являются аланинаминотрансфераза (АлАТ) и аспартатаминотрансфераза (АсАТ).
Н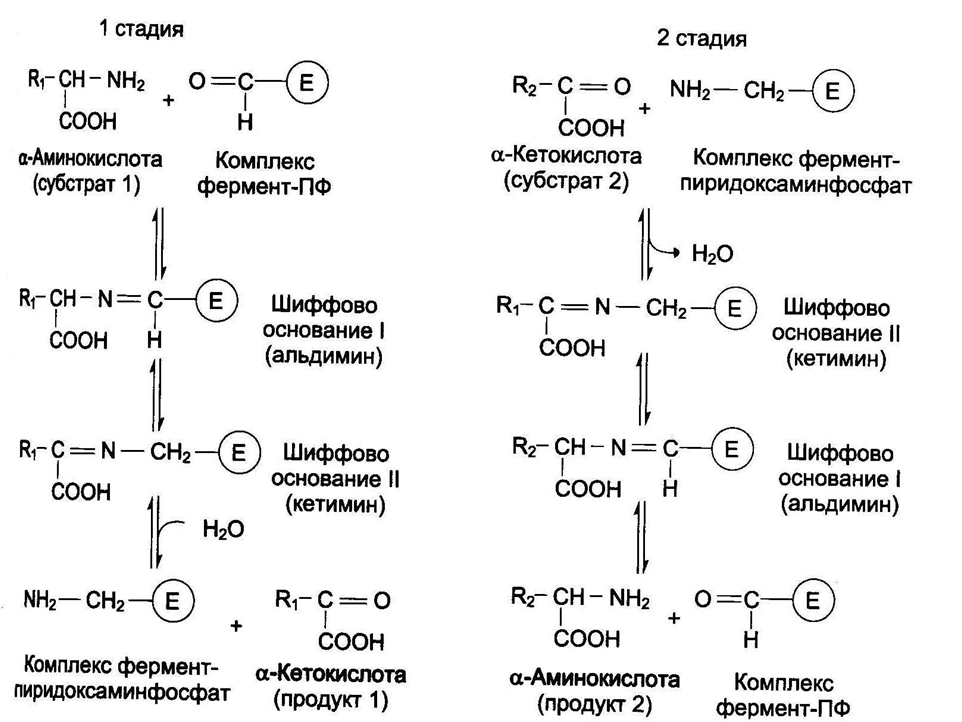 аибольшая
активность АсАТ обнаруживается в клетках
сердечной мышцы и печени, в то время как
в крови обнаруживается только фоновая
активность АлАТ и АсАТ. Поэтому можно
говорить об органоспецифичности этих
ферментов, что позволяет их широко
примененятьих с диагностической целью
(при инфарктах миокарда и гепатитах).
аибольшая
активность АсАТ обнаруживается в клетках
сердечной мышцы и печени, в то время как
в крови обнаруживается только фоновая
активность АлАТ и АсАТ. Поэтому можно
говорить об органоспецифичности этих
ферментов, что позволяет их широко
примененятьих с диагностической целью
(при инфарктах миокарда и гепатитах).
Дезаминирование аминокислот – реакция отщепления -аминогруппы от аминокислоты с выделением аммиака.
Различают два типа реакций дезаминирования:
прямое
непрямое.
Прямое дезаминирование – непосредственное отщепление аминогруппы от аминокислоты без промежуточных посредников.
В живой природе возможны следующие типы прямого дезаминирования:
окислительное,
восстановительное,
гидролитическое
путем внутримолекулярной перестройки.
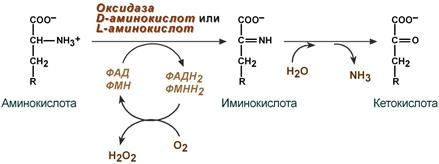
Но у человека дезаминирование происходит преимущественно окислительным путем в результате чего образуется соответствующая -кетокислота и выделяется аммиак. Процесс идет с участием ферментов оксидаз. Выделены оксидазы L-аминокислот, превращающие L-изомеры аминокислот, и D-оксидазы.
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное).
Аэробное прямое окислительное дезаминирование - катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН.
Анаэробное прямое окислительное дезаминирование - существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат.
Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования (см ниже).
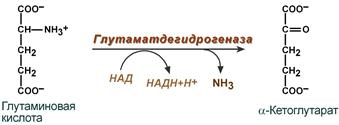
В печени реакция используется для получения аммиака из его транспортной формы глутаминовой кислоты. Далее аммиак входит в реакции синтеза мочевины.
Непрямое окислительное дезаминирование (трансдезаминирование):
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап: заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз.
Этот перенос - трансаминирование и его механизм довольно сложен.
В качестве конечной кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2").
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О.
В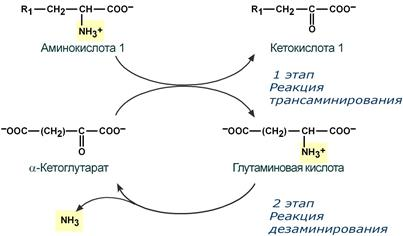 торой
этап: состоит в отщеплении
аминогруппы от аминокислоты 2
– дезаминирование.
торой
этап: состоит в отщеплении
аминогруппы от аминокислоты 2
– дезаминирование.
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты.
Этот этап осуществляется глутаматдегидрогеназой, которая имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование.
Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
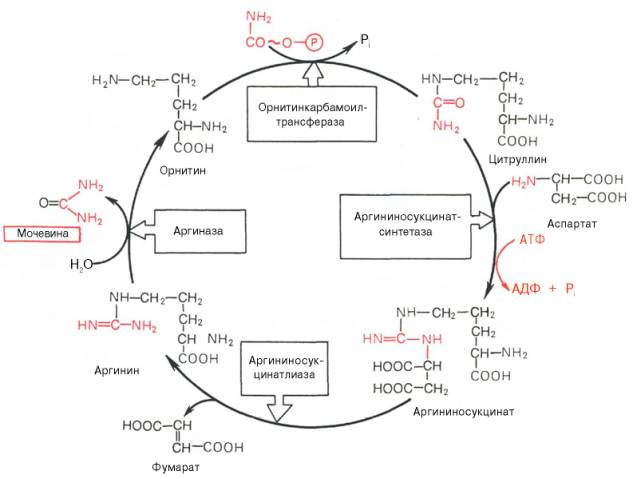
Синтез мочевины. Орнитиновый цикл:
В печени выполняет две функции:
превращение азота аминокислот в мочевину, которая выводится из организма, помогая избежать накопление токсичного аммиака;
синтез аргинина, из которого образуется мочевина
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового (соответственно аминокислотного) обмена.
На долю мочевины приходится до 80-85% от всего азота мочи.
Впервые Г. Кребс и К. Гензелейт в 1932 г. вывели уравнение реакции синтеза мочевины, которые представлены в виде цикла -орнитинивого цикла мочевинообразоавния Кребса.
Весь цикл мочевинообразования может быть представлен следующим образом.
На 1-м этапе: синтезируется макроэргическое соединение карбомоилфосфат – это метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов. Фермент – аммиакзависимая карбамоилфосфатсинтетаза:
Пиримидин←карбамоилфосфат→аргинин→мочевина ↓ ↓ ↓ ДНК РНК белки
Реакция требует затрату 2 АТФ,
Происходит в митохондриях клеток печени.
В качестве активного стимулирующего аллостерического эффектора действует N-ацетилглутамат.
На 2-м этапе: происходит кондесанция карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитин-карабамоилфосфатрансфераза.
На 3-м этапе: цитруллин превращается в аргинин в результате двух последовательно протекающих реакций.
Первая из них – это энергозависимая конденсация цитуллина и аспарагиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинатсинтетаза).
Вторая из них – аргининсукцинат распадается на аргинин и фумарат при участии другого фермента – аргининсукцинатлиазы.
На 4-м этапе: аргинин под действием аргиназы расщепляется на мочевину и орнитин, который вступает в новый оборот цикла, соединяясь с карбамоил-фосфатом, образуя цитруллин.
Суммарная реакция синтеза мочевины без учета всех промежуточных продуктов может быть в следующем виде:
CO2+NH3+2АТФ+2H2O+аспартат→мочевина+2АДФ+АМФ+фумарат+
+2Н3РО4+Н4P2О7
Данная реакция сопровождается снижением свободной энергии (ΔG=-40кДж), поэтому процесс всегда протекает в направлении синтеза мочевины.
Синтез мочевины энергетически дорого обходится организму. На синтез одной молекулы мочевины затрачивается четыре высокоэнергетических фосфатных группы:
две молекулы АТФ расходуются на синтез карабамоилфосфата
одна – на образование аргининоянтарной кислоты, при этом АТФ расщепляется на АМФ и который при гидролизе также образует две молекулы Н3РО4.