
- •7. Биосинтез пиримидиновых мононуклеотидов.
- •8. Биосинтез нуклеозидтрифосфатов.
- •9. Биосинтез дезоксирибонуклеотидов.
- •10. Синтез нуклеиновых кислот.
- •11. Структура и биологическая роль нуклеотидов и нуклеиновых кислот.
- •12. Биосинтез днк (репликация); условия, этапы, репарация.
- •13. Биосинтез рнк (транскрипция); условия, этапы, обратная транскрипция.
- •3 Этапа процесса:
- •14. Созревание и синтез транскрипта.
- •15. Процессинг тРнк и р рнк.
- •16. Биосинтез белка (трансляция); этапы, регуляция , и генетический код.
- •17. Нарушение процесса трансляции.
- •18. Факторы, определяющие состояние белкового обмена. Синтез аммонийных солей.
- •19. Общие пути обмена аминокислот. Биосинтез аминокислот.
- •20. Реакции трансаминирования, Дезаминирование. Синтез мочевины.
- •21. Метаболизм глюкозы.
- •22. Расчет выхода атф при анаэробном окислении глюкозы.
- •23. Расчет выхода атф при аэробном окислении.
- •24. Биологическое значение и классификация липидов.
- •26. Биосинтез жирных кислот, химизм, ферменты.
- •27. Биосинтез жирных кислот с длинной цепью углеродных атомов и непредельных.
- •28. Биосинтез триглицеридов, фосфолипидов и холестерина.
- •29. Синтез и распад кетоновых тел.
- •30. Этапы энергетического обмена.
- •31. Цикл Кребса.
- •32. Энергетический баланс одного оборота цтк.
- •33. Тканевое дыхание и окислительное фосфорилирование.
- •3 4. Компоненты системы синтеза атф в митохондриях
- •35. Хемиосмотическая теория окислительного фосфорилирования.
- •36. Механизм окислительного фосфорилирования. Короткий вариант 36 вопроса
- •Подробный вариант 36 вопроса
- •37. Регуляция энергетического обмена.
- •38. Другие пути использования кислорода.
- •39. Пути использования кислорода в реакциях биологического окисления.
- •40. Сравнительная характеристика путей синтеза пуриновых и пиримидиновых нуклеотидов.
15. Процессинг тРнк и р рнк.
р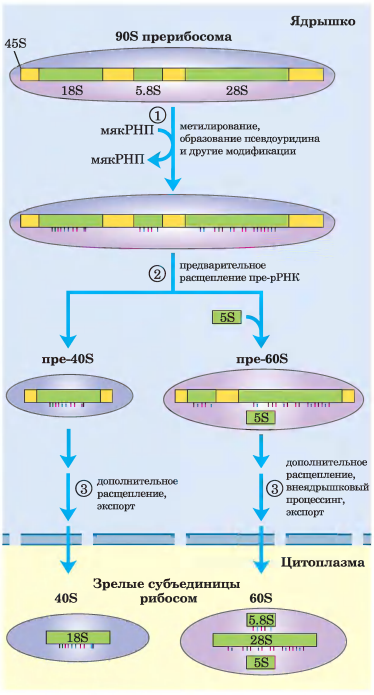 РНК
РНК
В ходе транскрипции первичный транскрипт 45S включается в ядрышковый прерибосомный комплекс 90S, в котором происходит сопряжение процессинга рРНК и сборки рибосом.
1) Предшественник 45S метилируется более чем по 100 нуклеотидам из 14 000 (по основаниям или по 2-ОН-группам), несколько остатков уридина превращаются в псевдоуридин, а также происходят некоторые другие модификации.
2) Серия ферментативных расщеплений 45S приводит к образованию 18S, 5,85 и 28S рРНК, и постепенно при присоединении рибосомных белков начинают формироваться субъединицы рибосом.
В реакциях расщепления и всех реакциях модификации участвует малая ядрышковая РНК (мякРНК), входящая в состав белковых комплексов (мякРНП) в ядрышке, напоминающих сплайсосомы. молекулы 5S рРНК образуются независимо.
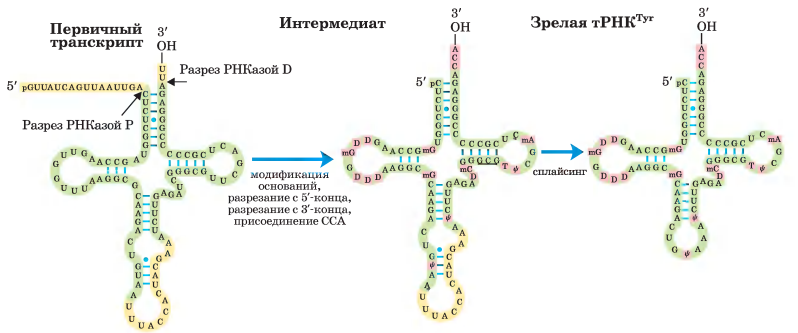 тРНК
тРНК
Сначала происходит процессинг концов: в первую очередь 5'-конца, затем 3'-конца. Потом к 3'-концу присоединяется последовательность ССА; эта стадия необходима в процессинге эукариотической тРНК и тех бактериальных тРНК, которые не имеют этой последовательности в первичном транскрипте. Одновременно с процессингом концов происходит модификация специфических оснований в оставшейся части транскрипта. Для показанной здесь эукариотической тРНК заключительная стадия - сплайсинг интрона из 14 нуклеотидов. Интроны встречаются в некоторых эукариотических тРНК, но не обнаружены в бактериальной тРНК.
16. Биосинтез белка (трансляция); этапы, регуляция , и генетический код.
Синтез белка происходит в пять стадий
Стадия 1: активация аминокислот. Для синтеза полипептида со специфической последовательностью необходимо соблюдение двух условий:
карбоксильная группа каждой аминокислоты должна быть активирована для облегчения формирования пептидной связи;
необходимо однозначное соответствие между каждой новой аминокислотой и кодирующей ее мРНК.
Оба эти требования удовлетворяются путем присоединения аминокислоты к тРНК на первой стадии синтеза белка. Принципиально важно соединить правильную аминокислоту с правильной тРНК. Эта реакция происходит в цитоплазме, а не на рибосоме. Каждая из 20 аминокислот ковалентно связывается со специфической тРНК с затратой энергии АТР с помощью активирующих Mg2+-зависимых ферментов, называемых аминоацил-тРНК-синтетазами. Связанную с соответствующей аминокислотой (аминоацетилированную) тРНК называют «нагруженной».
Стадия 2: инициация. Кодирующая полипептид мРНК связывается с меньшей из двух субъединиц рибосомы и с инициаторной аминоацил-тРНК.
Затем к ним присоединяется большая субъединица рибосомы, и формируется инициаторный комплекс. Инициаторная аминоацил-тРНК спаривается с кодоном AUG в мРНК, который обозначает начало полипептида. Этот процесс требует затраты GTP и запускается белками цитоплазмы, называемыми факторами инициации.
Стадия 3: элонгация. Полипептид удлиняется путем последовательного ковалентного связывания аминокислот, которые доставляются к рибосоме и точно размещаются специфическими молекулами тРНК путем спаривания с основаниями соответствующих кодонов в мРНК. Элонгация требует участия цитоплазматических белков, называемых факторами элонгации. Связыванию каждой поступающей молекулы аминоацил-тРНК и продвижению рибосом вдоль мРНК способствует гидролиз GTP.
Стадия 4: терминация и высвобождение. Сигналом окончания синтеза полипептидной цепи является стоп-кодон в мРНК. Новый полипептид высвобождается из комплекса с рибосомой с помощью факторов высвобождения, а рибосома готовится для синтеза следующего белка.
Стадия 5: укладка и посттрансляционный процессинг. Для перехода в активную форму новый полипептид должен принять свою специфическую трехмерную конформацию. До или после соответствующей упаковки полипептид может подвергаться ферментативным превращениям, таким как удаление одной или нескольких аминокислот (обычно с N-конца), присоединение ацетильной, фосфорильной, метильной, карбоксильной или других групп к определенным аминокислотным остаткам, протеолитическое расщепление и/или присоединение олигосахаридов или простетических групп.
Сейчас будут расписаны стадии более подробно)
Стадия 1. Активация аминокислот
Основными участниками первой стадии являются молекулы тРНК и аминокислоты. Аминокислоты присоединяются к акцепторным концам молекул тРНК ферментами аминоацил-тРНК-синтетаза (aminoacyl-tRNA synthetase).
Фермент аминоацил-тРНК-синтетаза (aminoacyl-tRNA synthetase) присоединяет аминокислоту к свободному 2' (класс I аминоацил- тРНК-синтетаз) или 3' (класс II аминоацил-тРНК-синтетаз) гидроксилу пентозы аденозина на 3'-конце молекулы тРНК в ходе АТФ-зависимой реакции.
В клетке существует 20 аминоацил-тРНК-синтетаз. Каждая из 20 различных синтетаз распознает одну аминокислоту и все совместимые с ней (родственные) тРНК.
Реакция аминоациллирования тРНК происходит в два этапа. Сначала в активном центре фермента α-карбоксил аминокислоты атакует α-фосфат АТФ и образуется фосфорилированная форма аминокислоты – аминоациладенилат. Затем, aминоацильный остаток передаётся на соответствующую тРНК.
Впоследствии на рибосоме антикодон аминоацил-тРНК связывается с кодоном в мРНК так, чтобы активированная аминокислота могла быть присоединена к растущей полипептидной цепи. На рисунке приведена схема активации фенилаланина (Phe.)
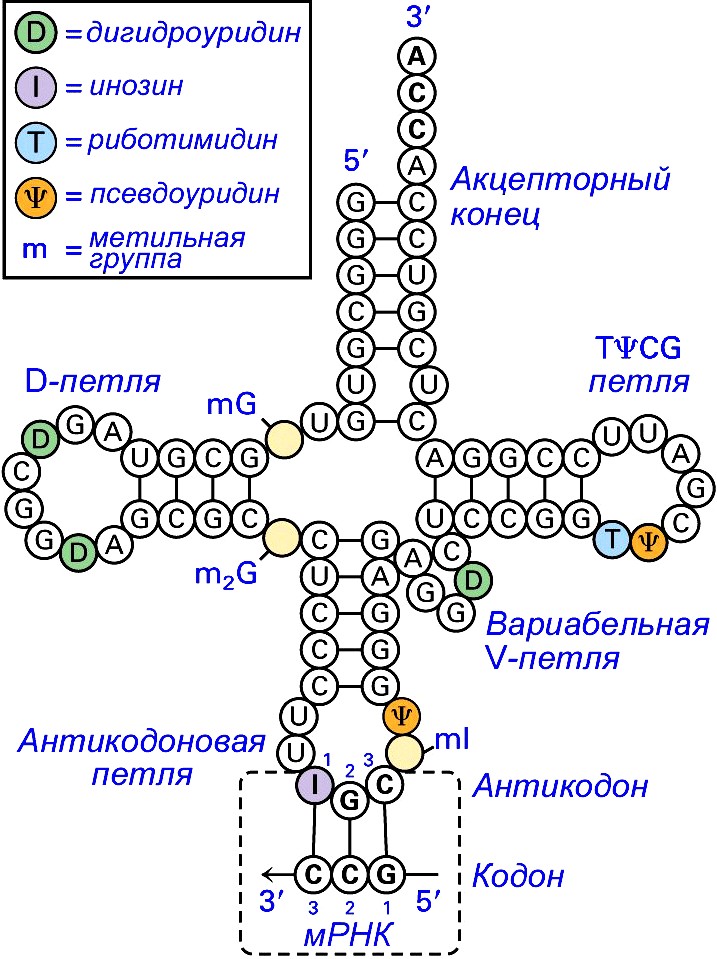 Молекулы
тРНК выполняют роль «словаря» при
«переводе» генетической информации с
четырёхбуквенного языка ДНК на
20-буквенный язык белков.
Молекулы
тРНК выполняют роль «словаря» при
«переводе» генетической информации с
четырёхбуквенного языка ДНК на
20-буквенный язык белков.
Рисунок 1 – Вторичная структура тРНК
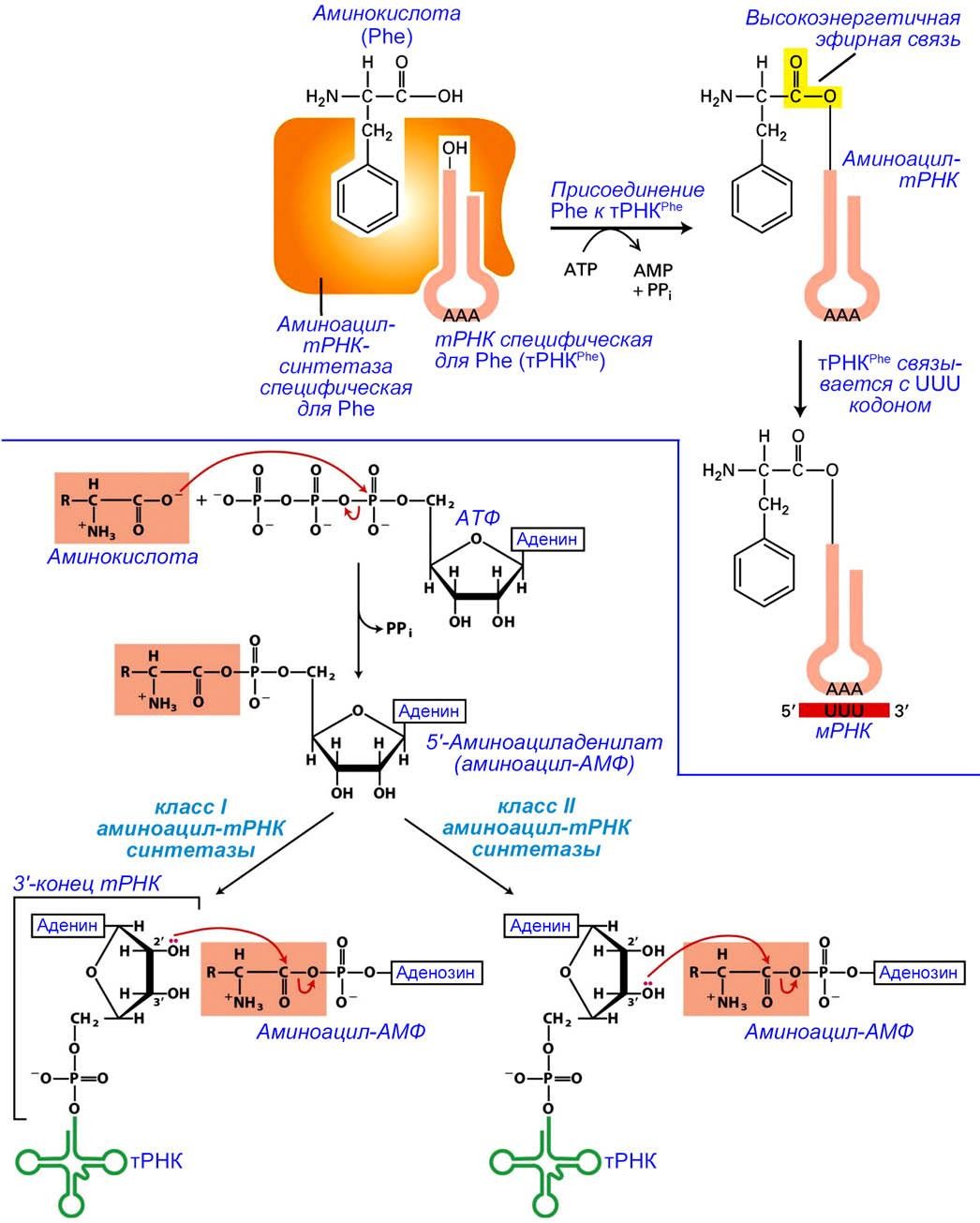
 Рисунок
2 – аминоациллирование тРНК
Рисунок
2 – аминоациллирование тРНК
Стадия 2. Инициация роста полипептидной цепи
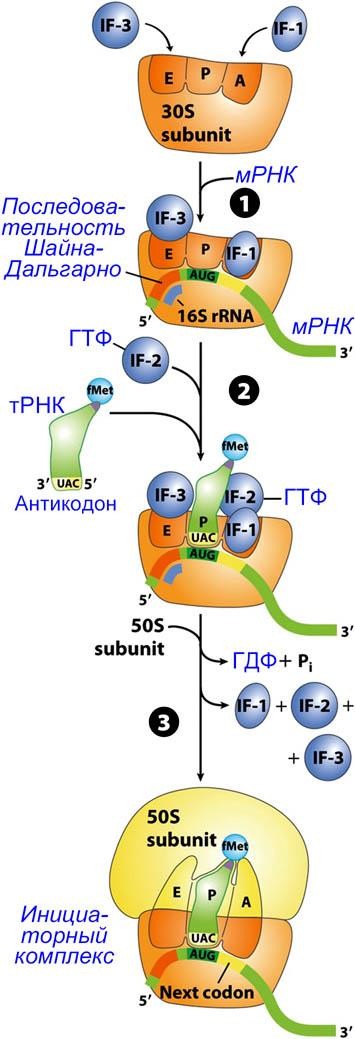
На второй стадии процесса биосинтеза белка происходит образование инициаторного комплекса – особой структуры, способной к началу синтеза полипептидной цепи на основе информации, заложенной в структуре матричной РНК. Основу инициаторного комплекса составляет рибосома.
Формирование инициаторного комплекса происходит в три этапа.
(1) Малая субъединица рибосомы (30S subunit) связывается с двумя белковыми факторами инициации (initiation factors) IF-1 и IF-3. Затем к ним присоединяется мРНК. У прокариот стартовый кодон AUG на 5'-конце мРНК устанавливается в правильное положение вследствие комплементарного спаривания последовательности Шайна-Дальгарно с 3'-концевой последовательностью рРНК малой субъединицы рибосомы.
(2) Со старт-кодоном (AUG) мРНК комплементарно связывается антикодон (UAC) инициаторной аминоацил- лированной тРНК (несущей формилметионин (с. 1-13) fMet-тPHKfMet), с которой связан белковый фактор инициации IF-2 и гуанозинтрифосфат (ГТФ).
(3) Происходит гидролиз ГТФ. За счёт освобождающейся при этом энергии, от комплекса отделяются факторы инициации IF-1, IF-2 и IF-3. Присоединение большой субъединицы рибосомы (50S subunit) приводит к образованию инициирующего комплекса.
П оследовательность
Шайна-Дальгарно (Shine-Dal- garno sequence, названная
в честь открывших её австралийских
исследователей John Shine и Lynn Dalgarno) – это
видоспецифичный сайт связывания рибосом
на молекуле мРНК прокариот, она содержит
от 4 до 9 пуринов на расстоянии от 8 до 13
нуклеотидов от 5'-конца мРНК. На рисунке
приведены примеры последовательностей
Шайна- Дальгарно для нескольких генов
E. coli и геномов двух бактериофагов.
оследовательность
Шайна-Дальгарно (Shine-Dal- garno sequence, названная
в честь открывших её австралийских
исследователей John Shine и Lynn Dalgarno) – это
видоспецифичный сайт связывания рибосом
на молекуле мРНК прокариот, она содержит
от 4 до 9 пуринов на расстоянии от 8 до 13
нуклеотидов от 5'-конца мРНК. На рисунке
приведены примеры последовательностей
Шайна- Дальгарно для нескольких генов
E. coli и геномов двух бактериофагов.
К омплементарное
спаривание консенсусной (подходящей
для всех видов) последовательности
Шайна-Дальгарно прокариот с 3'-концевой
последовательностью рибосомальной РНК
(рРНК) малой субъединицы рибосомы
представлено на рисунке.
омплементарное
спаривание консенсусной (подходящей
для всех видов) последовательности
Шайна-Дальгарно прокариот с 3'-концевой
последовательностью рибосомальной РНК
(рРНК) малой субъединицы рибосомы
представлено на рисунке.
Рисунок 3 – комплементарное спаривание
Рибосома имеет три сайта связывания тРНК:
А – аминоацильный сайт (aminoacyl (A) site);
Р – пептидильный сайт (peptidyl (P) site);
Е – сайт выхода тРНК (exit (E) site).
Только стартовая тPHKfMet связывается с Р-сайтом, все остальные аминоациллированные тРНК связываются с А-сайтом рибосомы.
Таким образом, в состав инициаторного комплекса входит рибосома, к которой присоединена мРНК со стартовым кодоном в Р-сайте, с которым, в свою очередь, связан аминоацильный комплекс инициирующей аминокислоты (fMet) с тРНК.
В А-сайте (аминоацильном) инициирующего комплекса находится второй по счету кодон м-РНК.
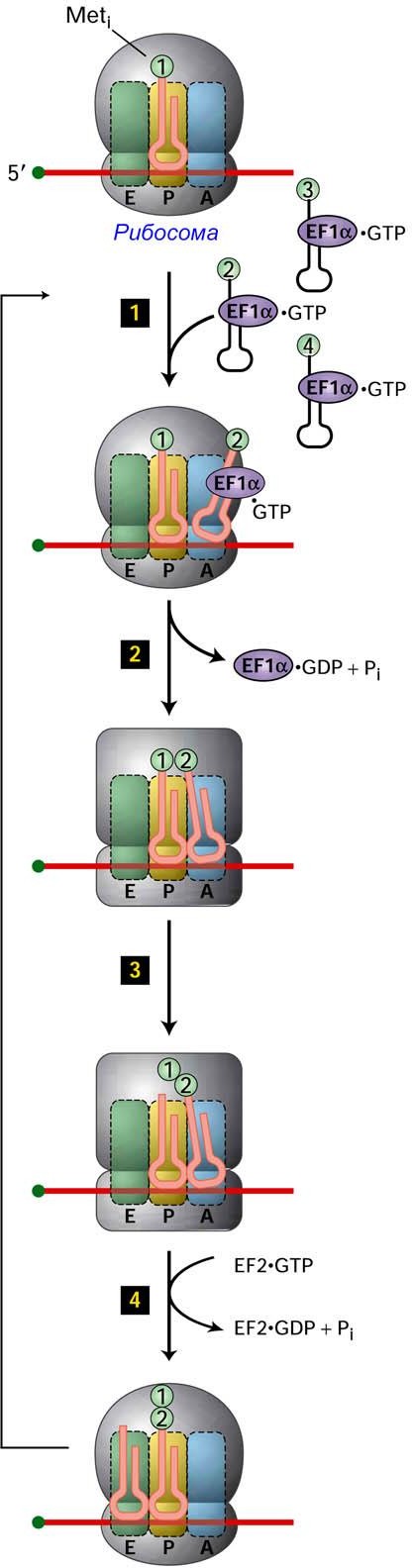
Стадия 3. Элонгация
 На
третьей стадии процесса биосинтеза
белка происходит элонгация (удлинение)
полипептидной цепи синтезируемого
белка, как результат собственно трансляции
(перевода).
На
третьей стадии процесса биосинтеза
белка происходит элонгация (удлинение)
полипептидной цепи синтезируемого
белка, как результат собственно трансляции
(перевода).
Основными этапами элонгации являются:
присоединение следующей аминоацил-тРНК;
конформационное изменение рибосомы;
формирование пептидной связи;
сдвиг, или транслокация, рибосомы на один кодон вдоль мРНК.
Для элонгации необходим набор специализированных белков – факторов элонгации, EF (elongation factors).
Используемые для биосинтеза белка аминоацил-тРНК присоединяют особый белковый фактор элонгации EF-1 (Tu) и ГТФ (GTP). При этом образуется тройной комплекс: аминоацил-тРНК–Tu–ГТФ. Комплекс, в состав которого входит соответствующая аминокислота, присоединяется к кодону мРНК, локализованному в А-сайте рибосомы. Присоединение происходит лишь в том случае, если антикодон т-РНК оказывается комплементарным кодону мРНК.
Гидролиз GTP стимулирует конформационное изменение рибосомы, при котором сближаются 3'-концы тРНК с аминокислотами, и высвобождение EF1. Важную роль в обеспечении всех этих превращений на рибосоме играет фактор элонгации Ts (не показан на рисунке), который переносит ГТФ на EF1 (Tu), «заряжая» его.
Между аминокислотами, связанными с тРНК, находящимися в А и Р сайтах образуется пептидная связь. Для этого аминокислота из Р-сайта переносится в А-сайт. Эта пептидилтрансферазная реакция катализируется большой рРНК. Каталитическая активность именно большой рРНК была доказана, тем, что она катализировала пептдилтрансферазную реакцию даже в условиях, когда из большой субъединицы рибосомы были удалены все малые белки. Другой аргумент в пользу каталитической активности большой рРНК, был получен из кристаллографических исследований пространственной структуры рибосомы, которые показали, что вблизи места, где происходит синтез пептидной связи, нет рибосомных белков. Аминокислота из Р-сайта, перенесённая в А-сайт, присоединяется к связанной с тРНК аминокислоте и становится N-концевой. Поэтому инициирующая аминокислота в синтезирующемся белке всегда оказывается N-концевой. В результате в А-сайте рибосомы оказывается дипептидил-тРНК, а в Р-сайте – остаётся «пустая» тРНК.
На следующем этапе рибосома, связывается со вторым фактором элонгации EF2 (G) (транслоказа), несущим ГТФ, и за счёт энергии гидролиза ГТФ перемещается вдоль мРНК в сторону 3'-конца на расстояние, равное одному кодону. В результате подобной транслокации «пустая» тРНК перемещается из P-сайта в Е-сайт (и затем десорбирует в цитозоль). В Р-сайте при этом оказывается дипептидил-тРНК, а А-сайт освобождается. После освобождения А-сайта рибосомы, появляется возможность для присоединения новой аминоацил-тРНК и последовательность событий, происходящих на этой стадии, повторяется.
В результате повторения этапов (1)–(4) к уже образованной полипептидной цепи последовательно присоединяются остальные остатки аминокислот.
Последовательность присоединения аминокислот, определяется первичной структурой (нуклеотидной последовательностью) мРНК.
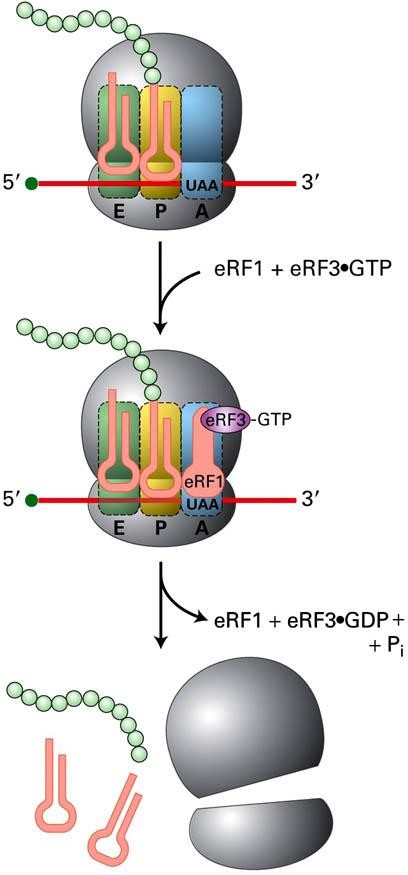
Стадия 4. Терминация
 После
присоединения последней аминокислоты
к полипептидной цепи наступает финальная
стадия белкового синтеза – терминация.
После
присоединения последней аминокислоты
к полипептидной цепи наступает финальная
стадия белкового синтеза – терминация.
Терминация происходит при появлении одного из трёх стоп-кодонов мРНК, следующих непосредственно за триплетом нуклеотидов, кодирующих включение в полипептидную цепь последней аминокислоты.
К стоп-кодонам относятся триплеты нуклеотидов:
УАА (UAA);
УАГ (UAG);
УГА (UGA)
Стоп-кодоны не кодируют аминокислот и представляют собой так называемые бессмысленные (nonsense) кодоны.
При попадании в А-сайт рибосомы стоп-кодона начинают действовать три фактора терминации – RF1, RF2 и RF3 (release factors).
Под влиянием этих факторов происходит:
• диссоциация рибосомы;
• разъединение субъединиц, мРНК и последней тРНК, которые теперь вновь готовы участвовать в новом цикле синтеза нового белка.
Эукариотический фактор терминации eRF1, чья форма подобна форме тРНК, связывается с А-сайтом и непосредственно распознаёт стоп-кодон.
Подобно некоторым из факторов инициации и элонгации, фактор высвобождения eRF3 связан с ГТФ. Связывание комплекса (eRF3–GTP) c eRF1 и гидролиз ГТФ обеспечивают отделение полипептида от тРНК и завершение синтеза белка.
Бактерии, в отличие от эукариот, имеют два фактора высвобождения RF1 и RF2 (которые функционально аналогичны эукариотическому фактору eRF1) и ГТФ-связан- ный фактор RF3, аналогичный eRF3.
В среднем трансляция эукариотической мРНК длится 30–60 секунд. Существуют два явления, которые значительно ускоряют этот процесс:
одновременное транслирование одной молекулы мРНК несколькими рибосомами;
быстрое рециклирование рибосомных субъединиц – диссоциировавшие с 3'-конца мРНК субъединицы снова быстро формируют рибосому на 5'-конце.
Одновременная трансляция мРНК несколькими рибосомами действительно наблюдается в электронном микроскопе и при седиментационном анализе, демонстрируя несколько присоединённых к одной мРНК рибосом, синтезирующих белки.
Такие структуры, называемые полирибосомами или полисомами, видны в виде циркулярных (круговых) образований в электронном микроскопе. Дальнейшие исследования клеток дрожжей объяснили круговую форму полисом и механизм эффективного рециклирования рибосом.
Оказалось, что цитозольные белки PABPI, которые найдены во всех эукариотических клетках – поли(А)-связывающие белки (poly(A)-binding protein), одновременно взаимодействуют с поли(А) хвостом мРНК и субъединицей 4G фактора eIF4.
А субъединица 4E этого же фактора eIF4 связывается с кэпом на 5'-конце мРНК. В результате концы мРНК соединяются промежуточными белками, и молекула мРНК «закольцовывается».
Поскольку два конца мРНК располагаются близко друг к другу, рибосомные субъединицы, освободившиеся на 3'-конце мРНК могут сразу же быть использованы на 5'- конце. Такой циркулярный способ синтеза белков обнаружен во многих эукариотических клетках.
Стадия 5. Посттрансляционный процессинг
Синтезированный на рибосоме полипептид, как правило, не обладает характерной для данного белка биологической активностью.
Поэтому осуществляется его своеобразное «созревание», которое происходит на заключительной, пятой стадии процесса белкового синтеза – стадии посттрансляционного процессинга.
В основе посттрансляционного процессинга лежат различные типы ковалентных превращений полипептидной цепи.
Уменьшение длины полипептидной цепи, за счёт протеолитического отщепления от неё ферментами пептидазами отдельных аминокислот с С- или N-конца, а также пептидных фрагментов разной длины.
Ковалентная модификация аминокислотных остатков, включённых в полипептидную цепь.
Ковалентная модификация может происходить путём:
фосфорилирования аминокислот, содержащих гидроксильную группу в радикале (серин, треонин, тирозин);
карбоксилирования остатков глутаминовой и аспарагиновой кислот;
метилирования;
гликозилирования (присоединение гликозидных остатков к аспарагиновой кислоте, серину или треонину);
присоединения простетических групп (фосфобиотина, гема, флавиновых коферментов и др.) и пр.
В результате превращений, происходящих на стадии посттрансляционного процессинга, молекула белка приобретает характерную для неё длину и присоединяет свойственный ей небелковый компонент.
Всё это обеспечивает возможность формирования нативной конформации полипептидной цепи и связанного с ней образования активных участков белковой молекулы (активных центров, участков связывания), определяющих возможность выполнения белком характерной для него биологической функции.
Регуляция синтеза
В генетическом аппарате наряду со структурными генами, кодирующими структуру определённых белков, существуют участки ДНК, выполняющие регуляторные функции. Группа структурных генов, отвечающих за синтез ферментов одного метаболического пути, находится под контролем гена-оператора, расположенного рядом. Структурные гены в совокупности с геном-оператором составляют оперон, или транскриптон. Функция гена-оператора контролируется пространственно удалённым от него геном-регулятором, который продуцирует белок-репрессор, находящийся в активной либо в неактивной форме. Активный белок-репрессор способен связываться с геном-оператором и тормозить транскрипцию структурных генов, следовательно, подавлять синтез белков. Вещества, вызывающие инактивацию белка-репрессора, являются индукторами синтеза белка, оказывающие противоположный эффект – корепрессорами.
С уществуют
два механизма регуляции синтеза белка
– индукция и репрессия.
Примером оперона, который регулируется
по механизму индукции, является лактозный
оперон, в состав которого наряду
с геном-оператором входят 3 структурных
гена, кодирующие ферменты катаболизма
лактозы. Лактоза является индуктором
данного оперона. При высокой концентрации
лактозы в среде ферменты синтезируются,
при низкой концентрации – нет.
уществуют
два механизма регуляции синтеза белка
– индукция и репрессия.
Примером оперона, который регулируется
по механизму индукции, является лактозный
оперон, в состав которого наряду
с геном-оператором входят 3 структурных
гена, кодирующие ферменты катаболизма
лактозы. Лактоза является индуктором
данного оперона. При высокой концентрации
лактозы в среде ферменты синтезируются,
при низкой концентрации – нет.
По механизму репрессии регулируется гистидиновый оперон, содержащий ген-оператор и 10 структурных генов, кодирующих ферменты, необходимые для биосинтеза гистидина. Гистидин является корепрессором данного оперона. При высокой концентрации гистидина в среде синтез ферментов прекращается, при отсутствии гистидина они синтезируются.

Генетический код - Система записи генетической информации в ДНК (и-РНК) в виде определенной последовательности нуклеотидов.
Свойства генетического кода
Триплетность - каждая аминокислота кодируется последовательностью из 3-х нуклеотидов. Триплет или кодон - последовательность из трех нуклеотидов, кодирующая одну аминокислоту.
Неперекрываемость - нуклеотид, входящий в состав кодона не входит в состав другого кодона
Коллинеарность – порядок расположения полипептидной цепи соответствует порядку расположения кодонов в полинуклеотидной цепи.
Вырожденность - все аминокислоты, за исключением метионина и триптофана, кодируются более чем одним триплетом.
Специфичность - один кодон кодирует одну аминокислоту. Например, кодон АУГ кодирует метионин.
Непрерывность: непрерывно, без знаков препинания.
Униполярность 5→3
Универсальность - генетический код един для всех живущих на земле существ.
