
- •7. Биосинтез пиримидиновых мононуклеотидов.
- •8. Биосинтез нуклеозидтрифосфатов.
- •9. Биосинтез дезоксирибонуклеотидов.
- •10. Синтез нуклеиновых кислот.
- •11. Структура и биологическая роль нуклеотидов и нуклеиновых кислот.
- •12. Биосинтез днк (репликация); условия, этапы, репарация.
- •13. Биосинтез рнк (транскрипция); условия, этапы, обратная транскрипция.
- •3 Этапа процесса:
- •14. Созревание и синтез транскрипта.
- •15. Процессинг тРнк и р рнк.
- •16. Биосинтез белка (трансляция); этапы, регуляция , и генетический код.
- •17. Нарушение процесса трансляции.
- •18. Факторы, определяющие состояние белкового обмена. Синтез аммонийных солей.
- •19. Общие пути обмена аминокислот. Биосинтез аминокислот.
- •20. Реакции трансаминирования, Дезаминирование. Синтез мочевины.
- •21. Метаболизм глюкозы.
- •22. Расчет выхода атф при анаэробном окислении глюкозы.
- •23. Расчет выхода атф при аэробном окислении.
- •24. Биологическое значение и классификация липидов.
- •26. Биосинтез жирных кислот, химизм, ферменты.
- •27. Биосинтез жирных кислот с длинной цепью углеродных атомов и непредельных.
- •28. Биосинтез триглицеридов, фосфолипидов и холестерина.
- •29. Синтез и распад кетоновых тел.
- •30. Этапы энергетического обмена.
- •31. Цикл Кребса.
- •32. Энергетический баланс одного оборота цтк.
- •33. Тканевое дыхание и окислительное фосфорилирование.
- •3 4. Компоненты системы синтеза атф в митохондриях
- •35. Хемиосмотическая теория окислительного фосфорилирования.
- •36. Механизм окислительного фосфорилирования. Короткий вариант 36 вопроса
- •Подробный вариант 36 вопроса
- •37. Регуляция энергетического обмена.
- •38. Другие пути использования кислорода.
- •39. Пути использования кислорода в реакциях биологического окисления.
- •40. Сравнительная характеристика путей синтеза пуриновых и пиримидиновых нуклеотидов.
Подробный вариант 36 вопроса
Окислительное фосфорилирование — это заключительный этап общего катаболизма. Напомню, что он включает: окислительное декарбоксилирование пирувата, цикл Кребса и окислительное фосфорилирование.
Окислительное фосфорилирование — сложный процесс. Он включает три этапа: перенос электронов по дыхательной цепи, создание градиента концентрации протонов и синтез АТФ.
Электроны, которые были получены в ходе катаболизма, попадают на комплексы дыхательной цепи. Там они перескакивают с одного комплекса на другой, пока не попадут на кислород. В ходе таких перескоков создаётся энергия. За счёт этого создаётся градиент концентрации протонов. Протоны стараются попасть обратно в матрикс митохондрий, но мембрана для них непроницаема. Так они и бьются в мембрану, пока не попадают на АТФ-синтазу. Транспорт протонов из межмембранного пространства в матрикс создаёт большое количество энергии. Эта энергия используется АТФ-синтазой для синтеза АТФ.
Дыхательная цепь состоит из четырёх комплексов. Комплексы — это гигантские белки. Они пронизывают внутреннюю мембрану митохондрий.
Для перемещения электронов по дыхательной цепи в ее комплексах находятся: коферменты, железо-серные белки, цитохромы и медь. С помощью редокс потенциалов они заставляют их передвигаться (у них есть и другое название — окислительно-восстановительные потенциалы). Дело тут такое, у молекул различное сродство к электронам. Чем больше окислительно-восстановительный потенциал молекулы, тем больше у неё сродство к электронам. Если расположить молекулы в порядке возрастания их потенциалов, то мы заставим двигаться электроны вдоль дыхательной цепи.
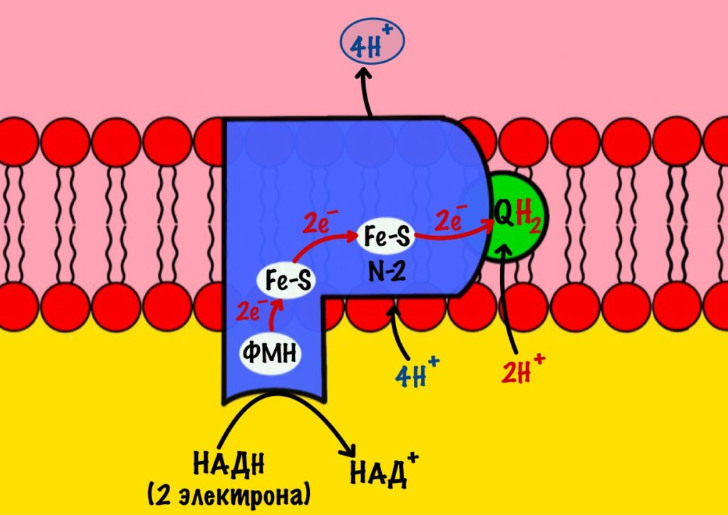
Комплекс 1 — НАДH-дегидрогеназа
В его состав входит ФМН и железо-серные белки. Его основная задача — принять электроны от НАДH и переместить на убихинон (коэнзим Q10).
Восстановленный НАДH — из общего катаболизма — отдаёт гидрид ион (два электрона и протон) этому комплексу. Электроны сначала попадают на ФМН, а потом на железо-серные белки — всего их восемь. Последний железо-серный белок — N-2. Этот белок отдаёт электроны на убихинон. В ходе этой серии реакций выделяется энергия. Энергия идёт на транспорт четырёх протонов из матрикса в межмембранное пространство.
Далее убихинон отсоединяется от первого комплекса и путешествует по внутренней мембране. Он жирорастворимый, поэтому это не составляет ему труда. Восстановленный убихинон присоединится к третьему комплексу, которому и отдаст свои электроны и протоны.
Второй комплекс — сукцинатдегидрогеназа
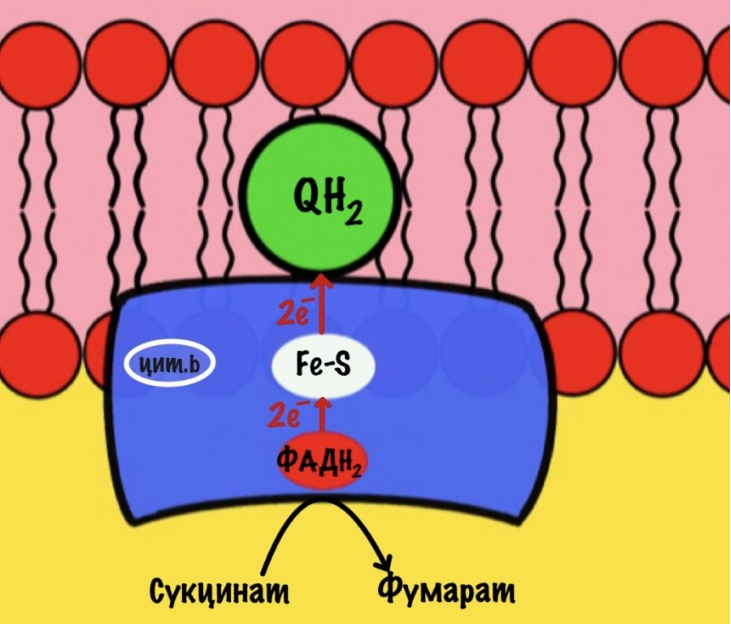 Задача
второго комплекса — транспорт электронов
с ФАДH2 их на убихинон. Второй комплекс
намного меньше первого, он включает
четыре субъединицы. Только одна
ответственна за реакцию сукцинатдегидрогеназы
— субъединица А. Кофермент ФАД тесно
связан с этим комплексом. Остальные
субъединицы транспортируют электроны.
В комплексе есть три железо-серных белка
и цитохром b. Железо-серные белки переносят
электроны на убихинон. Цитохром b не
участвует в транспорте электронов, он
нужен для избежания утечек электронов.
Иногда электроны сбиваются со своего
пути, а это может привести к образованию
токсичных форм кислорода.
Задача
второго комплекса — транспорт электронов
с ФАДH2 их на убихинон. Второй комплекс
намного меньше первого, он включает
четыре субъединицы. Только одна
ответственна за реакцию сукцинатдегидрогеназы
— субъединица А. Кофермент ФАД тесно
связан с этим комплексом. Остальные
субъединицы транспортируют электроны.
В комплексе есть три железо-серных белка
и цитохром b. Железо-серные белки переносят
электроны на убихинон. Цитохром b не
участвует в транспорте электронов, он
нужен для избежания утечек электронов.
Иногда электроны сбиваются со своего
пути, а это может привести к образованию
токсичных форм кислорода.
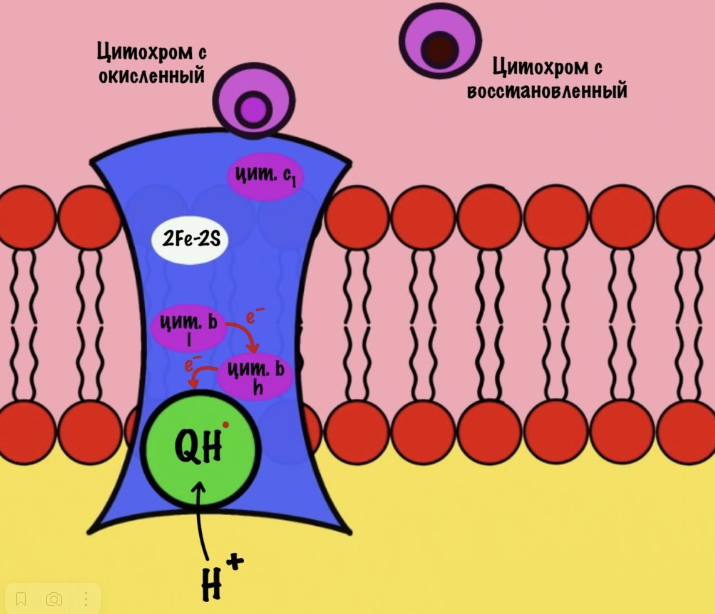
Третий комплекс — цитохром bc1 комплекс
Третий комплекс состоит из двух субъединиц. В каждой субъединице есть: 2Fe-2S железо-серный белок, цитохром b, цитохром c1.
Задача этого комплекса — транспорт электронов с восстановленного убихинона на цитохром c.
К комплексу присоединяется восстановленный убихинон. Он отдаёт один электрон на цитохром b, а другой на железо-серный белок. Дальше железо-серный белок отдаст электрон цитохрому c1. В это же время от убихинона отщепляются два водорода, которые транспортируются в межмембранное пространство третьим комплексом. Убихинон становится окисленным и отсоединяется от третьего комплекса.
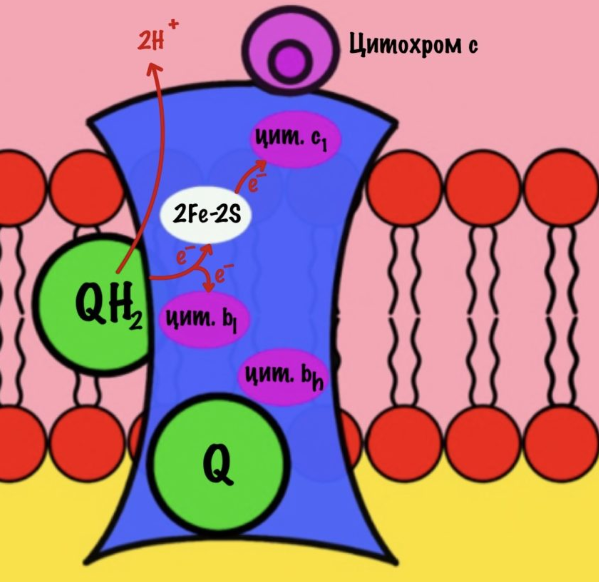
Цитохром c1 передаёт электрон цитохрому c. И тот отчаливает от третьего комплекса. Дальше восстановленный цитохром c попадёт на четвёртый комплекс, но об этом пока рано. К третьему комплексу присоединится следующий окисленный цитохром c.
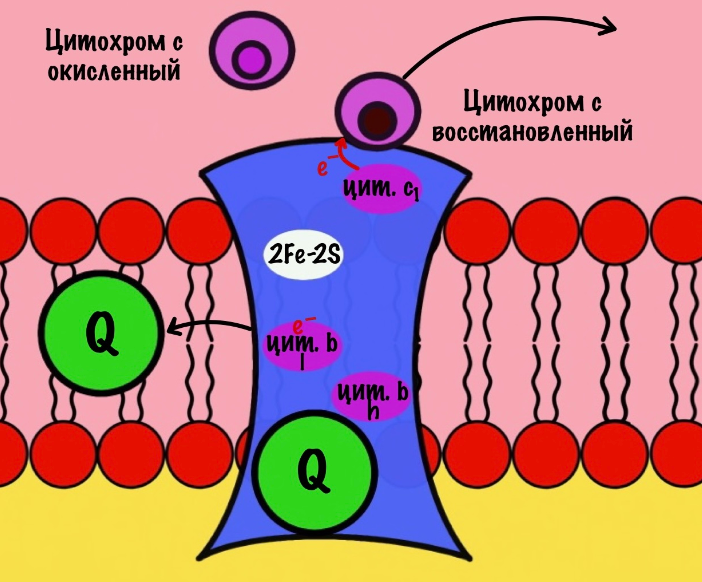
Второй электрон на цитохроме b. У цитохрома b есть два порфирина с железом: l и h. Электрон переходит с порфирина l на h, а дальше падает на убихинон. Но не тот же самый, а другой — окисленный. Он сидел в третьем комплексе и ждал своего часа. Также убихинон присоединяет протон водорода из матрикса — образуется полувосстановленный убихинон (семихинон). С этой молекулой пока ничего не сделаешь.
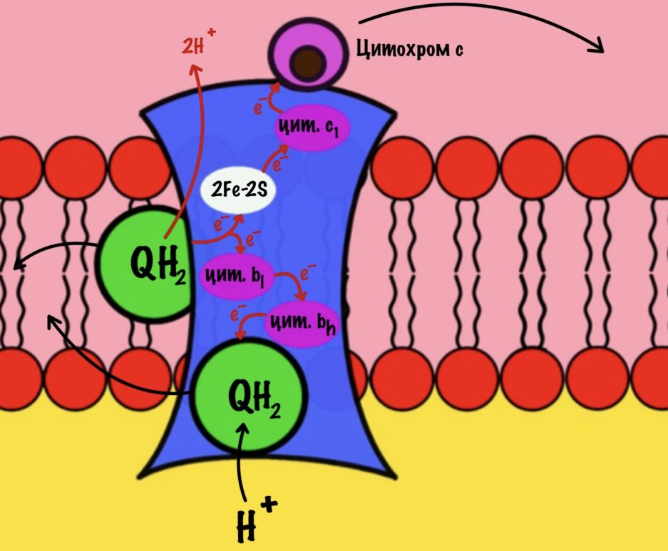
К третьему комплексу присоединяется ещё один восстановленный убихинон. Он снова отдаёт один электрон железо-серному белку, а другой цитохрому b. Два протона от убихинона вылетают в межмембранное пространство. От железо-серного белка электрон попадает на цитохром c1, а потом и на цитохром c. Ещё один электрон отправился на четвёртый комплекс. Второй электрон и протон из матрикса присоединяются к полувосстановленному убихинону, который ждёт своего часа. Он переходит в восстановленный убихинон. Восстановленный убихинон отсоединяется от третьего комплекса, чтобы присоединиться в другом месте к третьему комплексу – цикл завершён.
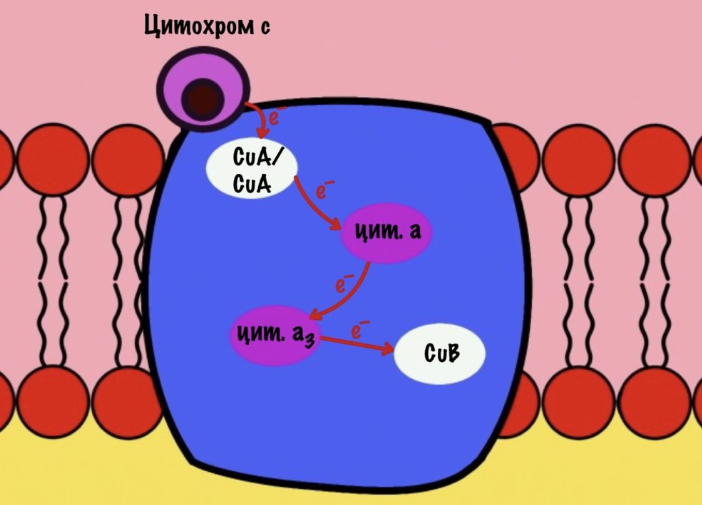
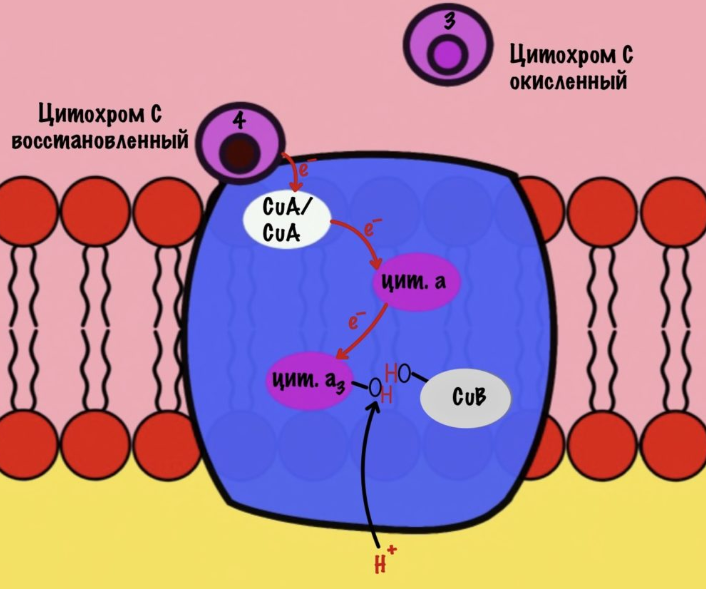
Четвёртый комплекс — цитохром c оксидаза
Цитохром с оксидаза имеет димерную структуру. Каждый мономер состоит из 13 субъединиц. Его задача — перенос электронов от цитохрома c на кислород. Кислород — это финальный акцептор электронов в дыхательной цепи.
Цитохром c присоединяется к четвёртому комплексу и передаёт свой электрон на CuA/CuA. Далее атомы меди отдают электрон на цитохром a, а тот на цитохром a3. Они могут принять только по одному электрону — там одно железо +3. Цитохром a3 скидывает электрон на CuB. Медь меняет степень окисления — переходит из +2 в +1.
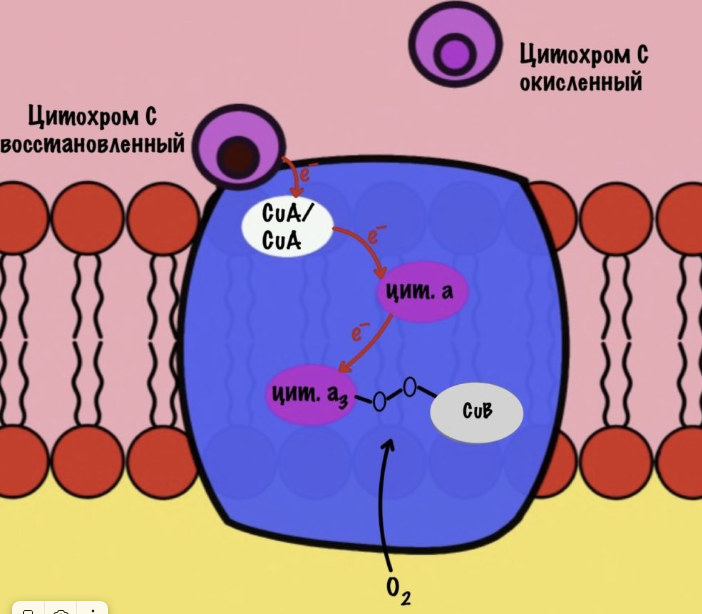
Дальше присоединяется второй цитохром c. Повторяется всё, что я написал выше. Но электрон не может попасть на CuB, потому что она уже +1, а больше электронов принять не может. Поэтому электрон останавливается на цитохроме a3. Теперь цитохром a3 и ион меди +1 могут связаться с кислородом — формируется пероксидный мостик. Кислород поглощает два электрона: один с цитохрома a3, а другой с CuB.
Присоединяется третий цитохром c. Этот электрон используется для того, чтобы разрушить пероксидный мостик между железом и медью. Но нужен не только электрон, но и протон — он берется из матрикса митохондрии. Это приводит к разрушению пероксидного мостика. Остаётся цитохром а3, который связан с кислородом, и медь с гидроксильной группой.

Присоединяется четвёртый электрон от цитохрома с, а один протон берется из матрикса. Это приводит к образованию гидроксильной группы на цитохроме а3.
Из матрикса берутся ещё два протона — это приводит к образованию двух молекул воды. При этом цитохром а3 и медь возвращаются в свою начальную форму.
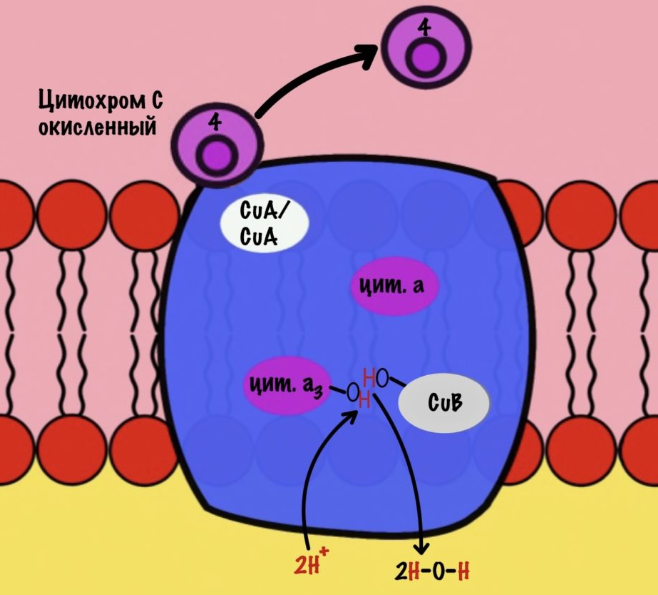
В ИТОГЕ ВСЕЙ ДЫХАТЕЛЬНОЙ ЦЕПИ:
Энергия электронов 1 НАДH идёт на транспорт 10 протонов. Энергия электронов 1 ФАДH2 идёт на транспорт 6 протонов.
АТФ-синтаза
АТФ-синтаза — это фермент, который состоит из двух больших частей (или доменов): Fо и F1. Fо — это протонная помпа, которая встроена в мембрану. Если перевести название на русский — олигомицин-чувствительная фракция (часть). F1 — это каталитический домен, который синтезирует АТФ.
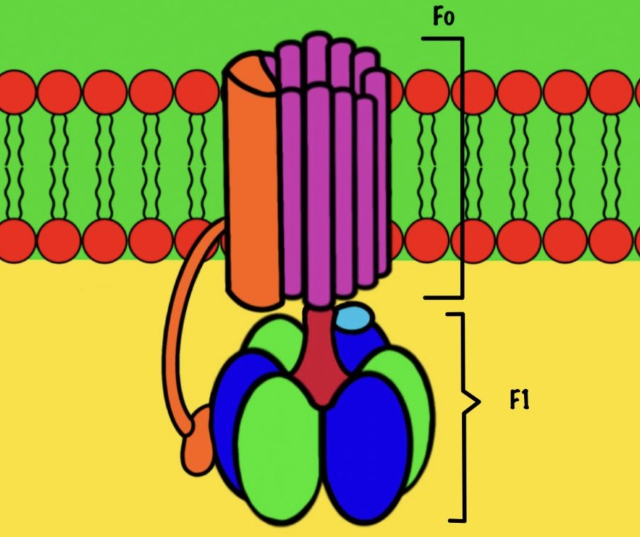
Регион F1
Начнём с него, а потом перейдём к вращению нашего кольца. Нас интересует гексамер, который участвует в синтезе АТФ. Гексамер состоит из трёх альфа и трёх бета цепей.

При этом альфа цепи всегда связаны с АТФ и не участвуют в его синтезе, поэтому они нас не интересуют. А вот бета цепи ответственны за:
Связывание АДФ и неорганического фосфата;
Синтез АТФ;
Высвобождение АТФ.
Каждая из бета-цепей легко синтезирует АТФ. Они настолько сближают АДФ с фосфатом, а также создают гидрофобное окружение вокруг них, что реакция синтеза АТФ идёт без каких-либо проблем и затрат энергии. А вот высвободить образованную АТФ эти субъединицы не могут, они имеют слишком большое сродство к ней.
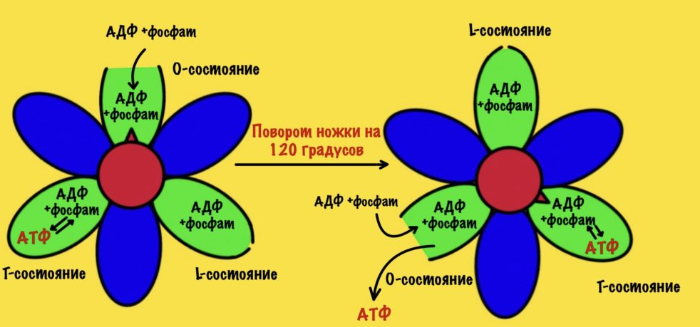
Вернёмся к бета-цепям. Они могут быть в трёх состояниях: open, loose и tense (открытое, свободное и напряжённое). Или O, L и T состояния. В O-состоянии бета-субъединица присоединяет АДФ и неорганический фосфат. В L-состоянии бета закрывает фосфат и АДФ в ловушку — они не могут выбраться из субъединицы. В T-состоянии синтезируется АТФ, которая не может отсоединиться от фермента из-за его высокого сродства. В АТФ-синтазе каждая из бета-субъединиц находится в одном из этих состояний. Одна в O, другая в L, а третья в T. Вращение гамма ножки вызывает переход бета-субъединицы из одного состояния в другое. Получается, что любые две бета-субъединицы не могут существовать в одном состоянии одновременно.
Ножка вращается на 120 градусов по часовой стрелке (если смотреть снизу). Это вызывает конформационные изменения в субъединицах, что приводит к переходу из одного состояния в другое. При этом одна бета-субъединица переходит из O-состояния в L. Вторая из L-состояния в T. А третья из T-состояния в O. В О состоянии бета-субъединица отсоединяет АТФ, а потом связывается со следующим АДФ и неорганическим фосфатом.
Давайте сделаем полный круг вращения. 360 градусов — это три поворота для нашей ножки. Каждая субъединица изменит свое состояние три раза. Получается, что в ходе такого вращения будет синтезировано три молекулы АТФ.
Регион Fo
Короче он отвечает за вращение F1 региона при синтезе АТФ за счёт энергии градиента концентрации протонов Н+, А НА ОСТАЛЬНОЕ ГЛУБОКО ПОХУЙ, ОДИН ХУЙ СЛИШКОМ ДРОЧЕВНО.
