
- •7. Биосинтез пиримидиновых мононуклеотидов.
- •8. Биосинтез нуклеозидтрифосфатов.
- •9. Биосинтез дезоксирибонуклеотидов.
- •10. Синтез нуклеиновых кислот.
- •11. Структура и биологическая роль нуклеотидов и нуклеиновых кислот.
- •12. Биосинтез днк (репликация); условия, этапы, репарация.
- •13. Биосинтез рнк (транскрипция); условия, этапы, обратная транскрипция.
- •3 Этапа процесса:
- •14. Созревание и синтез транскрипта.
- •15. Процессинг тРнк и р рнк.
- •16. Биосинтез белка (трансляция); этапы, регуляция , и генетический код.
- •17. Нарушение процесса трансляции.
- •18. Факторы, определяющие состояние белкового обмена. Синтез аммонийных солей.
- •19. Общие пути обмена аминокислот. Биосинтез аминокислот.
- •20. Реакции трансаминирования, Дезаминирование. Синтез мочевины.
- •21. Метаболизм глюкозы.
- •22. Расчет выхода атф при анаэробном окислении глюкозы.
- •23. Расчет выхода атф при аэробном окислении.
- •24. Биологическое значение и классификация липидов.
- •26. Биосинтез жирных кислот, химизм, ферменты.
- •27. Биосинтез жирных кислот с длинной цепью углеродных атомов и непредельных.
- •28. Биосинтез триглицеридов, фосфолипидов и холестерина.
- •29. Синтез и распад кетоновых тел.
- •30. Этапы энергетического обмена.
- •31. Цикл Кребса.
- •32. Энергетический баланс одного оборота цтк.
- •33. Тканевое дыхание и окислительное фосфорилирование.
- •3 4. Компоненты системы синтеза атф в митохондриях
- •35. Хемиосмотическая теория окислительного фосфорилирования.
- •36. Механизм окислительного фосфорилирования. Короткий вариант 36 вопроса
- •Подробный вариант 36 вопроса
- •37. Регуляция энергетического обмена.
- •38. Другие пути использования кислорода.
- •39. Пути использования кислорода в реакциях биологического окисления.
- •40. Сравнительная характеристика путей синтеза пуриновых и пиримидиновых нуклеотидов.
28. Биосинтез триглицеридов, фосфолипидов и холестерина.
Биосинтез высших жирных кислот— это не обратный процесс β-окисления.
Он имеет ряд особенностей.
Первая особенность заключается в том, что жирные кислоты собираются не из ацетил-КоА, а из трехуглеродистых фагментов — малоновой кислоты, связанной с КоА. В ходе сборки жирной кислоты малонил-КоА теряет карбоксильную группу и цепь жирной кислоты за один цикл нарастает на 2 атома углерода.
Вторая важная особенность биосинтеза ВЖК заключается в том, что цепь жирной кислоты удлиняется с помощью специального ацилпереносящего белка (АПБ).
Третья особенность биосинтеза ВЖК — коферментом редуктаз являются не ФАД или НАД, а НАДФН2.
Четвертая особенность этого процесса — биосинтез высших жирных кислот происходит в цитозоле, а не в митохондриях.
Биосинтез жирных кислот начинается с образования малонил-КоА из ацетил-КоА при участии фермента ацетил-КоА-карбоксилазы. Далее молекулы ацетил-КоА и малонил-КоА присоединяются к мультиэнзимному комплексу, содержащему АПБ и проходят ряд последовательных реакций конденсации, восстановления и дегидратации через стадии образования ацетоацетил-АПБ, β-гидроксибутирил-АПБ, кротонил-АПБ, бутирил-АПБ. Количество циклов биосинтеза жирной кислоты зависит от числа углеродных атомов.
Образовавшиеся жирные кислоты при участии глицерина превращаются в триглицериды, которые могут откладываться в жировых депо или использоваться с другой целью. Путь биосинтеза триглицеридовв тканях протекает, в основном, через образование глицерол-3-фосфата. Далее глицерол-3-фосфат присоединяет 2 молекулы ацил-КоА (активированной жирной кислоты), с образованием фосфатидной кислоты. Далее происходит дефосфорилирование фосфатидной кислоты и образование диглицерида, который затем эстерифицируется третьей молекулой ацил-КоА. Другой вариант биосинтеза триглицеридов возможен из метаболита гликолиза - диоксиацетон-3-фосфата. При участии фермента глицерол-3-фосфатдегидрогеназы он превращается в глицерол-3-фосфат, а далее следуют реакции биосинтеза триглицеридов, описанные выше. Эндогенные триглицериды транспортируются в составе ЛПОНП.
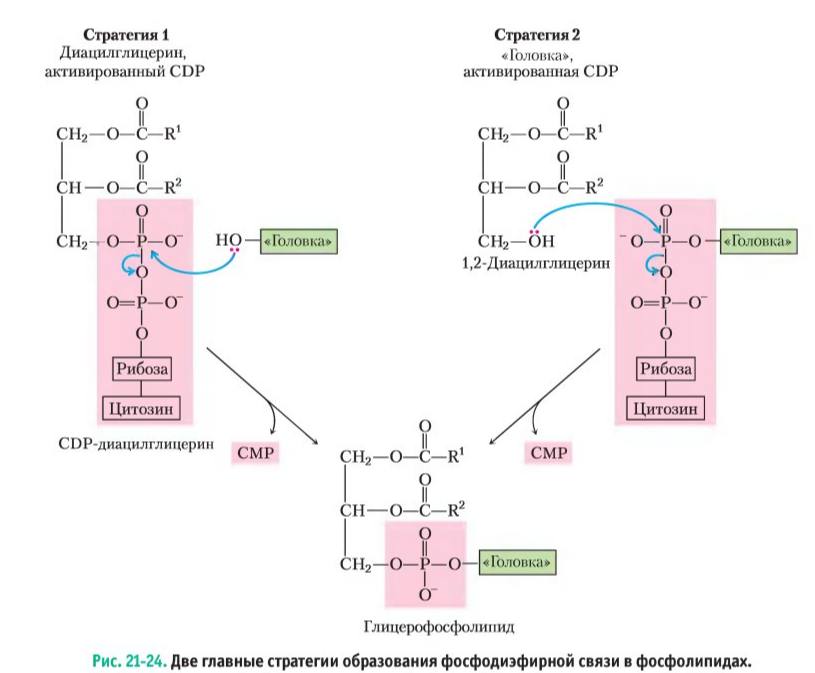
Фосфолипиды синтезируются из фосфатидной кислоты или диглицерида при участии цнтидинтрифосфата (ЦТФ) и таких азотсодержащих молекул как серии, этаноламин, холин и др. Нарушения синтеза фосфолипидов могут привести к жировой инфильтрации печени, поскольку фосфатидная кислота и диглицерид являются общими промежуточными продуктами для синтеза фосфолипидов и триглицеридов. Одной из причин нарушения синтеза фосфолипидов может быть недостаток в организме азотсодержащих молекул, особенно холина и метионина. Липотропные факторы – вещества, участвующие в биосинтезе фосфолипидов и предотвращающие жировую инфильтрацию печени. К ним относятся холин, этаноламин, серин, инозитол, метионин, пангамовая кислота (витамин В15), S-метилметионин (витамин U), витамины В6, В9, В12. Жировая инфильтрация печени – дистрофические изменения печеночной паренхимы, обусловленные избыточным накоплением в гепатоцитах триглицеридов вследствие нарушения синтеза глицерофосфолипидов и липопротеинов. Процесс развивается при сахарном диабете, токсических воздействиях на печень, нарушении питания.
Метаболизм холестерина.
Холестерин поступает в организм с пищей и синтезируется в организме. При участии фермента липопротеинлипазы в плазме крови происходит гидролиз триглицеридов из ЛПОНП и образование ЛПНП. ЛПНП переносят холестерин к тканям из печени. Обратный транспорт холестерина из тканей к месту его дальнейшей трансформации (печень) и удаления из организма осуществляется ЛПВП при участии фермента ЛХАТ (лецитин-холестерол-ацил-трансферазы). Основной путь удаления холестерина - его окисление в желчные кислоты. Часть холестерина удаляется с кожным салом, каловыми массами.
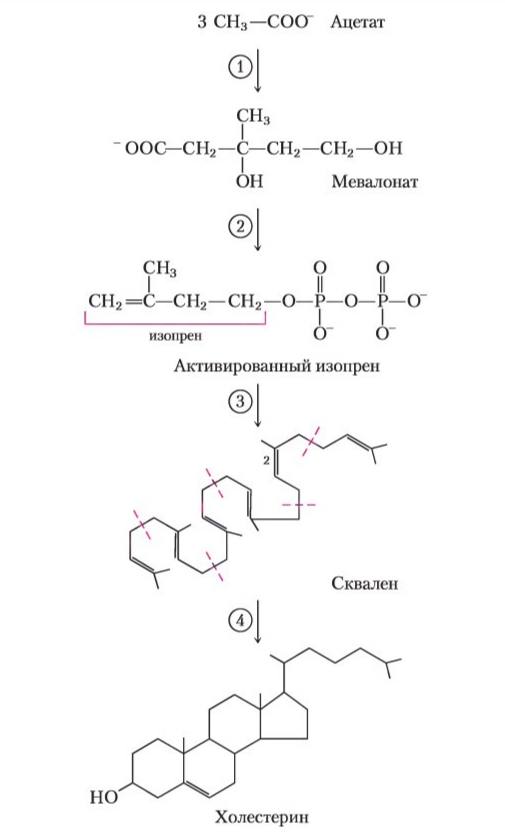
Холестерин синтезируется из ацетил-КоА. Процесс биосинтеза холестерина включает стадию образования мевалоновой кислоты, которая превращается через ряд промежуточных продуктов в сквален. Сквален подвергается циклизации и через ряд соединений превращается в холестерин. В организме холестерин используется для построения клеточных мембран, синтеза стероидных гормонов, витаминов группы Д, желчных кислот. Регуляция биосинтеза холестерина зависит от активности фермента, катализирующего реакцию синтеза мевалоновой кислоты. Основная доля холестерина удаляется из организма в виде желчных кислот, некоторое количество выделяется в кишечник в неизменном виде, или как вторичные желчные кислоты, под действием ферментов бактерий там восстанавливается в копростанол и холестанол, выводимых с фекалиями. Небольшая часть холестерина превращается в стероидные гормоны и в виде их конечных метаболитов выделяется с мочой.
