
- •Силикаты – это соли кремниевых кислот. Они твердые тугоплавкие вещества, не имеющие окраски.
- •Общие химические свойства металлов
- •2. Реакции металлов с кислотами:
- •3. Взаимодействие металлов с водой:
- •4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- •Область применения
- •В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е. атому углерода, связанному с наибольшим числом атомов водорода).
- •Реакции окисления алкенов
- •4. Окисление в присутствии солей палладия:
- •Классификация, номенклатура, изомерия
- •1. Кумулированные:
- •Номенклатура
- •2. Международная
- •В присутствии солей меди (I) и кислоты ацетилен легко димеризуется и далее тримеризуется:
- •Образование дисульфидов и их роль в биохимических процессах
- •Жиры
- •СЛОЖНЫЕ ЛИПИДЫ
- •1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
- •2. Взаимодействие с основаниями и кислотами
- •5. Качественные реакции!
- •5.1.1 Основный понятия и постулаты термодинамики
- •Исходные постулаты (положения) термодинамики. Пусть дан изолированный сосуд (рисунок 5.1.2), который разделен полупроницаемой перегородкой. В первой части сосуда температура Т1, во второй – температура Т2; Т1 > Т2.
- •5.1.2 Первый закон термодинамики, его формулировки
- •5.1.3 Термохимия
- •5.2.1 Второй закон термодинамики
- •5.2.2 Фундаментальные уравнения термодинамики
- •5.4.1 Предмет химической кинетики.
- •5.4.2 Основные понятия химической кинетики.
- •5.4.3 Кинетический закон действия масс – основной постулат химической кинетики.
- •5.4.4 Кинетические особенности протекания простых реакций.
- •5.4.5 Методы определения порядка реакции и константы скорости по экспериментальным данным.
- •5.4.6 Кинетические особенности протекания сложных реакций.
- •5.4.7 Зависимость скорости реакции от температуры.
- •5.4.8 Кинетика цепных реакций.
- •5.4.9 Кинетика фотохимических реакций.
- •5.4.10 Основы кинетики гетерогенных процессов.
- •5.4.11 Катализ.
- •5.4.1 Предмет химической кинетики
- •Химическая кинетика решает следующие задачи, перечисленные в порядке сложности их решения:
- •5.4.2 Основные понятия химической кинетики
- •АНАЛИЗ СМЕСИ АНИОНОВ
- •МЕТОДЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА
- •Титриметрические методы анализа
- •Кислотно-основное титрование
- •Окислительно-восстановительное титрование
- •Перманганатометрия. Стандартизация рабочего раствора перманганата калия
- •Комплексонометрическое титрование
- •Определение общей жесткости воды
- •1. Предмет аналитической химии.
- •2. Краткая история развития аналитической химии.
- •3. Методы аналитической химии.
- •4. Основные стадии химического анализа.
- •5. Статистическая обработка результатов измерений.
- •6. Отбор проб.
- •7. Потери и загрязнения при отборе пробы. Хранение пробы.
- •8. Подготовка пробы к анализу.
- •9. Аналитическая реакция и её характеристики.
- •10. Дробный и систематический анализ.
- •37. Сущность гравиметрического анализа.
- •38. Типы гравиметрических определений.
- •39. Теория осаждения.
- •40. Операции гравиметрического анализа.
- •41. Расчеты в гравиметрическом анализе.

548
гидролитическое и окислительное.
Гидролитические изменения в жире происходят под действием ферментов или микроорганизмов, приводя к образованию свободных жирных кислот. Если эти кислоты обладают короткой цепью (например, если образуется масляная кислота), то жиры приобретают прогорклый запах и вкус. Этот тип прогоркания характерен для коровьего масла.
Наиболее распространен окислительный тип прогоркания. Окисление молекулы жира приводит к образованию ряда альдегидов и кетонов с короткой цепью, которые также имеют неприятный запах и вкус. Для этого процесса необходимо присутствие кислорода.
4. Полимеризация масел. По этому признаку растительные масла делятся на три категории: высыхающие, полувысыхающие и невысыхающие.
Высыхающие масла (тунговое, льняное, периллевое) в тонком слое обладают способностью образовывать на воздухе эластичные, блестящие, гибкие и прочные пленки, нерастворимые в органических растворителях, устойчивые к внешним воздействиям. Используют для приготовления лаков и красок. Основной характерной чертой высыхающих масел является высокое содержание непредельных кислот. Иодное число не менее 140. Высыхающие масла, содержащие глицериды ненасыщенных кислот с двумя или тремя двойными связями, служат для приготовления олифы.
Полувысыхающие масла (подсолнечное, хлопковое) отличаются от высыхающих меньшим содержанием непредельных кислот (иодное число
127-136).
Невысыхающие масла (оливковое, миндальное) имеют иодное число ниже 90.
Гидрогенизация жиров (гидрирование). Этот процесс протекает в присутствии катализатора — мелкораздробленного никеля:
При этом жидкие растительные масла переходят в твердые. Полученные этим методом твердые жиры не только для технических целей, но и для производства пищевого жира – маргарина.
СЛОЖНЫЕ ЛИПИДЫ
К сложным липидам относят фосфолипиды и гликолипиды ФОСФОЛИПИДЫ. Фосфолипидами называют фосфорилированные
липиды.
В результате гидролиза фосфолипидов образуются высшие жирные

549
кислоты, спирт — глицерин или сфингозин, фосфорная кислота Н3РО4, часто
— азотистые основания (аминоспирты — коламин, холин, аминокислота — серин) и др.
Фосфолипиды в зависимости от природы спирта, входящего в состав молекулы, подразделяют на две группы: глицерофосфолипиды и
сфингомиелины.
Глицерофосфолипиды являются производными фосфатидной кислоты:
Вряду глицерофосфолипидов выделяют:
фосфатидилхолин (лецитин);
фосфатидилэтаноламин (кефалин);
фосфатидилсерин;
кардиолипин;
плазмалоген (этаноламиновый плазмологен). Глицерофосфолипиды являются основным компонентом клеточных
мембран (≈ 40 %).
Они, подобно мылам, имеют длинную неполярную углеводородную цепь («хвост») и полярную ионную фосфатидную группу («голова»). Неполярные группы ориентированы к центру бислоя, а полярные — по внешним сторонам.
Бислой является эффективным барьером для пропускания воды, ионов и других компонентов внутрь и из клеток.
Сфингомиелины — другая группа фосфолипидов. В результате гидролиза сфингомиелинов образуются двухатомный ненасыщенный аминоспирт — сфингозин, высшая жирная кислота, фосфорная кислота и холин.
N-ацилированный высшими жирными кислотами сфингозин называют
церамид.
Общая формула сфингомиелинов:

550
Сфингомиелины содержатся в мембранах животных и растительных клеток, нервной ткани, в ткани печени, почек и других органов. [
ГЛИКОЛИПИДЫ. Гликолипидами называют сложные липиды,
молекулы которых состоят из липидного и углеводного фрагментов. Гликолипиды входят в состав клеточных мембран, некоторые из них
принимают участие в формировании иммунитета, в процессах межклеточной адгезии и т. д. Гликолипиды широко представлены в нервной ткани, в частности, в ткани мозга. Они локализованы преимущественно на наружной поверхности плазматической мембраны, где их углеводные компоненты входят в число других углеводов клеточной поверхности. В
Взависимости от природы углеводного остатка гликолипиды делят на цереброзиды и ганглиозиды. В состав цереброзидов входит углевод гексоза, ганглиозиды содержат сложный олигосахарид.
Цереброзиды. Особенно высоко содержание цереброзидов в мембранах нервных клеток (миелиновой оболочке).
Продуктами гидролиза цереброзидов являются аминоспирт сфингозин, высшая жирная кислота (чаще – лигноцериновая, нервоновая, цереброновая) и гексоза (обычно D-галактоза).
Общая формула цереброзидов:
Ганглиозиды, в отличие от цереброзидов, содержатся преимущественно в сером веществе мозга и сосредоточены в плазматических мембранах нервных и глиальных клеток.
Продуктами гидролиза ганглиозидов являются аминоспирт сфингозин, ВЖК, D-глюкоза и D-галактоза, а также производные аминосахаров (N- ацетилглюкозамин и N-ацетилнейраминовая кислота).
.

551
Одним из простейших ганглиозидов является гематозид, выделенный из стромы эритроцитов.
НЕНАСЫЩЕННЫЕ КАРБОНОВЫЕ КИСЛОТЫ: АКРИЛОВАЯ, МЕТАКРИЛОВАЯ, ПОЛИМЕРЫ НА ИХ ОСНОВЕ
Ненасыщенные (непредельные) карбоновые кислоты являются производными непредельных углеводородов.
Строение их отличается тем, что в соединенном с карбоксильной группой углеводородном радикале имеются кратные связи. Наибольшее значение имеют непредельные кислоты с двойными связями. Среди них особое место, благодаря некоторым специфическим особенностям химического поведения, занимают α,β-ненасыщенные кислоты.
Номенклатура и изомерия
Для наименования непредельных кислот чаще всего применяют тривиальные названия.
Простейшей α,β-ненасыщенной монокарбоновой кислотой, содержащей двойную связь, является акриловая кислота (пропен-2-овая кислота):
СH2=CH—CОOH
В скобках даны названия кислот по международной заместительной номенклатуре.
Следующие за ней кислоты содержат четыре углеродных атома и существуют уже виде трех изомеров:
CH3—CH=CH—CОOH, кротоновая кислота (бутен-2-овая)
CH2=C (СН3)—CОOH, метакриловая кислота (2-метилпропен-2-овая)
CH2=CH—CH2—CОOH, винилуксусная кислота (бутен-3-овая)
Изомерия непредельных кислот обусловлена изомерией углеродного скелета (кротоновая и метакриловая кислоты) и изомерией положения

552
двойной связи по отношению к карбоксилу (кротоновая и винилуксусная кислоты).
Непредельным кислотам с двойной связью, так же как и этиленовым углеводородам, свойственна еще и геометрическая, или цис-транс изомерия. Цис- и транс-изомеры могут иметь совершенно разные тривиальные названия (таблица 3.6.6.2):
Таблица 3.6.6.2 – Номенклатура ненасыщенных карбоновых кислот
Тривиальное название |
Формула |
Название по ИЮПАК |
|
|
|
Кротоновая |
транс- СН3СН = СНСООН |
Транс-бутен-2-овая |
|
|
|
Изокротоновая |
цисСН3СН = СНСООН |
Цис-бутен-2-овая |
|
|
|
Олеиновая |
цис- СН3(СН2)7СН = СН(СН2)7СООН |
|
|
|
|
Элаидиновая |
транс- СН3(СН2)7СН = СН(СН2)7СООН |
|
Более 30% карбоновых кислот в липидном составе биологических мембран включают непредельные кислоты С20–С22. В живых организмах
высшие ненасыщенные карбоновые кислоты существуют исключительно в виде цис-изомеров. Так, жидкая олеиновая кислота представляет собой цис- изомер и широко распространена вопреки энергетически более устойчивому транс-изомеру – элаидиновой кислоте.
Способы получения непредельных карбоновых кислот основаны на уже известных методах введения в молекулу карбоксильной группы или образования двойной связи в карбоновой кислоте. Так, можно получать соединения этого типа дегидрогалогенированием α-галогенокислот или дегидратацией оксикислот, а также оксинитрилов с последующим гидролизом нитрила до карбоновой кислоты и т. п.
Особенности химических свойств
Ненасыщенные кислоты содержат кратную связь и карбоксильную группу, поэтому в ряду этих соединений сохраняются все свойства, как карбоновых кислот, так и непредельных соединений, а также проявляется специфика, вызванная присутствием обеих функций в одной молекуле и их взаимным влиянием.
1. Кислотные свойства. У ненасыщенных карбоновых кислот кислотные свойства несколько повышены по сравнению с насыщенными. Особенно это касается α, β-ненасыщенных кислот. Причина повышения кислотных свойств ненасыщенных кислот состоит в присутствии слабого отрицательного индукционного эффекта ненасыщенного радикала. Этот эффект связан с повышенной электроотрицательностью атомов углерода кратных связей, которые находятся в состоянии sp2- или sp-гибридизации. В связи с этим возникает момент отрицательного индуктивного влияния, приводящий к увеличению частичного положительного заряда на карбоксильном атоме углерода. Это, в свою очередь, усиливает мезомерный эффект р,π-сопряжения в карбоксильной группе, увеличивает полярность связи О—Н и облегчает отщепление протона

553
То, что повышение кислотных свойств ненасыщенных кислот — результат индуктивного влияния, показывает быстрое уменьшение констант ионизации по мере удаления винильного радикала от карбоксильной группы (индукционный эффект быстро затухает по цепи простых связей). Уже на расстоянии в два метиленовых звена кислотные свойства оказываются близки к таковым у уксусной кислоты (значение Ка для пентен-4-овой кислоты близко к уксусной – 2,11). Однако тот факт, что непредельная акриловая кислота оказывается заметно слабее муравьиной кислоты, показавает, что это влияние неабсолютное. Повышенная ЭО атома углерода в состоянии sp2-гибридизации в винильном радикале, лишь уменьшает общеизвестные электронодонорные свойства углеводородных радикалов:
2. Непредельные карбоновые кислоты, подобно насыщенным, способны образовывать различные производные (галогенангидриды,
ангидриды, амиды, сложные эфиры) в реакциях нуклеофильного замещения или другими непрямыми методами синтеза. Среди производных заслуживают внимания сложные эфиры α,β-ненасыщенных кислот, которые служат мономерами в реакциях полимеризации. В частности, метиловый эфир метакриловой кислоты (метилметакрилат) полимеризуется, образуя
плексигласс:
Этот полимерный продукт широко применяется в консервировании биопрепаратов, изготовлении покрытий, органических стекол, бытовых и промышленных изделий.
Реакции ненасыщенных кислот как непредельных соединении. Подобно соединениям этиленового ряда, ненасыщенные кислоты склонны к реакциям присоединения, окисления и полимеризации.

554
2. Реакции присоединения. В реакциях электрофильного присоединения (присоединение галогенов, галогеноводородов, воды), реакционная способность непредельных кислот, особенно αβненасыщенных, понижена из-за электроноакцепторного действия карбоксильной группы (отрицательный индукционный эффект вызванный дефицитом электронов на карбоксильном углероде). Оттягивая электронную плотность на себя, карбоксильная группа обедняет электронами двойную связь, препятствуя тем самым взаимодействию π-электронного облака с электрофильным реагентом. Действительно, реакция бромирования, например, идет медленнее с акриловой кислотой, чем с этиленом:
СH2=CH—COOH + Br2 → CH2(Br)—CH(Br)—COOH
α, β-дибромпропионовая к-та
При этом у α, β-ненасыщенных кислот карбоксильная группа влияет на направление присоединения. Общая тенденция в реакциях присоединения такова, что в случаях взаимодействия с несимметричным реагентом водород присоединяется к α-углероду, а другой остаток реагента – к β-углеродному атому. Другими словами, присоединение галогеноводородов, воды и некоторых других соединений идет против правила Марковникова.
Причина подобного направления реакции состоит в действии эффекта ππ-сопряжения в молекулах α, β-ненасыщенных кислот (I). При этом электронная плотность в общем электронном облаке смещена к карбонильному кислороду. В результате протон, первым атакующий молекулу непредельной кислоты, присоединяется к карбонильному кислороду. При этом образуется резонансно-стабилизированный катион (II), в котором положительный заряд оказывается на крайнем атоме углерода. Туда на последней стадии и направляется оставшийся нуклеофил (анион). Другими словами, αβ-ненасыщенная кислота представляет собой сопряженную диеновую систему, особенностью которой, как известно, является возможность присоединения по краям сопряженной системы, в 1,4- положении (III).

555
Образующийся при таком присоединении продукт (III) неустойчив и перегруппировывается с перемещением протона к α-углеродному атому, при этом вновь образуется карбонильная группа.
Реакции с бромом и иодом очень важны для качественного и количественного определения непредельных кислот. При взаимодействии с последними растворы этих галогенов теряют свою бурую окраску (обесцвечиваются), и это служит качественной реакцией на непредельные кислоты. Прибавляя растворы брома или иода до прекращения обесцвечивания, можно добиться полного насыщения всех кратных связей и по количеству израсходованного галогена определить количество кратных связей; на каждый моль кислоты с одной двойной связью расходуется 1 моль брома или иода.
Реакции окисления. Они протекают аналогично алкенам. При обработке непредельной кислоты мягким окислителем — перманганатом калия в щелочной среде (реакция Вагнера) или пероксидом водорода в муравьиной кислоте — осуществляется гидроксилирование: Например:
CH2=CH—COOH → CH2 (OH) —CH2 (OH) —COOH
акриловая кислота |
α,β-диоксипропионовая кислота |

556
Под действием жесткого окислителя двойная связь рвется с образованием из осколков молекулы кислот и/или кетонов:
Отдельные представители непредельных одноосновных кислот
Акриловая кислота CH2=CH—COOH. Представляет собой бесцветную жидкость с резким запахом; Ткип. 140 оС; Тпл. 13 оС. Большое значение имеют эфиры акриловой кислоты, применяемые в производстве пластических масс. Нитрил акриловой кислоты – акрилонитрил CH2=CH— C=N применяют в производстве одного из видов синтетического каучука. В присутствии кaтализаторов акрилонитрил полимеризуется с образованием высокомолекулярной смолы полиакрилонитрила:
Из полиакрилонитрила получают синтетическое волокно нитрон (или орлон) – один из видов искусственной шерсти. В текстильной промышленности его используют как непосредственно, так и в комбинации с др. волокнами – для выработки трикотажа, костюмных и различных технических тканей.
Метакриловая кислота (α-метилакриловая) CH2=C(CH3)–COOH.
Представляет собой бесцветную жидкость с менее резким запахом, чем у акриловой кислоты; (Ткип. = 161 оС, Тпл. = 15 оС). Ценным продуктом является метиловый эфир метакриловой кислоты, применяемый для получения пластических масс (органического стекла).
ДИКАРБОНОВЫЕ КИСЛОТЫ
Двухосновные карбоновые кислоты, содержащие в молекуле две карбоксильные группы называют дикарбоновыми кислотами.
Различают предельные и непредельные двухосновные кислоты; первые являются производными предельных углеводородов, вторые – непредельных и содержат в молекулах двойные или тройные связи между углеродными атомами.
Насыщенные дикарбоновые кислоты
Наибольший интерес представляют насыщенные (предельные) двухосновные кислоты с неразветвленной цепью углеродных атомов.
Названия двухосновных кислот, так же, как и одноосновных, производят от названий природных продуктов, в которых та или иная кислота была впервые обнаружена.
557
Гомологический ряд двухосновных предельных кислот возглавляет щавелевая кислота (таблица 3.6.6.3). Далее идет наращивание числа метиленовых звеньев, разделяющих две карбоксильные группы
Таблица 3.6.6.3 – Номенклатура дикарбоновых кислот предельного ряда
Тривиальное название |
Формула |
Название по ИЮПАК |
|
|
|
Щавелевая |
НООС – СООН |
Этандиовая |
|
|
|
Малоновая |
НООС– СН2 – СООН |
Пропандиовая |
|
|
|
Янтарная |
НООС– (СН2)2 – СООН |
Бутандиовая |
|
|
|
Глутаровая |
НООС– (СН2)3 – СООН |
Пентандиовая |
|
|
|
Адипиновая |
НООС– (СН2)4 – СООН |
Гександиовая |
|
|
|
По международной заместительной номенклатуре названия двухосновных кислот производят от названий углеводородов, имеющих такое же число углеродных атомов, как и цепь в молекуле кислоты, включая углеродные атомы обоих карбоксильных групп; к названию углеводорода добавляют окончание –диовая и слово кислота. Щавелевая кислота по заместительной номенклатуре – этандиовая кислота, малоновая – пропандиовая, янтарная – бутандиовая, глутаровая – пентандиовая и т. д. Эти названия мало употребительны и встречаются главным образом в справочной литературе.
Щавелевая кислота НООС–СООН – единственная двухосновная кислота, в которой две карбоксильные группы непосредственно соединены друг с другом (находятся рядом, т.е. в положении 1,2, или, иначе, α- положении). В углеродной цепи малоновой кислоты две карбоксильные группы уже разделены одним углеродным атомом (т.е. находятся в положении 1,3, или в β-положении друг к другу) и т.д. Взаимное расположение карбоксильных групп существенно сказывается на ряде свойств двухосновных кислот.
Свойства двухосновных кислот Физические свойства. Дикарбоновые кислоты – твердые
кристаллические вещества. Низшие кислоты заметно растворимы в воде и в незначительной степени растворяются в органических растворителях. Растворимость в воде у них выше, чем у монокарбоновых кислот с близкой молекулярной массой, благодаря большему числу полярных групп. Дикарбоновые кислоты образуют также больше межмолекулярных водородных связей, поэтому Тпл у них выше, чем у монокарбоновых. Они не обладают неприятным запахом, характерным для низкомолекулярных одноосновных кислот, так как большее число водородных связей приводит к более низкому давлению пара.
Химические свойства. По химическим свойствам двухосновные кислоты аналогичны одноосновным, но имеют ряд отличительных особенностей, обусловленных наличием в молекулах дух карбоксильных групп и их взаимным влиянием.

558
1. Кислотные свойства. У дикарбоновых кислот по сравнению предельными одноосновными кислотами повышены кислотные свойства. Причиной этой является не только дополнительная диссоциация по второй карбоксильной группе. На самом деле ионизация второго карбоксила протекает значительно труднее и вклад в кислотные свойства второй константы едва заметен. Электроноакцепторная группа, как известно, вызывает увеличение кислотных свойств карбоновых кислот, так как повышение δ+ на карбоксильном атоме углерода способствует усилению мезомерного эффекта рπ-сопряжения, что, в свою очередь усиливает поляризацию связи О—Н и облегчает ее диссоциацию. Этот эффект выражен тем больше, чем ближе друг к другу расположены карбоксильные группы.
Так щавелевая кислота весьма сильная кислота (Кдисс. = 5,9 10-2(по первой ступени)), тогда как одноосновная уксусная кислота (тоже с двумя углеродными атомами) во много раз более слабее (К= 1,76 10-5). Диссоциация двухосновных кислот по второй ступени идет намного труднее, чем по первой (у щавелевой кислоты К = 6,4 10-5). Сила двухосновных кислот зависит от взаимного расположения карбоксильных групп в углеродной цепи: чем они более удалены друг от друга, тем кислота слабее. Поэтому щавелевая кислота (с карбоксильными группами в α-положении) является наиболее сильной двухосновной кислотой. Поэтому токсичность щавелевой кислоты связана, прежде всего, с ее высокой кислотностью, величина которой приближается к таковой у минеральных кислот. Учитывая индуктивный характер влияния, понятно, что в гомологическом ряду дикарбоновых кислот кислотные свойства резко убывают по мере удаления карбоксильных групп друг от друга:
Двухосновные кислоты могут образовывать соли в результате замещения на металл либо в одной, либо в обоих карбоксильных группах и поэтому дают два ряда солей: кислые и средние соли. Например: СOONa–
COONa, щавелевокислый натрий (средняя соль); COOH–СOONa, кислый щавелевокислый натрий (кислая соль).
Функциональные производные двухосновных кислот. Так же, как и в одноосновных кислотах, гидроксил в карбоксильных группах двухосновных кислот может быть замещен различными атомами или группами. Такое замещение может произойти либо только в одной, либо в обеих карбоксильных группах, и поэтому существуют два ряда производных

559
двухосновных кислот: неполные и полные галогенангидриды, сложные эфиры, амиды и.т.д.
2. Отношение к нагреванию. Специфической особенностью дикарбоновых кислот является отношение к нагреванию. Продукты, получаемые в каждом случае, зависят от взаимного расположения двух карбоксильных групп.
Щавелевая и малоновая кислоты подвергаются декарбоксилированию при нагревании до температуры, близкой к плавлению: тесное соседство двух одноименно заряженных карбоксильных групп делает молекулу неустойчивой:
Янтарная и глутаровая кислоты, как имеющие более устойчивые молекулы, уже не отщепляют СО2, но подвергаются внутримолекулярной дегидратации с образованием, соответственно, пяти- и
шестичленных циклических внутримолекулярных ангидридов:
янтарный ангидрид
Обычные ангидриды, образованные из двух молекул кислоты (как в ряду монокарбоновых кислот), в этом случае не образуются. Циклические ангидриды проявляют те же самые свойства, что и любые ангидриды монокарбоновых кислот.
• Адипиновая кислота не образует достаточно устойчивого ангидрида, так как семичленный цикл, который должен был при этом образоваться, неустойчив. Зато при нагревании в присутствии оснований, например гидроксида бария, адипиновая кислота превращается в циклический кетон — циклопентанон.

560
3. Поликонденсация. Дикарбоновые кислоты способны вступать в реакции поликонденсации с диаминами или многоатомными спиртами с образованием полиамидов или полиэфиров и выделением простых молекул: воды, спиртов и т.п. Известный пример подобной реакции – получение полиамидного волокна (найлона 66) из адипиновой кислоты и гексаметилендиамина:
4. Отношение к окислителям. Среди двухосновных кислот очень легко окисляется щавелевая кислота, количественно превращаясь при этом в диоксид углерода и воду:
Реакция настолько чувствительна, что ее используют в объемном анализе для установления титров растворов перманганата калия; щавелевая кислота встречается в природе в виде кислой калиевой соли и содержится в кислице, щавеле, ревене.
СИНТЕЗЫ С МАЛОНОВЫМ ЭФИРОМ
Малоновая кислота обнаруживает еще одну, помимо способности к декарбоксилированию, специфическую особенность, обусловленную электроноакцепторным влиянием карбоксильных групп. В малоновой кислоте высокой подвижностью обладают α-водородные атомы метиленовой группы. Поляризация С—Н-связей возрастает под действием отрицательного индукционного эффекта соседних карбоксильных групп и изомерного эффекта δπ-сопряжения:

561
Водородные атомы настолько подвижны, что могут замещаться на металл, например, при действии металлического натрия. Однако совобободной кислотой это превращение невозможно, так как водородные атомы карбоксильных групп значительно подвижнее и замещаются в первую очередь.
Заместить α-водородные атомы метиленовой группы на натрий можно, лишь защитив карбоксильные группы от взаимодействия, что позволяет сделать полная этерификация малоновой кислоты. Чаще всего для этих целей используют диэтиловый эфир малоновой кислоты, который называют просто малоновым эфиром:
Малоновый эфир при взаимодействии с натрием, отщепляя водород, образует натрий-малоновый эфир:

562
Анион Na-малонового эфира стабилизирован сопряжением неподеленной электронной пары углерода с π-электронами связей С=О.
Na-Малоновый эфир как нуклеофил легко вступает во взаимодействие с разнообразными молекулами, содержащими электрофильный центр, например с галогеналканами, которые в ходе реакции нуклеофильного замещения вводят в малоновый эфир алкильный радикал (реакции алкилирования):
Алкилирование можно продолжить, заместив еще один водород на натрий и подвергнув полученный Na-этилмалоновый эфир повторному алкилированию. Эти реакции в сочетании с возможностью декарбоксилирования свободной малоновой кислоты открывают широкие перспективы для синтеза разнообразных соединений и в первую очередь карбоновых кислот. Так, после гидролиза полученного выше метилэтилмалонового эфира и его последующего декарбоксилирования получают замещенную монокарбоновую кислоту:

563
Синтезы с малоновым эфиром легко планируются. Зная, что в конечном продукте от малоновой кислоты остается фрагмент -СНз—СООН, подбирают алкилирующие агенты, содержащие радикалы необходимого строения и размера. С помощью малонового эфира можно синтезировать дикарбоновые кислоты. Для этого алкилирующий агент должен содержать карбоксильную группу, но не в свободном виде (иначе произойдет гидролиз Na-производного), а в форме эфира. Так, алкилируя Na-малоновый эфир этиловым эфиром бромуксусной кислоты, после гидролиза продукта и последующего декарбоксилирования получают двухосновную янтарную кислоту:
Ненасыщенные дикарбоновые кислоты
Важнейшими из соединений этого ряда являются малеиновая кислота и фумаровая кислота, которые относятся друг к другу как цис- и транс- изомеры.
Малеиновая кислота получается каталитическим парофазным окисление бензола и бутена –2:

564
Фумаровая кислота получается фотохимической изомеризацией малеиновой кислоты:
Фумаровая и малеиновая кислоты могут использоваться в качестве сырья для получения полиэфирных волокон:
Ароматические карбоновые кислоты Ароматические карбоновые (аренкарбоновые) кислоты содержат
карбоксильную группу в ароматическом кольце или боковой цепи. По количеству карбоксильных групп различают моно-, ди- и поликарбоновые кислоты.
Ароматические кислоты, содержащие в молекулах одну карбоксильную группу, называются одноосновными кислотами, содержащие две карбоксильные группы — двухосновными и т. д.
Карбоксильная группа в молекуле кислоты может находиться в бензольном ядре и в боковой цепи ароматического углеводорода.
•Если карбоксильная группа находится в бензольном ядре ароматической кислоты, название кислоты обычно производят от названия бензойной кислоты, указывая предварительно те группы, которые, кроме карбоксила, замещают атомы водорода в бензольном ядре. Так, кислота C6H4(NO2)СООН называется нитробензойной.
•Если карбоксильная группа находится в боковой цепи ароматического углеводорода, название ароматической кислоты обычно производят от

565
названия соответствующей жирной кислоты. Например, кислоту C6H5–СН2– СООН называют фенилуксусной кислотой. Многие ароматические кислоты имеют эмпирические наименования.
Примеры номенклатуры аренкарбоновых кислот и их замещенных приведены в таблице 3.6.6.4.
Таблица 3.6.6.4 – Номенклатура ароматических карбоновых кислот
|
Тривиальное название |
Систематическое название |
|
|
|
|
Бензойная |
Бензолкарбоновая |
|
|
|
|
о-Толуиловая |
2-Метилбензойная |
|
|
|
|
Фенилуксусная |
Фенилэтановая |
|
|
|
|
Коричная |
3-Фенилпропеновая |
|
|
|
|
Фталевая |
о-Бензолдикарбоновая |
|
|
|
|
Изофталевая |
м-Бензолдикарбоновая |
|
|
|
|
Терефталевая |
п-Бензолдикарбоновая |
|
|
|
|
Тримеллитовая |
1,2,4-Бензолтрикарбоновая |
|
|
|
|
Пиромеллитовая |
1,2,4,5- |
|
Бензолтетракарбоновая |
|
|
|
|
|
|
|
|
Салициловая |
2-Гидроксибензойная |
|
|
|
|
Антраниловая |
2-Аминобензойная |
|
|
|
Физические свойства

566
Ароматические кислоты – это твердые кристаллические вещества. Низшие гомологи несколько растворимы в воде и перегоняются с водяным паром. Ароматические кислоты хорошо растворимы в спирте и эфире.
Бензольное кольцо и карбоксильная группа образуют сопряженную систему. Карбоксильная группа действует как электроноакцептор (-I и –M- эффекты). В результате аренкарбоновые кислоты превышают по кислотности насыщенные и α,β-непредельные карбоновые кислоты. На силу аренкарбоновых кислот влияет природа и положение заместителя в ароматическом кольце. Это влияние согласуется с электронными эффектами заместителей.
Химические свойства 1. Кислотные свойства
Реакции аренкарбоновых кислот по карбоксильной группе аналогичны соответствующим превращениям алифатических карбоновых кислот.
2. Реакции замещения в ароматическом кольце
Аренкарбоновые кислоты вступают в реакции с электрофилами с образованием продуктов электрофильного замещения (нитрования, сульфирования, галогенирования) в бензольном кольце. Реакции протекают в жестких условиях, заместитель вступает преимущественно в мета-положение к карбоксильной группе.
Важнейшие представители Бензойная кислота – бесцветное кристаллическое вещество, легко
возгоняется. В промышленности ее получают окислением толуола кислородом в присутствии бензоатов Co и Mn. Обладает всеми свойствами монокарбоновых кислот. Используется как исходное вещество в синтезе красителей, душистых веществ, лекарственных препаратов. Обладает бактерицидными свойствами. Используется как консервант пищевых продуктов.
Бензоилхлорид – высококипящая бесцветная жидкость, лакриматор. Используется как бензоилирующий агент.
Ароматические дикарбоновые кислоты 1. Методы получения
Основной метод получения – окисление диметиларенов.
Фталевую кислоту в виде ангидрида в промышленности получают окислением о-ксилола или нафталина кислородом воздуха в присутствии катализаторов на основе V2O5-TiO2 при 350-4000С:

567
Терефталевую кислоту получают окислением п-ксилола кислородом в уксусной кислоте в присутствии солей Co и Mn:
Другой промышленный метод получения терефталевой кислоты – изомеризация дикалиевой соли о-фталевой кислоты:
Химические свойства арендикарбоновых кислот в основном аналогичны свойствам монокарбоновых кислот. Они дают все реакции, характерные для карбоксильной группы. Арендикарбоновые кислоты по первой ступени являются более сильными кислотами, чем монокарбоновые
Важнейшие представители
Фталевая кислота – бесцветное кристаллическое вещество, мало растворима в воде. При нагревании в присутствии дегидратирующих агентов легко превращается во фталевый ангидрид:
Практическое применение имеют производные фталевой кислоты – ангидрид, имид, сложные эфиры.
Фталевый ангидрид – бесцветное кристаллическое вещество, легко возгоняется. При взаимодействии со спиртами в присутствии серной кислоты дает сложные моно- и диэфиры:

568
Диалкиловые эфиры фталевой кислоты (диалкилфталаты) используют как пластификаторы полимеров, высококипящие растворители, репелленты.
Смногоатомными спиртами фталевый ангидрид образует полиэфиры. Например, на основе фталевого ангидрида и глицерина получают алкидные (глифталевые) смолы:
Саммиаком и первичными аминами фталевый ангидрид в зависимости от условий дает фталиминовую кислоту, фталимид или диамид фталевой кислоты:
Ацилирование фталевым ангидридом бензола и алкилбензолов приводит к о-ароилбензойным кислотам и далее к антрахинонам.
При конденсации фталевого ангидрида с фенолами образуются производные трифенилметана, которые называют фталеинамина. Их используют как индикаторы и красители (фенолфталеин, флуоресцеин).
Терефталевая кислота – бесцветное кристаллическое вещество, мало растворима в воде и органических растворителях. Крупнотоннажный промышленный продукт.
Её диметиловый эфир (диметилтерефталат) используется для получения полиэтилентерефталата, который применяют для изготовления синтетического волокна лавсан:

569
Как видно, вещества взаимодействуют между собой по типу многократно повторяющейся реакции этерификации, в результате образуются макромолекулы лавсана и низкомолекулярный продукт – вода. Напомним, что процессы, в результате которых из низкомолекулярных веществ образуется высокомолекулярное соединение и побочный низкомолекулярный продукт, называются поликонденсацией.
Лавсан обладает следующими достоинствами:
прочность;
устойчивость к сминанию;
упругость;
невосприимчивость к действию микробов;
способность сохранять тепло;
отсутствие усадки;
устойчивость к действию ультрафиолета;
инертность по отношению к химическим реагентам;
простота ухода.
Синтетическим материалам присущи недостатки. Лавсан не является исключением. Для него характерны следующие негативные свойства:
плохая проницаемость воздуха;
маленькое водопоглощение;
подверженность образованию статического электричества;
устойчивость к действию многих красителей;
жесткость.
Недостатки материала компенсируются его доступной стоимостью.
570
3.7 ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
ПЛАН
3.7.1Углеводы.
3.7.2Гидроксикарбоновые кислоты
3.7.3Аминокислоты.
3.7.1 Углеводы
Углеводы (глициды) – органические соединения, содержащие в молекуле одновременно альдегидную и кетонную группу и несколько спиртовых групп, имеющие в подавляющем большинстве состав Cn(H2O)m.
Впервые термин «углеводы» был предложен К.Г. Шмидтом в 1844 г. В то время предполагали, что все углеводы имеют общую формулу Cm(H2O)n, т.е. углевод + вода. Отсюда название «углеводы». Например, глюкоза и фруктоза имеют формулу С6(Н2О)6, тростниковый сахар (сахароза) C12(H2O)11, крахмал [С6(Н2О)5]n и т.д. В дальнейшем оказалось, что ряд соединений, по своим свойствам относящихся к классу углеводов, содержат водород и кислород в несколько иной пропорции, чем указано в общей формуле (например, дезоксирибоза С5Н10О4). В 1927 г. Международная комиссия по реформе химической номенклатуры предложила термин «углеводы» заменить термином «глициды», однако старое название «углеводы» укоренилось и является общепризнанным.
Химия углеводов занимает одно из ведущих мест в истории развития органической химии. Тростниковый сахар можно считать первым органическим соединением, выделенным в химически чистом виде. В 1861 г. A.M. Бутлеровым был осуществлен синтез (вне организма) углеводов из формальдегида, который явился первым синтезом представителей, входящих в состав живых организмов. Химическая структура простейших углеводов была выяснена в конце XIX в. в результате фундаментальных исследований Э. Фишера. Значительный вклад в изучение углеводов внесли ученые А.А. Колли, П.П. Шорыгин, Н.К. Кочетков и др. В 20-е годы XX в. работами английского исследователя У. Хеуорса были заложены основы структурной химии полисахаридов. Со второй половины XX в. происходит стремительное развитие химии и биохимии углеводов, обусловленное их важным биологическим значением.
Классификация углеводов
Углеводы можно рассматривать как альдегидные или кетонные производные полиатомных (содержащих более одной ОН-группы) спиртов или как соединения, при гидролизе которых образуются эти производные.
Согласно принятой в настоящее время классификации, углеводы по способности к гидролизу подразделяются на три основные группы:
моносахариды, олигосахариды и полисахариды.

571
Моносахариды не гидролизуются, а олиго- и полисахариды, способные к гидролизу, их можно рассматривать как продукты поликонденсации моносахаридов.
Моносахариды (простые углеводы или монозы) – это полигидроксикарбонильные соединения, в которых каждый атом углерода (кроме карбонильного) связан с группой ОН.
Общая формула моносахаридов – Сn(H2O)n, где n =3-9.
По числу углеродных атомов (n) в молекуле моносахариды (монозы) подразделяются на триозы (С3), тетрозы (С4), пентозы (С5), гексозы (С6) и т.д. Окончание –оза указывает на принадлежность вещества к классу углеводов.
По химическому строению различают:
-альдозы – моносахариды, содержащие альдегидную группу;
-кетозы – моносахариды, содержащие кетонную группу (как правило,
вположении 2).
Моносахариды можно рассматривать как производные многоатомных спиртов, содержащие карбонильную (альдегидную или кетонную) группу. Если карбонильная группа находится в конце цепи, то моносахарид представляет собой альдегид и называется альдозой; при любом другом положении этой группы моносахарид является кетоном и называется
кетозой.
Обычно моносахариды классифицируют с учетом сразу двух этих признаков, например:
В природе встречаются производные моносахаридов, содержащие аминогруппу (аминосахара), карбоксильную группу (сиаловые кислоты, аскорбиновая кислота), а также атом Н вместо одной или нескольких групп ОН (дезоксисахара).
Олигосахариды – углеводы, содержащие от 2 до 10 моносахаридных
остатков. |
Олигосахариды, состоящие из одинаковых моносахаридных |
|||||
остатков, |
называют |
гомоолигосахаридами, |
а |
из |
разных |
– |

572
гетероолигосахаридами.
При гидролизе олигосахаридов образуется соответствующее число тех же моносахаридов. К этой группе относятся, например дисахариды – сахароза, лактоза, целлобиоза и др.
Наиболее распространёнными из олигосахаридов являются дисахариды и трисахариды. По химической природе дисахариды — это О-гликозиды (ацетали), в которых вторая молекула моносахарида выполняет роль агликона.
Взависимости от строения дисахариды делятся на две группы:
восстанавливающие и невосстанавливающие.
Полисахариды – это сложные углеводы или полиозы, построенные из большого числа остатков моносахаридов (n).
Химический состав полисахаридов выражается общей формулой:
(C6H10O5)n.
Всвою очередь полисахариды делят на две группы:
а) сахароподобные углеводы или олигосахариды в состав молекул которых входит от 3 до 20 остатков моносахаридов;
б) несахароподобные или высокомолекулярные полисахариды,
образующиеся поликонденсацией моносахаридов.
Полисахариды имеют молекулярную массу от 104 до 109. Полный гидролиз полисахаридов приводит к образованию соответствующих моносахаридов.
Полисахариды, состоящие из остатков моносахарида одного вида, называются гомополисахаридами. Если полисахарид состоит из моносахаридов двух видов или более, его называют гетерополисахаридом. К высокомолекулярным полисахаридам (гомополисахаридам) относятся, прежде всего, крахмал, гликоген, клетчатка.
Моносахариды (рибоза, дезоксирибоза, глюкоза, фруктоза)
В моносахаридах неразветвленная цепь атомов углерода включает от 3 до 10 атомов. В природе распространены и имеют наибольшее значение пентозы (С5Н10О5) и гексозы (С6Н12О6).
Глюкоза |
Фруктоза |
Полигидроксиальдегид |
Полигидроксикетон |

573
Полигидроксиальдегид Полигидроксиальдегид
Изомерия моносахаридов. Для моносахаридов как гетерофункциональных соединений характерны разнообразные виды изомерии.
Структурная изомерия – изомерия характера функциональной группы. Функциональными изомерами являются альдозы и кетозы. Например, глюкоза и фруктоза являются функциональными изомерами.
Стереохимия моносахаридов, D- и L-ряды
Пространственная изомерия
Все моносахариды содержат асимметричные атомы углерода: альдотриозы – один центр асимметрии, альдотетрозы – 2, альдопентозы – 3, альдогексозы – 4 и т.д.
Кетозы содержат на один асимметричный атом меньше, чем альдозы с тем же числом углеродных атомов
Общее число стереоизомеров для любого моносахарида выражается формулой N = 2n, где N – число стереоизомеров, а n – число асимметричных атомов углерода.
Все изомеры моносахаридов подразделяются на D- и L-формы (D- и L-
конфигурация или ряды) по сходству расположения групп атомов у последнего центра асимметрии (рисунок 3.7.1). Природные гексозы:
глюкоза, фруктоза, манноза и галактоза – принадлежат, как правило, по стереохимической конфигурации к соединениям D-ряда.
Пентозы
D–рибоза |
L–рибоза |
D–дезоксирибоза |
L–дезоксирибоза |
|
|
Гексозы

574
D–глюкоза |
L– глюкоза |
D–фруктоза |
L–фруктоза |
|
Рисунок 3.7.1 – Формулы пентоз и гексоз
Поскольку молекулы моносахаридов построены несимметрично, то для них не существует оптически неактивных мезоформ. Так, известны D(+) и L(-) – глюкоза, являющиеся зеркальными изображениями одной по отношению к другой. Экспериментальный факт, фиксируемый поляриметром, вращения поляризованного света вправо обозначается знаком (+); вращение влево – знаком (-). Символы знаков D(+) – и L(-) могут очень часто не совпадать.
Отношение изомеров к D- или L-ряду по предложению русского химика А.М. Розанова в 1906 году основано на получении моносахаридов из соответствующего оптически активного глицеринового альдегида путем надстройки углеродной цепи. Молекула глицеринового альдегида имеет один асимметрический атом углерода (С*). Конфигурацию стереоизомера, у которого группа –ОН находится по правую сторону асимметрического атома углерода назвали D-глицериновый альдегид. Соответственно, зеркальное изображение D-глицеринового альдегида (антипода) назвали L- глицериновым альдегидом с группой – ОН, находящейся по левую сторону асимметрического атома углерода (С*).
Моносахариды, полученные из D-глицеринового альдегида путем надстройки углеродной цепи со стороны альдегидной группы, условились относить к D-ряду независимо от знака вращения поляризованного света. Соответственно, моносахариды, полученные из L-глицеринового альдегида, относят к L-ряду.
Кольчато-цепная таутомерия. Пиранозные и фуранозные формы, α- и β-аномеры. Мутаротация. Эпимеризация

575
Изображенные линейными формулами альдозы во многом не отражают физические и химические свойства моносахаридов. Такие структуры возможны в растворах и то в незначительных количествах (тысячные доли процента).
Как показал А.А. Колли, в глюкозе, как и в других альдогексозах, не четыре, а пять гидроксилов. Колли предложил для всех моносахаридов циклические структуры. Появление пятого гидроксила, названного гликозидным, является следствием внутримолекулярной реакции между карбонильной группой и одним из гидроксилов моносахарида.
Известно, что взаимодействие альдегидов со спиртами приводит к образованию полуацеталей:
Карбонильная и гидроксильная группы моносахаридов взаимодействуют внутримолекулярно с образованием циклического полуацеталя:
При этом возникает новый хиральный центр – бывший карбонильный, а теперь аномерный атом углерода. Наиболее устойчивы циклические полуацетали, содержащие шестичленный (пиранозный) или пятичленный (фуранозный) циклы. Они образуются при взаимодействии альдегидной группы с гидроксильной группой в положении 5 или 4 моносахарида соответственно.
Например, образование полуацетальной формы глюкозы происходит вследствие взаимодействия альдегидной группы с гидроксилом при пятом атоме углерода, в результате образуется шестичленный цикл – глюкопираноза (название от гетероцикла пиран), состоящий из пяти атомов углерода и одного атома кислорода. Если же цикл образуется с участием гидроксильной группы при четвертом атоме углерода, то образуются производные пятичленного кислородсодержащего гетероциклического соединения – фурана, цикл – глюкофураноза.
Для более реального изображения моносахаридов как циклических полуацеталей используют перспективные формулы, предложенные в 1925 году лауреатом Нобелевской премии Н. Хеуорсом.
Для перехода от проекционных формул Фишера к перспективным формулам Хеуорса поступают следующим образом. Все группы, которые в проекционной формуле Фишера расположены слева от углеродного скелета,

576
вформуле Хеуорса располагаются сверху, а те группы, которые расположены
впроекционной формуле Фишера справа от углеродного скелета, в формуле Хеуорса располагаются внизу. При этом гликозидный гидроксил может располагаться под плоскостью цикла рядом с гидроксилом при втором атоме углерода (в цис-положении). Такая структура отвечает α-D-глюкопиранозе. Равновероятно, что в процессе образования полуацеталя может возникнуть структура, в которой гликозидный гидроксил может находиться в трансположении по отношению к гидроксилу при втором атоме углерода, т.е. располагаться над плоскостью цикла. Такая структура отвечает β-D- глюкопиранозе.
α-D- и β-D-глюкопиранозы являются аномерами.
Аномеры – это изомеры циклических форм углеводов, отличающихся пространственным расположением гликозидных (полуацетальных) гидроксилов по отношению к плоскости цикла.
Так, к примеру, глюкоза в водном растворе существует в виде α- и β- пираноз, α- и β-фураноз, открытой альдегидной форме, между которыми в растворах устанавливается равновесие:
Циклические формулы углеводов изображают, по предложению Хеуорса, перспективными формулами.
Уточним стереоизомерные отношения, например, в ряду D-альдоз. Между собой D-альдозы с одинаковым числом атомов углерода (D- альдотетрозы, D-альдопентозы, D-альдогексозы и т.д.) являются диастереомерами. Среди них выделяют особый тип диастереомеров, который называют эпимерами.

577
Эпимеры – это диастереомеры, которые отличаются по конфигурации только одного хирального центра.
Конформационная изомерия. Для моносахаридов полуацетальной структуры характерна конформационная (поворотная) изомерия, обусловленная различным расположением в пространстве атомовуглерода, водорода и гидроксильных групп. Конформации (конформеры) полуацетальных моносахаридов представляют собой стереоизомерные структуры, находящиеся в подвижном равновесии, способные к различному превращению путем инверсии, выражающейся в выгибании и вращении вокруг σ-связей.
Циклы в ряду альдопираноз, подобно циклогексановому кольцу не плоские и существуют в виде нескольких (восьми) конформеров, среди которых термодинамически наиболее устойчивыми являются конформации кресла. α-D- и β-D-глюкопираноза представляют собой кресловидные структуры, изображаемые конформационными формулами:
По сравнению с α-D-глюкопиранозой, β-D-глюкопираноза термодинамически более устойчива и количественно преобладает в растворе равновесной смеси, из-за того, что все гидроксильные группы расположены

578
экваториально, между ними конформационные силы отталкивания сведены к минимуму. В α-D-глюкопиранозе имеет место так называемый аномерный эффект 2, являющийся следствием диполь-дипольного отталкивания между гетерокислородом цикла и гликозидным гидроксилом, вынужденным занять аксиальное положение.
В кристаллическом состоянии моносахариды существуют исключительно в виде циклических полуацеталей. При растворении в воде или действии химических реагентов происходит таутомеризация, в результате которой образуются открытые формы (карбонильные структуры), переходящие в пиранозные или фуранозные формы моносахаридов.
Существование равновесия между линейной и циклическими формами моносахаридов получило название цикло-оксо-таутомерии.
Явление изменения удельного вращения свежеприготовленного раствора моносахарида называют мутаротацией. Явление мутаротации – одно из доказательств существования цикло-оксо-таутомерии у моносахаридов. Ход мутаротации можно проследить по изменению оптической активности, величины удельного угла вращения раствора моносахарида. Процесс мутаротации ускоряется добавками к раствору небольших количеств аммиака. Так, угол вращения свежеприготовленного раствора α-D-глюкопиранозы, равный +112,20, постепенно уменьшается, доходя до величины равной +52,70.
Аналогично угол удельного вращения свежеприготовленного раствора β-D-глюкопиранозы, равный +18,70, со временем возрастает, доходя до величины равной +52,70. В обоих случаях происходит мутаротация α-D- и β- D-глюкопиранозы соответственно. В результате в растворе устанавливается равновесная смесь, состоящая из α-D- глюкопиранозы (36,2%) и из термодинамически более устойчивой β-D- глюкопиранозы (63,8%).

579
Гликозиды. Особые свойства гликозидного гидроксила. Образование гликозидов
Полуацетали (полукетали) при взаимодействии со спиртами в кислой среде дают ацетали (кетали):
Моносахариды, являясь циклическими полуацеталями (полукеталями) также образуют ацетали (кетали) – гликозиды:
Итак, гликозиды – это ацетали углеводов. Неуглеводная часть гликозида называется агликоном (можно перевести как ― «несахар»). В приведённом примере это метоксигруппа – остаток метилового спирта (выделено красным).
Названия гликозидов строятся следующим образом: агликон + гликозид. Окончание -оза меняется на–озид. В самом начале названия указывают атом, через который агликон присоединяется к углеводной части.
Классификация гликозидов
Гликозиды могут классифицироваться в зависимости от того через какой атом агликон связан с сахарной частью гликозида:
Примером С-гликозидаможет служить псевдоуридин, примером S-

580
гликозида– синигрин, содержащийся в горчице. Нуклеозиды –N-гликозиды рибозы и дезоксирибозы с нуклеиновыми основаниями, являются компонентами нуклеотидов, ДНК и РНК.
В зависимости от размера цикла гликозиды подразделяются на пиранозиды и фуранозиды:
По сахару, образующему гликозид, они могут классифицироваться следующим образом:
Свойства гликозидов
В кислой среде (но не в щелочной) гликозиды легко гидролизуются на компоненты. Гликозиды очень эффективно гидролизуются ферментами. При этом ферменты очень ярко проявляют свою стереоспецифичность. - Глюкозидаза из дрожжей (мальтаза) легко расщепляет -гликозиднуюсвязь и не трогает -глюкозидную. -Глюкозидаза(например, эмульсин миндаля) гидролизует -глюкозидную связь, не затрагивая -глюкозидную.
Эти наблюдения послужили для Э. Фишера основанием для создания концепции специфичности действия ферментов, которая называется ― «ключ к замку».

581
У гликозидов отсутствует подвижный атом водорода, поэтому они не способны к кольчато-цепной таутомерии и, соответственно, к мутаротации.
Образование простых эфиров (алкилирование)
Простые эфиры легко образуются при действии алкилирующих агентов (алкилгалогениды, алкилсульфаты) на спирты. В случае моносахаридов, однако, при этом также алкилируется и гликозидная OH-группа,образуя гликозид:
Простые эфиры не гидролизуются, в то время как гликозидная связь легко подвергается гидролитическому расщеплению в кислой среде:
Эфиры моносахаридов, в отличие от самих моносахаридов, являются соединениями летучими, что позволяет их разделять перегонкой.
Образование сложных эфиров (ацилирование)
Одним из способов образования сложных эфиров является

582
взаимодействие спиртов и ацилирующих агентов, таких как ангидриды кислот и хлорангидриды. Аналогичным образом моносахариды легко ацилируются ангидридами кислот. Например, взаимодействие глюкозы с уксусным ангидридом приводит к образованию пентаацетильного производного:
Наибольшее значение имеют эфиры моносахаридов и фосфорной кислоты. Фосфаты рибозы и дезоксирибозы являются структурными компонентами нуклеотидов и нуклеиновых кислот – ДНК и РНК. Фосфаты глюкозы, фруктозы и других моносахаридов имеют большое значение в биологической химии. Гликолиз, брожение, цикл Кальвина (темновая фаза фотосинтеза), пентозофосфатный цикл, синтез ди- и полисахаридов идут с участием фосфатов.
Эфиры серной кислоты являются структурными элементами хондроитинсульфата (полисахарид соединительной ткани) и гепарина (антикоагулянт).
Реакции окисления и восстановления глюкозы. Глюконовая, глюкаровая и глюкуроновая кислоты. Глюцит (сорбит), ксилит. Аскорбиновая кислота (витамин С).
Окисление моносахаридов
Окисление моносахаридов может идти с образованием:
•1. глюконовых кислот,
•2. глюкаровых (аровых) кислот,
•3. глюкуроновых (уроновых) кислот
•других веществ
Глюконовые кислоты образуются при окислении альдегидной группы до карбоксильной:
Названия этих кислот образуются по схеме: окончание -оза заменяется на -оновая кислота.
Глюкоза при окислении даёт глюконовую кислоту, галактоза – галактоновую, манноза – манноновую и т.д. Глюконовая кислота в виде фосфорного эфира является компонентом пентозофосфатного цикла. Глюконат кальция используется в медицине как источник кальция.
Окисление ионами меди (II) или серебра в щелочной среде также

583
может приводить к гликоновым кислотам, однако в щелочной среде идёт окислительная деструкция моносахаридов с образованием ряда продуктов, в том числе и гликоновых кислот.
В случае аммиачного раствора оксида серебра (реактив Толленса) идёт реакция серебряного зеркала – при нагревании раствора глюкозы с  идёт восстановление серебра, которое откладывается в виде тонкого серебристого слоя на стенках пробирки.
идёт восстановление серебра, которое откладывается в виде тонкого серебристого слоя на стенках пробирки.
Ионы меди (II) также восстанавливаются при нагревании с образованием жёлтого CuOH, который разлагается с образованием красного
 . Иногда восстановление идёт до металлической меди – образуется медное зеркало.
. Иногда восстановление идёт до металлической меди – образуется медное зеркало.
Для окисления моносахаридов ионами меди (II) используется в основном реактив Фелинга – раствор  в щелочном растворе виннокислого калия. В этом случае медь находится в растворе в виде комплекса с ионами винной кислоты и при нагревании не образуется чёрный CuO, маскирующий исходный синий цвет и цвет образующихся производных меди(I). В прошлом окисление глюкозы реактивом Фелинга использовалось для количественного определения глюкозы.
в щелочном растворе виннокислого калия. В этом случае медь находится в растворе в виде комплекса с ионами винной кислоты и при нагревании не образуется чёрный CuO, маскирующий исходный синий цвет и цвет образующихся производных меди(I). В прошлом окисление глюкозы реактивом Фелинга использовалось для количественного определения глюкозы.
В настоящее время в клинике концентрацию глюкозы определяют глюкозооксидазным методом, в основе которого лежит окисление глюкозы кислородом воздуха катализируемое ферментом глюкозооксидазой:
Глюкаровых (аровые) кислоты образуются при жёстком окислении. При этом окисляется и альдегидная группа и первичная спиртовая:

584
Названия этих кислот образуются по схеме: окончание -оза заменяется на –аровая кислота. Соответственно глюкоза даёт глюкаровую, а манноза маннаровую кислоты.
Глюкуроновые (уроновые) кислоты образуются при окислении первичной спиртовой группы, не затрагивая альдегидную группу:
Синтез уроновых кислот сложнее, чем получение гликоновых или гликаровых, поскольку необходимо защитить легко окисляюмую альдегидную группу. Поэтому в начале альдегидную группу моносахарида защищают – моносахарид превращают в гликозид (альдегидной группы в нём нет, значит она защищена), далее окисляют гликозид – окисляется первичноспиртовая группа, и далее гидролизуют гликозид уроновой кислоты.

585
Уроновые кислоты выполняют важную биологическую функцию – вывод из организма ксенобиотиков и токсичных веществ.
Ксенобиотики (от греч. — чужой и — жизнь), чужеродные для организмов соединения (промышленные загрязнения, пестициды, препараты бытовой химии, лекарственные средства и т. п.).
Глюкурониды хорошо растворимы в воде и выводятся с мочой, отсюда происходит название уроновых кислот (лат. urina - моча).
Уроновые кислоты также являются компонентами метаболического пути уроновых кислот, в ходе которого синтезируется аскорбиновая кислота (у человека не синтезируется) и являются мономерами различных полисахаридов (пектиновые вещества, гепарин, гиалуроновая кислота, хондроитин, гепарин и т.д.).
Окисление до других веществ. В организме глюкоза окисляется до углекислого газа и воды с выделением и запасанием энергии, этот процесс очень сложен и изучается в курсе биологической химии. Он включает в себя гликолиз, окислительное декарбоксилирование пировиноградной кислоты и цикл Кребса.
При поджигании на воздухе моносахариды, плавясь, медленно

586
сгорают, ионы лития являются катализаторами этого процесса.
Восстановление моносахаридов
Известно, что альдегиды и кетоны восстанавливаются до спиртов. Оксогруппа моносахаридов также при соответствующих условиях способна восстанавливаться в спиртовую.
При восстановлении моносахаридов образуются многоатомные спирты.
Тривиальные названия таких спиртов выводятся из названий моносахаридов путем замены окончания -оза на окончание –ит:
Ксилоза ксилит Манноза маннит Глюкоза глицит (сорбит)
В настоящее время в биохимической литературе распространились названия с окончаниями – итол: маннитол, ксилитол и т.д. Следует отметить, что в русской химической литературе приняты названия с окончанием –ит, а маннитол и ксилитол – это транслитерация английских mannitol и xylitol.
Многоатомные спирты обладают сладким вкусом и используются как заменители сахара. Например, для этой цели используются ксилит и сорбит, свободно продающиеся в продуктовых магазинах.
Восстановление глюкозы в сорбит является первой стадией химического синтеза аскорбиновой кислоты:

587
Сорбит далее окисляют микробиологически, используя Acetobacter suboxydans, образующюся L-сорбозу в несколько стадий превращают в аскорбиновую кислоту.
Аскорбиновая кислота (витамин С), 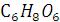 , водорастворимый витамин. Отсутствие аскорбиновой кислоты в пище человека понижает сопротивляемость к заболеваниям, вызывает цингу, заболевание, ранее уносившее десятки тысяч жизней.
, водорастворимый витамин. Отсутствие аскорбиновой кислоты в пище человека понижает сопротивляемость к заболеваниям, вызывает цингу, заболевание, ранее уносившее десятки тысяч жизней.
Слово ― «аскорбиновая» происходит от а – отрицающая частица и scorbutus – цинга. То есть аскорбиновая кислота означает ― «противоцинготная» кислота.
Аскорбиновая кислота также используется в аналитической химии в аскорбинометрии, которую применяют для определения Fe(III), Hg(II), Au(III), Pt(IV), Ag(I), Ce(IV), Mo(VI), W(VI),  ,
,  , хлоратов, броматов,
, хлоратов, броматов,
иодатов, ваданатов, дихроматов, а также нитро- нитрозо-,азо- и иминогрупп в органических соединениях.
Изомеризация моносахаридов
Изомеризация в щелочной среде (перегруппировки Лобри де Брюйна – ван Экенштейна) идут через ендиольную форму:

588
Взаимные превращения моносахаридов являются своеобразным случаем кетоенольной таутомерии.
В живом организме моносахариды также могут легко превращаться друг в друга под действием ферментов, например, одна из стадий гликолиза включает себя изомеризацию глюкозо-6-фосфатавофруктозо-6-фосфат.
При нагревании же моносахаридов в щелочных растворах происходит их разрушение с образованием различных продуктов.
Качественные реакции на моносахариды
При нагревании пентоз с соляной кислотой происходит их дегидратация с образованием фурфурола:
Фурфурол (фурфураль), светло-желтая жидкость с запахом ржаного хлеба, tкип 161,5С. Сырье для получения фурановых смол, фурана, тетрагидрофурана, фурфурилового спирта, лекарственных препаратов (фурацилин, фуразолидон).
С анилином фурфурол образует ярко-красный пигмент, что является качественной реакцией на пентозы.
Аналогичная реакция дегидратации идёт и с гексозами – при этом образуется 5- гидроксифурфурол, который даёт красное окрашивание с резорцином. Кетогексозы (фруктоза) дегидратируются до доведения жидкости до кипения, в то время как альдогексозы требуют кипячения.
589
Таким образом можно отличить кетогексозы от альдогексоз. Эта качественная реакция на кетогексозы называется реакцией Селиванова: при нагревании до кипения раствора, содержащего резорцин, соляную кислоту и кетогексозу развивается красное окрашивание. Чтобы добиться красного окрашивания с альдогексозами требуется кипячение раствора.
При взаимодействии с фенилгидразином образуются хорошо кристаллизующиеся озазоны, которые имеют чёткие температуры плавления и поэтому используются для идентификации моносахаридов.
Брожение. Брожение или ферментация – процесс разложения углеводов на более простые соединения под влиянием ферментов, выделяемых микроорганизмами. В большинстве случаев брожение сопровождается выделением газообразных продуктов (СО2, Н2 и др.). В зависимости от образующихся главных продуктов различают следующие виды брожения: спиртовое, молочно-кислое, лимонно-кислое, маслянокислое, глицериновое и др. Брожению подвергаются сахара с числом углеродных атомов, кратным трем. Особенно важное значение имеет спиртовое брожение. Под влиянием энзима зимазы, содержащейся в дрожжах, и катализаторов гексозы бродят, образуя в качестве главного
продукта этанол. Процесс изображается общей схемой: С6Н12О6 |
→ |
2С2Н5ОН + 2СО2 |
|
Процессов брожения углеводов рассматривается в курсе биохимии.
Свойства отдельных моносахаридов и их производных
D-глюкоза (декстроза, виноградный сахар). Является самым распространённым моносахаридом. Глюкозу получают путём кислотного гидролиза картофельного или кукурузного крахмала, и составляет основную массу патоки, широко применяемой в кондитерской промышленности.
В свободном виде содержится в крови, являясь основным энергетическим субстратом для мозга. Постоянный уровень глюкозы поддерживается с помощью гормона инсулина, который уменьшает концентрацию глюкозы в крови за счёт поглощения её тканями, а также глюкагона, глюкокортикоидов, адреналина и других гормонов, которые увеличивают её концентрацию. При сахарном диабете гормон инсулин вырабатывается поджелудочной железой в недостаточном количестве, что приводит к тому, что глюкоза не всасывается тканями, и её концентрация в крови значительно увеличивается.
Также глюкоза в свободном виде содержится в зелёных частях растений, в различных фруктах и мёде. Входит в состав крахмала, гликогена, целлюлозы, гемицеллюлоз, декстранов, сахароза, мальтозы и многих гликозидов.
Интересно, что L-глюкоза, являясь энантиомером обычной природной D-глюкозы, также является сладкой, но не усваивается организмом, в связи с чем она может быть использована как заменитель сахара.
D-фруктоза (левулёза, плодовый сахар). Название левулёза (лат. laevus
– левый) связано с тем, что водные растворы фруктозы имеют удельное

590
вращение -92,4ᴏ, т.е. плоскополяризованный свет фруктоза вращает влево, в отличие от глюкозы, которая вращает его вправо (отсюда второе название глюкозы – декстроза; лат. dextrus – правый).
Фруктоза содержится в зелёных частях растений, в нектаре цветов, в плодах, в мёде. Входит в состав сахарозы, а также многих полисахаридов.
D-галактоза. В свободном кристаллическом виде выделяется на плодах плюща. Встречается в качестве составной части некоторых дисахаридов (лактоза) и полисахаридов (хондроитин, агар-агар, слизи, гемицеллюлозы).
Получение моносахаридов
Природные источники
Многие моносахариды содержатся в биологических объектах.
Растения и некоторые бактерии (цианобактерии) способны синтезировать углеводы из углекислого газа и воды на свету. Этот процесс известен как фотосинтез. В процессе фотосинтеза не только образуется глюкоза, но и выделяется кислород, необходимый для дыхания всех аэробных организмов. За внешней простотой общей реакции фотосинтеза кроются две фазы фотосинтеза – световая и темновая, являющиеся очень сложными:
6СО2 + 6Н2О → С6Н12О6 + 6О2
Гидролиз дисахаридов, олигосахаридов и полисахаридов.
Сахароза + H2O → глюкоза + фруктоза
Мальтоза + H2O → глюкоза + глюкоза
Лактоза + H2O → глюкоза + галактоза
При гидролизе крахмала, клетчатки, гликогена образуется глюкоза.
Реакция Бутлерова
При действии гидроксидов щелочноземельных металлов на раствор формальдегида в воде образуется смесь сахаров – метиленитан или формоза:
Это реакция, осуществлённая А.М. Бутлеровым в 1861 году является первым примером синтеза углеводов из более простых веществ.
Аналогичная смесь сахаров образуется при действии щелочей на смесь глицеринового альдегида и дигидроксиацетона, которая образуется при

591
окислении глицерина (Э. Фишер), и на гликолевый альдегид (Фентон). Последние две реакции идут по механизму альдольной конденсации.
Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
Дисахариды или биозы – сложные сахара общей формулы С12Н22О11. Они относятся к группе олигосахаридов, которые при гидролизе
образуют два моносахарида:
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6
сахароза |
моносахариды |
К важнейшим дисахаридам относятся: сахароза, лактоза мальтоза, и целлобиоза.
По химической структуре дисахариды представляют собой гликозиды, образованные в результате отщепления молекулы воды от двух моносахаридов за счет гидроксилов по одному от каждого из них. При этом один из гидроксилов является гликозидным.
По химическим свойствам биозы делят на невосстанавливающие и восстанавливающие сахара. Если отщепление молекулы воды произошло за счет гликозидных гидроксилов обеих молекул моносахаридов, то образуется невосстанавливающий дисахарид, называемый
гликозидогликозидом.
Такие дисахариды существуют только в циклических конфигурациях и не могут изомеризоваться в цепные карбонильные формы и, следовательно, не обладают восстановительными свойствами. В частности, водные растворы гликозидгликозидных дисахаридов не дают реакцию "серебряного зеркала", не обесцвечивают реактив Фелинга, не подвергаются мутаротации. Типичным примером невосстанавливающего дисахарида является сахароза.
Если отщепление воды произошло за счет гликозидного гидроксила только одного из моносахаридов и негликозидного гидроксила другого моносахарида, то образуется восстанавливающий дисахарид, в котором один из циклов сохраняет гликозидный гидроксил, способный в водных растворах изомеризоваться, превращаясь в цепную карбонильную форму. К восстанавливающим дисахаридам относятся мальтоза, лактоза и целлобиоза, водные растворы которых дают реакцию "серебряного зеркала" и восстанавливают раствор Фелинга.
Сахароза – дисахарид, построенный из остатков глюкозы и фруктозы. Гликозидная связь образуется за счёт полуацетальных гидроксильных групп

592
и глюкозы и фруктозы (отмечено красным):
Таким образом, в молекуле сахарозы отсутствует полуацетальная ОНгруппа, поэтому сахароза не восстанавливает жидкость Фелинга и относится к невосстанавливающим дисахаридам.
Мальтоза – дисахарид, построенный из двух остатков глюкозы, которые связываются за счёт полуацетальной гидроксильной группы одной молекулы глюкозы и спиртовой ОН-группы другой молекулы глюкозы:
В молекуле мальтозы присутствует полуацетальная гидроксильная группа (выделена красным цветом) и, следовательно, мальтоза относится к восстанавливающим дисахаридам - она восстанавливает жидкость Фелинга.
Почему так важен для проявления восстановительных свойств именно полуацетальный гидроксил будет ясно из последующего изложения - см. химические свойства дисахаридов.
Тип гликозидной связи
Очень важно уметь определять тип гликозидной связи в олиго- и полисахаридах.
Во-первых, гликозидная связь характеризуется стереохимически - то есть указывается каким аномером является данный гликозид ( -аномер или-аномер).
Во-вторых, указываются номера атомов углерода, которые связаны через кислородный мостик:

593
Обрати внимание! В местах «сгибов» гликозидной связи никаких атомов нет! Это просто удобный способ изображения этих структур. Если связь С-O изобразить обычной прямой чертой, то придётся переворачивать один моносахаридный остаток, а это очень неудобно для восприятия.
Номенклатура дисахаридов
Гликозил-гликозиды (невосстанавливающие дисахариды) называются также, как и гликозиды. Например, сахарозу можно представить, как гликозид глюкозы, в котором агликоном является остаток фруктозы или наоборот - как гликозид фруктозы, агликоном которой является остаток глюкозы. В соответствии с правилами номенклатуры, альдоза старше кетозы, поэтому выбирается первый вариант (агликон выделен зелёным) и сахароза имеет такое полное название: -D-фруктофуранозил- -D-глюкопиранозид (а не -D-глюкопиранозил- -D- фруктофуранозид).
В случае восстанавливающих дисахаридов основой считается агликон - остаток моносахарида со свободной полуацетальной ОН-группой (у

594
мальтозы выделен зелёным цветом). Второй остаток моносахарида считается заместителем. В названии указываются стереохимические особенности гликозидной связи и атомы углерода, через которые связаны остатки моносахаридов. В соответствии с этим -мальтоза называется -D- глюкопиранозил-(1 4)- -D-глюкопираноза.
Соответственно, -мальтоза будет иметь следующее название: -D- глюкопиранозил-( 1 4)- -D-глюкопираноза.
Физические свойства дисахаридов
Физические свойства дисахаридов практически не отличаются от свойств моносахаридов. Дисахариды также являются бесцветными кристаллическими веществами, хорошо растворимыми в воде, плохо растворимыми в гидрофобных растворителях. Дисахариды являются оптически активными соединениями, причём восстанавливающие дисахариды способны к мутаротации.
Химические свойства дисахаридов
Химические свойства восстанавливающих дисахаридов повторяют свойства моносахаридов. Свойства невосстанавливающих дисахаридов отличаются некоторым своеобразием.
1. Кольчато-цепная таутомерия. Мутаротация
К кольчато-цепной таутомерии способны только восстанавливающие дисахариды. Рассмотрим это на примере мальтозы:

595
Фуранозные формы также образуются в данном случае, но вклад их несущественен.
2. Окисление дисахаридов
Реактив Фелинга, реактив Толленса окисляют только восстанавливающие дисахариды, которые способны образовывать открытую альдегидную форму. При этом восстанавливающие дисахариды окисляются в
бионовые кислоты:
Лактоза окисляется в лактобионовую кислоту, целлобиоза в целлобионовую кислоту. Сахароза и трегалоза реактивом Фелинга не окисляются, ибо являются невосстанавливающими дисахаридами.
3. Гидролиз дисахаридов
Дисахариды являются гликозидами, то есть ацеталями. А гидролиз ацеталей не катализируется основаниями, поэтому для катализа гидролиза дисахаридов используются кислоты. Гидролиз дисахаридов идёт при нагревании в присутствии каталитических количеств кислоты:

596
Гидролиз сахарозы называется инверсией сахарозы. Инверсия (лат. Inversio – перестановка) – это изменение какой – либо величины на обратную.
Например, инверсия геомагнитного поля Земли - это изменение направления (полярности) магнитного поля Земли на обратное в ходе которого южный и северный полюса меняются местами, наблюдается через интервалы времени от 500 тыс. лет до 50 млн. лет. Инверсия в биологии - разрыв и поворот на 180 участка хромосомы.
В случае гидролиза сахарозы, явление сопровождаемое процесс гидролиза, стало обозначать сам процесс. Дело в том, что при гидролизе сахарозы угол вращения плоскости поляризации света меняется, и он из положительного становится отрицательным. Почему это наблюдается? Удельное вращение сахарозы +66,5 , а глюкозы и фруктозы +52,5 и -92,4 соответственно.
При гидролизе сахарозы образуется эквимольная смесь глюкозы и фруктозы, в результате удельное вращение становится отрицательным. Продукт гидролиза сахарозы называют инвертным сахаром-он слаще, чем сахароза.
В организме гидролиз дисахаридов катализируют ферменты. Например, сахароза в кишечнике гидролизуется под действием фермента сахаразы, лактоза - под действием фермента лактазы.
4. Образование гликозидов, простых и сложных эфиров и хелатных комплексных соединений с ионами меди (II)
Как и моносахариды, дисахариды способны проявлять эти свойства. Однако следует уточнить, что только восстанавливающие дисахариды способны образовывать гликозиды, так как именно у них есть свободная
597
полуацетальная ОН-группа.
Отдельные дисахариды Сахароза (тростниковый сахар, свекловичный сахар).
-D-фруктофуранозил- -D-глюкопиранозид
Сахароза чрезвычайно распространена в растениях и играет огромную роль в питании человек. Характерная особенность сахарозы - лёгкость её гидролиза в кислом растворе - скорость её гидролиза примерно в 1000 раз больше, чем скорость гидролиза мальтозы или лактозы.
Сахароза - невосстанавливающий дисахарид.
Мальтоза (солодовый сахар, лат. malt - солод), -D-глюкопиранозил- (1 4)-D- глюкопираноза. Остатки глюкозы в молекуле мальтозы связаны - 1,4 - гликозидной связью. Мальтоза образуется при гидролизе крахмала под действием (фермента амилазы; если долго жевать хлеб можно почувствовать сладковатый вкус мальтозы, образующейся из крахмала хлеба под действием амилазы слюны. Мальтоза содержится в большом количестве в солоде и сусле.
Солод, продукт проращивания зерен злаков (ячменя, ржи, пшеницы, овса). Применяется в производстве пива. Сусло - сладкий водный экстракт солода, предназначенный к сбраживанию. Продуктом сбраживания сусла является пиво.
Мальтоза - восстанавливающий дисахарид.
Целлобиоза. -D-глюкопиранозил-(1 4)-D-глюкопираноза.
Остатки глюкозы связаны -1,4 - гликозидной связью. Является строительной единицей клетчатки (целлюлозы). В свободном виде содержится в соке некоторых деревьев. Целлобиоза - восстанавливающий дисахарид.
Лактоза (лат. lactis - молоко) - молочный сахар. -D-галактопиранозил- (1 4)-D- глюкопираноза. Остаток галактозы связан с остатком глюкозы - 1,4 - гликозидной связью. Лактоза содержится только в молоке млекопитающих (2-8 %).
Вырабатывается в больших количествах из молочной сыворотки, идёт на производство лактулозы и как инертный наполнитель для лекарственных препаратов. Лактоза является восстанавливающим дисахаридом.
В организме гидролиз лактозы происходит под действием фермента лактазы. При недостаточности выработки лактазы наблюдается лактазный дефицит и неспособность переваривать лактозу. Поэтому при потреблении молока людьми с лактазным дефицитом, лактоза не переваривается, а начинает сбраживаться кишечной микрофлорой с различными неприятными последствиями (метеоризм, диаррея). Это явление носит также следующие названия непереносимость лактозы, мальабсорбция лактозы, гиполактазия.
У большинства людей и млекопитающих ген лактазы выключается по мере взросления. Это объясняется тем, что млекопитающие потребляют молоко только в младенчестве, и в дальнейшем нет смысла тратить энергию и аминокислоты на синтез лактазы. Однако, в результате мутации в одном из
598
регуляторных генов, чей продукт выключал ген лактазы, этот фермент (лактаза) стал синтезироваться на протяжении всей жизни. Примерно 70% европейцев усваивают молоко (то есть переносят лактозу) в зрелом возрасте, тогда как в Африке. Океании и Центральной Азии только 30% населения умеют вырабатывать лактозу. Однако, отдельные народы Африки с традиционно высоким потреблением молока (тутси, фуланы, туареги и др.) не имеют проблем с перевариванием лактозы.
Полисахариды (крахмал, целлюлоза, хитин, гликоген).
Молекулы полисахаридов состоят из большого количества остатков моносахаридов.
Полисахариды чрезвычайно широко распространены среди животных, растений, грибов и микроорганизмов и играют либо строительную роль, либо выполняют функцию запасных питательных веществ.
Классификация полисахаридов Полисахариды могут быть разветвлёнными и неразветвлёнными
(линейными). Полисахариды, состоящие из остатков только одного моносахарида, называются гомополисахаридами, а полисахариды, состоящие из остатков разных моносахаридов – гетерополисахаридами. Гомополисахариды также называются гликанами. Гликаны могут быть гексозанами или пентозанами, то есть состоять из остатков гексоз или пентоз.
В зависимости от химической природы моносахаридных звеньев различают глюканы, маннаны, галактаны, арабаны, ксиланы и т.д.
Структура полисахаридов
Первичная структура полисахаридов – это последовательность мономерных остатков. Помимо первичной структуры полисахариды могут обладать вторичной структурой – например, амилоза представляет собой макромолекулу, свёрнутую в спираль.
Физические свойства полисахаридов
Как правило, полисахариды в чистом виде представляют собой белью аморфные вещества. Высокомолекулярные полисахариды плохо растворимы в воде, а если растворимы, то образуют суспензии и мутные коллоидные растворы (раствор крахмала в воде - клейстер).
Химические свойства полисахаридов 1. Окисление
По химической природе полисахариды можно рассматривать как полигликозиды; и остаток моносахарида со свободной полуацетальной гидроксигруппой находится на самом конце цепи. Учитывая, что в состав полисахаридов входят тысячи или даже миллионы остатков моносахаридов, доля восстанавливающего концевого остатка относительно всей макромолекулы очень мала. Поэтому можно считать, что полисахариды не восстанавливают жидкость Фелинга.
Естественно, что полисахариды легко окисляются жёсткими окислителями, например, горение целлюлозы наблюдал каждый, кто видел,

599
как горит бумага, хлопчатобумажная ткань или вата.
2. Образование простых и сложных эфиров
Полисахариды образуют простые и сложные эфиры. Особенно важно образование сложных эфиров в случае целлюлозы (см. далее).
3. Гидролиз
Гидролиз полисахаридов не катализируется основаниями, так как гидролиз гликозидов катализируется кислотами. Гидролиз полисахаридов используется для получения моносахаридов, например, путём гидролиза крахмала получают глюкозу.
In vivo гидролиз полисахаридов гидролизуется ферментами: крахмал гидролизуется амилазами, целлюлоза – целлюлазами, гемицеллюлозы – гемицеллюлазами.
Крахмал
Крахмал, как правило, представляет собой смесь двух полисахаридов - амилозы и амилопектина.
В амилозе остатки глюкозы связаны друг с другом -1,4-гликозидной связью, поэтому можно также считать, что мономером амилозы является мальтоза:
n = 200–1000
M = 40000–160000
Молекулы амилозы свёрнуты в спираль – на каждый виток спирали приходится 6 остатков глюкозы:
Во внутреннюю полость спирали могут входить молекулы йода,

600
образуя комплексы синего цвета, что используется в аналитической химии для качественного обнаружения как йода, так и крахмала.
Амилопектин имеет разветвлённое строение. В основной цепи остатки глюкозы связаны как и в амилозе – -1,4-гликозидными связями, а в местах ветвления - 1,6-гликозиднымй связями:
Между точками ветвления располагается 20-25 глюкозных остатков:
Участки между точками ветвления также имеют спиральную вторичную структуру и также могут образовывать комплексы с йодом синефиолетового цвета. Молекулярная масса амилопектина 1-6 миллионов.
Амилоза легко растворяется в тёплой воде, амилопектин же растворяется в воде плохо и даёт очень вязкий раствор – клейстер.
Клейстер, клейкий раствор, получаемый нагреванием крахмала в воде. Применяют в малярных, переплетных и других работах.
Соотношение содержания амилозы и амилопектина в крахмале зависит от источника выделения (таблица 3.7.1).

601
Таблица 3.7.1 – Содержание амилозы и амилопектина в крахмале из различных источников
Источник |
Амилоза, % |
Амилопектин, % |
|
|
|
Картофель |
20 |
80 |
|
|
|
Пшеница |
24 |
76 |
|
|
|
Рис |
17 |
83 |
|
|
|
Кукуруза |
22 |
78 |
|
|
|
Яблоки |
100 |
0 |
|
|
|
При частичном гидролизе крахмала образуются полисахариды - декстрины. Декстринизация идёт при нагревании крахмала, например при выпечке хлеба, или глажении накрахмаленных тканей. При этом декстрины образуют блестящую корочку.
При полном гидролизе крахмала образуется глюкоза, а при гидролизе катализируемом ферментом амилазой, образуется дисахарид мальтоза.
Функция крахмала – запасающая. Крахмал образуется в клубнях картофеля и семенах злаков для последующего питания прорастающего молодого растения.
Гликоген (животный крахмал)
Гликоген содержится в основном в печени, мышцах животных и также найден в грибах и в зёрнах сахарной кукурузы.
По структуре гликоген аналогичен амилопектину, однако гликоген является более разветвлённым полисахаридом - расстояние между точками ветвления обычно 10-12 глюкозных остатков (минимальное расстояние 6 глюкозных остатков).
Гликоген растворим в воде, образуя коллоидный раствор, окрашивается йодом в фиолетово-коричневый или фиолетово-красный цвет.

602
Молекулярная масса гликогена достигает 100 миллионов.
Функция гликогена – запасающая. Гликоген участвует в поддержании уровня глюкозы в крови – при недостатке глюкозы в крови гликоген гидролизуется с образованием глюкозы (гликогенолиз), а при избытке глюкозы – синтезируется, что уменьшает концентрацию глюкозы в крови. Два эти процесса регулируются гормонально.
Целлюлоза (клетчатка)
Целлюлоза – самый распространённый полисахарид и самое распространённое органическое вещество на Земле.
Целлюлоза обладает большой механической прочностью и составляет основу клеточных стенок клеток растений. Клетчатка составляет более 50% древесины, а хлопок представляет собой почти чистую целлюлозу. Бумага также представляет собой довольно чистую целлюлозу. Целлюлоза считается растительным полисахаридом, однако она найдена и в животном мире у оболочников (Tunicata), покров которых она образует.
Молекулы целлюлозы являются линейными, молекулы глюкозы связаны -1,4-гликозидными связями, поэтому можно считать, что мономером целлюлозы является целлобиоза:
n = 2500-12000
M = 400000-2000000
Целлюлоза не растворима в воде. Однако целлюлозу можно растворить
вреактиве Швейцера – концентрированный раствор  . Продавливая полученный вязкий раствор через фильеры (мелкие отверстия)
. Продавливая полученный вязкий раствор через фильеры (мелкие отверстия)
всернокислотную ванну можно высадить целлюлозу в виде нитей: таким образом получают искусственный медноаммиачный шёлк.
Эфиры целлюлозы являются важными производными, использующимися в промышленности.
1.Нитроцеллюлоза.
Эфиры целлюлозы с азотной кислотой получают, обрабатывая целлюлозу смесью концентрированных азотной и серной кислот:

603
Нитроцеллюлоза с максимальным содержанием азота называется пироксилин (12,5-13,5% N), который используется для приготовления бездымного пороха.
Нитроцеллюлоза с меньшим количеством азота (10,5-12,3% N) хорошо растворима в спирте. Такой раствор называется коллодий и используется для герметизации ран. Пластифицированная нитроцеллюлоза имеет название целлулоид, который используется для изготовления многих предметов: пуговиц, расчёсок, щёток и киноплёнки.
2. Ацетат целлюлозы
Ацетат целлюлозы получают действием на целлюлозу уксусного ангидрида в присутствии небольшого количества концентрированной серной кислоты.
Ацетаты целлюлозы являются термопластичными полимерами, которые используются для изготовления ацетатного волокна, лаков, пластмасс и киноплёнок.
3. Ксантогенаты целлюлозы.
Ксантогенаты целлюлозы образуются при взаимодействии целлюлозы с щёлочью в сегоуглероде ( ).
).
Образующийся ксантогенат растворим в воде с образованием коллоидного раствора. В этом растворе происходит отщепление ксантогенатных остатков с образованием целлюлозы - в результате вязкость раствора увеличивается,
благодаря чему образующийся продукт получит название вискоза (лат. viscosus — вязкий). Вискоза применяется для приготовления вискозного волокна, плёнки (целлофан) и искусственной кожи (кирза).
Хитин
Основной компонент наружного скелета насекомых, ракообразных и других членистоногих. У некоторых грибов заменяет целлюлозу. Подобно

604
целлюлозе хитин выполняет опорные и механические функции в этих организмах.
Хитин является не только функциональным, но и структурным аналогом целлюлозы - хитин построен из остатков N-ацетилглюкозамина, соединённых -1,4-гликозидными связями:
3.7.2 Гидроксикарбоновые кислоты
Гидроксикислоты или оксикислоты – это органические кислоты,
содержащие одну или несколько ОН – групп. Общая формула:
R – (COOH)n
|
(OH)m
где n – количество карбоксильных групп, m – гидроксильных. Классификация. В зависимости от количества карбоксильных групп
гидроксикислоты подразделяют на одноосновные (один карбоксил), двухосновные (два карбоксила), трёхосновные (три карбоксила) и т.д.
НО–СН2–СООН |
СООН–СН–СН2–СООН |
СООН–СН2–С(СООН)–СН2–СООН |
|
| |
| |
|
НО |
НО |
гликолевая кислота |
яблочная кислота |
лимонная кислота |
(одноосновная) |
(двухосновная) |
(трехосновная) |
По расположению гидроксильной группы относительно карбоксила гидроксикислоты подразделяют на α-, β-, γ- и т.д.
При названии гидроксикислот используют тривиальную, радикальнофункциональную и заместительную номенклатуру.
Тривиальная номенклатура чаще всего употребляется для названия гидроксикислот. В ней отражаются особо заметные свойства, источник нахождения и т.д. Например, гликолевая кислота сладкая, винная кислота выделена из винного камня, молочная кислота находится в молоке и молочных продуктах и т.д.
В названии кислот по радикально-функциональной номенклатуре указывают тривиальное название соответствующей карбоновой кислоты, а наличие гидроксильной группы отражается в виде префикса с соответствующей буквой греческого алфавита. Например, гликолевая
605
кислота по этой номенклатуре будет иметь название α-гидроксиуксусная; молочная кислота – α-гидроксипропионовая, а яблочная кислота – α- гидроксиянтарная.
При названии гидроксикислот по заместительной номенклатуре указывается название соответствующей карбоновой кислоты по этой же номенклатуре, а наличие гидроксильной группы показывается в виде префикса гидрокси- с наличием цифры, обозначающей местоположение этой группы. Так, гликолевая кислота по этой номенклатуре будет названа 2- гидроксиэтановая, молочная кислота – 2-гидроксипропановая, а яблочная кислота – 2-гидроксибутандиовая.
Следует отметить, что в практике (биохимической, фармакологической) чаще всего употребляют тривиальные названия гидроксикислот.
Наиболее важные представители гидроксикислот
Гликолиевая кислота HOCH2COOH содержится во многих растениях, например, свекле и винограде.
Молочная кислота (соли лактаты) CH3CH(OH)COOH. Широко распространена в природе, является продуктом молочнокислого брожения углеводов. Содержит асимметрический атом углерода и существует в виде двух энантиомеров. В природе встречаются оба энантиомера молочной кислоты. При молочнокислом брожении образуется рацемическая D,L- молочная кислота. D-молочная (мясо-молочная) кислота образуется при восстановлении пировиногралной кислоты под действием кофермента НАДН и накапливается в мышцах при интенсивной работе.
Яблочная кислота (соли малаты) HOOCCH(OH)CH2COOH.
Содержится в незрелых яблоках, рябине, фруктовых соках. Является ключевым соединением в цикле трикарбоновых кислот. В организме образуется путем гидратации фумаровой кислоты и далее окисляется коферментом НАД+ до щавелевоуксусной кислоты.
Винная кислота (соли тартраты) HOOCCH(OH)CH(OH)COOH.
Содержит два хиральных центра и имеет 3 стереоизомера: D-винную кислоту, L-винную кислоту и оптически неактивную мезовинную кислоту. D-винная кислота содержится во многих растения, например, в винограде и рябине. При нагревании D-винной кислоты образуется рацемическая D,L- винная (виноградная) кислота. Мезовинная кислота образуется при кипячении других стереоизомеров в присутствии щелочи и при окислении малеиновой кислоты.
Оптическая изомерия оксикислот
Для окси-, аминокислот, углеводов традиционно используют вместо более общей R,S-номенклатуры – D,L-номенклатуру. В этой номенклатуре определяется относительная конфигурация хирального центра, эталоном являются конфигурации D- и L- глицеринового альдегида.

606
Количество стереоизомеров: 2n = 2 (n=количество С*, 1), т.е. имеется пара энантиомеров или оптических антиподов.
Для изображения конфигураций D- и L- энантиомеров используются проекции Фишера. Для их написания выполняются следующие правила:
1.В верхней части проекции располагается группа содержащая С1 или старшая группа;
2.На горизонтали располагаются атом водорода и функциональная (- ОН) группа.
Альдегидная и -СН2ОН группы располагаются на вертикальной линии,
аводород и гидроксил на горизонтальной.
Если гидроксил расположен справа – это D-конфигурация или D-
ряд.
Если гидроксил расположен слева – это L- конфигурация или L-ряд.
Для того, чтобы установить R,S-конфигурацию приведенных эннантиомеров, определяют старшинство групп по Кану – Ингольду – Прелогу, которые в данном случае следующее:
OH > CHO >CH2OH > H
(1)(2) (3) (4)
Делают четное число перестановок у хирального центра С*, при этом младший заместитель должен располагаться в нижней части проекции Фишера. Определяют, как изменяется старшинство заместителей у хирального центра: если по часовой стрелке, то это R- конфигурация, если
против, то S- конфигурация.
Молочная кислота CH3–C*H (ОН)–COOH существует в виде пары энантиомеров (nC*=1).
(мясо-молочная кислота)
S-конфигурация |
R-конфигурация |

|
607 |
[α]= +2,67 15 (2,5%) |
[α]= -2,67 15 (2,5%) |
[α] – удельный угол вращения (зависит от температуры и концентрации раствора)
(+) – вращение плоскополяризованного света «вправо» (-) – вращение плоскополяризованного света «влево»
Рацемат молочной кислоты – D, L (±) молочная кислота имеет температуру плавления 180С (рацемат оптически неактивен, [α] = 0)
В человеческом организме в процессе активной работы глюкоза, содержащаяся в мышцах, превращается в L (+) молочную кислоту. В процессе кисло-молочного брожения углеводы превращаются в D (-) молочную кислоту, либо в рацемат D, L (±).
Яблочная кислота СООН–С*Н (ОН)–СН2–СООН
S-конфигурация |
R-конфигурация |
Старшинство заместителей:
OH > CООH >CH2СООH > H
(1) |
(2) |
(3) |
(4) |
Винные кислоты HOOC–C*H(ОН)–C*H(ОН)–COOH n C = 2
У винной кислоты имеется только одна пара энантиомеров (D и L – винные кислоты). Причиной является симметричное строение винной кислоты. Кроме пары энантиомеров имеется мезо-форма (мезовинная кислота), которая оптически неактивна, и рацемат (виноградная кислота):

608
Температура плавления виноградной кислоты (рацемата) 2050С. D-винная и мезовинная кислоты, L-винная и мезовинная кислоты
являются диастереомерами. Полное название D-винной кислоты по R,S- номенклатуре: 2(R),3(R)- диоксибутандиовая кислота.
Особенности химических свойств
α-Оксикислоты являются более сильными кислотами, чем обычные карбоновые кислоты, что обусловлено наличием акцепторной (-ОН) группы в углеводородном радикале. Реакции оксикислот идут по одной или двум функциональным группам (-ОН, -СООН) в зависимости от природы реагента.
3.7.3 Аминокислоты
Аминокислотами называются органические соединения, в молекулах которых содержатся одновременно аминогруппа -NH2 и карбоксильная группа -СООН.
Их можно рассматривать как производные карбоновых кислот. Аминокислоты – карбоновые кислоты, у которых в радикале атом водорода замещен на аминогруппу.
Общая формула аминокислот: (NH2)х - CnH2n - (COOH)y.
Известно несколько сотен аминокислот. Важнейшими являются 20 аминокислот, входящих в состав белков, их называют протеиногенными.
Общее строение протеиногенной aминокислоты:
Аминокислоты, из которых построены белки, имеют аминогруппу в α- положении по отношению к карбоксильной группе. Нумерация в молекулах аминокислот идет от старшей карбоксильной группы. Младшая указывается в префиксе как аминогруппа:
Классификация аминокислот. Основные представители природных α-аминокислот, их стереохимия.
Существуют различные способы классификации аминокислот.
Например, по числу аминных и карбоксильных групп.

|
|
609 |
|
|
|
Моноаминомонокарбоновые кислоты содержат одну аминогруппу и |
|||
одну |
карбоксильную |
(основное |
количество |
аминокислот). |
Моноаминодикарбоновые кислоты: аспарагиновая и глутаминовая содержат по две карбоксильные группы на одну аминогруппу. Диаминомонокарбоновые аминокислоты: лизин, аргинин, гистидин, наоборот, при одной карбоксильной группе имеют две амино - (или имино-)
группы. |
|
|
|
|
Из всех аминокислот выделяют: |
|
|
|
|
Серосодержащие |
аминокислоты: |
цистеин |
и |
метионин. |
Гидроксиаминокислоты: серин, треонин, тирозин в радикале имеют гидроксигруппу.
Циклические аминокислоты: фенилаланин, тирозин, триптофан, пролин, гистидин имеют в радикале кольцо.
Ароматические аминокислоты содержат ароматическое кольцо: тирозин, фенилаланин, триптофан.
Иминокислота вместо аминосодержит иминогруппу: пролин.
Для биологического функционирования аминокислот в составе белков определяющим является полярность радикала R. По этому признаку аминокислоты разделяют на следующие основные группы (таблица 3.7.3).
Таблица 3.7.3 – Важнейшие аминокислоты
Формула |
Название |
Обозначение |
pI |
|
|
|
|
Аминокислоты, содержащие неполярный радикал R |
|
||
|
|
|
|
|
Глицин |
Gly |
5,97 |
|
|
|
|
|
Аланин |
Ala |
6,0 |
|
|
|
|
|
Валин |
Val |
5,96 |
|
|
|
|
|
Лейцин |
Leu |
5,98 |
|
|
|
|
|
Изолейцин |
Ile |
6,02 |
|
|
|
|
|
Фенилаланин |
Phe |
5,48 |
|
|
|
|

610
|
|
|
|
|
|
|
|
Триптофан |
Trp |
|
5,89 |
|
|
|
|
|
|
|
|
Пролин |
Pro |
|
6,30 |
|
|
|
|
|
|
|
|
Метионин |
Met |
|
5,74 |
|
|
|
|
|
|
|
|
Цистин |
(Cys)2 |
|
5,0 |
|
|
|
|
|
|
Аминокислоты, содержащие полярный неионогенный радикал R |
|
||||
|
|
|
|
|
|
|
|
Серин |
Ser |
|
5,68 |
|
|
|
|
|
|
|
|
Треонин |
|
|
5,60 |
|
|
|
|
|
|
|
|
Гидроксипролин |
Hyp |
|
5,8 |
|
|
|
|
|
|
|
|
Аспаргин |
Asn |
|
5,41 |
|
|
|
|
|
|
|
|
Глутамин |
Gln |
|
5,65 |
|
|
|
|
||
Аминокислоты, содержащие полярный положительно заряженный радикал R |
|||||
|
|
|
|
|
|
|
|
Лизин |
Lys |
|
9,74 |
|
|
|
|
|
|

611
|
5-Гидроксилизин |
|
9,15 |
|
|
|
|
|
Аргинин |
Arg |
10,76 |
|
|
|
|
|
Гистидин |
His |
7,59 |
|
|
|
|
Аминокислоты, содержащие полярный отрицательно заряженный радикал R |
|||
|
|
|
|
|
Аспаргиновая |
Asp |
2,77 |
|
кислота |
||
|
|
|
|
|
|
|
|
|
Глутаминовая |
Gly |
3,22 |
|
кислота |
|
|
|
|
|
|
|
|
|
|
|
Тирозин |
Tyr |
5,66 |
|
|
|
|
|
Цистеин |
Cys |
5,07 |
|
|
|
|
Аминокислоты, содержащие неполярный радикал R. Такие группы
располагаются внутри молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный неионогенный радикал R.
Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не способные к ионизации в водной среде (спиртовый гидроксил, амидная группа). Такие группы могут располагаться как внутри, так и на поверхности молекулы белка. Они участвуют в образовании водородных связей с другими полярными группами.
Аминокислоты, содержащие радикал R, способный к ионизации в водной среде с образованием положительно или отрицательно заряженных групп. Такие аминокислоты содержат в боковом радикале дополнительный основный или кислотный центр, который в водном растворе может соответственно присоединять или отдавать протон.

612
В белках ионогенные группы этих аминокислот располагаются, как правило, на поверхности молекулы и обуславливают электростатические взаимодействия.
Моноаминокарбоновые кислоты по взаимному расположению амино- и карбоксильной групп делятся на α, β, γ, δ,…- аминокислоты.
Стереохимия аминокислот
Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Будучи растворенными в воде (или в НСl), они способны вращать плоскость поляризованного луча (исключение составляет глицин). Это свойство связано с наличием в молекуле всех природных аминокислот (за исключением глицина) в α-положении асимметрического атома углерода (т. е. атома углерода, все четыре валентные связи которого заняты различными заместителями).
Величины удельного вращения вправо или влево являются количественной характеристикой оптической активности, и для большинства аминокислот составляет от 10 до 30°. Примерно половина аминокислот белков оказалась правовращающей, их обозначают знаком «+» (Ала, Иле, Глу, Лиз и др.), а чуть меньше половины – левовращающей (Фен, Трп, Лей и др.), их обозначают знаком «–». Все эти аминокислоты принадлежат к L- ряду, а величина и знак оптического вращения зависят от природы радикалов аминокислот и значения рН раствора, в котором измеряют оптическое вращение.
Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Ниже представлены L- и D-стереоизомеры глицеринового альдегида. Рядом показаны пространственные конфигурации L- и D-аланина:

613
Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду.
Среди белковых аминокислот имеются две аминокислоты (треонин и изолейцин), которые содержат по два асимметрических атома углерода. Следовательно, если не в природе, то, во всяком случае, в лаборатории возможно получить четыре стереоизомерные формы этих аминокислот (при чисто химическом, но не ферментативном синтезе аминокислот в лаборатории обычно образуется оптически неактивная смесь L- и D- изомеров, обозначаемых как DL-аминокислоты, или рацематы). Для треонина известны все четыре изомера. Если условно обозначить символом L выделенный из природных белков треонин, то его зеркальное отображение называют D-треонином.
Два других изомера, получивших наименование диастереоизомеров, или аллоформ, также могут иметь L- и D-формы. Структурные конфигурации всех четырех стереоизомеров треонина можно представить следующими формулами:
Свойства аминокислот
Аминокислоты, имея кислотную (карбоксильную) и основную (аминную) группу, являются амфотерными соединениями.
Значение рН, при котором аминокислота является электрически нейтральной (существует только в виде цвиттер-ионов), называется
изоэлектрической точкой, рI.
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
