
- •Силикаты – это соли кремниевых кислот. Они твердые тугоплавкие вещества, не имеющие окраски.
- •Общие химические свойства металлов
- •2. Реакции металлов с кислотами:
- •3. Взаимодействие металлов с водой:
- •4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- •Область применения
- •В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е. атому углерода, связанному с наибольшим числом атомов водорода).
- •Реакции окисления алкенов
- •4. Окисление в присутствии солей палладия:
- •Классификация, номенклатура, изомерия
- •1. Кумулированные:
- •Номенклатура
- •2. Международная
- •В присутствии солей меди (I) и кислоты ацетилен легко димеризуется и далее тримеризуется:
- •Образование дисульфидов и их роль в биохимических процессах
- •Жиры
- •СЛОЖНЫЕ ЛИПИДЫ
- •1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
- •2. Взаимодействие с основаниями и кислотами
- •5. Качественные реакции!
- •5.1.1 Основный понятия и постулаты термодинамики
- •Исходные постулаты (положения) термодинамики. Пусть дан изолированный сосуд (рисунок 5.1.2), который разделен полупроницаемой перегородкой. В первой части сосуда температура Т1, во второй – температура Т2; Т1 > Т2.
- •5.1.2 Первый закон термодинамики, его формулировки
- •5.1.3 Термохимия
- •5.2.1 Второй закон термодинамики
- •5.2.2 Фундаментальные уравнения термодинамики
- •5.4.1 Предмет химической кинетики.
- •5.4.2 Основные понятия химической кинетики.
- •5.4.3 Кинетический закон действия масс – основной постулат химической кинетики.
- •5.4.4 Кинетические особенности протекания простых реакций.
- •5.4.5 Методы определения порядка реакции и константы скорости по экспериментальным данным.
- •5.4.6 Кинетические особенности протекания сложных реакций.
- •5.4.7 Зависимость скорости реакции от температуры.
- •5.4.8 Кинетика цепных реакций.
- •5.4.9 Кинетика фотохимических реакций.
- •5.4.10 Основы кинетики гетерогенных процессов.
- •5.4.11 Катализ.
- •5.4.1 Предмет химической кинетики
- •Химическая кинетика решает следующие задачи, перечисленные в порядке сложности их решения:
- •5.4.2 Основные понятия химической кинетики
- •АНАЛИЗ СМЕСИ АНИОНОВ
- •МЕТОДЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА
- •Титриметрические методы анализа
- •Кислотно-основное титрование
- •Окислительно-восстановительное титрование
- •Перманганатометрия. Стандартизация рабочего раствора перманганата калия
- •Комплексонометрическое титрование
- •Определение общей жесткости воды
- •1. Предмет аналитической химии.
- •2. Краткая история развития аналитической химии.
- •3. Методы аналитической химии.
- •4. Основные стадии химического анализа.
- •5. Статистическая обработка результатов измерений.
- •6. Отбор проб.
- •7. Потери и загрязнения при отборе пробы. Хранение пробы.
- •8. Подготовка пробы к анализу.
- •9. Аналитическая реакция и её характеристики.
- •10. Дробный и систематический анализ.
- •37. Сущность гравиметрического анализа.
- •38. Типы гравиметрических определений.
- •39. Теория осаждения.
- •40. Операции гравиметрического анализа.
- •41. Расчеты в гравиметрическом анализе.

УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ ПОЛЕССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Н.А. Глинская, И.А. Ильючик
ХИМИЯ
для специальностей
6-05-0511-01 Биология,
6-05-0511-02 Биохимия,
6-05-0511-06 Биотехнология, 6-05-0821-02 Ландшафтное проектирование и строительство, 6-05-0831-01 Водные биоресурсы и аквакультура, 1-31 01 01 Биология (по направлениям)
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА ТЕОРЕТИЧЕСКИЙ РАЗДЕЛ
-конспект лекций ПРАКТИЧЕСКИЙ РАЗДЕЛ
-примерный перечень тем лабораторных и практических занятий КОНТРОЛЬНО–ДИАГНОСТИЧЕСКИЙ РАЗДЕЛ
-примерный перечень вопросов контрольных точек
-примерный перечень тем рефератов ВСПОМОГАТЕЛЬНЫЙ РАЗДЕЛ
-список рекомендуемой литературы
-примерный перечень вопросов для подготовки к экзаменам и зачетам
Пинск
ПолесГУ
2023

2
РЕЦЕНЗЕНТЫ
Г.Н. Хованская, заместитель директора по научной работе ГП «Институт биохимии биологически активных соединений НАН Беларуси», кандидат медицинских наук, доцент
Н.С. Ступень, доцент кафедры зоологии, генетики и химии УО «Брестский государственный университет им. А.С. Пушкина», кандидат технических наук, доцент
Рассмотрено и утверждено на заседании научно-методического совета _29.12.2023 г., протокол №_2_
СОГЛАСОВАНО |
СОГЛАСОВАНО |
|
Заведующий кафедрой |
Декан биотехнологического |
|
биохимии и биоинформатики |
факультета |
|
___________Н.А. Глинская |
________ |
В.Т. Чещевик |
___________2023 г. |
___________2023 г. |
|
Зарегистрировано в центре цифрового развития регистрационное свидетельство №_____ от ____________20___ г.
3
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Электронный учебно–методический комплекс (ЭУМК) предназначен для подготовки студентов дневной и заочной форм обучения. Он является нормативным документом, которым определяются содержание обучения и устанавливаются требования к объему и уровню подготовки студентов по специальностям 6-05-0511-01 Биология, 6-05-0511-02 Биохимия, 6-05-0511- 06 Биотехнология, 6-05-0821-02 Ландшафтное проектирование и строительство, 6-05-0831-01 Водные биоресурсы и аквакультура и 1-31 01 01 Биология (по направлениям).
Целью учебной дисциплины «Химия» является изучение основополагающих разделов общей и неорганической, органической, аналитической, физической и коллоидной химии, формирующих фундаментальную и практическую подготовку по химии.
Задачи учебной дисциплины:
-Знакомство с внутренней логикой химической науки, изучение сведений об основных законах и закономерностях химии, строении вещества и природы химической связи, а также о закономерностях протекания различных химических процессов;
-Изучение особенностей строения, химических свойств, важнейших методов получения и идентификации основных классов органических соединений;
-Формирование представлений о связи строения органических молекул с их реакционной способностью, о механизмах органических реакций, о взаимосвязи различных классов органических соединений и их взаимопревращений;
-Получение системных знаний о строении, свойствах индивидуальных веществ и их смесей, их реакционной способности, методах разделения и концентрирования, физико-химических закономерностях протекания химических и фазовых превращений, особенностях и свойствах дисперсно-коллоидных систем, а также поверхностных явлениях на границах раздела фаз.
-Обучение будущего специалиста практическим навыкам и умениям
вобласти общей и неорганической, аналитической, физической и коллоидной химии, которые позволят решать конкретные теоретические и практические задачи в предметной отрасли.
Данный электронный учебно-методический комплекс позволяет эффективно организовать управляемую самостоятельную работу студентов, а также обеспечить индивидуальный подход в обучении, повысить результативность образовательного процесса, совершенствовать контроль и самоконтроль.
Он раскрывает требования к содержанию изучаемой дисциплины, образовательным результатам, средствам их достижения и оценки, объединяет в единое целое различные дидактические средства и подчиняет
4
их целям обучения и воспитания.
Формы текущего контроля: устный и письменный опрос, тестирование, написание и защита рефератов, выполнение контрольных работ, защита отчетов по лабораторным работам и др.
Форма промежуточной аттестации – зачеты и экзамены.
Ксдаче зачета допускаются студенты, успешно выполнившие программу по дисциплинам «Аналитическая и физическая химия», «Аналитическая и коллоидная химия», «Химия», «Общая и аналитическая химия».
Ксдаче экзамена допускаются студенты, успешно выполнившие программу по дисциплинам «Общая и аналитическая химия», «Неорганическая химия», «Органическая химия» и «Химия».
Контроль усвоения знаний: оценка учебных достижений студентов осуществляется по 10-балльной шкале, утвержденной Министерством образования Республики Беларусь, в соответствии с критериями оценки результатов учебной деятельности обучающихся в учреждениях высшего образования.
5
ТЕОРЕТИЧЕСКИЙ РАЗДЕЛ
|
|
|
ПЛАН ЛЕКЦИЙ |
|
|
|
|
|
|
|
|
|
Стр. |
РАЗДЕЛ 1 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОБЩЕЙ ХИМИИ |
8 |
|||||
1.1 |
Введение |
|
|
|
8 |
|
1.2 |
Основные понятия и законы химии |
|
15 |
|||
1.3 |
Строение атома |
|
|
|
32 |
|
1.4 |
Периодический закон и периодическая система элементов |
42 |
||||
1.5 |
Химическая связь и строение вещества |
|
50 |
|||
1.6 |
Химические реакции |
|
|
75 |
||
1.7 |
Растворы |
|
|
|
81 |
|
1.8 |
Окислительно-восстановительные процессы |
|
118 |
|||
1.9 |
Комплексные соединения |
|
|
129 |
||
РАЗДЕЛ 2 ХИМИЯ ПРОСТЫХ ВЕЩЕСТВ И СОЕДИНЕНИЙ |
138 |
|||||
ЭЛЕМЕНТОВ |
|
|
|
|
||
2.1 |
Водород и элементы группы VІІ А |
|
143 |
|||
2.2 |
Элементы VI A группы (халькогены) |
|
156 |
|||
2.3 |
Элементы группы V A |
|
|
176 |
||
2.4 |
Элементы группы IVA |
|
|
196 |
||
2.5 |
Общий обзор металлов |
|
|
209 |
||
2.6 |
Металлы А – групп |
|
|
218 |
||
2.7 |
Переходные элементы (металлы В – групп) |
|
243 |
|||
РАЗДЕЛ 3 ОРГАНИЧЕСКАЯ ХИМИЯ |
|
|
279 |
|||
3.1 |
Предмет органической химии |
|
|
279 |
||
3.2 |
Классификация, |
номенклатура, |
изомерия |
органических |
|
|
соединений |
|
|
|
286 |
||
|
|
|
|
|||
3.3 |
Электронное |
строение и |
реакционная |
способность |
|
|
органических соединений |
|
|
309 |
|||
|
|
|
||||
3.4 |
Методы выделения, очистки и идентификации органических |
|
||||
соединений |
|
|
|
335 |
||
|
|
|
|
|||
3.5 |
Углеводороды |
|
|
|
341 |
|
3.5.1 |
Алканы |
|
|
|
341 |
|
3.5.2 |
Циклоалканы |
|
|
|
357 |
|
3.5.3 |
Алкены |
|
|
|
364 |
|
3.5.4 |
Алкадиены |
|
|
|
383 |
|
3.5.5 |
Алкины |
|
|
|
392 |
|
3.5.6 |
Ароматические углеводороды |
|
|
399 |
||
3.6 |
Гомофункциональные соединения |
|
425 |
|||
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
3.6.1 Галогенпроизводные углеводородов |
|
|
|
425 |
|||||||||
3.6.2 Спирты, фенолы, простые эфиры |
|
|
|
|
442 |
||||||||
3.6.3 Тиолы |
|
|
|
|
|
|
|
|
|
479 |
|||
3.6.4 Амины |
|
|
|
|
|
|
|
|
|
484 |
|||
3.6.5 Карбонильные соединения |
|
|
|
|
|
500 |
|||||||
3.6.6 Карбоновые кислоты и их производные |
|
|
515 |
||||||||||
3.7 |
Гетерофункциональные органические соединения |
|
|
570 |
|||||||||
3.7.1 |
Углеводы |
|
|
|
|
|
|
|
|
570 |
|||
3.7.2 |
Гидроксикарбоновые кислоты |
|
|
|
|
604 |
|||||||
3.7.3 |
Аминокислоты |
|
|
|
|
|
|
|
608 |
||||
3.8 |
Гетероциклические соединения |
|
|
|
|
622 |
|||||||
РАЗДЕЛ 4 АНАЛИТИЧЕСКАЯ ХИМИЯ |
|
|
|
|
646 |
||||||||
4.1 |
Введение. Метрологические основы химического анализа |
646 |
|||||||||||
4.2 |
Методы пробоотбора и пробоподготовки основных объектов |
661 |
|||||||||||
анализа |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
4.3 |
Методы обнаружения и идентификации |
|
|
|
673 |
||||||||
4.4 |
Реакции и процессы, используемые в аналитической химии |
686 |
|||||||||||
4.4.1 |
|
Кислотно-основное равновесие |
|
|
|
|
686 |
||||||
4.4.2 |
|
Равновесие |
в |
растворах |
с |
участием |
|
реакций |
|
||||
|
комплексообразования |
|
|
|
|
|
701 |
||||||
|
|
|
|
|
|
|
|||||||
4.4.3 |
|
Равновесие в |
растворах с |
участием |
реакций |
окисления- |
|
||||||
|
восстановления |
|
|
|
|
|
|
|
706 |
||||
|
|
|
|
|
|
|
|
|
|||||
4.4.4 |
|
Равновесие осадок-раствор |
|
|
|
|
|
709 |
|||||
4.5 |
Методы разделения и концентрирования |
|
|
|
716 |
||||||||
4.6 |
Методы количественного анализа |
|
|
|
|
733 |
|||||||
4.6.1 |
|
Гравиметрические методы анализа |
|
|
|
733 |
|||||||
4.6.2 |
|
Титриметрические методы анализа |
|
|
|
744 |
|||||||
4.7 |
Физико-химические методы анализа |
|
|
|
764 |
||||||||
4.7.1 |
|
Электрохимические методы анализа |
|
|
|
767 |
|||||||
4.7.2 |
|
Оптические методы анализа |
|
|
|
|
|
792 |
|||||
4.7.3 |
|
Хроматография |
|
|
|
|
|
|
|
834 |
|||
РАЗДЕЛ 5 ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ |
|
843 |
|||||||||||
5.1 |
Основные |
понятия |
и |
постулаты |
термодинамики. |
Первый |
|
||||||
закон термодинамики. Термохимия |
|
|
|
|
843 |
||||||||
|
|
|
|
|
|||||||||
5.2 |
Второй |
закон |
термодинамики |
и |
его приложения. |
|
|||||||
Фундаментальные уравнения термодинамики |
|
|
864 |
||||||||||
|
|
|
|||||||||||
5.3 |
Термодинамика |
растворов |
и |
гетерогенных |
систем. |
|
|||||||
Химические равновесия |
|
|
|
|
|
|
887 |
||||||
|
|
|
|
|
|
|
|||||||
5.4 |
Основные |
понятия |
и |
постулаты химической |
кинетики. |
|
|||||||
Кинетические |
закономерности |
протекания |
химических |
900 |
|||||||||
|
|||||||||||||
7
реакций различных типов. Катализ Предмет и задачи электрохимии. Теория растворов
5.5электролитов. Неравновесные явления в растворах 929 электролитов. Электродные равновесия Общая характеристика и классификация дисперсных систем.
5.6Поверхностные явления. Адсорбция на границе раздела фаз. 981 Получение дисперсных систем и из свойства
5.7 Высокомолекулярные соединения и их растворы |
1029 |
8
КОНСПЕКТ ЛЕКЦИЙ
РАЗДЕЛ 1 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОБЩЕЙ ХИМИИ
1.1 ВВЕДЕНИЕ
ПЛАН
1.1.1Предмет и задачи общей и неорганической химии. Химии в системе естественных наук.
1.1.2Связь химии с другими естественными науками.
1.1.3Значение химии для биологии, экологии и охраны окружающей
среды.
1.1.1 Предмет и задачи общей и неорганической химии. Химии в системе естественных наук
Простейшим носителем химической формы движения материи является атом (в том числе и ионизированный). Атом – система, состоящая из ядра и движущихся в поле ядра электронов. При химическом взаимодействии атомов образуются молекулы (а также радикалы, ионы). Молекула представляет систему, состоящую из нескольких ядер, в общем поле которых движутся электроны. Следовательно, молекула – наименьшая частица вещества, образованная за счет ковалентных связей и определяющая его химические свойства. При химическом взаимодействии одни конфигурации ядер и электронов (т. е. одни молекулы) превращаются в другие конфигурации ядер и электронов (другие молекулы). В химических превращениях обычно участвуют не отдельные частицы, а их множества – вещества. Химические превращения (реакции) сопровождаются энергетическими эффектами, величины которых обычно лежат в интервале 10–103 кДж/моль; температуры, при которых эти превращения осуществляются, составляют 10–4000 К. Итак, химия – это наука о химической форме движения материи. Ее можно также определить, как науку о превращениях веществ, сопровождающихся перераспределением химических связей между атомами, входящими в состав химических частиц (молекул, ионов, радикалов и др.), и свободными атомами. Краткое определение химии – это наука о веществах, их свойствах и превращениях. Чтобы полнее охарактеризовать положение химии в системе естественных наук, нужно определить то, что всегда для нее являлось «единым, общим, неизменным». Главной задачей химии во все времена было получение веществ с заданными свойствами. Осуществление превращений одних веществ в другие требует знания законов, по которым происходят такие превращения, т. е. химия должна решать теоретическую задачу генезиса свойств веществ. Кроме того, как никакая другая наука, химия является по сути производительной силой общества. Таким образом, химия решает

9
двуединую задачу – получение веществ с заданными свойствами (на это направлена производственная деятельность человека) и выявление способов управления свойствами вещества (на реализацию этого направлена познавательная, теоретическая деятельность человека).
Все многочисленные разделы химии (неорганическая, органическая, аналитическая, физхимия и др.) так или иначе решают эту задачу, образуя единое древо химической науки. Вся история химии является закономерным процессом смены способов решения ее двуединой задачи, что определяется изменениями уровня материального и духовного развития общества. Получение лекарств, красителей, керамики и многих тысяч других веществ и материалов в настоящее время осуществляется совсем не так, как сто-двести лет назад, а, тем более, в древности. Со сменой исторических периодов менялся и господствующий метод интерпретации химических процессов.
Современная химия – это, прежде всего, совокупность квантовых представлений о веществе и его преобразовании. Говоря о месте химии в системе естественных наук, следует отметить, что в природе существует иерархия в организации материи и соответствующих форм ее движения (в порядке их усложнения): элементарные частицы → атом → молекула → макромолекула → надмолекулярные комплексы → органеллы клетки → живая клетка.
В наших знаниях эта иерархия отражена в соответствующих науках таким образом, что более сложные явления и процессы описываются на основе более простых: физика → химия → биология.
1.1.2 Связь химии с другими естественными науками
Химия – одна из отраслей естествознания, она тесно связана как с другими науками, так и со всеми отраслями народного хозяйства (рисунок
1.1).
Рисунок 1.1 – Связь химии с другими науками
10
Превращения одних веществ в другие сопровождаются различными физическими явлениями, например, выделением или поглощением теплоты. Поэтому химикам необходимо знать физику.
Основой существования живой природы является обмен веществ. Ученый-биолог, не сведущий в законах химии, не сможет понять и объяснить этот процесс.
Химические знания необходимы и геологу. Используя их, он успешно будет проводить поиск полезных ископаемых. Врач, фармацевт, косметолог, металлург, кулинар, не имея соответствующей химической подготовки, не достигнут вершин мастерства.
Химия является точной наукой. Перед тем как осуществить химический эксперимен и после его завершения, ученый-химик проводит необходимые расчеты. Их результаты дают возможность сделать правильные выводы. Поэтому деятельность химика невозможна без знания математики.
Соприкосновение химии с другими науками порождает специфические области взаимного их проникновения. Так, области перехода между химией
ифизикой представлены физической химией и химической физикой. Между химией и биологией, химией и геологией возникли особые пограничные области – геохимия, биохимия, биогеохимия, молекулярная биология. Важнейшие законы химии формулируются на математическом языке, и теоретическая химия не может развиваться без математики. Химия оказывала
иоказывает влияние на развитие философии, и сама испытывала и испытывает её влияние.
Окружающая среда все больше загрязняется из-за внесения чрезмерного количества удобрений в почву, выделения выхлопных газов автомобилей в воздух, вредных веществ различных производств в водоемы, а также бытовыми отходами. Все это приводит к уничтожению растений, гибели животных, ухудшению здоровья людей. Серьезную угрозу для всего живого представляет химическое оружие – особые, чрезвычайно ядовитые вещества. Уничтожение запасов такого оружия требует немалых усилий, средств и времени.
Взаимосвязь человека и природы изучает молодая естественная наука экология. В поле зрения ученых-экологов постоянно находятся проблемы защиты окружающей среды от загрязнений. Сохранение природы для будущих поколений зависит от бережного отношения к ней каждого из нас, от уровня нашей культуры, химических знаний.
1.1.3Значение химии для биологии, экологии и охраны окружающей
среды
Взаимосвязи химии с биологией способствовало становление органической химии. Развитие науки дало возможность детально исследовать строение и состав живой клетки, химические процессы в живых организмах, позволило выявить взаимосвязь между биологическими функциями организма и химическими реакциями.
11
Такие свойства живого, как рост, размножение, подвижность, способность реагировать на изменения внешней среды, связаны с определенными комплексами химических превращений в клетках.
Значение химии в биологических исследованиях чрезвычайно велико. Именно благодаря химии была раскрыта роль хлорофилла как химической основы фотосинтеза, гемоглобина как основы процесса дыхания. Была выяснена химическая природа передачи нервного возбуждения, определена структура нуклеиновых кислот и др. Оказалось, что все функции и процессы, происходящие в живом организме, можно изложить языком химии в виде конкретных химических реакций.
На границе биологии, химии и физики возникли следующие науки: биохимия – наука об обмене веществ и химических процессах в живых организмах; биоорганическая химия – наука о строении, функциях и способах синтеза соединений, из которых состоят живые организмы; физикохимическая биология – наука о функционировании сложных систем передачи информации и регулировании биологических процессов на молекулярном уровне, а еще биофизика, биофизическая химия и радиационная биология.
Все естественные науки изучают природу, но каждая, со своей стороны. Только объединение всех знаний воедино создает целостную картину мира.
Одной из глобальных проблем современной цивилизации является проблема охраны окружающей среды, в том числе минимизация воздействия химических веществ и материалов на биосферу нашей планеты.
Биосфера – это область жизни на Земле. В состав биосферы входят атмосфера, литосфера (часть земной коры и почва), гидросфера (океаны, моря, реки, озера), флора и фауна.
Биосфера, в которой существует жизнь на нашей планете, складывается из ряда экологических систем. До конца XVII в. между деятельностью человека и природой существовало равновесие. Вырубка лесов, распахивание почв, выброс различных веществ в атмосферу компенсировались природой. Но в последующий период истории производственная деятельность человека привела к нарушению сложившегося экологического равновесия. Загрязнение окружающей среды связано прежде всего с отравлением воды, воздуха, почвы, которое непосредственно влияет на здоровье и самочувствие людей.
Химическая промышленность выпускает огромное количество химических веществ и материалов, среди которых пластмассы и минеральные удобрения, синтетические волокна и каучуки, строительные материалы, лаки и краски, моющие средства и лекарства, пищевые добавки, кислоты, щёлочи, соли и др. Технологии их производства никогда не были безотходными и в большинстве своем остаются таковыми и сегодня.
Вредные отходы химических производств выбрасываются в атмосферу, поступают в канализацию, а из нее – в природные водоемы. В результате этого в окружающую среду постоянно и, к сожалению, в очень больших
12
количествах попадают вредные вещества. Это приводит к нарушению естественного баланса веществ на нашей планете и снижает способность природы к саморегуляции. Процессы самоочищения в окружающей среде происходят очень медленно в силу того, что чуждые природе, не встречающиеся в ней ранее химические соединения с трудом включаются в естественные круговороты и пищевые цепи. Бактерии и грибы, солнечный свет и кислород атмосферы попросту не справляются с разложением молекул загрязнителей на более простые и менее вредные соединения. Это уже явилось причиной нежелательных изменений в атмосфере, гидросфере и литосфере Земли, которые негативно сказались на состоянии растительного и животного мира, на здоровье человека.
Загрязнение воды приводит к повышению концентрации биогенных элементов (азота, серы, фосфора, калия и др.). Это в свою очередь вызывает бурное развитие водорослей, водоемы превращаются в болота. Загрязнение воды соединениями металлов (свинца, ртути, кадмия, селена и др.) при превышении их ПДК (предельно допустимых концентраций) вызывает серьезные нарушения здоровья людей. Загрязнение органическими веществами промышленного и природного происхождения приводит к уменьшению количества растворенного в воде кислорода, водоемы теряют способность к самоочищению, вода приобретает гнилостный запах, гибнут рыба и другие обитатели водоемов.
Воздействие на атмосферу продуктов сжигания топлива из-за содержания в них оксидов углерода, азота и серы приводит к снижению качества воздуха и вызывает кислотные дожди. Из-за переноса воздушных масс на большие расстояния кислотные дожди могут выпадать за сотни километров от источника загрязнения. Они губительно действуют на строительные сооружения, памятники архитектуры. Выбросы углекислого газа и химических веществ, снижающих содержание озона в верхних слоях атмосферы, могут привести к изменению климата или образованию озоновых дыр. Загрязнение атмосферы может быть связано также с попаданием в нее твердых частиц (цементной пыли, пыли горно-металлургических предприятий и т. д.). Накопление в атмосфере пыли, задерживающей солнечные лучи, способно привести к понижению температуры на Земле.
Загрязнение атмосферы выбросами промышленных предприятий, двигателей внутреннего сгорания и продуктами сгорания твердого топлива в условиях высокой влажности могут приводить к образованию смога в больших городах. Известно много экологических катастроф, связанных с образования смога, которые привели к массовой заболеваемости и гибели людей.
Загрязнение почвы возможно не только в случае попадания в нее отходов химических производств или солей тяжелых металлов, но и при неграмотном применении минеральных удобрений и ядохимикатов. Загрязняющие вещества из почвы по пищевым цепочкам способны попадать в организм человека, концентрироваться в нем и приводить к отравлению.

13
Наконец возможно потенциальное заражение воздуха, воды и почвы радиоактивными отходами, образующимися при производстве ядерного оружия и атомной энергии. Особое внимание к таким загрязнителям связано с ликвидацией последствий аварий на Чернобыльской АЭС в апреле 1986 г. и на АЭС Фукусима-1 в Японии в 2011 г.
Главная причина загрязнения окружающей среды – безграмотное применение и использование различных процессов, химических веществ и материалов. Поэтому изучение химических и экологических свойств веществ позволяет не только их рационально использовать, но и свести к минимуму отрицательные воздействия на окружающую среду.
Лучшим способом защиты окружающей среды является применение безотходных или малоотходных технологий. При безотходной технологии рационально используются все компоненты сырья и энергии. В малоотходном производстве вредное воздействие на среду не превышает допустимого уровня. Например, при промышленном синтезе оксида серы(VI) непрореагировавший, экологически опасный сернистый газ многократно возвращается в производство.
Примерно с середины 90-х гг. прошлого века в химической промышленности начало развиваться новое научное направление – так называемая Зеленая химия, что предполагает вдумчивый отбор исходных материалов и схем процессов, который полностью исключает использование вредных веществ, позволяет получать нужные вещества и материалы, не нанося вреда окружающей среде на всех стадиях производства.
На любом производстве необходимо стремиться к использованию безотходных технологий и предусматривать возможность переработки и утилизации промышленных отходов.
Методы очистки отходов можно разделить на физические, химические и биологические. К физическим методам относят фильтрацию, осаждение в специальных отстойниках, промывание, пыле- и газоулавливание и др. Химические методы очистки связаны с переводом отходов в нерастворимое или малорастворимое состояние с целью последующей нейтрализации, окисления или восстановления. Например, промышленные отходы хлороводорода можно нейтрализовать содой:
Большое значение имеет биологическая очистка сточных вод. После отстойников сточные воды помещают в специальные камеры, где через воду пропускают воздух. Это приводит к быстрому росту бактерий, которые питаются органическими примесями в воде. Бактерии образуют массу, называемую активным илом. Этот ил оседает в отстойниках. Степень очистки воды при использовании данного биохимического способа достигает
90 %.
14
Необходимо отметить, что отходы производства могут рассматриваться как источники вторичного сырья. Так, переработка отходов ОАО «Гомельский химический завод» позволит получать гипс, а твердые отходы использовать при строительстве дорог. Металл в виде вторичного сырья используется уже довольно широко: примерно половина мирового производства связана с его переработкой.
Очень актуальным в последнее время является решение проблемы защиты окружающей среды от бытового мусора – так называемых твердых бытовых отходов (ТБО). В Беларуси ежегодно скапливается около 3 млн т таких отходов. Их количество, приходящееся на одного жителя страны, составляет примерно 2,5 т в год. Как показывает практика, одним из эффективных способов решения данной проблемы является раздельный сбор бытового мусора. Он позволяет использовать значительную часть ТБО (битое стекло, пластиковые бутылки, бумагу) для вторичной переработки, значительно упрощает и удешевляет утилизацию других бытовых отходов.
Загрязнение окружающей среды – это прежде всего отравление воды, воздуха, почвы, непосредственно влияющее на здоровье и самочувствие человека.
Главная проблема загрязнения окружающей среды связана с безграмотным использованием химических веществ.
Наилучшим способом защиты окружающей среды является применение безотходных или малоотходных технологий, комплексная переработка отходов.
Существуют физические, химические и биологические методы очистки отходов.
15
1.2 ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
ПЛАН
1.2.1Основные понятия химии
1.2.2Основные стехиометрические законы
1.2.3Газовые законы
1.2.4Важнейшие классы и номенклатура неорганических веществ.
1.2.1 Основные понятия химии
Атомно-молекулярное учение заключается в следующем:
1.Все вещества состоят из молекул.
2.Молекулы состоят из атомов.
3.Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Рассмотрим следующие определения:
Вещество – вид материи, которая обладает массой покоя. Состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др. Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы. Такие вещества принято подразделять на простые и сложные. Простые вещества образованы атомами одного хим. элемента и потому являются формой его существования в свободном состоянии, напр. Сера, железо, озон, алмаз. Сложные вещества образованы разными элементами и могут иметь состав постоянный (стехиометрические соединения или дальтониды) или меняющийся в некоторых пределах (нестехиометрические соединения или бертоллиды).
Молекула – наименьшая частица вещества, обладающая его химическими свойствами.
Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы, обозначаемые символом данного элемента (Ag, Fe, Mg).
Химический элемент – это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно 118 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Ионы (от греч. ion – идущий), одноатомные или многоатомные частицы, несущие электрический заряд. Положительные ионы называют
16
катионами (от греч. kation, буквально – идущий вниз), отрицательные – анионами (от греч. anion, буквально идущий вверх). В свободном состоянии существуют в газовой фазе (в плазме).
Валентность (от лат. valentia – сила), способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи. Количественной мерой валентности атома элемента Э служит число атомов водорода или кислорода (эти элементы принято считать соответственно одно- и двухвалентными), которые Э присоединяет, образуя гидрид ЭНх или оксид ЭnОm. Валентность элемента может быть определена и по другим атомам с известной валентностью. В рамках электронной теории химической связи валентность атома определяется числом его неспаренных электронов в основном или возбужденном состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Реакции химические (от лат. re- – приставка, означающая обратное действие, и actio – действие), превращения одних веществ (исходных соединений) в другие (продукты реакции) при неизменяемости ядер атомов. Исходные вещества иногда называют реагентами, однако чаще (особенно в органической химии) термин "реагент" используют по отношению к одному, наиболее активному исходному соединению, определяющему направление химической реакции.
Атомное ядро – центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра – положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы – химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Химическая формула – это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс – цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле). Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Простые вещества – молекулы, состоят из атомов одного и того же элемента.
Cложные вещества – молекулы, состоят из атомов различных химических элементов.
Аллотропия – явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам.
Международная единица атомных масс равна 1/12 массы изотопа 12C –
основного изотопа природного углерода. |
|
1 а.е.м = 1 /12 • m (12C) = 1,66057 • 10-27 кг |
(1.2.1) |
17
Относительная атомная масса (Ar) – безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C. Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м.
Ar(Mg) = 24,312
m(Mg) = 24,312 • 1,66057 • 10-24 = 4,037 • 10-23 г
Относительная молекулярная масса (Mr) – безразмерная величина,
показывающая, во сколько раз масса молекулы данного вещества больше 1 12 массы атома углерода 12C.
Mr = mr / (1/12 mа(12C)) |
(1.2.2) |
mr – масса молекулы данного вещества; mа(12C) – масса атома углерода 12C.
Mr = ΣAr(Э) |
(1.2.3) |
Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов. Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения – моль.
Количество вещества, моль означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается ν, измеряется в моль.
Моль – количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Число Авогадро ди Кваренья (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 • 1023. (Постоянная Авогадро имеет размерность – моль-1).
Молярная масса показывает массу 1 моля вещества (обозначается M).
M = m / n |
(1.2.4) |
Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества и численно равна его относительной молекулярной массе, однако первая величина имеет размерность г/моль, а вторая – безразмерная.
M = NA • m(1 молекула) = NA • Mr • 1 а.е.м. = (NA • 1 а.е.м.) • Mr = Mr (1.2.5)
18
1.2.2 Основные стехиометрические законы
Химическая стехиометрия − учение о составе веществ и их изменении в ходе химических превращений (это слово образовано от греческих слов «стехион» − элемент и «метрон» − мера).
Законы стехиометрии обычно считают составными частями атомномолекулярного учения.
Закон сохранения массы и энергии: суммарные массы и энергии веществ, вступающие в реакцию, всегда равны суммарным массам и
энергиям продуктов реакции.
Например,
NaOH + HCl = NaCl + H2O, m1 m2 m3 m4,
где m1, m2 – массы исходных веществ, которые вступают в реакцию; m3, m4 – массы продуктов, которые образуются в результате реакции.
m1 + m2 = m3 + m4.
Закон постоянства состава: всякое чистое вещество, независимо от способов его получения, всегда имеет постоянный качественный и количественный состав.
В качестве примера рассмотрим состав воды: качественный ее составона состоит из кислорода и водорода, количественный состав – 88,89% и 11,11% соответственно.
Она имеет выше приведенный состав независимо от того, как она получена: синтезом из водорода и кислорода, реакцией нейтрализации или из кристаллогидратов.
Закон кратных отношений: если два элемента образуют между собой несколько соединений, то массы атома одного элемента, приходящиеся на одну и ту же массу атома другого элемента, относятся между собой как небольшие целые числа.
На примере оксидов серы:
Ar(S) = 32 |
Ar(O) = 16 |
1) SO2 |
m(S) : m(O) = 32 : 32 = 1 : 1 |
2) SO3 |
m(S) : m(O) = 32: 48 = 2 : 3 |
Закон эквивалентов. Одновременно с законом кратных отношений был сформулирован закон эквивалентов.
Эквивалент – это реальная или условная частица вещества, которая в данной кислотно-основной реакции эквивалентна одному катиону водорода или в ОВР одному электрону.
19
Фактор эквивалентности ƒэкв. (Х) или 1/Z число, равное той доле частицы Х, которая является эквивалентом вещества в данной реакции (ƒэкв
≤ 1).
ƒэкв рассчитывают на основании стехиометрических коэффициентов реакции.
Например:
(1) H2S + 2Na OH = Na2S +H2O |
ƒэкв (H2S) =1/2 |
В этом случае одному катиону H+ эквивалентна условная частица, равная 1/2 молекулы H2S (участвуют оба иона водорода каждой молекулы).
(2) H2S + Na OH = NaHS +H2O ƒэкв.(H2S) =1
Одному иону H+ эквивалентна реальная частица – молекула H2S (в молекуле H2S замещается только один катион водорода).
Количество моль-эквивалентов измеряется в молях, как любое количество вещества. Масса 1 моль эквивалента, молярная масса эквивалента, равна произведению фактора эквивалентности на молярную массу вещества
M(ƒэкв (х) х) = ƒэкв (х) ∙ М(х) |
(1.2.6) |
Так, молярная масса эквивалента иона алюминия:
М(1/3Аl+3) =1/3 ∙ 27 = 9 г/моль
Количество моль-эквивалентов можно определить по формуле:
m
nэкв = —— (1.2.7)
Mэкв
Молярная масса эквивалента и эквивалент элемента не являются постоянной величиной в соединении, а зависят от валентности или степени окисления элемента.
Например:
Мэкв(С) в С+2О= 12 ∙ 1/2 = 6 г/моль
Мэкв(С) в С+4О2= 12 ∙ 1/4 = 3 г/моль
Постоянными являются эквиваленты:
Мэкв(Н) = 1,008 г/моль Мэкв(О) = 8 г/моль,

20
Мэкв(Аl) = 9 г/моль, Мэкв(Са) = 20 г/моль.
Если не учитывать конкретную химическую реакцию, то фактор эквивалентности и молярная масса эквивалентов сложных веществ рассчитываются по формулам:
(1.2.8)
(1.2.9)
где: М – молярная масса вещества, В – валентность функциональной группы, N – число функциональных групп.
Для кислот функциональной группой является ион водорода, для оснований – ион гидроксила, для солей – ион металла и т.д.(H+, OH-, Kat +n, An-n)
Для определения эквивалентной массы сложного вещества в реакции следует разделить его полную массу (М) на сумму замещенных радикалов
(H+, OH-, Kat+n, Ann-).
1) для кислот: ƒэкв равен единице, деленной на основность кислоты, которая определяется числом ионов водорода:
1/Z = ƒэкв (HCl) = 1 1/Z = ƒэкв (H2SO4) = 1/2 1/Z = ƒэкв (H3PO4) = 1/3
Молярная масса эквивалента кислоты равна произведению фактора эквивалентности на молярную массу кислоты:
Мк
Мэкв (кислоты) = ƒэкв ∙ Мк = —
Nн+
где: Мк – молекулярная (формульная) масса кислоты,
Nн+ – число атомов водорода, способных замещаться на металл.
Например: Мэкв (H2SO4) = 1/2 ∙ 98 = 49 г/моль
Молярная масса эквивалента кислоты может быть рассчитана как сумма молярных масс эквивалентов водорода и кислотного остатка:
Мэкв (H2SO4) = Мэкв (Н+) + Мэкв (SO42-) = 1 + 48 = 49 г/моль
21
2) для оснований ƒэкв равен единице, деленной на кислотность, равную числу гидроксогрупп, вступающих в реакцию:
ƒэкв (NaOH) = 1/Z ( NaOH) = 1
ƒэкв (Ca(OH)2) = 1/Z (Ca(OH)2) = 1/2
Молярная масса эквивалента основания равна произведению фактора эквивалентности на молярную массу основания:
Мосн
Мэкв (основания) = ƒэкв ∙ Мосн = —— Nон-
где: Мосн – молекулярная масса основания, Nон- – число гидроксогрупп.
Пример: Мэкв (Cr(OH)3) = 1/3 ∙ 103 = 34,3 г/моль
Молярная масса эквивалента основания может быть рассчитана как сумма молярных масс эквивалентов металла и гидроксогруппы:
Мэкв (Cr(OH)3) = 52/3 + 17 = 34,3 г/моль
3) для солей: ƒэкв соли равен единице, деленной на произведение числа атомов металла в молекуле соли на степень окисления металла:
ƒэкв (Na2SO4) = 1/Z (Na2SO4) =1/2
ƒэкв Al2(SO4)3 = 1/2 ∙ 3
Молярная масса эквивалента соли равна произведению фактора эквивалентности на молярную массу соли:
Мэкв (соли) = ƒэкв (соли) ∙ Мс = Мс / NMe·с.о.(Me)
где: Мс – молекулярная масса соли, NМе – число атомов металла,
с.о.(Me) – степень окисления металла
3 4 2
Например: Мэкв Al2(SO4)3 = ——— = 57 г/моль
2 ∙ 3
Молярная масса эквивалента соли может быть рассчитана как сумма
22
молярных масс металла и кислотного остатка:
Мэкв Al2(SO4)3 = 27/3 + 48 = 57г/моль
4) для оксидов ƒэкв равен единице, деленной на произведение числа атомов кислорода на степень окисления кислорода:
ƒэкв (H2O) = 1/Z ( H2O) = ½
ƒэкв (SO2) = 1/Z (SO2) = 1/4 1
ƒэкв (Mn2O7) = —— 7∙ 2
Молярная масса эквивалента оксида равна произведению фактора эквивалентности на молярную массу оксида:
Мокс
Мэкв (оксида) = ƒэкв ∙ Мокс = ———
No ∙ с.о.(О)
где: Мокс – молекулярная масса оксида, Nо – число атомов кислорода
с.о.(О) – степень окисления кислорода в оксиде, которая равна всегда -
2.
Мокс
Мэкв (оксида) = ———
Nо ∙ 2
222
Пример: Мэкв (Mn2O7) = —— = 15,9 г/моль
7 ∙ 2
Молярная масса эквивалента оксида может быть рассчитана как сумма молярных масс эквивалентов элемента и кислорода:
Мэкв (Mn2O7) = 55/7 + 8 = 15,9 г/моль
В ОВР для определения ƒэкв необходимо единицу разделить на число отданных или присоединенных электронов.
Вещества вступают в реакцию в эквивалентных количествах:
2Н2 + О2 = 2Н2О
4экв 4экв 4экв

23
В 1792 г. немецким физиком Рихтером был сформулирован закон эквивалентов: массы реагирующих друг с другом веществ (m1, m2) пропорциональны молярным массам их эквивалентов (МЭ1, МЭ2):
Из математической записи закона эквивалентов следует, что количество моль - эквивалентов веществ в реакции равны между собой:
n экв1 = nэкв2
Для реакций с участием газов используют молярный объем эквивалента – это объем, занимаемый 1 моль - эквивалентом газа.
Так, Мэкв(Н) = 1г/моль, если моль газа 2г/моль занимают V=22,4 л, то 1 эквивалент – в два раза меньший объем, равный 11,2 л.
Vэкв (Н2) = 22,4 : 2 = 11,2 л.
Аналогично Мэкв(О)= 1/4М(О2) = 32 : 4 = 8г/моль, отсюда
Vэкв(О2) = 22,4 : 4 = 5,6 л.
Тогда математическая запись закона через эквивалентный объем:
1.2.3 Газовые законы
Закон объемных отношений: при постоянных давлении и температуре объемы реагирующих между собой газов, а также объемы газообразных продуктов реакции относятся как небольшие целые числа.
Например: 2СО + О2 → 2СО2
Отношение объемов равно:
V (CO) : V(O2) : V(CO2) = 2 : 1 : 2
Закона Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится равное число молекул.
Следствия из закона Авогадро:
1. При одинаковых условиях 1 моль любого газа занимает одинаковый объем.
24
При н.у. (т.е. Р =101325 Па и Т = 273,15 К) 1 моль различных газов занимает объем 22,4 л. Такой объем называется молярным объемом газа (Vm) и имеет размерность (л/моль) Vм = 22,4 л/моль, тогда количество вещества газа определяется по формуле:
nг = Vг / Vm |
(1.2.10) |
где, Vг – объем газа.
3. Отношение масс равных объемов различных газов равно отношению
их молярных масс: |
|
m1/m2 = M1/M2 = D2 |
(1.2.11) |
Это отношение называется относительной плотностью первого газа по второму (D2).
Откуда, М1 = D2 ∙ М2.
Например, плотность кислорода по водороду DН2= 32/2=16;
МО2 = 2 ∙ DН2=2 ∙ 16 = 32г/моль
При использовании плотности по воздуху Dвозд говорят о средней молярной массе воздуха (29 г/моль), так как воздух является смесью газов
(М1=29 ∙ Dвозд).
Объединенный газовый закон: для данной массы газа произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная:
P V / T = const или P0 V0 / T0 = P V / T. |
(1.2.12) |
Уравнение Менделеева – Клапейрона (уравнение состояния |
|
идеального газа): для 1 моля любого газа P0V0 / T0 |
величина одинакова и |
называется универсальной газовой постоянной R. Для n молей газа: |
|
Р V = n R T= (m / M) R T, |
(1.2.13) |
где m – масса газа; M – молярная масса; Р – давление;
V – объем;
T – абсолютная температура (К);
R – универсальная газовая постоянная (8,314 Дж /(моль∙К).

25
1.2.4 Важнейшие классы и номенклатура неорганических веществ
Исходя из состава молекул все вещества делятся на простые и сложные. Простые вещества состоят из одного элемента, в состав сложных входят два или более элементов. Простые вещества, в свою очередь делятся на металлы и неметаллы (металлоиды). Сложные вещества делят на органические и неорганические. Органическими принято называть углеводороды и их производные. Неорганические – разделяются на классы; таким образом, существует 4 основных класса неорганических соединений: оксиды, основания (гидроксиды), кислоты, соли.
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления «– 2». В молекулах оксидов атомы кислорода и связного с ним элемента находятся в таком количестве, что их валентности взаимно насыщены. По функциональным признакам оксиды подразделяются на солеобразующие и несолеобразующие (безразличные). К последним относятся такие, которые не образуют ни кислот, ни оснований.
Солеобразующие оксиды подразделяются на основные, кислотные, амфотерные.
Элементы, обладающие постоянной валентностью, образуют оксиды только одной из перечисленных групп (основные, кислотные, амфотерные). Элементы, проявляющие переменную валентность, могут образовывать различные оксиды.
Основными называются оксиды, взаимодействующие с кислотами (или кислотными оксидами) образуя соль и воду:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
хлорид железа (III)
CuO + H2SO4 → CuSO4 + H2O
сульфат меди (II)
СaO + CO2 → CaCO3
карбонат кальция
Соединения оксидов с водой относятся к классу соответствующих оснований
26
Na2O + H2O → 2NaOH CaO + H2O → Ca(OH)2
Основные оксиды образуются металлами. С основаниями основные оксиды не взаимодействуют.
Номенклатура: в названиях оксидов вначале указывают слово «оксид», а затем в родительском падеже название второго элемента: ВаО – оксид бария; Na2O – оксид натрия.
Если элемент, образующий оксид, имеет переменную валентность, то после названия элемента римской цифрой указывают его валентность: P2O5 – оксид фосфора (V), Fe2O3 – оксид железа (III).
Кислотными оксидами называются такие, которые при взаимодействии с основаниями (или оксидами) образуют соль и воду:
CO2 + 2NaOH → Na2CO3 + H2O
Для кислотных оксидов употребляется еще название ангидрид (что означает «безводный»).
Присоединяя воду, кислотные оксиды образуют кислоты:
SO3 + H2O → H2SO4
P2O5 + 3H2O → 2H3PO4
Кислотные оксиды образуются неметаллами (например, N2O5
– азотный ангидрид, CO2 – угольный ангидрид, SO2 – сернистый ангидрид), а также некоторыми металлами, когда они проявляют высокую валентность (например, CrO3 – хромовый ангидрид, Mn2O7 – марганцовый ангидрид).
С кислотными, кислотные оксиды обычно не реагируют. Амфотерные оксиды. Это такие оксиды, которые в зависимости от
условий проявляют основные и кислотные свойства, то есть при взаимодействии с кислотами ведут себя как основные оксиды, им соответствуют основания (Al2O3 – Al(OH)3; ZnO – Zn(OH)2):
Al2O3 + 6HCl → 2AlCl3 + 3H2O
хлорид алюминия
ZnO + 2HCl → ZnCl2 + H2O
хлорид цинка
а при взаимодействии с основаниями – как кислотные оксиды, им соответствуют кислоты: (Al2O3 – HАlO2, ZnO – H2ZnO2):
Al2O3 + 2KOН → KАlO2 + H2O
алюминат калия

27
ZnO + 2NaOH → Na2ZnO2 + H2O
цинкат натри
Не все амфотерные оксиды в одинаковой степени взаимодействуют с основаниями и кислотами. У одних более выражены основные свойства, у других кислотные.
Основаниями называются сложные вещества, состоящие из металла и одной или нескольких гидроксильных групп (ОН).
Гидроксильные группы одновалентны, поэтому их число в молекуле основания численно равно валентности металла, входящего в состав основания: КОН; Са(ОН)2; Аl(OH)3.
Формулы оснований отражают тип их диссоциации:
Ba(OH)2 ↔ Ba 2+ + 2OH−.
В основу классификации оснований положена их растворимость в воде.
Растворимые в воде основания называются щелочами. Щелочи дают щелочные и щелочноземельные металлы. Концентрированные растворы щелочей называют едкими щелочами, например: КОН – едкое кали; NaOH – едкий натр; Ba(OH)2 – едкий барий.
По силе основания делятся на:
Общие свойства оснований (окрашивание индикатора, взаимодействие с кислотами и солями) обусловлены наличием в их растворах ионов гидроксила:
NaOH + HCl → NaCl + H2O (реакция нейтрализации)
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaCl

28
Лакмус окрашивает в синий цвет.
Номенклатура. Названия оснований образуются так же, как и оксидов. Ca(OH)2 – гидроксид кальция, Fe(OH)2 – гидроксид железа (II), Fe(OH)3 – гидроксид железа (III)
Кислоты – сложные вещества, состоящие из кислотных остатков, к которым присоединены атомы водорода, способные замещаться на атомы металла.
Кислотные остатки – это группы атомов (а иногда и один атом), связанные в молекуле кислоты с атомами водорода, способными замещаться атомами металла. Кислотные остатки входят в состав молекул кислот и солей и обычно сохраняются в реакциях как единое целое. Валентность кислотного остатка равна числу атомов водорода, с которым соединен кислотный остаток в молекуле кислоты. Например: H2SO4 дает два кислотных остатка:
а HNO3 – один кислотный остаток HNO3  H+ + NO3-. Кислоты классифицируют по составу на кислородсодержа-ие и бескислородные.
H+ + NO3-. Кислоты классифицируют по составу на кислородсодержа-ие и бескислородные.
В зависимости от числа атомов водорода в молекуле кислоты, способных замещаться на металл, различают одно- и многоосновные кислоты.
Основность кислоты равна числу атомов водорода в молекуле. Кислородсодержащим кислотам соответствуют сложные по составу
кислотные остатки, т.е. их можно представить, как продукт взаимодействия кислотного оксида – ангидрида с водой:
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
CrО3 + H2O → H2CrO4
29
Бескислородным – соответствуют простые остатки:
HCl → H+ + Cl¯
Бескислородные кислоты ангидридов не имеют.
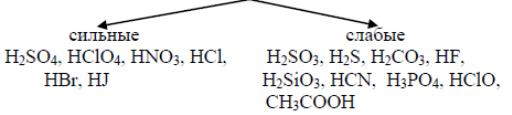
По силе классификации кислоты
Кислоты в водном растворе имеют кислый вкус. В растворах кислот лакмус окрашивается в красный цвет. Наиболее общее свойство кислот – способность взаимодействовать с основаниями (реакции нейтрализации), основными оксидами и металлами с получением солей:
H2SO4 + Fe(OH)2 → FeSO4 + 2H2O
H2SO4 + FeO → FeSO4 + H2O
H2SO4 + Zn → ZnSO4 + H2
Номенклатура. Название получают от названия образующего кислоту элемента (кислотообразователя) с прибавлением окончаний «ная», «вая»:
H2CO3 – угольная; H2SiO3 – кремниевая; HNO3 – азотная если элемент проявляет низшую валентность, окончание будет «истая»: HNO2 – азотистая; H2SO3 – сернистая;
Название бескислородных кислот имеет окончание «водород»: HCl – хлороводород (соляная); HF – фтороводород (плавиковая); HCN – циановодород (синильная).
Соли – сложные вещества, состоящие из кислотных остатков и атомов металлов или других более сложных атомных группировок.
Соли можно рассматривать как продукт полного или частичного замещения атомов водорода в молекуле кислоты на металл или же продукт полного или частичного замещения гидроксильных групп в основании на кислотный остаток. Например, из H2SO4 – серной кислоты можно получить две соли Na2SO4 (продукт полного замещения водорода на атомы натрия) и NaHSO4 (продукт частичного замещения атомов водорода).
Na2SO4 ↔ 2Na+ + SO 2-
NaHSO4 ↔ Na+ + HSO4-
30
В зависимости от состава различают соли:
двойные: KAl(SO4)2, NaKCO3;
комплексные: K3[Fe(CN)6], [Zn(NH3)4]Cl2;
|
средние (нормальные): MgSO4, KNO3, |
CaCO3, |
Cr(NO3)3; |
|
|
кислые: NaH2PO4, Ca(HCO3)2;
основные: AlOHSO4, MgOHCl, (ZnOH)2SO4.
Средние соли следует рассматривать как продукт полного замещения атомов водорода в молекуле кислоты на атом металла.
Zn + H2SO4 → ZnSO4 + H2↑
CuO + 2HCl → CuCl2 + H2O
1 моль 1 моль
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
сульфат магния
Средние соли не содержат при атоме металла ни групп OH¯, ни атомов водорода.
Название средней соли строят из названия аниона в именительном падеже и названия катиона в родительном падеже: BaCO3 – карбонат бария; Fe3(PO4)2 – фосфат железа (II) или ортофосфат железа (II); NaCl – хлорид натрия; SnS – сульфид олова (II).
Кислые соли – это продукты частичного, неполного замещения атомов водорода в молекуле кислоты на атом металла. Эти соли содержат при атоме металла атомы водорода. Кислые соли получаются при взаимодействии кислот с основаниями в тех случаях, когда количество взятого основания недостаточно для образования средней соли:
1 моль 2 моля
NaOH + H2SO4 → NaHSO4 + H2O
гидросульфат натрия
Название кислой соли строится от названия средней с добавлением частицы «гидро». Кислые – также называют гидросолями.
Кислые соли могут образовывать только двух- и многоосновные кислоты, одноосновные кислоты кислых солей не образуют.
Основные соли – продукт частичного замещения гидроксогрупп в молекуле основания на кислотный остаток. Данные соли содержат при атоме металла группы OH¯. Основные соли получаются в тех случаях, когда при взаимодействии кислоты с основанием взятого количества кислоты оказывается недостаточно для образования средней соли:
2 моля 1 моль
Al(OH)3 + 2HCl → AlOHCl2 + 2H2O
гидроксохлорид алюминия
31
Название основных солей строится от названия средней соли с добавлением в начале слова «гидроксо».
Основные соли могут быть образованы только гидроксидами, содержащими не менее двух гидроксогрупп.
Двойные соли – атомы водорода в двух или многоосновной кислоте замещены не одним металлом, а двумя различными. Например, NaAl(SO4)2.
Комплексными, или координационными, соединениями
называются соединения, полученные путем сочетания отдельных, способных к самостоятельному существованию простых соединений, ионов или молекулярных групп. В молекулах комплексных соединений всегда можно выделить центральный атом или ион, получивший название комплексообразователя, вокруг которого сгруппированы, или координированы, другие ионы или молекулярные группы – лиганды, или адденды.
[Zn(NH3)4]Cl2, K2[PtCl6], [Co(NH3)5Cl]Cl2
Характерной особенностью солей является то, что они представляют собой конечный продукт генетического ряда рассмотренных классов неорганических соединений:
элемент → оксид → основание (кислота) → соль.
Этот ряд иллюстрирует возможность образования веществ одного класса из веществ другого класса, так называемую генетическую взаимосвязь веществ различных классов. Самыми характерными свойствами солей являются их реакции ионного обмена с кислотами, щелочами и друг с другом.
32
1.3 СТРОЕНИЕ АТОМА
ПЛАН
1.3.1Модели атомов
1.3.2Характеристика квантовых чисел
1.3.3Распределение электронов в атомах элементов
1.3.1 Модели атомов
Развитие теории строения атома шло через создание различных моделей. Из них наиболее близка современным представлениям модель Резерфорда (1911 г.).
Суть этой модели в следующем:
-в центре атома находится положительно заряженное ядро, радиус которого в 10 000 раз меньше радиуса атома; в ядре сосредоточена практически вся атомная масса, т.к. оно состоит из сравнительно тяжелых частиц: протонов (заряд протона (+1)) и нейтронов (с нулевым зарядом).
-вокруг ядра вращаются электроны (заряд электрона (-1)), которые в 1 870 раз легче протонов, а их радиус в 10 раз меньше радиуса ядра; электрон обозначается буквой е.
-заряд ядра (равный числу протонов в нем) определяет число электронов в атоме элемента, а значит, его химическую индивидуальность.
Подчеркнем, что эта модель лежит в основе современных определений атома. Первое из них: атом – это электронейтральная частица, состоящая из положительно заряженного ядра и движущихся в его электростатическом поле отрицательно заряженных электронов.
Второе определение (отражающее химическую сущность): атом – это мельчайшая частица, представляющая элемент, т.к. ее разделение на субатомные частицы (протон, нейтрон, электрон) приводит к утрате
индивидуальных химических свойств элемента.
Однако в начале XX века модель Резерфорда не получила признание, т.к. по представлениям классической механике вращающийся электрон должен выделять энергию и в конечном итоге, притягиваясь ядром, падать на него.
Развивая теорию Резерфорда, Н. Бор предположил, что это не происходит, т.к. электрон движется по строго определенным разрешенным замкнутым траекториям (орбитам) без изменения энергии, а поглощает или выделяет ее лишь при переходе с одной орбиты на другую (что объясняет образование атомных спектров веществ). Но и модель тоже Бора имеет недостатки:
1. Теория внутренне противоречива, т.к. базируется, с одной стороны, на законах классической механики, а с другой – квантовой. Поэтому она не может описать, например, механизм перехода электрона с одной орбиты на другую;
33
2.Не позволяет рассчитать энергию е даже для самого простого случая многоэлектронных систем – атома гелия (а лишь для одноэлектронных частиц, в частности, для атома водорода);
3.Не объясняет всех деталей спектра атомов, например, различную интенсивность линий даже в случае водорода.
Современной атомной моделью является квантово-химическое
описание состояний электронов в атоме, которое основано на следующих положениях:
I. Квантование энергии излучения. Оно объясняется, в частности,
наличием строго определенных состояний е в атоме. Разность энергий этих состояний равна кванту энергии E (излучаемой или поглощаемой при переходе электрона из одного состояния в другое), которая рассчитывается по формуле Планка:
E = hν |
(1.3.1) |
В этой формуле ν = c / λ (ν и λ – частота излучения и длина волны, соответственно, c – скорость света, равная 3 108 м/с), а h – постоянная Планка (6,626 10−34 Дж с), которая, как и c, является фундаментальной
константой природы и представляет собой наименьшее значение действия.
II. Принцип неопределенности Гейзенберга. (Установлен в 1927 г.).
Его суть,:при малых значениях массы частицы (m) нельзя одновременно с достаточной точностью определить и ее скорость (υ), и ее координату ( x ),
т.к. xΔυ = h /(2πm) (где – погрешность |
определения). В частности, для е |
(m = 9,11 10−31 кг): h /(2πm) ≈ 10−4 и при |
x = 0,001 нм или 10−12 м (это |
точность определения радиуса атома)
электрона в атоме порядка 106 − 107
получим Δυ = 108 м/с. В то время как υ м/с, т.е. меньше, чем погрешность Δυ.
Поэтому в квантовой химии не определяют траекторию движения е, а лишь рассчитывают вероятность его нахождения в той или иной точке пространства вокруг ядра, т.е. используют вероятностный (статистический) метод описания.
III. Двойственная природа электрона. Хотя е имеет заряд и ненулевую массу покоя (т.е. проявляет свойства корпускулы), но обладает и явно выраженными волновыми свойствами. Его длина волны может быть
рассчитана по уравнению Луи де Бройля: λ = h /mυ. (Уравнение легко выводится из формулы Планка и соотношения Эйнштейна: E = mc2 , если вместо c подставить υ). Закон де Бройля (открыт им в 1924 г.) утверждает,
что любая частица, а не только фотон, имеет корпускулярно-волновой характер движения. Так, экспериментально обнаружена дифракция не только электронов, но и нуклонов, атомов гелия, молекул водорода и др.

34
Чтобы отразить волновой характер движения электронов в атоме, Шредингер в 1926 г. предложил для описания его состояния использовать
уравнение сферической стоячей волны, которое отражает периодические изменения волновой функции в трехмерном пространстве атома.
Уравнение Шредингера связывает волновые свойства электрона ( Ψ ) и
его энергетические характеристики (E), поэтому коротко может быть записано следующим образом:
(1.3.2)
где H – оператор Гамильтона, который, в частности, показывает, что состояние электрона в атоме описывается дифференциальным уравнением
(производными Ψ 2-го порядка по всем осям координат).
Решить уравнение Шредингера – это значит определить волновую функцию Ψ в явном виде и рассчитать энергию электрона (E) в одном из
разрешенных состояний.
Результатом решения уравнения Шредингера являются, в частности, значения трех параметров, т.н. квантовых чисел: главного, орбитального и магнитного. Причем условия решения уравнения Шредингера (вытекающие из условий существования электрона в атоме) определяют целочисленность значений этих параметров.
Волновая функция Ψ, заданная тремя квантовыми числами, называется
атомной орбиталью. Ею называют также часть пространства вокруг ядра, в котором с 90%- вероятностью можно обнаружить электрон.
Вероятность нахождения электрона в том или ином элементарном объеме пространства является электронной плотностью данного объема и
рассчитывается по формуле: Ψ2dV . Здесь dV – это объем, заключенный
между двумя сферами, имеющими общий центр (в котором находится ядро атома), причем радиусы сфер (R1 и R2) различаются между собой на величину dR; а
Ψ2 – это плотность вероятности нахождения е в атоме на расстоянии
(R1+dR/2) от ядра.
Отметим, что для любой атомной орбитали электронная плотность в центре атома равна нулю, но по мере увеличения расстояния от ядра она растет от нуля до максимального своего значения, а затем уменьшается, асимптотически приближаясь снова к нулю.
Причем расстояние от центра атома до максимума электронной плотности орбитали считается ее радиусом, а радиус внешней орбитали является орбитальным радиусом атома; в дальнейшем он называется просто радиусом атома или атомным радиусом и обозначается английской буквой r.

35
Современное представление о строении атомов химических элементов сводится к следующим положениям:
1.Атом состоит из ядра и электронов.
2.Ядро заряжено положительно, а электроны – отрицательно.
3.Ядро состоит из протонов и нейтронов (нуклонов).
4.Протон является носителем элементарного положительного заряда, равного 1,6•10-19 Кл. Электрон является носителем отрицательного заряда, равного 1,6•10-19 Кл. Нейтрон заряда не имеет. Таким образом, заряд ядра Z равен числу протонов Np:
Z = Np |
(1.3.3) |
5.Число протонов определяет порядковый номер элемента в периодической системе.
6.Протоны и нейтроны имеют примерно одинаковые массы (1,67•10-24
г= 1 а.е.м.). Масса атома определяется суммой протонов и нейтронов. Масса электрона равна 9,1•10-28 г (0,00055 а. е. м.), что примерно в 2000 раз меньше массы протона. Сумма протонов Np и нейтронов N определяет массовое число атома А:
А = Np + N = Z + N |
(1.3.4) |
В обозначении элемента указывают |
массовое число и количество |
протонов,  , например
, например  .
.
7. Электроны вращаются вокруг ядра. Число электронов равно числу протонов, поэтому атом электронейтрален.
Изотопы − атомы с одинаковыми значениями Z, но различными А и N, например
Изобары − атомы с одинаковыми значениями А, но различными Z и N, например
Устойчивому состоянию ядер атомов соответствует определённые соотношения A / Z ≈ 2 для лёгких элементов, ≈ 2,6 для тяжёлых.
При нарушении устойчивого протонно-нейтронного соотношения ядро (а вместе с ним и атом) становится радиоактивным.
Радиоактивностью называется самопроизвольное превращение неустойчивых ядер в другие ядра, сопровождающееся испусканием различных частиц, например, α –распад.
1.3.2 Характеристика квантовых чисел
1) Главное квантовое число (n) характеризует энергетический уровень, или общий запас энергии электрона, а также размеры электронного облака. Для реально существующих атомов n может иметь значения целых

36
чисел от 1 до 7, соответственно номеру периода, в котором находится элемент, соответствующие энергетические уровни (электронные слои) обозначаются большими буквами латинского алфавита.
С увеличением n возрастают энергия электрона и размер электронного облака.
2) Орбитальное или побочное квантовое число (ℓ) характеризует энергетический подуровень и форму электронного облака. В пределах уровня электроны распределяются по подуровням. Значения ℓ связаны со значением n и принимают число значений, равное n. ℓ изменяется от 0 до n-1.
Например: при n=4, ℓ может иметь 4 значения 0, 1 ,2 и 3, т.е. этот уровень состоит из 4-х подуровней. Используя обозначения, принятые в спектроскопии подуровни обозначают малыми буквами латинского алфавита.
Число подуровней равно номеру уровня (n).
Схема подразделения энергетических уровней на подуровни (рисунок
1.3.1):
Рисунок 1.3.1 – Подразделение энергетических уровней на подуровни
Электроны с орбитальным квантовым числом 0 называются s- электронами. Орбитали и электронные облака имеют сферическую форму. Электроны с орбитальным квантовым числом 1 называются р-электронами. Орбитали и соответственно электронные облака имеют форму,

37
напоминающую гантель. Электроны с орбитальным квантовым числом 2 называются d-электронами. Орбитали имеют четырехлепестковую форму. Электроны с орбитальным квантовым числом 3 получили название f- электронов. Форма их орбиталей еще сложнее, чем форма d-орбиталей (рисунок 1.3.2).
Рисунок 1.3.2 – Формы атомных орбиталей
3) Магнитное квантовое число (mℓ) определяет ориентацию электронного облака в пространстве, связано с орбитальным квантовым числом и может принимать целочисленные значения от –ℓ до + ℓ через 0.
Для s-подуровня ℓ= 0, mℓ = 0, поэтому для s-орбитали один вариант расположения в пространстве.
Для p-подуровня ℓ = 1, mℓ = -1, 0, +1, т.е. соответствуют три значения mℓ, три орбитали взаимно перпендикулярные, т.к. координированы вдоль осей x, y, z. Такие орбитали обозначаются px, py, pz.
Облакам d электронов (ℓ = 2), соответствует 5 значений магнитного квантового числа mℓ = –2, –1, 0, +1, +2.
f-электронам (ℓ = 3) соответствуют 7 значений магнитного квантового числа ml = –3, –2, –1, 0, +1, +2, +3. Имеет место, соответственно, 5 и 7 различных ориентаций f-, и d-орбиталей в пространстве.
4) Спиновое квантовое число (ms) характеризует собственное вращение электрона вокруг своей оси. Может принимать всего 2 значения +½ и –½, которые отличаются. как и остальные квантовые числа, на единицу.
Если спин равен +½, то электрон вращается по часовой стрелке, если – ½, то против часовой стрелки (в графических формулах клетка – орбиталь, стрелка – электрон).
ms = +1/2 |
ms = – 1/2 |

38
Таким образом, состояние электрона в атоме может быть описано с помощью 4-х квантовых чисел n, ℓ, mℓ, ms. Они характеризуют спин, энергию электрона, объём и форму пространства, в котором вероятно его пребывание около ядра.
При переходе атома из одного квантового состояния в другое, в связи с чем меняются значения квантовых чисел, происходит перестройка электронного облака. При этом атом поглощает или испускает квант энергии.
1.3.3 Распределение электронов в атомах элементов
Распределение электронов в атомах элементов определяется основными положениями: принципом Паули, принципом наименьшей энергии, правилом Хунда и правилом Клечковского.
По принципу наименьшей энергии каждый электрон в атоме занимает свободную орбиталь с наиболее низкой энергией. С ростом порядкового номера элемента электроны заполняют орбитали и уровни в порядке возрастания их энергии: уровни заполняются от 1 до 7, а подуровни в последовательности s, p, d, f. Опытным путём определена последовательность возрастания энергии − так называемая шкала энергии.
Эта шкала имеет вид, где вертикальными линейками отделены периоды.
Электронная формула водорода 1s1. В графических электронных формулах каждая ячейка обозначается клеткой, клетка − орбиталь, стрелка − электрон, направление стрелки − направление спина, свободная клетка − свободная орбиталь.
Заполнение электронами орбиталей происходит в соответствии с принципом Паули и правилом Хунда.
Принцип исключения Паули − в атоме не может быть двух электронов с одинаковыми значениями всех четырёх квантовых чисел.
Это значит, что на орбитали, характеризуемой тремя квантовыми числами, не может быть более двух электронов. Два электрона, находящиеся на одной орбитали, отличаются друг от друга значениями спинового квантового числа, т.е. они имеют одинаковые значения n, ℓ, mℓ, но

39
противоположно направлены или имеют антипараллельные спины, обозначаются противоположно направленными стрелками ↑↓ и называются спаренными. Неспаренные электроны изображаются одной стрелкой ↑, они являются валентными.
Валентность − способность одного атома элемента присоединять определённое число электронов и определяется числом неспаренных электронов.
Распределение электронов по нескольким ячейкам одного подуровня происходит в соответствии с правилом Хунда: в пределах подуровня электроны заполняют наибольшее число орбиталей, в связи с чем сумма их спиновых чисел должна быть максимальной.
В электронных формулах число впереди − номер энергетического уровня, буквой выражается подуровень (тип орбитали), индекс справа вверху − число электронов на подуровне. В качестве примера рассмотрим распределение электронов в атомах элементов второго периода (рисунок
1.3.3).
Принцип Паули позволяет рассчитать ёмкость электронных уровней и подуровней. На N-ом уровне может разместиться столько электронов, сколько возможно сочетаний из ℓ, mℓ, ms.
Ёмкость энергетического уровня (число электронов в уровне) легко
определить по формуле |
|
|
|
Nn = 2n2 |
(1.3.5) |
N1 = 2 |
|
|
N2 |
= 2·4 =8 |
|
N3 |
= 2·9 =18 |
|
N4 |
=2·16 =32 |
|
40
Рисунок 1.3.3 – Распределение электронов в атомах элементов второго периода
Число электронов в подуровне |
Nℓ = 2 (2ℓ + 1) |
(1.3.6) |
|||
на подуровнях |
s |
ℓ = 0 |
Ns = 2 (2·0+1 ) = 2 |
|
|
|
p |
ℓ = 1 |
Np = 2 |
(2·1+1) = 6 |
|
|
d |
ℓ = 2 |
Nd = 2 |
(2·2+1) = 10 |
|
|
f |
ℓ = 3 |
Nf = 2 (2·3+1) = 14 |
|
|
Общее число состояний (квантовых ячеек или орбиталей) |
в уровне |
||||
равно n2 : I – 1, II – 4, III – 9, IV – 16.
Порядок заполнения АО электронами определяется также правилом Клечковского, которое учитывает зависимость энергии орбитали от значений главного (n) и орбитального (ℓ) квантовых чисел :
АО заполняются электронами в порядке последовательного увеличения суммы n + ℓ, а при одинаковых значениях этой суммы − в порядке последовательного возрастания главного квантового числа n.
1s n +ℓ = 1 + 0 = 1 2s n + ℓ = 2 + 0 = 2 3s n + ℓ = 3 + 0 = 3 3p n + ℓ = 3 + 1 = 4 3d n + ℓ = 3 + 2 = 5 4s n + ℓ = 4 + 0 = 4
Так, орбиталь 1s энергетически более выгодна, чем орбиталь 2s, и поэтому электронами заполняется раньше. 4s орбиталь заполняется раньше 3d, так как сумма n + ℓ у нее меньше.
При написании электронных формул следует учитывать так называемый «проскок электрона» из ns подуровня на (n - 1) d. Так, электронная формула меди должна быть 1s22s22p63s23p63d94s2, однако на внешнем уровне у атома меди не 2 электрона, а один − второй электрон «провалился» на d-подуровень второго снаружи уровня, т.е. на (n - 1) d - подуровень. Расположение электронов у 28Сu 1s22s22p63s23p63d104s1.
Провал электронов наблюдается у следующих 10 элементов: Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, Рd, Pt. Исключение составляет палладий − у него 2s-электрона провалились на соседний уровень. Провал электронов энергетически более выгоден, т.к. образуются более устойчивые электронные конфигурации (p0 , p3 , p6 ; d0, d5 , d10).
Состояние атома с полностью или наполовину заполненным подуровнем (т.е. когда на каждой орбитали имеется по одному электрону) является более устойчивым.
Для атома углерода электроны разместятся по уровням и подуровням следующим образом, что соответствуют нормальному состоянию атома, т.е. минимальному значению энергии (рисунок 1.3.4).

41
Рисунок 1.3.4 – Нормальное состояние атома углерода
Однако при затрате сравнительно незначительной энергии возможен перевод электронов в пределах одного и того же уровня, с одного подуровня на другой, энергетически более высокий.
Углерод переходит в возбуждённое состояние, что сопровождается разъединением спаренных электронов, т.е. распадом двухэлектронных облаков на одноэлектронные. Такой процесс называют промотированием.
Такое состояние атома, в котором при незаполненном нижнем подуровне имеются электроны на более высоком подуровне, называется
возбуждённым (рисунок 1.3.5).
Рисунок 1.3.5 – Возбужденное состояние атома углерода
В нормальном состоянии углерод двухвалентен, в возбуждённом − четырёхвалентен.
42
1.4 ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
ПЛАН
1.4.1Периодический закон Д.И. Менделеева
1.4.2Структура периодической системы элементов Д. М. Менделеева
1.4.3Периодичность изменения свойств химических элементов 1.4.3.1 Атомные и ионные радиусы элементов 1.4.3.2 Энергия ионизации (потенциал ионизации ПИ)
1.4.3.3 Электроотрицательность (ЭО)
1.4.3.4 Периодичность изменения кислотно-основных свойств соединений при высшей степени окисления атомов элементов
1.4.1 Периодический закон Д.И. Менделеева
Открытие периодического закона и разработка периодической системы химических элементов Д.И.Менделеева явились вершиной развития химии в
XIX веке.
Обширная сумма знаний о свойствах 63 элементов, известных к тому времени была приведена в стройный порядок. Таблица Менделеева состояла из 12 горизонтальных рядов и 8 групп. Номер группы соответствовал высшей валентности элементов по кислороду.
Попытки классифицировать химические элементы имели место и до Менделеева.
Менделеев считал, что основной характеристикой элементов является их атомные веса (относительные атомные массы) и в 1869г. Впервые сформировал периодический закон, к которому шел 15 лет.
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
При размещении элементов в периодической системе (таблице) Менделеев руководствовался не только правилом постепенного возрастания атомного веса, но и принципом периодичности химических свойств, что позволило ему в нескольких местах системы правильно расположить элементы не в порядке возрастания атомных весов, а с нарушением этого порядка, как требовали химические аналоги (Со – Ni, Te – J). Для некоторых элементов он изменил общепринятые в то время атомные веса в 1,5 – 2 раза
(Bt, Jn, Ce, U и др.).
Менделеев предсказал многие неизвестные тогда элементы, для которых в периодической системе были оставлены места, а для 3-х из них названых экаалюминием, экабором и экасилицист, подробно описал ожидаемые свойства. Вскоре эти элементы были открыты: аналог алюминия Al – гелий Ga Лекоком де Буабодраном в 1875г; аналог бора В – скандий Sc

43
Л. Нильюном в 1879г; аналог кремния Si – геманий Ge А. Вильклером в
1886г.
Формулировка периодического закона была ошибочной, несмотря на всю огромную его значимость, так как в Х1Х веке совершенно отсутствовали какие-либо представления о сложности строения атома.
В 1914г. Английский физик Г. Мозли, опираясь на знания о сложном строении атома, установил закон, сущность которого заключалась в том. Что величина зарядов ядер атомов последовательно возрастает от элемента к элементу на 1.
На основании закона Мозли можно было однозначно определить заряд ядра любого элемента и тем самым порядковым номером его в периодической системе.
Мозли установил, что заряд ядра атома элемента равен порядковому
номеру элемента в таблице Менделеева.
Периодический закон получил новую формулировку:
Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Но причина периодического изменения свойств элементов оставалась по-прежнему не вскрытой, т. к. заряды ядер изменяются от 1 до 118 (последний открытый элемент)
Основным ключом к разгадке природы периодичности является строение электронной оболочки атомов.
Причина периодичности свойств элементов, открытая Менделеевым, заключается в том, что по мере возрастания числа электронов, окружающих ядро, наступает такая стадия, когда заканчивается заполнение следующего. При этом элементы с 1, 2, 3 и т.д. электронами в этом новом наружном слое воспроизводят химические свойства элементов, имеющих также 1, 2, 3 и т.д. электронов в предшествовавшем теперь уже глубинном слое. Например:
Современная формулировка периодического закона:
Строение и свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атомов, и определяется периодически повторяющимися однотипными электронными конфигурациями их атомов.
1.4.2 Структура периодической системы элементов Д. М. Менделеева

44
Периодическая система элементов является графическим изображением периодического закона. Их известно более 500, но наиболее широко используются три: 1) короткая, 8-клеточная; 2) полудлинная, 18клеточная; 3) длиннопериодичная, 32-клеточная.
Во всех таблицах элементы располагаются в порядке возрастания заряда ядра их атомов.
Физической основой структуры периодической системы элементов служит определенная последовательность формирования электронных конфигураций атомов по мере роста порядкового (атомного) номера элемента Z.
В зависимости от того, какой энергетический подуровень заполняется электронами последним, различают четыре электронных семейства s-, p-, d-, f- элементов:
1)s- элементы – последним заполняется s- подуровень внешнего энергетического уровня;
2)p- элементы – p- подуровень внешнего энергетического уровня;
3)d- элементы – d- подуровень предпоследнего энергетического
уровня;
4)f- элементы – f- подуровень третьего снаружи уровня.
Элементы со сходной электронной конфигурацией внешних энергетических уровней обладают и сходными химическими свойствами.
Химические элементы по структуре невозбужденных атомов подразделяются на естественные совокупности, что отражено в периодической системе в виде горизонтальных и вертикальных рядов – периодов и групп.
Периодом называется последовательный ряд элементов (расположенных в порядке возрастания ядер их атомов), электронная конфигурация внешнего энергетического уровня которых изменяется от ns1 до ns2 np6 (первого периода ns1 и ns2)
Всего 7 периодов:
При этом номер периода совпадает со значением главного квантового числа n внешнего энергетического уровня.
Различие в последовательности заполнения внешних и более близких к ядру уровней объясняет причину различной длины периодов.
45
Каждый из периодов (исключая первый) начинается типичным металлом (металл щелочной группы) и заканчивается благородным газом, которому предшествует неметалл, т.е. в периоде с увеличением заряда ядра атомов наблюдается постепенное изменение свойств от металлических к типично неметаллическим, что связывается с увеличением числа электронов на внешнем энергетическом уровне.
Первые три периода (малые) содержат только s- и p- элементы, у которых наиболее отчетливо проявляются отличия в свойствах.
Остальные 4 периода называются большими (двухрядными в короткой 8-клеточной)
Четвертый и пятый периоды содержат вставные декады из 10dэлементов каждая, называемая переходными.
То есть отличительной особенностью элементов 4-го и 5-го периодов является то, что между элементами с электронной конфигурацией 4 s2 и 4 p1- 6; 5s2 и 5p1-6 вклиниваются 10 элементов с электронной конфигурацией соответственно 3d1-10 и 4d1-10.
Шестой период, кроме переходных металлов 6s25d1-10 имеет вторую вставку из 14∫ f-элементов, именуемых лантаноидами (58Ce ÷ 71Lu), т.е. после 57La идет застройка электронами 4 подуровня.
Седьмой период содержит неполную декаду d-элементов (они представлены лиш началом вставки), а есть вставки 14∫ f-элементов, называемых актиноидами (90Th ÷103Lr), т.е. после 89Ac в седьмом периоде идет застройка электронами 5f-подуровня.
Лантаноиды и актиноиды обычно выносятся за пределы таблицы.
В соответствии с максимальным числом электронов на внешнем энергетическом уровне невозбужденных атомов элементы периодической системы подразделяются на 8 вертикальных рядов – групп.
Положение в группах s- и p-элементов определяется общим числом электронов внешнего энергетического уровня.
Например, P (3s2 3p3), имеющий на внешнем уровне 5е-, относится к V группе; Ar (3s23p6) – к VIII группе; Ca (4s2) – к II группе и т.д.
Положение в группах d- элементов обуславливается общим числом s- электронов внешнего и d-электронов предвнешнего уровней.
По этому признаку первые 6 элементов каждого семейства d-элементов располагаются в одной из соответствующих групп: Sc (4s23d1), в III группе;
Mu (4s23d5) в VII группе; Fe (4s23d6) в VIII группе и т.д. Zn (4s23d10), у
которого предвнешний уровень завершен и внешними являются 4s2- электроны, относятся во II группе.
За счет "проскока" одного ns электрона на (n-1) d- подуровнь ns2(n-1)d9
→ ns1(n-1)d10 элементы Cu (4s13d10); Ag (5s14d10); Au (6s15d10) относятся к I группе. Co (4s23d7) и Ni ( 4s23d8); Rn ( 5s14d8) и Pd (5s04d10) Yr (6s25d9) и Pt
(6s15d9) вместе с Fe, Ru и Os обычно помещаются в VIII группу.
В соответствии электронных структур семейства 4f- (лантаноиды) и 5f- (актиноиды) элементов помещают в III группу.
46
Элементы групп подразделяются на подгруппы:
s- и p- элементы составляют главную подгруппу или подгруппу А, d- элементы побочную или подгруппу В. Элементы, размещенные на одной вертикали в подгруппе, являются аналогами, а в группе – неполными аналогами.
Элементы I А подгруппы называются щелочными металлами, а II А (кроме Be) – щелочно-земельными.
Номер группы соответствует числу валентных электронов и равен высшей валентности и высшей степени окисления атомов в возбужденном состоянии (исключение составляют O, F, Br, At, Po, Fe, Cu, Ag, Au и большинство благородных газов).
У s- и p- элементов валентными являются электроны внешнего уровня n, у d- электронов s- электроны внешнего уровня n и d- электроны предвнешнего уровня (n-1).
Степень окисления – это условный заряд атома в молекуле, исходя из предположения, что молекула состоит из ионов. Итак, максимальная степень окисления соответствует номеру группы, а минимальная степень для неметаллов равна 8 – номер группы).
1.4.3 Периодичность изменения свойств химических элементов
Периодическая зависимость элементов от заряда ядра атомов распространяется на самые разнообразные химические и физические характеристики элементов: атомные и ионные радиусы, ионизационные потенциалы, сродство к электрону, электроотрицательность, степень окисления, окислительно-восстановительные свойства и др.
1.4.3.1 Атомные и ионные радиусы элементов
Химические свойства элемента определяются его способностью образовывать соединения с другими элементами.
В наибольшей мере эти свойства зависят от размера атома или иона, им образованного.
Атомные радиусы rат в периоде слева направо уменьшаются. Это объясняется тем, что внутри периода число электронных слоев остается постоянным, а заряд ядра атомов растет, увеличивая притяжение внешних электронной оболочки.
Происходит сжатие электронной оболочки. Это особенно наглядно видно в периодах, содержащих типические элементы:
2-ой период |
Li |
Be |
B |
C |
N |
O |
F |
rат |
1.55 |
1.1 |
0.83 |
0.65 |
0.55 |
0.47 |
0.42 |
У переходных d-элементов в больших периодах убывает не столь быстро и немонотонно, как это имеет место для непереходных элементов этого периода. Еще медленнее уменьшаются радиусы атомов в рядах f- элементов.
47
Таким образом, в изменении радиусов атомов сохраняется принцип периодичности.
Радиусы атомов в А-группах с возрастанием порядкового номера элемента закономерно увеличивается (сверху вниз в группе), что связано с ростом числа электронных слоев.
I А-группа
Li
Na
K
Rb
Cs
Fr
У переходных элементов В-групп рост rат происходит в меньшей степени, чем у непереходных, и осуществляется в основном при переходе от первого элемента данной В-группы ко второму.
↑ |
IY-группа |
rат А0 |
|
Период |
4 |
Ti |
1.46 |
|
5 |
Zr |
1.57 |
|
6 Hf |
≈ −"− |
|
То же для rат Nb ≈ rат Ta. Это объясняется тем, что увеличение rат при переходе из 5-го в 6-ой период за счет роста числа электронных слоев с 5 до 6 успевает компенсироваться уменьшением радиусов вдоль шестого периода элементов Cs–Ba – лантаиды (Ce–Lu), т.е. вследствие удлинения 6-го периода на 14 элементов.
То же для радиусов Nb – Ta, W – Mо, семейства платиновых элементов. Рассмотренное явление обусловлено лантаноидным сжатием, т. е. сжатием электронной оболочки атомов элементов-лантаноидов.
Таким образом, радиус атома в группе сверху вниз увеличивается, а в периоде слева направо уменьшается.
Чем больше rат, тем легче атом отдает электроны. Поэтому одни элементы (щелочные и щелочноземельные металлы) проявляют тенденцию отдавать электроны, другие (прежде всего галогены и халькогены), типические неметаллы – присоединять электроны. Металлы являются восстановителями, неметаллы – окислителями.
Восстановительные свойства в периоде слева направо ослабляются, а окислительные - увеличиваются.
Поскольку в А-группах и группе III В радиусы атомов увеличиваются и, следовательно, становятся слабее связи с ядром внешних электронов, восстановительные свойства металлов сверху вниз усиливаются, а окислительные свойства неметаллов – ослабляются.
Для металлов В-групп (кроме III) восстановительные свойства нарастают в обратном порядке – снизу вверх.
48
Таким образом, наиболее сильные восстановители размещаются в левом нижнем углу периодической системы, наиболее сильные окислители в правой верхней части ее.
В изменении радиусов ионов наблюдается так же периодичность,
причем rаниона > rатома > rкатиона
1.4.3.2 Энергия ионизации (потенциал ионизации ПИ)
Минимальная энергия, необходимая для отрыва наиболее слабо связанного электрона от невозбужденного атома, называется энергией ионизации (ЭИ).
Э – е → Э+ – ЭИ
Например:
Na – e → Na+ – 490 кДж
Энергия ионизации равна потенциалу ионизации (ПИ) численно. Для атомов, у которых число электронов во внешнем уровне больше одного, существует несколько ПИ: ПИ1, ПИ2, ПИ3 … соответственно отрыву первого, второго, третьего и т. д. электронов, причем ПИ1 < ПИ2 < ПИ3 …
Таким образом, ЭИ количественно характеризует энергию связи электрона в атоме.
Энергия ионизации является мерой восстановительных свойств, или мерой металличности элемента. Чем < ЭИ, тем > восстановительная способность элемента, тем он более выраженный металл.
ЭИ в группе сверху вниз уменьшается (усиление восстановительных свойств), а в периоде слева направо увеличивается (ослабление восстановительных свойств).
В В-группах (кроме III В группы) восстановительные свойства усиливаются снизу вверх.
1.4.3.2 Сродство к электрону (энергия сродства к электрону ЭС)
Энергия, которая выделяется при присоединении электрона к атому,
называется энергией сродства к электрону (ЭС).
Э – е → Э- – ЭС
Например: Сl – e → Cl- + 362 кДж
Поскольку присоединять электроны способны элементы – окислители, постольку ЭС характеризует количественно окислительные свойства атомов.
ЭС в группе сверху вниз уменьшается (ослабление окислительных свойств), а в периоде слева направо увеличивается (усиление окислительных свойств).
Сродство к электрону для металлов не характерно.
49
1.4.3.3 Электроотрицательность (ЭО)
Электроотрицательность (ЭО) – условная величина,
характеризующая способность атома в молекуле притягивать к себе электроны.
ЭО в группе сверху вниз уменьшается (усиление восстановительных свойств, ослабление окислительных свойств), а в периоде слева направо увеличивается (ослабление восстановительных свойств, усиление окислительных свойств).
ЭО лития принимается за 1. Наибольшей ЭО обладают самые маленькие атомы с 7 внешними электронами – атомы галогенов малых периодов. Наименьшая ЭО у самых больших атом с одним внешним электроном – атомом щелочных металлов больших периодов. То есть самая большая ЭО у элементов, расположенных в верхнем правом углу таблицы, р- элементов VII А группы (ЭОF = 4); самая маленькая ЭО у элементов, расположенных в нижнем левом углу таблицы, S- элементов I А группы
(ЭОFr = 0.7).
1.4.3.4 Периодичность изменения кислотно-основных свойств соединений при высшей степени окисления атомов элементов
Изменение кислотно-основных свойств особенно четко проявляется у элементов 3-го периода. Это видно из ряда их гидроксидов, химический характер которых меняется от основного к кислотному:
NaOH; Mg (OH)2; |
Al(OH)3; |
H2SiO3; H3PO4 |
H2SO4; HClO4 |
основания |
амфотерное |
слабые |
сильные |
|
основание |
кислоты |
кислоты |
Таким образом, в периоде слева направо происходит усиление кислотных свойств, а в группе сверху вниз – усиление основных свойств.
Эта периодическая закономерность в целом сохраняется и для больших периодов, но для них характер изменения свойств повторяется дважды:
От I А-группы к VII В-группе и от I В-группы к VII А-группе.
50
1.5 ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
ПЛАН
1.5.1Ковалентная связь. Свойства ковалентной связи
1.5.2Ионная связь
1.5.3Межмолекулярные взаимодействия. Водородная связь
1.5.4Металлическая связь. Кристаллические решетки
1.5.5Метод валентных связей
1.5.6Метод молекулярных орбиталей
Под термином химическая связь подразумевается совокупность сил, связывающих атомы, ионы или молекулы друг с другом в новые устойчивые образования: молекулы, сложные ионы, кристаллы, ассоциаты.
Различают следующие основные типы химических связей: ковалентная, ионная, металлическая и водородная.
1.5.1 Ковалентная связь. Свойства ковалентной связи
Ковалентная связь – связь между атомами, осуществляемая за счет обобществления ими электронной пары, возникающая в результате взаимодействия (часто называемом перекрыванием) атомных орбиталей и образования молекулярных орбиталей, охватывающих оба атома. Каждая ковалентная связь имеет определенные качественные и количественные характеристики. К ним относятся: энергия связи, длина связи, направленность связи, кратность связи, полярность связи, поляризуемость связи.
Энергия связи (Есв, кДж/моль) — энергия, выделяющаяся при образовании химической связи, или энергия, необходимая для того, чтобы разъединить атомы и удалить их на такое расстояние, на котором они не взаимодействуют. Энергия связи характеризует ее прочность. Например, для ковалентной связи она изменяется в диапазоне: 200—1000 кДж/моль.
Длина связи (l) – это расстояние между ядрами взаимодействующих атомов. Ориентировочно оценить длину связи можно, исходя из атомных или ионных радиусов. Для ковалентной связи это 0,1–0,2 нм (100–200 им). На основании длин связей между атомами в молекуле можно вычислить ковалентные радиусы атомов.
Образование ковалентной связи является результатом взаимодействия валентных электронных облаков атомов. Но такое взамодействие возможно только при определенной взаимной ориентации электронных облаков; при этом область взаимодействия располагается в определенном направлении по отношению к связанным атомам. Иначе говоря, ковалентная связь обладает направленностью. Углы между связями называются валентными.

51
Если взаимодействие атомных орбиталей происходит вдоль линии, проходящей через центры атомов, то такая связь называется -связью
(сигма-связью) (рисунок 1.5.1).
Рисунок 1.5.1– Образование -связи на примере молекул Н2, НСl, Сl2
Все -связи обладают осевой симметрией относительно межъядерной оси, фрагменты химических частиц могут вращаться вокруг межъядерной оси без нарушения степени перекрывания атомных орбиталей, образующих-связи. Совокупность направленных, строго ориентированных в пространстве -связей создает структуру химической частицы.
При последующем взаимодействии атомных орбиталей, перпендикулярных оси -связи, образуются -связи (пи-связи) (рисунок
1.5.2).
Рисунок 1.5.2 – Варианты образования л-связи на примере молекулы С2Н4
Врезультате между атомами возникают кратные связи.
Вслучае -связи, не имеющей осевой симметрии, свободное вращение фрагментов химической частицы вокруг -связи становится невозможным, так как должно привести к разрыву -связи.
Помимо - и -связей, возможно образование еще одного вида связи – δ-связи (дельта-связи) (рисунок 1.5.3). Обычно такая связь реализуется
после образования атомами - и -связей при наличии у атомов d-и f- орбиталей путем взамодействия их «лепестков» сразу в четырех местах.

52
Рисунок 1.5.3 – Образование δ-связи
Кратность связи характеризуется числом электронных пар, принимающих участие в образовании связи между атомами. Связи могут быть одинарными ( -связь), двойными ( -связь и -связь) и тройными ( - связь и две -связи). В некоторых случаях происходит образование делокализованных ковалентных связей, кратность которых не может быть выражена целым числом, например, в молекуле азотной кислоты или в бензоле (рисунок 1.5.4).
Рисунок 1.5.4 – Образование делокализованных ковалентных связей
Ковалентная связь характеризуется полярностью. Если связь образована атомами с одинаковой электроотрицательностью, то электронная пара в равной степени принадлежит обоим атомам, и такая связь называется
неполярной (Н2) (рисунок 1.5.5):
Рисунок 1.5.5 – Неполярная ковалентная связь
Если ковалентная связь образована атомами, различающимися своей электроотрицательностью, то пара электронов связи смещена в сторону атома с большей электроотрицательнотыо, и такая связь называется
полярной (НС1) (рисунок 1.5.6):
Рисунок 1.5.6 – Полярная ковалентная связь

53
Полярность связи характеризуется ее дипольным моментом ( ):
(1.5.1)
где δ – заряд полюса диполя; l – длина диполя.
Дипольный момент – величина векторная, за положительное направление обычно принимают направление от δ+ к δ-. Для многоатомных молекул дипольный момент равен векторной сумме дипольных моментов отдельных связей. Если полярные связи в молекуле расположены симметрично, то положительные и отрицательные заряды компенсируют друг друга, и молекула в целом является неполярной (например, С02, СС14) (рисунок 1.5.7).
Примечание: сплошными стрелками показаны направления смешения электронной плотности ковалентных связей и неподеленных электронных пар; пунктирными – дипольные моменты молекул
Рисунок 1.5.7 – Взаимное расположение атомов в молекулах типа С02, Н20, ВС13 и NH3
По той же причине неполярны и другие высокосимметричные молекулы (СН4, РС15, SF6 и т.п.) с полярными ковалентными связями. Многоатомные молекулы с несимметричным расположением полярных связей являются в целом полярными. Примером служат молекулы Н20 и NH3.
Поляризуемость связи – способность электронной плотности связи смещаться под действием внешнего электрического поля или других воздействий. При этом возникает так называемый наведенный дипольный момент, который исчезает при выключении поля. У полярных молекул такой наведенный дипольный момент векторно складывается с постоянно существующим.
Различают несколько механизмов образования ковалентной связи – обменный, донорно-акцепторный и дативный.
При обменном механизме осуществляется взаимодействие двух атомных орбиталей, каждая из которых занята одним электроном. Таким образом, каждый из связываемых атомов выделяет для образования пары по электрону, как бы обмениваясь ими:

54
Гораздо чаще реализуется донорно-акцепторный механизм, когда пара электронов предоставляется одним из партнеров, образующих связь, а второй атом предоставляет пустую (вакантную) орбиталь:
Свойства связи не зависят от того, по какому из этих двух механизмов она образовалась.
Для элементов, обладающих d- и f-орбиталями, возможен третий механизм образования ковалентной связи, называемый дативным. В этом случае каждый из связанных атомов одновременно является и донором, и акцептором. Примером может служить молекула хлора. Два атома хлора в молекуле С12 образуют ковалентную -связь по обменному механизму, объединяя свои неспаренные Зр-электроны. Кроме того, происходит взаимодействие 3py-орбитали первого атома хлора, на которой находится пара электронов, с вакантной Зd-орбиталью второго атома С1-2, а также взаимодействие Зрz-орбитали второго атома С1-2, на которой также находится пара электронов, с вакантной Зd-орбиталью первого атома С1-1.
Действие дативного механизма приводит к увеличению прочности связи, поэтому молекула С12 является более прочной, чем молекула F2, в которой связь образуется только по обменному механизму.
Существуют два пути разрыва ковалентной связи: гомолитический и гетеролитический (рисунок 1.5.8):
Рисунок 1.5.8 – Пути разрыва ковалентной связи
При гемолитическом разрыве связи (гомолизе) каждый из атомов забирает себе один из электронов связи, превращаясь в свободный радикал (частицу с неспаренным электроном). Такой разрыв связи характерен, как правило, для неполярных или малополярных связей и требует значительной затраты энергии. Поэтому он обычно осуществляется под действием
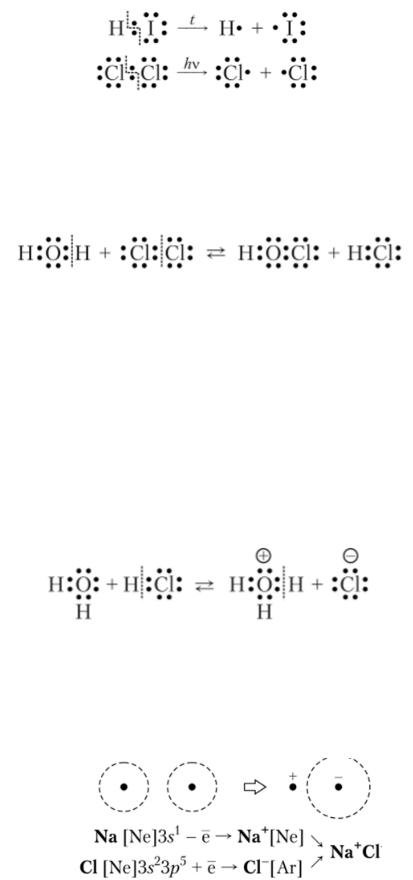
55
облучения квантами достаточно высокой энергии, высокой температуры или высокоактивных частиц:
Тип разрыва ковалентной связи определяется как строением самой молекулы, так и условиями осуществления процесса. Так, под действием ультрафиолетового излучения молекулы хлора в газовой фазе или неполярных растворителях относительно легко диссоциируют на отдельные атомы, тогда как в водных растворах для них характерны реакции диспропорционирования по гетеролитическому механизму:
Образующаяся в последней реакции хлорноватистая кислота (НОС1) постепенно разлагается на НС1 и атомарный кислород, обладающий сильным бактерицидным действием.
На этом основано применение хлора и его производных для дезинфекции питьевой воды.
При гетеролитическом разрыве связи (гетеролизе) один из атомов забирает себе пару электронов связи, образуя анион или нейтральную молекулу, другой теряет электроны, образуя катион или нейтральную молекулу. Такой разрыв, как правило, характерен для полярных ковалентных связей.
Гетеролитический разрыв связи характерен для процессов диссоциации полярных молекул и обменных реакций в водных растворах, например:
1.5.2 Ионная связь
Ионная связь – связь, возникающая за счет электростатического притяжения между ионами. Ионная связь – это предельный случай ковалентной полярной связи (рисунок 1.5.9). Она образуется между атомами, значительно различающимися, но электроотрицательности (как правило, более 1,8 по шкале Полинга):
Рисунок 1.5.9 – Ионная связь
56
Отметим, что идеальной ионной связи практически не существует. Даже в тех соединениях, которые обычно относят к ионным, не происходит полного перехода электронов от одного атома к другому, электроны частично остаются в общем пользовании. Так, связь во фториде лития на 80% ионная, а на 20% ковалентная, так что правильнее говорить о степени ионности ковалентной связи.
1.5.3 Межмолекулярные взаимодействия. Водородная связь
К межмолекулярным взаимодействиям относят все типы взаимодействий между частицами, приводящие к образованию из них непрочных ассоциатов: ион-ионное (в жидкостях), ион-дипольное, дипольдипольное, диполь – индуцированный диполь, дисперсионные взаимодействия (индуцированный диполь – индуцированный диполь), водородная связь(Е < 150 кДж/моль).
Водородная связь – слабая химическая связь, возникающая между атомами водорода, ковалентно связанными с атомами элементов с высокой ОЭО (N, О, F), другими атомами с достаточно высокой ОЭО, обладающими неподеленной парой электронов (N, О, F).
Различают межмолекулярные и внутримолекулярные водородные связи. Относительно низкая энергия водородной связи позволяет ей легко разрушаться и восстанавливаться при обычных условиях, что особенно важно в биологических системах.
Водородная связь является особым видом химической связи. Известно, что соединения водорода с сильно электроотрицательными неметаллами, такими как F, О, N, имеют аномально высокие значения температуры кипения. Если в ряду Н2Те – H2Se – H2S температура кипения закономерно уменьшается, то при переходе от FI2S к Н20 наблюдается ее резкое увеличение (рисунок 1.5.10). Сходная картина имеет место и в ряду других соединений, в том числе галогеноводородных кислот.
Наблюдаемая аномальная зависимость (рисунок 1.5.10) свидетельствует о наличии специфического взаимодействия между молекулами Н20, HF и NH3. Такое взаимодействие будет затруднять отрыв молекул друг от друга, т.е. уменьшать их летучесть, а следовательно, повышать температуру кипения соответствующих веществ. Вследствие большой разницы в ЭО химические связи Н–X (Х= F, О, N) сильно поляризованы. Поэтому атом водорода имеет положительный эффективный заряд (δ+), а на атомах F, О и N другой молекулы находится избыток электронной плотности, и они заряжены отрицательно (δ-). Происходит взаимодействие положительно заряженного атома водорода одной молекулы с электроотрицательным атомом другой молекулы (Y—H…F, О, N):

57
Рисунок 1.5.10 – Зависимость температуры кипения некоторых водородсодержащих соединений от положения элемента в Периодической таблице
В результате этого образуется трехцентровая водородная связь, и молекулы или фрагменты молекул притягиваются друг к другу (на рисунке 1.5.11 и 1.5.12 тремя точками обозначены водородные связи).
Рисунок 1.5.11 – Водородные связи в молекуле HF
Рисунок 1.5.12 – Водородные связи в молекуле Н20
Вследствии наличия водородных связей молекулы фторида водорода HF в твердом, жидком и даже в газообразном состоянии ассоциированы в
зигзагообразные цепочки (рис. 1.5.11).
58
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары (рис.
1.5.12).
Энергия водородной связи уменьшается с повышением температуры, поэтому вещества в парообразном состоянии реализуют способность к образованию водородной связи лишь в незначительной степени.
Несмотря на то, что энергия водородной связи (21–29 кДж/моль) приблизительно в 10–20 раз меньше энергии ковалентной связи, она обусловливает существование димерных молекул (Н20)2, (HF)2 и муравьиной кислоты в газообразном состоянии.
Именно водородные связи между молекулами заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. В интервале температур от 0 до 100°С, вода уже не имеет упорядоченную межмолекулярную структуру. Поэтому в жидкой воде молекулы связаны между собой в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты — все крупнее. Наконец, образуется лед, который имеет упорядоченную структуру. В кристалле льда между молекулами остаются пустоты. Общий объем увеличивается. Поэтому лед имеет меньшую плотность, чем жидкая вода, и плавает на поверхности воды.
Водородные связи лежат в основе самых тонких явлений жизнедеятельности. Например, именно благодаря этим связям ферменты способны специфически распознавать вещества, реакции которых они ускоряют. Дело в том, что белковая цепь каждого фермента имеет строго определенную пространственную конфигурацию, закрепленную множеством внутримолекулярных водородных связей между группировками атомов С=0 и N–Н. В свою очередь молекула вещества имеет группировки, способные давать водородные связи с определенным участком молекулы фермента – так называемым активным центром. В результате внутримолекулярные связи в этом веществе ослабевают, и ферменты буквально «раскусывают» молекулу.
Но этим не ограничивается роль слабых водородных связей в процессе жизнедеятельности. Именно благодаря таким связям происходит точное копирование молекулы ДНК, передающей из поколения в поколение всю генетическую информацию; водородные связи определяют специфичность действия многих лекарственных препаратов; ответственны они и за вкусовые ощущения, и за способность наших мышц сокращаться.
1.5.4 Металлическая связь. Кристаллические решетки
Металлическая связь – химическая связь в металлах, осуществляемая за счет валентных электронов. Энергия металлической связи в 3–4 раза меньше энергии ковалентной связи. Атомы металлов имеют избыток свободных валентных орбиталей по отношению к числу валентных электронов. При сближении таких атомов электроны приобретают

59
способность относительно свободно перемещаться между ядрами именно благодаря высокой концентрации свободных орбиталей (рис. 1.5.13).
Рисунок 1.5.13 –Пример реализации металлического типа связи
В результате этого в решетке металлов возникают свободные электроны (так называемый электронный газ), непрерывно перемещающиеся между положительными ионами, притягивая их и обеспечивая стабильность решетки.
У переходных металлов часть валентных электронов оказывается локализованной, осуществляя направленные ковалентные связи между атомами. Поскольку ковалентная связь прочнее металлической, у переходных металлов гораздо более высокие температуры плавления и кипения по сравнению со щелочными и щелочноземельными металлами.
Металлическая связь характерна для металлов только в твердом или жидком состоянии. В газообразном состоянии металлы существуют в виде отдельных одноили двухатомных молекул с ковалентными связями.
Кристаллическая решетка металлов. Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, т.е. расположение атомов в них характеризуется определенным порядком – периодичностью как по различным направлениям, так и по разным плоскостям. Этот порядок определяется понятием «кристаллическая решетка». Другими словами, кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Например, меди соответствует гранецеитрированная кристаллическая решетка (2), цинку – гексагональная (4) (рисунок 1.5.14).
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки, и типом взаимодействия между ними. Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых вандерваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.

60
Рисунок 1.5.14 – Простые кристаллические решетки:
1 – простая кубическая; 2 – гранецеитрированная кубическая; 3 –объемноцентрированная кубическая; 4 – гексагональная'
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые вапдерваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицателыюстями (например, галогениды щелочных металлов).
Для описания химической связи в настоящее время используются два подхода: метод валентных связей и метод молекулярных орбиталей.
1.5.5 Метод валентных связей
В методе валентных связей химическая связь рассматривается как двухэлектронная и двухцентровая, т. е. пара электронов, образующих связь, локализована в пространстве между двумя атомами и находится в их общем пользовании. Возможны два механизма образования общей электронной пары. Первый называется обменным и заключается в спаривании двух электронов, принадлежащих разным атомам и имеющим противоположные спины. Его можно выразить следующей схемой:
Второй механизм, называемый донорно-акцепторным, приводит к образованию химической связи за счет предоставления одним атомом в общее пользование пары электронов, а другим – свободной орбитали.
Атом, предоставляющий электронную пару, называется донором, а атом, имеющий свободную орбиталь, – акцептором. Схема образования связи в этом случае выглядит так:
Рассмотрим возможности предсказания состава химических соединений между водородом и элементами второго периода Периодической системы: Li, Be, B, C, N, O, F, так как в атоме водородаимеется только один электрон, и образование связи будет происходить по обменному механизму.

61
Атом лития на 2s-подуровне имеет один неспаренный электрон и, следовательно, соединение должно иметь состав LiH. У атома бериллия этот подуровень заполнен и нет ни одного неспаренного электрона, следовательно, бериллий не должен образовывать ни одной химической связи. У бора и следующих за ним элементов (C, N, O, F) происходит последовательное заполнение 2p-подуровня, и атомы этих элементов будут иметь определенное число неспаренных электронов. Если при образовании связей учитывать только наличие неспаренных электронов, то для этих элементов должны образоваться следующие водородные соединения: BH, CH2, NH3, H2O, HF. Отсюда видно, что, применяя только обменный механизм образования химической связи, можно вступить в противоречие с экспериментальными данными: бериллий образует соединение с водородом состава BeH2, водородные соединения бора также имеют другой состав, а простейшее соединение углерода с водородом имеет состав CH4.Устранить это противоречие можно, предположив, что атомы элементов второго периода в образовании молекул участвуют в возбужденном состоянии, т. е. происходит распаривание s-электронов и переход их на p-подуровень. Но тут возникает другое несоответствие с опытными данными. Поскольку энергии s- и p-электронов различны, то и энергии образуемых ими химических связей должны отличаться, а, следовательно, подобные связи Э–Н должны иметь разную длину (в зависимости от того, орбитали какого типа принимают участие в их образовании). Согласовать теорию и эксперимент можно, введя предположение об усреднении энергий s- и p-подуровней и образовании новых уровней, на которых энергии электронов, находящихся уже на орбиталях другого типа, одинаковы. А раз это так, то по правилу Хунда, в атоме появляется максимальное число неспаренных электронов. Эта гипотеза получила название явления гибридизации, а орбитали, образующиеся в результате усреднения энергий подуровней, называются гибридными. Естественно, что при этом меняются и форма электронных облаков, и их расположение в пространстве. В зависимости от того, какие орбитали участвуют в образовании гибридных орбиталей, рассматривают различные типы гибридизации и пространственные конфигурации образовавшихся гибридных орбиталей (рисунок 1.5.15). Число получившихся гибридных орбиталей должно быть равно общему числу орбиталей, вступивших в гибридизацию. В зависимости от того, какие орбитали взаимодействуют между собой, рассматривают несколько типов гибридизации:
Рисунок 1.5.15 – Пространственное расположение электронных облаков для различных типов гибридизации
62
sp-гибридизация. В этом явлении принимают участие s- и одна p- орбитали, и в результате образуются две орбитали нового типа, которые называются sp-гибридными. Эти орбитали имеют форму, показанную на рисунке, оси их лежат на одной прямой, образуя угол 180°. В образовании связей в молекуле BeH2 принимают участие sp-гибридные орбитали атома берилия и молекула имеет линейное строение;
sp2-гибридизация. Во взаимодействие вступают s- и две p-орбитали, в результате чего образуются три орбитали нового типа, которые называются sp2-гибридными (см. рисунок 1.5.15). Оси этих орбиталей лежат в одной плоскости, и углы между ними равны 120°. Например, атом бора в молекуле BF3 находится в sp2-гибридном состоянии, и эта молекула имеет форму правильного треугольника с атомом бора в центре;
sp 3-гибридизация. В этом случае исходными являются s- и три p- орбитали. В результате гибридизации образуются четыре новые орбитали – sp3-гибридные (см. рисунок 1.5.15). Оси этих орбиталей направлены от центра к вершинам тетраэдра, углы между осями равны 109°28′. CH4 – молекула метана, где реализуется этот тип гибридизации, имеет тетраэдрическое расположение атомов водорода. В молекуле аммиака (NH3) атом азота тоже находится в sp3-гибридном состоянии, три пары электронов являются общими с атомами водорода и участвуют в образовании связей, а одна электронная пара (неподеленная электронная пара) принадлежит только атому азота. Для предсказания геометрии молекулы аммиака атом азота следует поместить в центр тетраэдра, атомы водорода – в три вершины, а неподеленную электронную пару – в четвертую вершину. Естественно, положение этой электронной пары экспериментальными методами зафиксировать невозможно, находят лишь положения атомов водорода и азота. Все это приводит к тому, что молекула аммиака имеет пирамидальную форму. Аналогично можно рассмотреть строение молекулы воды. В ней две неподеленные электронные пары кислорода занимают две вершины тетраэдра, а две другие заняты атомами водорода, что приводит к угловой форме молекулы воды. Описывать геометрию молекулы HF с этих позиций не имеет смысла, т. к. ясно, что она будет линейна, поскольку через две точки можно провести одну прямую линию.
Неподеленная электронная пара образует более размытое «электронное облако», чем связывающая (обобществленная, общая), поэтому она занимает больший объем, приводя к уменьшению валентных углов по сравнению с тетраэдрическими.
Валентные электроны располагаются не только на s- и p-орбиталях, но и на d. Последние также принимают участие в образовании гибридных орбиталей. Осуществляются два случая гибридизации с участием d- орбиталей: sp3d2 и sp3d. В первом случае молекула реализует октаэдрическое строение, а во втором образуется тригональная бипирамида.
63
Предположение об образовании гибридных орбиталей было большим достижением теории валентных связей, но не описывало все возможные пространственные конфигурации молекул, встречающиеся в природе.
Более общую теорию пространственного строения молекул предложил Гиллеспи, исходя из чисто электростатических представлений. Она базировалась на большом экспериментальном материале, обобщенном Сидвиком и Пауэллы. Основные положения теории заключаются в следующем:
1.Геометрия молекулы или иона определяется исключительно числом электронных пар на валентной оболочке центрального атома.
2.Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т. е. электронные пары ведут себя так, как если бы они взаимно отталкивались. Геометрические многогранники, реализующиеся при этом, подчиняются формуле Декарта-Эйлера: «число вершин + число граней – число ребер равно двум».
3.Область пространства, которую занимает несвязывающая неподеленная пара электронов имеет большие размеры, чем та область, которая занята связывающей электронной парой.
4.Размер области пространства, занятой связывающей парой электронов, уменьшается с увеличением электроотрицательности лиганда и с уменьшением электроотрицательности центрального атома.
5.Две электронные пары двойной связи занимают большую область пространства, чем одна электронная пара простой связи.
Обозначения, использованные для описания геометрической конфигурации молекул:
А – многовалентный атом;
X – атомы, связанные с атомом А; n – число атомов X;
E – неподеленная пара электронов;
m – количество неподеленных электронных пар.
Тогда формула молекулы по Гиллеспи записывается так: AXnEm. Геометрия молекулы зависит от суммы n + m. Число n, определяющее количество атомов X, непосредственно присоединенных к атому A, равно и его координационному числу. Каждая электронная пара принимается за точечный заряд. Центральный атом А помещается в центр сферы некоторого радиуса, который для однотипных присоединенных атомов X равен длине связи A–X. На поверхности сферы располагаются точечные электронные пары. Применяя правило максимального удаления электронных пар на сфере друг от друга, можно вывести геометрию простейших молекул и ионов, постепенно увеличивая сумму поделенных и неподеленных пар (рисунок
1.5.16).
Молекулу AX рассматривать не имеет смысла, так как она всегда линейна, сколько бы атом А ни имел неподеленных электронных пар.

64
Молекула AX2 также всегда линейна, так как максимальное отталкивание двух электронных пар располагает их на концах диаметра условной сферы.
Три связывающие электронные пары, максимально удаленные друг от друга, образуют правильный треугольник (молекулы AX3). В этом случае угол X-A-X равен 120°. Такое строение имеют молекулы BF3, AlF3. Если одну из связывающих электронных пар заменить неподеленной парой электронов, молекула будет описываться формулой AX2E и иметь угловое строение, причем, согласно третьему правилу Гиллеспи, угол X-A-X станет меньше 120°. Примером такой геометрии может служить молекула SnF2.
Четыре связывающие пары электронов в пространстве образуют тетраэдр. По Гиллеспи, это тип AX4. Угол X-A-X составит 109°28′.
Рисунок 1.5.16 – Зависимость геометрии молекул от расположения атомов и электронных пар на поверхности сферы
Типичными представителями этого типа молекул являются молекулы CH4, CCl4, SnF4. Последовательно уменьшая число связывающих пар электронов и увеличивая число неподеленных электронных пар, для молекул типа AX3E приходим к их тригональному пирамидальному строению, а для молекул типа AX2E2 – к угловому. Такая геометрия получается, если в вершинах тетраэдра последовательно локализуются неподеленные электронные пары, что приводит к уменьшению тетраэдрического угла.
Примером молекулы типа AX3E является молекула аммиака NH3, а типа AX2E2 – молекула воды H2O.
65
Координационное число «пять» реализуется в молекулах типа AX5. Примерами подобных молекул являются пентафторид и пентахлорид фосфора (PF5, PCl5). Пять атомов галогенов в пространстве занимают вершины тригональной бипирамиды. Три атома располагаются в экваториальной плоскости, образуя равнобедренный треугольник, а два – соответственно над и под этой плоскостью. Расстояние A–X от центра молекулы до одной из вершин пирамиды, называемое аксиальным, больше аналогичного экваториального. Валентный угол между связями, лежащими в экваториальной плоскости, равен 120°, а в аксиальной – 180°. При выводе геометрической формы молекул, являющимися производными от тригональной бипирамиды, для неподеленных электронных пар возникают две альтернативные возможности расположения. При аксиальном расположении она испытывает отталкивание от трех близлежащих атомов, а в экваториальной – от двух. Поэтому первые неподеленные пары электронов всегда занимают экваториальное положение как энергетически наиболее выгодное. Примером может служить молекула тетрафторида серы SF4, которая имеет форму качелей или дисфеноида. В молекулах типа AX3E2, таких, как ClF3 или ICl3, вторая неподеленная электронная пара располагается также в экваториальной плоскости. Поэтому все четыре атома находятся в одной плоскости, напоминая по форме букву Т. За счет того, что неподеленная пара электронов занимает область пространства большего размера, происходит искажение соответствующих валентных углов в сторону их уменьшения. Третья неподеленная пара электронов, также занимая положение в экваториальной плоскости, преобразует Т-образную молекулу в линейную. Представителем молекул типа AX2E3 является молекула XeF2.
Наиболее выгодное размещение шести атомов X вокруг центрального атома A – октаэдрическое. Молекулы типа AX6, например, SF6, имеют форму октаэдра. Первая неподеленная пара электронов занимает любую из вершин октаэдра, превращая его в квадратную пирамиду. Примером молекулы типа AX5E может служить IF5. Для второй электронной пары имеются две возможности расположения: по соседству с первой (цис-положение) и напротив нее (транс-положение). Максимальное отталкивание заставляет принять транс-ориентацию двух электронных пар.
Вследствие этого молекулы типа AX4E2 имеют форму квадрата, например, XeF4. Увеличивая дальше число неподеленных пар электронов для молекул типа AX3E3 и AX2E4, легко прийти к выводу соответственно о Т- образном и линейном их строении. Примеры веществ с таким типом молекул неизвестны.
Аналогичным образом, исходя из теории максимального отталкивания электронных пар, можно предсказать строение молекул с числом электронных пар более шести. Но соединения такого состава практически в дальнейшем встречаться не будут, и поэтому ограничимся лишь рассмотрением геометрии молекул, описанных выше.

66
Таким образом, теория валентных связей и максимального отталкивания электронных пар обладает лишь предсказательной силой в обосновании геометрии молекул. Объяснить же многие другие экспериментальные факты они не могут. Эти методы несостоятельны при описании электрондефицитных молекул, таких как бороводороды, с нечетным числом электронов. Они также испытывают большие трудности при объяснении цвета соединений и предсказании их магнитных свойств.
1.5.6 Метод молекулярных орбиталей
Большей предсказательной силой обладает метод молекулярных орбиталей (МО). В нем молекула рассматривается как единая система ядер и электронов. Последние находятся в общем пользовании всех ядер атомов, образующих молекулу. Таким образом, метод МО химическую связь рассматривает как многоцентровую и многоэлектронную. В этом случае для приближенного решения уравнения Шредингера волновая функция, соответствующая молекулярной орбитали, задается как линейная комбинация атомных орбиталей, т. е. как сумма и разность атомных волновых функций с коэффициентами, указывающими на долю их вклада в образование молекулярной орбитали:
Полученный метод получил название линейной комбинации атомных орбиталей (ЛКАО-МО).
В методе ЛКАО МО для образования устойчивой молекулярной орбитали необходимо, чтобы энергии атомных орбиталей были близки друг к другу. Кроме того, нужно, чтобы их симметрия не сильно отличалась. При выполнении этих двух требований коэффициенты c1 и c2 должны быть близкими по своим значениям, а это, в свою очередь, обеспечивает максимальное перекрывание электронных облаков. При сложении атомных орбиталей образуется молекулярная орбиталь, энергия которой понижается относительно энергий атомных орбиталей. Такая молекулярная орбиталь называется связывающей. Волновая функция, соответствующая связывающей орбитали, получается в результате сложения волновых функций с одинаковым знаком. Электронная плотность при этом концентрируется между ядрами, и волновая функция принимает положительное значение. При вычитании атомных орбиталей энергия молекулярной орбитали повышается. Эта орбиталь называется разрыхляющей. Электронная плотность в этом случае располагается за ядрами, а между ними равна нулю. Волновая функция в двух образовавшихся электронных облаках имеет противоположные знаки, что хорошо видно из схемы образования связывающей и разрыхляющей орбиталей, приведенной на рисунке 1.5.17:

67
Рисунок 1.5.17 – Схема образования связывающей и разрыхляющей молекулярных орбиталей
Когда атомная орбиталь одного из атомов вследствие большой разницы в энергии или симметрии не может взаимодействовать с атомной орбиталью другого атома, она переходит в энергетическую схему молекулярных орбиталей молекулы с энергией, соответствующей ей в атоме. Орбиталь этого типа называется несвязывающей.
Классификация орбиталей на σ или π производится в соответствии с симметрией их электронных облаков аналогично σ- и π-связям в методе валентных связей: σ-орбиталь имеет такую симметрию электронного облака, при которой поворот ее вокруг оси, соединяющей ядра, на 180° приводит к орбитали, по форме не отличимой от первоначальной. Знак волновой функции при этом не меняется. В случае же π-орбитали при повороте ее на 180° знак волновой функции меняется на противоположный. Отсюда следует, что s-электроны атомов при взаимодействии между собой могут образовывать только σ-орбитали, а три (шесть) p-орбитали атома – одну σ- и две π-орбитали, причем σ-орбиталь возникает при взаимодействии pX атомных орбиталей, а π-орбиталь – при взаимодействии pY и pZ. Молекулярные π-орбитали повернуты относительно межъядерной оси на 90°. Здесь наблюдается полная аналогия с методом валентных связей.
Для того чтобы отличать связывающие и разрыхляющие орбитали друг от друга, а также их происхождение, принята следующая система обозначений. Связывающая орбиталь обозначается сокращением «св», располагающимся справа вверху после греческой буквы, обозначающей орбиталь, а разрыхляющая – соответственно «разр». Принято еще одно обозначение: звездочкой помечаются разрыхляющие орбитали, а без звездочки – связывающие. После обозначения молекулярной орбитали пишется обозначение атомной орбитали, которой молекулярная обязана своим происхождением, например, πразр2py. Это означает, что молекулярная орбиталь π-типа, разрыхляющая, образовалась при взаимодействии 2 pyатомных орбиталей (рисуноук 1.5.18):

68
Рисунок 1.5.18 – Схема образования связывающих и разрыхляющих орбиталей для 2р-атомных орбиталей
При рассмотрении электронного строения молекулы с точки зрения метода молекулярных орбиталей (МО) нужно руководствоваться следующими правилами:
1.Электроны в молекуле, как и в атоме, занимают соответствующие орбитали, которые характеризуются своим набором квантовых чисел;
2.Число образующихся молекулярных орбиталей равно числу атомных орбиталей участвующих в их образовании;
3.Распределение электронов по молекулярным орбиталям, так же как и
ватоме, подчиняется принципу наименьшей энергии, принципу Паули и правилу Хунда;
4.Для молекул, образованных атомами одного химического элемента (гомоядерных), выигрыш в энергии за счет образования связывающей орбитали компенсируется повышением энергии разрыхляющей орбитали.
На энергетической диаграмме обе орбитали располагаются симметрично относительно атомных орбиталей (рисунок 1.5.19):
Рисунок 1.5.19 – Энергетическая диаграмма молекулярных орбиталей для гомоядерных молекул (на примере молекулы водорода)
5. В гетероядерных (разноэлементных) молекулах связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома (B), а разрыхляющие – ближе к орбитали менее электроотрицательного атома
(A). Разность в энергиях исходных атомных орбиталей (b) равна полярности связи. Эта разность является мерой ионности связи, а разность в энергиях между связывающей орбиталью и атомной орбиталью более

69
электроотрицательного атома определяет ковалентность связи (рисунок
1.5.20):
Рисунок 1.5.20 –Энергетическая диаграмма молекулярных орбиталей для гетероядерной молекулы
6. Кратность химической связи равна половине разности числа электронов, расположенных на связывающих орбиталях, и числа электронов на разрыхляющих.
Для примера разберем энергетические диаграммы и электронное строение гетероядерных и гомоядерных молекул и ионов, образованных двумя атомами элементов первого и второго периодов Периодической системы.
У элементов первого периода валентной орбиталью является 1sорбиталь. Эти две атомных орбитали образуют две -молекулярные орбитали
– связывающую и разрыхляющую. Рассмотрим электронное строение молекулярного иона H2+ . Он имеет один электрон, который будет занимать более энергетически выгодную s-связывающую орбиталь. В соответствии с правилом подсчета кратности связи она будет равна 0,5, а так как в ионе имеется один неспаренный электрон, H2+ будет обладать парамагнитными свойствами. Электронное строение этого иона запишется по аналогии с электронным строением атома так: св1s1. Появление второго электрона на s- связывающей орбитали приведет к энергетической диаграмме, описывающей молекулу водорода, возрастанию кратности связи до единицы и диамагнитным свойствам. Возрастание кратности связи повлечет за собой и увеличение энергии диссоциации молекулы H2 и более короткому межъядерному расстоянию по сравнению с аналогичной величиной у иона водорода. Электронное строение H2 можно записать так: св1s2.
Двухатомная молекула He2 существовать не будет, так как имеющиеся у двух атомов гелия четыре электрона расположатся на связывающей и

70
разрыхляющей орбиталях, что приводит к нулевой кратности связи. Но в то же время ион He2+ будет устойчив и кратность связи в нем равна 0,5. Так же, как и ион водорода, этот ион будет обладать парамагнитными свойствами.
У элементов второго периода появляются еще четыре атомных орбитали: 2s, 2px, 2py, 2pz, которые будут принимать участие в образовании молекулярных орбиталей. Различие в энергиях 2s- и 2p-орбиталей велико, и они не будут взаимодействовать между собой с образованием молекулярных орбиталей. Эта разница в энергиях при переходе от первого элемента к последнему будет увеличиваться. В связи с этим обстоятельством электронное строение двухатомных гомоядерных молекул элементов второго периода будет описываться двумя энергетическими диаграммами,
отличающимися порядком расположения на них св2px и св2py,z. При относительной энергетической близости 2s- и 2p-орбиталей, наблюдаемой в
начале периода, включая атом азота, электроны, находящиеся на разр2s- исв2px-орбиталях, взаимно отталкиваются. Поэтому св2py- и св2pz-орбитали оказываются энергетически более выгодными, чем св2px-орбиталь. На рисунке 1.5.21 представлены обе диаграммы.
Так как участие 1s-электронов в образовании химической связи незначительно, их можно не учитывать при электронном описании строения молекул, образованных элементами второго периода.
Представленные на рисунке 1.5.21 энергетические диаграммы, подтвержденные спектроскопическими данными, показывают следующий порядок размещения молекулярных орбиталей с увеличением энергии от Li2 до N2 включительно:
σсвяз1s< σразр1s<< σсвяз2s< σразр2s< πСВ2pУ = πСВ2pz < σсвяз2pX< πразр2pУ < πразр2pz << σразр2pX;
а от O2 и далее:
σсвяз1s< σразр1s<< σсвяз2s< σразр2s<< σсвяз2pX< πСВ2pУ = πСВ2pz < πразр2pУ < πразр2pz << σразр2pX.
Рисугок 1.5.21 – Энергетические диаграммы уровней двухатомных молекул при значительном и незначительном энергетическом различии атомных 2s- и 2pорбиталей
71
Второй период системы открывают литий и бериллий, у которых внешний энергетический уровень содержит лишь s-электроны. Для этих элементов схема молекулярных орбиталей ничем не будет отличаться от энергетических диаграмм молекул и ионов водорода и гелия, с той лишь разницей, что у последних она построена из 1s-электронов, а у Li2 и Be2 – из 2s-электронов. 1s-электроны лития и бериллия можно рассматривать как несвязывающие, т. е. принадлежащие отдельным атомам. Здесь будут наблюдаться те же закономерности в изменении порядка связи, энергии диссоциации и магнитных свойств. Ион Li2+ имеет один неспаренный электрон, расположенный на св2s-орбитали – ион парамагнитен.
Появление второго электрона на этой орбитали приведет к увеличению энергии диссоциации молекулы Li2 и возрастанию кратности связи с 0,5 до 1. Магнитные свойства приобретут диамагнитный характер. Третий s-электрон расположится на разр-орбитали, что будет способствовать уменьшению кратности связи до 0,5 и, как следствие этого, понижению энергии диссоциации. Такое электронное строение имеет парамагнитный ион Be2+. Молекула Be2, так же как и He2, существовать не может из-за нулевого порядка связи. У этих молекул число связывающих электронов равно числу разрыхляющих.
Дальнейшее заполнение молекулярных энергетических уровней для двухатомных гомоядерных молекул и некоторых ионов элементов второго периода показано на рисунке 1.5.22.
Как видно из рисунка, по мере заполнения связывающих орбиталей энергия диссоциации молекул увеличивается, а с появлением электронов на разрыхляющих орбиталях уменьшается. Ряд заканчивается нестабильной молекулой Ne. Из рисунка также видно, что удаление электрона с разрыхляющей орбитали приводит к повышению кратности связи и, как следствие этого, увеличению энергии диссоциации и уменьшению межъядерного расстояния. Ионизация молекулы, сопровождаемаяудалением связывающего электрона дает прямо противоположный эффект.
Сравните энергетические диаграммы следующих двух пар молекул и ионов: O2+ , O2, N2+ , N2, приведенные на рисунке 1.5.22:
Гетероядерные молекулы. Из двухатомных молекул самой прочной является молекула азота, кратность связи в которой равна трем. Логично предположить, что у гетероядерных молекул и однозарядных ионов, имеющих одинаковое число электронов с N2 – четырнадцать, – кратность связи будет такой же. Такими молекулами являются CO, BF, BeNe и ионы CN–, NO+, CF+, BO–. По аналогии с молекулой азота они должны обладать высокими значениями энергий диссоциации. Такой вывод нетрудно сделать, распространяя схему молекулярных орбиталей гомоядерных молекул на гетероядерные. При этом надо учитывать, что 2s- и p-орбитали с увеличением заряда ядра понижают свою энергию, а расщепление между ними по энергии растет.
72
Рисунок 1.5.22 – Энергетические диаграммы двухатомных молекул и ионов элементов второго периода Периодической системы
Вследствие этого появляются существенные отличия в образовании молекулярных орбиталей у некоторых гетероядерных молекул от гомоядерных. Проиллюстрируем это утверждение на примере иона NO+ и молекулы CO.
Поскольку заряды ядер атомов азота и кислорода отличаются на единицу, существенного отличия в энергиях их атомных орбиталей не наблюдается и схема молекулярных орбиталей иона NO+ будет аналогична схеме молекулярных орбиталей молекулы азота (рисунок 1.5.23а).
Рисунок 1.5.23 – Энергетические диаграммы для иона NO+ (a) и молекулы СО (б)
Все орбитали атома кислорода по энергии расположены ниже, чем соответствующие атомные орбитали атома углерода, т. к. заряд ядра кислорода на две единицы больше. Результатом этих энергетических различий будет существенное отличие молекулярных орбиталей оксида углерода от молекулярных орбиталей иона NO+ (рисунок 1.5.23б). 2s-
73
орбиталь кислорода располагается значительно ниже 2s-орбитали углерода, следствием чего является их слабое взаимодействие, приводящее к образованию слабосвязывающей св-орбитали, энергия которой практически не отличается от атомной 2s-орбитали кислорода. В то же время энергии 2pорбиталей кислорода и 2s-орбитали углерода близки. Эта близость приводит к образованию двух св -связывающий и разр -разрыхляющей орбиталей. Если верхняя занятая -орбиталь в ионе NO+ обладает ярко выраженным связывающим характером, то в молекуле CO эта орбиталь является слаборазрыхляющей. Поэтому ион СО+ имеет энергию диссоциации несколько большую, чем молекула СО. Образование других перечисленных выше молекул и ионов сомнительно, т. к. в них энергетические различия еще больше, чем у СО.
Металлическая связь. В отличие от ионных и ковалентных соединений металлы отличаются высокой электропроводностью и теплопроводностью. Высокая электропроводность металлов указывает на то, что электроны свободно могут передвигаться во всем его объеме.
Иными словами, металл можно рассматривать как кристалл, в узлах решетки которого расположены ионы, связанные электронами, находящимися в общем пользовании, т. е. в металлах имеет место сильно нелокализованная химическая связь. Совокупность электронов, обеспечивающих эту связь, называют электронным газом.
Более общий подход к представлению о ионных, ковалентных и металлических кристаллов можно получить, применяя представлениеметода молекулярных орбиталей к ним. Предположим, что твердое тело представляет из себя единую молекулу, образованную большим числом атомов. Внешние орбитали этих атомов при взаимодействии образуют связывающие и несвязывающие молекулярные орбитали. Энергетическая зоны, образованные связывающими молекулярными орбиталями, называют валентной зоной. Зона, объединяющая несвязывающие орбитали, называется зоной проводимости. Энергетические различия электронов в пределах зоны малы, и изменение их энергии в зоне можно представить, как непрерывную полосу энергии. Между зоной проводимости и валентной зоной отсутствуют какие-либо уровни энергий. Поэтому там электроны находиться не могут. Энергетическая зона, разделяющая валентную зону и зону проводимости, носит название запрещенной.
Рисунок 1.5.24 – Энергетические зоны в кристалле, образованные атомными орбиталями
74
Электропроводность в твердом теле обеспечивается преодолением электронами запрещенной зоны, т. е. протекание электрического тока обеспечивается переходом электронов из валентной зоны в зону проводимости. В зависимости от ширины запрещенной зоны все твердые тела можно разделить на три класса: диэлектрики, полупроводники и проводники-металлы. Для изоляторов ширина запрещенной зоны составляет более 3 электронвольт, для полупроводников она лежит в пределах от 0,1 до 3 эВ. В металлах вследствие перекрывания валентной зоны и зоны проводимости запрещенная зона практически отсутствует.

75
1.6 ХИМИЧЕСКИЕ РЕАКЦИИ
ПЛАН
1.6.1Химическая кинетика.
1.6.2Химическое равновесие.
1.6.1 Химическая кинетика
Кинетика – наука о скоростях и механизмах процессов.
Химическая кинетика изучает скорости и механизмы химических реакций.
Под скоростью химической реакции понимается число элементарных актов взаимодействия реагентов в единицу времени (сек., мин., час) в единице объема (мл, литр, м3) – для гомогенных реакций или на единице поверхности для гетерогенных.
На практике скорость химической реакции выражается изменением концентрации реагентов или продуктов в единицу времени.
(1.6.1)
Классификация химических реакций
а) Гомогенные – реакции в которых реагенты находятся в одном агрегатном состоянии
б) Гетерогенные – реакции в которых реагенты находятся в различных агрегатных состояниях.
Классификация типов реакцийв химической кинетике:
1.Простые.
2.Сложные.
Простая или элементарная реакция протекает в одну стадию, без образования промежуточных веществ.
Простые реакции делятся на:
1) мономолекулярные – в элементарном акте участвует одна молекула (разложение):
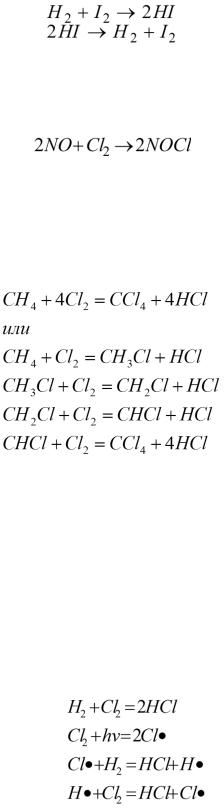
76
2)бимолекулярные – в элементарном акте участвуют 2 молекулы (столкновение двух молекул):
3)трехмолекулярные – в элементарном акте участвуют три молекулы, вероятность их столкновения мала:
Сложные реакции протекают в несколько стадий с образованием промежуточных продуктов. Сложные реакции бывают:
1) последовательные – связанная система реакций, в которых продукты предыдущих стадий расходуются в последующих:
2)параллельные реакции – связанная система реакций, имеющих одни
ите же исходные реагенты, но различные продукты реакции.
4 KClO3 = 4 KCl + 6O2
4 KClO3 = 3 KClO4 + KCl
3) цепные реакции – связанная система сложных реакций, протекающих последовательно, параллельно и сопряженно с участием свободных радикалов:
Закон действующих масс (Гульдберг и Вааге): скорость химической реакции пропорциональна концентрации реагирующих веществ.

77
(1.6.2)
где: k – константа скорости химической реакции,
СА, СВ – молярные концентрации реагентов в любой момент времени моль/л,
a, b – стехиометрические коэффициенты,
а– порядок реакции по веществу А, b – порядок реакции по веществу В,
а+ b –общий кинетический порядок реакции. Общий порядок простой реакции совпадает с ее молекулярностью.
Пример:
-по N2O первый порядок,
-по Н2 первый порядок, суммарный второй.
Для простой реакции общий порядок равен сумме частных порядков.
Если реакция сложная, то происходит ряд промежуточных превращений и порядок реакции равен порядку реакции лимитирующей стадии.
В сложных реакциях порядок реакции не совпадает с ее молекулярностью. Молекулярность – это число одновременно сталкивающихся молекул.
Пример: Реакция образования воды, сложная цепная реакция:
2Н2 + О2 = 2Н2О
Н2 + О2 = ОН• + ОН• ОН• + Н2 = Н2О + Н• Н• + О2= ОН• + О• О• + Н2 = ОН• + Н•
-порядок по водороду – 0,4;
-порядок по кислороду – 0,3;
-сумма равна 0,7;

78
-порядок реакции не совпадает со стехиометрическими коэффициентами;
-молекулярность равна трем.
Влияние температуры на скорость химической реакции (Правило Вант-Гоффа): чем выше температура, тем больше скорость химической реакции.
При увеличении температуры на каждые 100 скорость химической реакции увеличивается в 2-4 раза.
(1.6.3)
Где, Т2 > Т1 , γ – температурный коэффициент Вант-Гоффа, показывает во сколько
раз возросла скорость химической реакции.
Энергия активации. Первое условие протекания реакции является столкновение реагирующих молекул, но не каждое столкновение приводит к реакции, реагируют только те молекулы, у которых кинетическая ЕК достаточна для преодоления отталкивания электронных оболочек, эта повышенная энергия достаточная для взаимодействия молекул, называется
энергией активации Еа кДж/моль.
Энергия активации характеристика реакции в целом, а не для вещества. Энергия активации – это наименьшая энергия необходимая для того,
чтобы молекула прореагировала.
Реакция начинается только между теми частицами, которые обладают повышенной энергией, такие частицы при столкновении сначала образуют активированный комплекс, что-то вроде промежуточного соединения, существующего в течение очень короткого времени. Затем активированный комплекс разрушается с образованием продуктов реакции. Образование активированного комплекса более энергетически выгодно, чем предварительный полный распад молекул, вступающих в реакцию.
Зависимость константы скорости k химической реакции от температуры T устанавливает уравнение Аррениуса:
(1.6.4)
Где, К – константа скорости реакции, е – основание натурального логарифма, Т – температура, в К,
R – молярная газовая постоянная 8,31 Дж/моль·К Еа – энергия активации, Дж/моль,
79
А – предэкспоненциальный множитель, показывает общее число столкновений.
Скорость химической реакции в значительной мере зависит от энергии активации. Для подавляющего большинства реакций она лежит в пределах от 50 до 250 кДж/моль. Реакции, для которых Еа >150 кДж/моль при комнатной температуре, практически не протекают.
Влияние давления на скорость химической реакции. Если в реакции участвуют газообразные вещества, то повышение давления равносильно сжатию газа, т.е. увеличению его концентрации.
При увеличении концентрации газообразного компонента скорость реакции в соответствии с законом действующих масс возрастает.
При понижении давления газ расширяется, и его концентрация в системе падает, это вызывает уменьшение скорости реакции.
↑ давления → ↑ конц-ции газа → ↑ v х.р. ↓ давления → ↓ конц-ции газа → ↓ v х.р.
Катализ. Это один из наиболее распространенных в химической практике методов ускорения химических реакций
Катализаторы – это вещества, которые ускоряют химические реакции за счет участия в образовании промежуточных соединений, в состав продуктов они не входят и следовательно, в реакции не расходуются.
Иначе говоря, в присутствии катализатора возникают другие активированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов, возникающих без катализатора.
Таким образом в присутствии катализаторов энергия активации реакции понижается.
Уменьшение энергии активации приводит к увеличению скорости реакции.
Если катализатор и взаимодействующие вещества находятся в одной фазе, катализ называется гомогенным. Если катализатор находится в системе в виде самостоятельной фазы – гетерогенным.
Влияние катализатора на скорость реакции при гомогенном катализе объясняется образованием промежуточного соединения катализатора с реагирующим веществом. Так, медленно протекающая реакция А+В=АВ ускоряется катализатором К, вследствие образования реакционноспособного промежуточного соединения А+К=АК, которое взаимодействует с другим исходным веществом В с образованием продукта реакции АВ и выделением катализатора К в первоначальном виде АК+В=АВ+К.
1.6.2 Химическое равновесие
Состояние равновесия – это такое состояние системы, при которой ΔG = 0, а скорость прямой реакции равна скорости обратной:
аА + вВ = сС + dD
V прямой = V обратной

80
Константа равновесия характеризует количественное состояние равновесия
(1.6.5)
Для расчета константы равновесия используются равновесные концентрации.
Если в реакции все вещества находятся в газообразном состоянии, то вместо равновесных концентраций можно использовать значения парциальных давлений.
Парциальное давление – это такое давление газа, входящего в смесь, которое он оказывал бы, если бы занимал тот объем, который занимает вся смесь.
Пример:
Смещение равновесия. При изменении внешних условий меняются равновесные концентрации, происходит смещение равновесия. Направление смещения химического равновесия при изменении внешних условий определяется правилом Ле-Шателье: при внешнем воздействии
равновесие смещается в сторону ослабления этого воздействия.
Факторы, влияющие на химическое равновесие: 1. Температура
Повышение температуры – смещает равновесие в сторону эндотермической реакции.
Понижение температуры – смещает равновесие в сторону экзотермической реакции.
2. Давление Повышение давления смещает равновесие в сторону меньшего объема.
Н2 + N2 → 2NH3
3 1 →2
Если равные объемы, то давление не влияет на смещение равновесия.
3.Концентрация
Повышение концентрации исходных веществ смещает равновесие в сторону продуктов реакции.
Повышение концентрации продуктов реакции смещает равновесие в сторону исходных веществ.
Введение катализатора не влияет на смещение равновесия, но ускоряет процесс достижения равновесия.
81
ТЕМА 1.7 РАСТВОРЫ
ПЛАН
1.7.1Общие представления о растворах.
1.7.1.1.Характеристика растворов.
1.7.1.2 Физическая и сольватная теории растворов. 1.7.1.3 Растворы твердых веществ в жидкостях. 1.7.1.4 Растворы жидкостей в жидкостях.
1.7.1.5 Растворы газов в жидкостях.
1.7.1.6 Способы выражения состава растворов.
1.7.2Свойства разбавленных растворов неэлектролитов. 1.7.2.1 Давление пара растворов. Первый закон Рауля. 1.7.2.2 Замерзание и кипение растворов. Второй закон Рауля. 1.7.2.3 Осмотическое давление. Закон Вант-Гоффа.
1.7.3Свойства растворов электролитов.
1.7.3.1Особенности применения законов Вант-Гоффа и Рауля к растворам электролитов. Степень ионизации.
1.7.3.2Константа диссоциации. Закон разведения Оствальда.
1.7.3.3Теория кислот и оснований Бренстеда и Лоури.
1.7.4Ионное произведение воды. Величина РН – мера активной кислотности среды.
1.7.5Гидролиз солей.
1.7.5.1Типы гидролиза.
1.7.5.2Ступенчатый гидролиз.
1.7.5.3Степень гидролиза. Константа гидролиза.
1.7.6 Гетерогенные равновесия. Константа растворимости. Условия образования и растворения осадков.
1.7.1 Общие представления о растворах
Растворы играют важное значение в жизни и практической деятельности человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.). Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов.
Всякий раствор состоит, по крайней мере, из двух компонентов: вещества – растворителя и растворенного вещества. Растворителем обычно считают то вещество, которое, образуя раствор, не меняет своего агрегатного состояния либо присутствует в большем количестве. Однако такой подход в ряде случаев неправомерен. Так, например, высококонцентрированные растворы солей представляют собой растворы воды в раздвинутой разупорядоченной кристаллической решетке электролита. Понятия
82
«растворитель» и «растворяемое вещество» имеют, таким образом, реальный смысл для сильно разбавленных растворов.
Характерной чертой растворов (точнее, истинных растворов) является диспергирование веществ – компонентов раствора до состояния молекул, ионов или атомов. Такие системы называют молекулярно-дисперсными. Это сообщает растворам свойство однородности, что позволяет отнести их к гомогенным системам. Следовательно, истинные (или просто) растворы – гомогенные молекулярно-дисперсные системы.
1.7.1.1 Характеристика растворов
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах.
Растворы обладают признаками, как химических соединений (химических систем), так и механических смесей (физических систем).
Общее между механическими смесями и растворами состоит в том, что и те и другие, могут быть переменного состава, тогда как у химических соединений состав обычно постоянен. В растворах и смесях компоненты, их образующие, не утрачивают своих индивидуальных свойств (например, кислород остается самим собой при растворении его в воде), в химических же соединениях свойства первоначально взятых веществ не сохраняются. Вместе с тем растворы отличаются от смесей. Первые – гомогенны (это их приближает к химическим соединениям), вторые – гетерогенны. Кроме того, ряд явлений, возникающих при растворении (в отличие от смесей), указывает на химическое взаимодействие растворителя с растворяемым веществом: тепловые эффекты; выделение из растворов кристаллов, в состав которых входит вода (кристаллогидраты); сжатие растворов и др. Такие двойственные признаки у растворов позволяют отнести их к физико-химическим системам. Раствор приходит в устойчивое состояние лишь после того, как в нем произойдут физико-химические превращения.
Взависимости от агрегатного состояния растворы могут быть газовые, жидкие и твердые.
Вгазовых растворах (смесях) наблюдается неограниченная взаимная растворимость газов, обусловленная слабым межмолекулярным взаимодействием. Растворимость в газах жидких и твердых тел возрастает с увеличением давления, когда плотность газов приближается к плотности жидкостей и проявление сил адгезии становится ощутимым.
Жидкие растворы наиболее распространены. Все природные воды (морская, речная, озерная, подземная) представляют собой растворы различных веществ. Жидкие солевые растворы содержатся в клетках животных и растительных организмов, в среде которых протекают биологические реакции. В лабораторной практике, химической технологии, холодильном деле, различных промышленных производствах широко применяются жидкие растворы.
83
Из твердых растворов весьма важны системы, образующиеся при сплавлении некоторых металлов.
Таким образом, растворителем обычно является жидкость или твердое вещество с большей массой, а растворяемым – вещество в любом агрегатном состоянии: жидком, твердом или газообразном.
Растворение кристалла в жидкости протекает следующим образом. Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы. Последние благодаря диффузии равномерно распределяются по всему объему растворителя. Отделение молекул от поверхности твердого тела вызывается, с одной стороны, их собственным колебательным движением, а с другой, – притяжением со стороны молекул растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы одновременно не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность еще нерастворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов. Понятно, что выделение молекул из раствора будет идти тем быстрее, чем выше их концентрация в растворе. А так как последняя по мере растворения вещества увеличивается, то, наконец, наступает такой момент, когда скорость растворения становится равной скорости кристаллизации. Тогда устанавливается динамическое равновесие, при котором в единицу времени столько же молекул растворяется, сколько и выделяется из раствора. Раствор, находящийся в равновесии с растворяющимся веществом,
называется насыщенным раствором.
1.7.1.2 Физическая и сольватная теории растворов
Как уже отмечалось, по ряду признаков растворы могут быть расценены как физические системы. Некоторые свойства растворов, например, осмотическое давление, понижение температуры замерзания и другие, зависят не от природы растворенного вещества, а от числа частиц, находящихся в растворе. Эти факты позволили сформировавшейся к концу XIX в. физической теории растворов рассматривать их как смеси и отрицать химическое взаимодействие растворителя с растворяемым веществом.
Д.И. Менделеев в работах «Рассуждение о соединении спирта с водой» (1865) и «Исследование растворов по удельному весу» (1887) пришел к противоположному выводу о том, что растворитель не является индифферентной средой, а взаимодействует с растворяемым веществом (химическая, или сольватная, теория).
Действительно, растворение в воде спирта или серной кислоты ведет к разогреванию раствора, что указывает на взаимодействие компонентов раствора. Помимо энергетического эффекта, растворение веществ в ряде случаев сопровождается сжатием растворов (явление контракции) за счет образования продуктов взаимодействия. Например, для получения 1000 мл
84
спирта крепостью 40 % требуется израсходовать 400 мл безводного спирта и 633 мл воды, общий объем которых на 33 мл больше объема раствора. Наконец, образование окрашенных ионов, например, [Cu(OH2)4]2+, из бесцветной безводной соли CuSO4 также свидетельствует о взаимодействии компонентов раствора.
Процесс взаимодействия растворителя с растворяемым веществом называется сольватацией, а продукты взаимодействия – сольватами. Если растворителем является вода, процесс носит название гидратации, а продукты – гидратов. Изучение сольватов (гидратов) показало, что они представляют собой образования из молекул или молекул и ионов, между которыми проявляются ван-дер-ваальсовы силы (особенно, если молекулы полярны) либо возникают водородные и донорно-акцепторные связи, например, при ионнодипольном взаимодействии. В последнем случае ионы связаны с молекулами воды в аквакомплексы.
Сольватация – экзотермический процесс. Сольваты (гидраты) не являются химическими соединениями, поскольку в химических соединениях связь ковалентная или ионная, а в гидратированных ионах и молекулах осуществляется донорно-акцепторная и водородная связь, либо связь слабыми ван-дер-ваальсовыми силами. Для ряда сольватов (гидратов) не сохраняется постоянный состав, он может меняться с изменением концентрации и температуры. С повышением концентрации вещества или ростом температуры число молекул воды, входящих в гидрат (или аквакомплекс), снижается вследствие уменьшения доли растворителя в растворе и ослабления ориентационного взаимодействия, связанного с усилением теплового движения. Например, при различной концентрации трехокиси серы из водного раствора при охлаждении выпадают кристаллы состава H2SO4·4H2O, H2SO4·2H2O, H2SO4·H2O и др. Для спирта установлены гидраты состава С2Н5ОН·3Н2О, С2Н5ОН·4Н2О, С2Н5ОН·8Н2О. Эти относительно нестойкие соединения растворителя с растворенным веществом, способные существовать только в растворе, находятся в подвижном равновесии друг с другом и продук-тами их распада, так что раствор являет собой динамически равновесную систему.
С изменением концентрации меняется внутренняя структура растворов. Для разбавленных водных растворов она определяется структурой растворителя, для концентрированных – главным образом, структурой второго компонента, так как в последнем случае вода растворена в веществе. Молекулы воды распределяются в разупорядоченной кристаллической решетке вещества, частицы которого раздвинуты в пространстве. При высокой концентрации многозарядных ионов происходит структурирование растворителя.
Следовательно, сольватная теория подразумевает образование раствора как следствие взаимодействия между частицами его компонентов и существование как результат обменного взаимодействия между всеми
85
частицами, в том числе и вновь возникшими в процессе растворения. Таковы основные положения гидратной теории растворов.
К растворам приложима как физическая, так и гидратная теория. Для сильно разбавленных растворов, где сольватация не оказывает заметного влияния на структуру и свойства растворителя, или, например, для растворов неполярных жидкостей, где сольватация не имеет места, применима физическая теория. Водные растворы, в которых второй компонент – полярное вещество или ионное соединение, удовлетворительно описываются гидратной теорией. Поэтому современная теория растворов является синтезом физической и химической теорий.
1.7.1.3 Растворы твердых веществ в жидкостях
Хотя растворителями могут быть самые разнообразные жидкости, в большинстве случаев имеют дело с водными растворами. Разные вещества растворяются в воде в различной степени. Мерой их растворимости является концентрация насыщенного раствора, т.е. такая концентрация, при которой осадок, образованный растворяемым веществом, находится в равновесии с жидкостью (при этом новая порция вещества, внесенная в раствор, растворяться не будет). Численно растворимость может быть выражена теми же способами, что и состав, например, процентным отношением массы растворенного вещества к массе насыщенного раствора или количеством растворенного вещества, содержащимся в 1 л насыщенного раствора. Часто растворимость выражают также числом единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя; инода выраженную этим способом растворимость называют коэффициентом растворимости.
Растворимость различных веществ в воде изменяется в широких пределах. Если в 100 г воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым; если растворяется менее 1 г вещества – малорастворимым и, наконец, практически нерастворимым, если в раствор переходит менее 0,01 г вещества.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако обычно вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак), а неполярные вещества – в неполярных растворителях (бензол, сероуглерод).
Растворение большинства твердых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решетки твердого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов). Прилагая принцип Ле Шателье к равновесию между веществом в кристаллическом состоянии и его насыщенным раствором приходим к выводу, что в тех случаях, когда вещество растворяется с
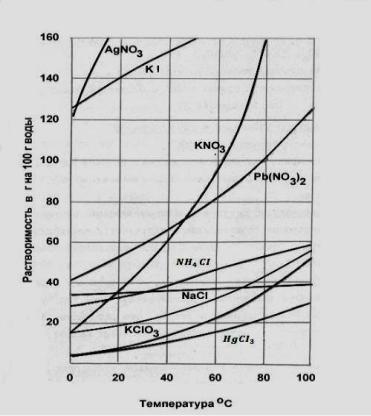
86
поглощением энергии, повышение температуры должно приводить к увеличению его растворимости.
КРИСТАЛЛ + РАСТВОРИТЕЛЬ ↔ НАСЫЩЕННЫЙ РАСТВОР ± Q
Если же, однако, энергия гидратации (сольватации) достаточно велика, чтобы образование раствора сопровождалось выделением энергии, растворимость с ростом температуры понижается. Это происходит, например, при растворении в воде многих солей лития, магния, алюминия.
Зависимость между растворимостью и температурой очень удобно изображать графически – в виде кривых растворимости. Для построения кривой растворимости откладывают на горизонтальной оси температуру, а на вертикальной – растворимость вещества при соответствующей температуре.
На рисунке 1.7 приведено несколько характерных кривых растворимости. Резко поднимающиеся вверх кривые растворимости нитратов калия, свинца, серебра показывают, что с повышением температуры растворимость этих веществ сильно возрастает. Растворимость хлорида натрия лишь незначительно изменяется по мере повышения температуры, что показывает почти горизонтальная кривая растворимости этой соли.
Рисунок 1.7 – Растворимость солей
В целом изменение растворимости с повышением температуры происходит неравномерно и индивидуально для каждого вещества. Растворимость большинства твердых веществ с повышением температуры увеличивается.
87
При растворении твердых тел в воде объем системы обычно изменяется незначительно. Поэтому растворимость веществ, находящихся в твердом состоянии, практически не зависит от давления.
1.7.1.4 Растворы жидкостей в жидкостях
Жидкость в жидкости может растворяться неограниченно, ограниченно или совсем не растворяться, что обусловлено природой веществ. Спирт и вода растворяются неограниченно в любых соотношениях. Вода и анилин, вода и фенол, эфир и вода растворяются ограниченно.
Для ряда жидкостей с ограниченной взаимной растворимостью с повышением температуры увеличивается растворимость одной жидкости в другой и при некоторой температуре становится неограниченной. Температура, при которой ограниченная взаимная растворимость жидкостей переходит в неограниченную, называется критической температурой растворения. Так, при температуре ниже 66,4 ºС фенол ограниченно растворим в воде, а вода ограниченно растворима в феноле. Температура 66,4 ºС – критическая температура растворения для системы вода – фенол: начиная с этой температуры, обе жидкости неограниченно растворимы друг в друге.
Как и в случае растворения твердых тел, взаимное растворение жидкостей обычно не сопровождается значительным изменением объема. Поэтому взаимная растворимость жидкостей мало зависит от давления и заметно возрастает лишь при очень высоких давлениях (порядка тысяч атмосфер). Если в систему, состоящую из двух несмешивающихся жидкостей, ввести третье вещество, способное растворяться в каждой из этих жидкостей, то растворенное вещество будет распределяться между обеими жидкостями пропорционально своей растворимости в каждой из них. Отсюда вытекает закон распределения, согласно которому «Вещество, способное растворяться в двух несмешивающихся растворителях, распределятся между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества»:
С1/С2 = К |
(1.7.1) |
Где, С1 и С2 – концентрации растворенного вещества в первом и втором растворителях; К – так называемый коэффициент распределения.
Так, коэффициент распределения йода между водой и хлороформом равен 130. Если к воде, содержащей растворенный йод, добавить не смешивающийся с нею хлороформ, взболтать эту систему и дать ей отстояться, то после установления равновесия концентрация йода в хлороформе окажется в 130 раз более высокой, чем в воде, независимо от общего количества растворенного йода. Таким образом, с помощью хлороформа можно извлечь (экстрагировать) из воды преобладающую часть растворенного в ней йода. Такой, основанный на законе распределения
88
способ извлечения растворенного вещества из раствора с помощью второго растворителя, не смешивающегося с первым, называется экстракцией и широко применяется в лабораторной практике и в химической промышленности.
1.7.1.5 Растворы газов в жидкостях
При контакте газов с жидкостями последние поглощают (абсорбируют) их, образуя растворы газов. Растворимость газов выражают числом кубических сантиметров газа, растворяющегося при 0ºС и атмосферном давлении в 1 (или 1000) см3 растворителя (коэффициент абсорбции α), либо числом граммов газа, растворяющихся в 100 г растворителя при определенной температуре и парциальном давлении данного газа, равном 1 атм.
Растворимость газов в жидкостях зависит от природы растворителя и газа, температуры, давления и наличия в растворе других растворимых веществ. Эти факторы обусловливают весьма широкие пределы растворимости. Так, природа растворителя и газа может обусловить их химическое взаимодействие, диссоциацию молекул газа в растворе и пр. Растворимость таких газов велика. Например, в 1 л воды при 0 ºС и давлении 1 атм растворяется: НСl – 505 л, H2S – 4,67 л, СО2 – 1,71 л. Газы, не испытывающие взаимодействия с растворителем, растворяются в значительно меньшей степени. При тех же условиях в 1 л воды растворяется кислорода 48,9 мл, азота 23,5 мл, водорода 21,7 мл.
Растворимость газов в воде сопровождается экзотермическим эффектом вследствие сольватации, поэтому, согласно принципу Ле Шателье, увеличение температуры снижает их растворимость и, наоборот, снижение температуры повышает их растворимость.
Растворимость газов в жидкостях в значительной степени зависит от давления и описывается законом Генри, гласящим, что «Концентрация (растворимость) газа в жидкости прямо пропорциональна его давлению над раствором»:
α = К р, |
(1.7.2) |
где, α – коэффициент абсорбции, выражающий растворимость газа в жидкости; К – коэффициент пропорциональности, зависящий от природы веществ; р – давление.
Закон Генри применим для условий невысоких давлений и малой растворимости газов при отсутствии их диссоциации, сольватации и других изменений в растворе.
Растворимость большинства газов существенно снижается, если в растворе содержатся вещества, способные сольватироваться или распадаться на ионы. Например, растворимость хлора в воде и насыщенном растворе поваренной соли разнится в 7 – 10 раз.

89
1.7.1.6 Способы выражения состава растворов
Состав любого раствора может быть выражен как качественно, так и количественно. Обычно при качественной оценке применяют такие понятия, как разбавленный и концентрированный раствор. Раствор с относительно низким содержанием растворенного вещества называют разбавленным, а раствор с относительно высоким содержанием растворенного вещества – концентрированным. Насыщенные растворы применяют сравнительно редко. В большинстве случаев пользуются ненасыщенными растворами, содержащими меньше растворенного вещества, чем его содержит при данной температуре насыщенный раствор.
Для количественной оценки растворов используются другие понятия. Состав раствора (и, в частности, содержание в нем растворенного вещества) может выражаться разными способами – как с помощью безразмерных единиц (долей или процентов), так и через размерные величины – концентрации. В химической практике наиболее употребительны следующие величины, выражающие содержание растворенного вещества в растворе
Массовая доля растворенного вещества в растворе (w) показывает содержание растворенного вещества в 100 граммах раствора. В математической форме она выражается формулой:
(1.7.3)
Где, mв-ва – масса растворенного вещества, г; mр-ра – масса всего раствора, г.
Массовая доля выражается в долях единицы или процентах.
Молярная концентрация СМ раствора или молярность показывает число молей растворенного вещества в 1 литре раствора. В математической форме она выражается формулой:
(1.7.4)
где: mв-ва – масса растворенного вещества, г;
М – молярная масса растворенного вещества, г/моль; V р-ра – объем раствора, л
Единица измерения: моль/дм3 или моль/л. Также в тексте вместо указания размерности молярной концентрации ставят заглавную букву М, тогда 1 моль/дм3 = 1 М.
Нормальная концентрация (эквивалентная концентрация) СН (Сэ)
раствора или нормальность показывает число эквивалента растворенного вещества в 1 литре раствора. В математической форме она выражается формулой:

90
(1.7.5)
где: mв-ва – масса растворенного вещества, г; V р-ра – объем раствора, л;
mЭ – эквивалентная масса, г/моль. Единица измерения: моль/ дм3 или моль/л.
Также для обозначения нормальной концентрации используют символ «н», тогда 1 моль/дм3 = 1 н. Если Vр-ра выражать в миллилитрах, то
(1.7.6)
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка.
Пусть V1 л раствора 1 вещества с нормальностью Сн1 реагирует с V2 л раствора 2 вещества с нормальностью Сн2. Это означает, что в реакцию вступило Сн1 V1 эквивалентов вещества 1 и Сн2 V2 эквивалентов вещества 2. Т.е. если 2 вещества реагируют друг с другом без остатка, то, учитывая, закон эквивалентов должно соблюдаться следующее соотношение:
(1.7.7)
Где, Сн1, Nщ – нормальность раствора щелочи; Vщ – объем раствора щелочи;
Сн2 , Nк – нормальность раствора кислоты; Vк – объем раствора кислоты.
Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
На основании этой зависимости можно не только вычислять требуемые для проведения реакций объемы растворов, но и обратно, по объемам затраченных на реакцию растворов находить их концентрации.
Моляльная концентрация Сm раствора или моляльность показывает число молей растворенного вещества в 1000 грамм растворителя. В математической форме она выражается формулой:
(1.7.8)
где: m р-ра – масса вещества, растворенного в данной массе растворителя, г;

91
Мв-ва – его молярная масса вещества, г/моль; m р-ля – масса растворителя, г;
mв-ва – масса вещества, растворенного в 1000 г растворителя. Единица измерения: моль/кг или моль/1000 г.
Титр раствора Т показывает число граммов растворенного вещества в 1 миллилитре или 1 см3 раствора. В математической форме он выражается формулой:
(1.7.9)
Единица измерения: г/см3 или г/мл.
Для двухкомпонентного раствора, приготовленного путем растворения вещества в растворителе, справедливы следующие соотношения:
mр-ра = V р-ра ρ; |
(1.7.10) |
|
|
m р-ра = m в-ва + m р-ля |
(1.7.11) |
|
|
Где, V р-ра – объем раствора, мл; |
|
ρ – плотность раствора, г/см3. |
|
Vр-ра ≈ Vр-ля (для разбавленных растворов). |
|
При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная – на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: С%
– процентная концентрация, СМ – молярная концентрация, Сн – нормальная концентрация, mЭ – эквивалентная масса, ρ – плотность раствора; М – молярная масса, то формулы для пересчета из процентной концентрации будут следующими:
(1.7.12)
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию в процентную.
Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна молярной массе (например, для HCI, KCI, КОН), то нормальная концентрация равна молярной концентрации. Так 1 и. раствор соляной кислоты будет одновременно 1 М раствором. Однако для большинства соединений эквивалентная масса не равна молярной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной

92
концентрации. Для пересчета из одной концентрации в другую можно использовать формулы:
См М = Сн · mэ |
(1.7.13) |
(1.7.14)
1.7.2 Свойства разбавленных растворов неэлектролитов
Некоторые вещества, такие как сахара, глицерин, мочевина, спирты, в растворах не распадаются на ионы, и поэтому их растворы электрический ток не проводят. Эти вещества называют неэлектролитами.
1.7.2.1 Давление пара растворов. Первый закон Рауля
При растворении какого-либо нелетучего вещества в воде (или любом другом растворителе) активная поверхность испарения снижается вследствие того, что часть ее будет занята молекулами растворенного вещества. В результате этого будет уменьшаться испарение растворителя и парциальное давление его насыщенных паров над раствором (система замкнутая, состояние равновесное).
Сказанное иллюстрирует следующий опыт (рисунок 1.7.2). Если под колпак поместить два сосуда, содержащие одинаковые объемы раствора А и растворителя Б, то через некоторое время объем раствора А увеличится (правый рисунок) Это происходит потому, что под колпаком устанавливается давление, соответствующее состоянию насыщенного пара для растворителя. Этот пар будет пересыщенным для раствора, поскольку давление пара над ним ниже, что вызовет его конденсацию. Убыль пара из газовой фазы повлечет за собой испарение новой порции растворителя из сосуда Б и т.д.
Рисунок 1.7.2 – Опыт, обнаруживающий понижения давления паров растворителя над раствором
Рауль экспериментально установил (1887), что понижение давления насыщенного пара растворителя, находящегося в равновесии с разбавленным раствором, прямо пропорционально мольной доле нелетучего растворенного вещества (первый закон Рауля):
∆р = р0 ·Nх |
(1.7.15) |
93
Где, ∆р – абсолютное понижение давления паров: ∆р = р0 – р1; р0 – давление насыщенных паров над чистым растворителем; р1 – то же над раствором нелетучих веществ;
Nх – мольная доля растворенного вещества.
Закон Рауля имеет и другие формы выражения, например:
∆р/ р0 = Nх, |
(1.7.16) |
Где, ∆р/р0 – относительное понижение давления пара растворителя над раствором, которое не зависит ни от природы растворителя и растворенного
вещества, ни от температуры, или |
|
р1 = р0·Nу, |
(1.7.17) |
где, Nу – мольная доля растворителя.
Для случая раствора жидкости в жидкости давление пара каждого компонента (Х) пропорционально мольной доле другого компонента (Y) в растворе (значение р0 при этом соответствует давлению пара чистого компонента (Y) при данной температуре).
1.7.2.2 Замерзание и кипение растворов. Второй закон Рауля
К выводу о понижении температуры замерзания растворов по сравнению с чистым растворителем можно прийти на основании следующих рассуждений. Пусть в равновесную систему вода – лед будет внесен второй компонент, например глицерин, растворяющийся в жидкой фазе, но практически не испаряющийся и не переходящий в твердую фазу. Введение глицерина в воду вызовет падение давления пара над раствором, что произойдет за счет конденсации части паров. Поскольку конденсация пара – экзотермический процесс, то равновесие вода – лед будет нарушено в результате повышения температуры и как следствие таяния льда. Чтобы систему привести в исходное состояние, температуру надо понизить. Иначе говоря, температура замерзания (кристаллизации) растворов ниже, чем у чистого растворителя.
Известно, что жидкости закипают при давлении их насыщенных паров, равном внешнему. Следствием снижения давления насыщенного пара растворителя над раствором является повышение температуры кипения раствора по сравнению с чистым растворителем и понижение температуры его замерзания.
Часто из растворов переходит в пар при кипении или кристаллизуется при замерзании только растворитель, вследствие чего концентрация раствора по мере его кипения или замерзания возрастает. Это, в свою очередь, приводит к еще большему повышению температуры кипения или понижению температуры замерзания раствора. Таким образом, раствор в отличие от чистого растворителя кипит или замерзает не при постоянной температуре, а

94
в некотором интервале температур. Данное свойство растворов описывается вторым законом Рауля для разбавленных растворов неэлектролитов:
«Изменение температуры кипения или замерзания раствора прямо пропорционально его моляльной концентрации»:
(1.7.18)
(1.7.19)
Где, Cm – моляльная концентрация, моль/кг или моль/1000 г;
К – криоскопическая константа, соответствует понижению температуры замерзания раствора, содержащего 1 моль вещества в 1000 г растворителя;
Е – эбулиоскопическая константа, соответствует повышению температуры кипения раствора, содержащего 1 моль вещества в 1000 г растворителя;
m в-ва – масса вещества, растворенного в данной массе растворителя, г; М – его молярная масса вещества, г/моль;
m 1 – масса растворителя, г.
Разность между tзам |
чистого растворителя и tзам раствора |
|
называется понижением температуры замерзания раствора |
||
∆tзам = tзам. р-ля – tзам. р-ра |
(1.7.20) |
|
где ∆tзам – понижение температуры замерзания раствора; |
||
Разность между tкип |
раствора и tкип |
чистого растворителя |
называется повышением температуры кипения раствора |
||
∆tкип = tкип. р-ра – t кип. р-ля |
(1.7.21) |
|
где ∆tкип – повышение температуры кипения раствора.
Второй закон Рауля используют для определения молекулярного веса вещества (методы криоскопии и эбулиоскопии). Температура кристаллизации может служить также показателем чистоты вещества. Например, температура кристаллизации чистого четыреххлористого углерода –230 С. Если она окажется более низкой, то это будет свидетельствовать о содержании в нем примесей.
Величина криоскопической константы зависит не от природы растворенного вещества, а от природы растворителя (таблица 1.7.1); для воды она равна КН2О = 1,86.
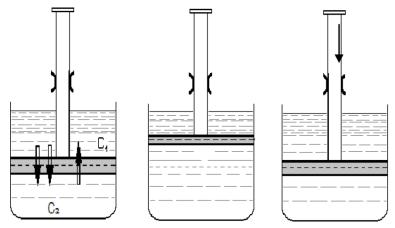
95
Таблица 1.7.1 – Криоскопические и эбулиоскопические постоянные некоторых веществ
Растворитель |
Константа |
Растворитель |
|
Константа |
|||
К |
Е |
К |
|
Е |
|||
|
|
|
|
||||
|
|
|
|
|
|
|
|
Вода |
|
1,86 |
0,52 |
Уксусная кислота |
3,9 |
|
3,07 |
Бензол |
|
5,07 |
2,57 |
Этиловый спирт |
– |
|
1,04 |
Фенол |
|
7,27 |
3,60 |
Хлороформ |
4,9 |
|
3,80 |
2 |
|
|
|
|
|
|
|
|
Для растворов электролитов законы Вант-Гоффа и Рауля в |
||||||
рассмотренном выше виде не применимы. |
|
|
|
||||
1.7.2.3 Осмотическое давление. Закон Вант-Гоффа
Если два раствора одного и того же вещества, но различной концентрации (С2 > С1) разделить в сосуде поршнем (рисунок 1.7.3, а), снабженным полупроницаемой перегородкой (проницаемой для молекул растворителя и непроницаемой для молекул растворенного вещества), то через некоторое время поршень поднимится (рисунок 1.7.3, б) в результате перехода молекул растворителя из менее концентрированного раствора в более концентрированный. При этом концентрации обоих растворов постепенно выравниваются. Такое явление называется осмосом. Осмос, таким образом, является диффузией молекул растворителя в раствор через перегородку.
Диффузия в жидкостях, как и диффузия вообще, есть самопроизвольный процесс переноса вещества, обусловленный беспорядочным тепловым движением молекул, конечный результат которого
– выравнивание концентраций в растворе. В отсутствие перегородки диффузионный процесс подразумевает перемещение молекул растворенного вещества в растворителе
Рисунок 1.7.3 – Явление осмоса
Осмотическое давление возникает на границе растворов разной концентрации (или на границе раствора и растворителя) при наличии между ними полупроницаемой перегородки. В качестве последней могут быть использованы пленка нелакированного целлофана, коллодиевая пленка,
96
специальным образом обработанная керамика и даже жидкостный слой (фенол, насыщенный водой, для воды).
Молекулы растворителя диффундируют через перегородку в прямом и обратном направлениях (см. стрелки на рисунке). Однако число их неодинаково вследствие различной скорости. Чтобы удержать поршень в первоначальном положении, необходимо приложить силу р, компенсирующую действие осмотических сил (рисунок 3, в), возникающих на границе между растворами. Осмотические силы, отнесенные к единице площади их действия (численно равные р/S, где S – площадь перегородки),
называются осмотическим давлением росм .
Якоб Вант-Гофф установил (1887) возможность описания осмотического давления разбавленных растворов с помощью законов, применяемых для идеальных газов (законы Бойля – Мариотта, Гей-Люссака, Авогадро и др.). Иначе говоря, молекулы растворенного вещества создают такое давление, какое они производили бы, находясь в газообразном состоянии при данной температуре Т, К и занимая объем V, равный объему раствора. Исходя из этой аналогии, осмотическое давление росм (Н/м2) может
быть выражено уравнением Клапейрона – Менделеева |
|
росм ·V = n·R·T или росм = n·R·T/V· и росм = C·R·T, |
(1.7.22) |
где, n – число молей растворенного вещества, моль; С – молярная концентрация, моль/дм3;
R – универсальная газовая постоянная, Дж/(моль·К).
Таким образом, осмотическое давление прямо пропорционально концентрации растворенного вещества и абсолютной температуре (закон ВантГоффа).
Закон Вант-Гоффа, как и рассмотренный ранее закон Генри, является предельным законом, т.е. наиболее точно описывает разбавленные растворы при некоторой бесконечно малой концентрации растворенного вещества, исключающей взаимодействие между его частицами. Состояние и поведение растворов в этом случае можно уподобить идеальному газу, поэтому такие растворы называют идеальными. Однако это не значит, что предельные законы не применимы для больших концентраций. Но в последнем случае результат требует введения поправки. В практике предельные законы применяются без существенных поправок.
1.7.3 Свойства растворов электролитов
Вещества, диссоциирующие в воде или других полярных жидкостях (а также расплавах) на ионы и потому способные проводить электрический ток, называются электролитами, а явление распада на ионы –
электролитической диссоциацией. Ионы представляют собой частицы,
несущие положительный (катионы) или отрицательный (анионы) заряд.

97
1.7.3.1 Особенности применения законов Вант-Гоффа и Рауля к растворам электролитов. Степень ионизации
К растворам кислот, оснований, солей законы Вант-Гоффа и Рауля в рассмотренном ранее виде не применимы. Например, раствор ZnCl2 с моляльной концентрацией 1 моль/кг замерзает при – 4,67 0С вместо – 1,86, как этого требует теория. Подобным образом величины росм, ∆р, ∆tкип найденные для электролитов опытным путем (обозначим их индексом «*» в отличие от соответствующих величин для неэлектролитов), также будут больше в i раз (для 1 моль/кг раствора ZnCl2 i = 4,67/1,86 = 2,51), т.е.
р٭осм/росм = ∆р٭/ ∆р = ∆t٭зам/∆tзам = ∆t٭кип /∆tкип = i (1.7.23)
Коэффициент i называется изотоническим. Анализ значений коэффициента i показал, что его величина для таких солей, как KCl, NaBr, больше единицы и при разведении стремится к двум, т.е. i→2; для молекул CaF2, MgCl2 i > 2 и i →3. В первом случае молекулы солей состоят из двух частиц во втором – из трех, соответственно и i → 2 и 3. Поскольку свойства растворов, описываемые законами Рауля и Вант-Гоффа, главным образом обусловлены числом частиц, содержащихся в единице объема раствора (частичной концентрацией), постольку это явилось основанием для предположения, что молекулы кислот, оснований и солей распадаются в растворах на составляющие их частицы, названные ионами (гипотеза ионизации С. Аррениуса, 1887). Гипотеза ионизации послужила основой разработанной в последующем теории электролитической диссоциации.
Таким образом, изотонический коэффициент показывает, во сколько раз увеличивается общее число частиц в растворе в результате происшедшей полной или неполной ионизации вещества, т.е.
Исходя из этого, законы Вант-Гоффа и Рауля в приложении к
электролитам получают следующий вид: |
|
росм = i C·R·T, |
(1.7.24) |
∆р = i· р0 Nх, |
(1.7.25) |
∆tзам = i ·К · Сm , |
(1.7.26) |
∆ tкип = i ·Е · Сm |
(1.7.27) |
Заметим, что коэффициент i для бинарных электролитов (молекула распадается на два иона) не достигает максимального значения, равного 2, а терцинарных (молекула распадается на три иона) – 3. К максимальным значениям коэффициент i приближается лишь при бесконечном разведении. Этот факт говорит о том, что не все молекулы электролита в растворе распадаются на ионы и степень их ионизации с разведением возрастает.

98
Если в раствор внесено Σ молей (молекул) электролита и из них подверглось ионизации σ молей (молекул), то распавшаяся на ионы часть α от общего числа молекул может быть определена как
α = σ/Σ (или α = 100 σ /Σ %), |
(1.7.28) |
где α – степень ионизации, характеризующая динамическое равновесие между ионами и молекулами;
иначе α – отношение числа молекул, претерпевших ионизацию, к общему количеству молекул электролита.
Изотонический коэффициент i связан со степенью ионизации α соотношением, вытекающим из определения коэффициента i, т.е.
(1.7.28)
Где, α – число молекул, претерпевших ионизацию; при n ионах, образующихся из каждой молекулы, n·α∙Σ – число образовавшихся ионов в растворе;
(1 – α) – число молекул, не подвергшихся ионизации; (1 – α) Σ – число неионизированных молекул.
С увеличением разведения i → n и α → 1. Выше приведенное уравнение позволяет взаимно вычислять α или i, если известна одна из этих величин.
Связь между ними выражается уравнением
(1.7.29)
По величине α для 0,1н. растворов электролиты подразделяют на:
слабые (α ≤ 0,03), средние (α = 0,03 ÷ 0,3) и сильные (α > 0,3).
1.7.3.2 Константа диссоциации. Закон разведения Оствальда
Количественно электролитическую диссоциацию как равновесный обратимый процесс можно охарактеризовать константой диссоциации (ионизации). Связь между константой диссоциации, степенью диссоциации и концентрацией электролита установил В. Оствальд.
Рассмотрим диссоциацию раствора слабой уксусной кислоты:
CH3COOH H+ + CH3COO-.
К этому равновесию можно применить закон действующих масс и записать выражение для константы диссоциации уксусной кислоты:
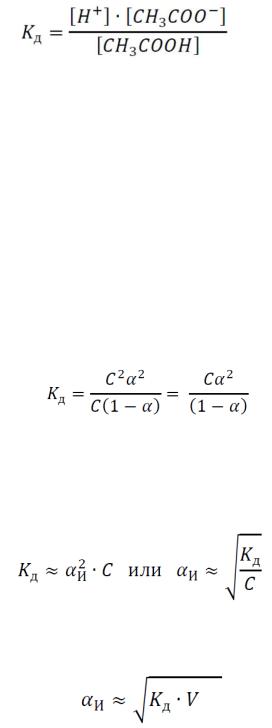
99
(1.7.30)
Если С – начальная концентрация кислоты, то в момент равновесия концентрация ионов будет равна
[H+] = [CH3COO-] = C · αи,
а концентрация непродиссоциировавших молекул
[CH3COOH] = C - C · αи = C(1 - αи).
Подставив значения равновесных концентраций компонентов раствора в выражение (1.7.30) и выполнив преобразования, получим уравнение, которое в теории растворов называется законом разведения Оствальда:
(1.7.31)
Уравнение выражает зависимость αи от концентрации раствора. Если электролит очень слабый αи << 1, следовательно, величиной степени диссоциации в знаменателе можно пренебречь и уравнение примет вид
(1.7.32):
(1.7.32)
Если вместо 1/С в уравнение (1.7.32) подставить V = 1/C, называемую разбавлением, уравнение (1.7.33) примет вид:
(1.7.33)
Закон Оствальда иможет быть сформулирован следующим образом:
Степень диссоциации слабого электролита возрастает с разбавлением раствора.
Сильные электролиты не подчиняются этому закону, т.к. для них константа диссоциации не является постоянной величиной и зависит от концентрации раствора. Применимость закона разбавления Оствальда является одним из признаков слабых электролитов.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, диссоциация фосфорной кислоты идет в три ступени:

100
Диссоциация по ступеням характеризуется константами:
Суммарное равновесие H3PO4 3H+ + PO43− характеризует суммарнаяс константа диссоциации:
Константы диссоциации отдельных ступеней и суммарная константа диссоциации связаны друг с другом соотношением Ксум = К1 ∙ К2 ∙ К3. Распад электролита по каждой последующей ступени происходит в меньшей степени, чем по предыдущей, т.е. К1 > К2 > К3. Характер изменения констант диссоциации объясним тем, что энергия, необходимая для отрыва иона от электронейтральной молекулы меньше, чем энергия отрыва иона от заряженной частицы, и возрастает по мере увеличения её заряда. Энергия ионизации минимальна, когда ион отрывается от нейтральной молекулы электролита. Отрыв иона на каждой следующей ступени диссоциации требует возрастающей энергии, т.к. удаление иона происходит от частицы, заряд которой на последующих ступенях становится больше.
1.7.3.3Теория кислот и оснований Бренстеда и Лоури
Для характеристики многих электролитов в водных растворах используют понятия кислоты и основания, данные Аррениусом:
Кислотой называют электролит, иссоциирующий в растворах с образованием ионов водорода Н+;
Основанием называют электролит, диссоциирующий в растворах с образованием гидроксид-ионов ОН-;
Диссоциация гидроксида ЭОН может протекать по двум типам:
Э ―О ┼ Н Н+ + ЭО- (кислотный гидроксид)
101
Э ┼ О―Н Э+ + ОН- (основный гидроксид)
т.е. разрыв может происходить по обеим связям группы Э―О―Н. Известно, что от разности электроотрицательности элементов, размера
и эффективного заряда атомов зависит полярность и прочность связей. Диссоциация гидроксида будет протекать по кислотному типу если энергия разрыва связи О―Н значительно меньше энергии разрыва Э―О, а по основному типу – если энергия разрыва связи О―Н больше энергии разрыва связи Э―О.
При сравнимой прочности связи О―Н и Э―О диссоциация одновременно может протекать по кислотному и основному типам:
Н+ + ЭО- ЭОН Э+ + ОН- Гидроксиды такого типа называют амфотерными или амфолитами,
т.е. они могут диссоциировать в растворе с образованием и ионов водорода, и гидроксид-ионов. К амфолитам относят гидроксиды цинка, алюминия, хрома(III) и других амфотерных элементов, а также аминокислоты, белки, нуклеиновые кислоты.
Применение принципа Ле Шателье к цепочке кислотноосновных
равновесий Н+ + ЭО- ЭОН Э+ + ОН- показывает, что с увеличением в системе концентраций гидроксид-ионов возрастает вероятность диссоциации по кислотному типу, а увеличение концентрации ионов водорода приводит кпреимущественной диссоциации по основному типу. Это означает, что в щелочной среде амфолиты проявляют кислотный характер, а в кислой основной.
Например, Al(OH)3 при взаимодействии с кислотами ведет себя как основание:
Al(OH)3 + 3HCl = AlCl3 + 3H2O,
а при взаимодействии со щелочами как кислота:
Al(OH)3 + NaOH = Na[Al(OH)4] + H2O
Согласно теории Аррениуса свойства кислот, обусловлены наличием в их растворах ионов водорода, а свойства оснований – присутствием гидроксид-ионов, но данная теория справедлива только для их водных растворов. Изучение процессов, протекающих без участия растворителя или в неводных растворах, потребовало существенного дополнения к теории Аррениуса.
В 1923 г И. Бренстедом и Т. Лоури была предложена обобщающая теория кислот и оснований, которая получила название – протолитическая теория.
102
Кислотой называется вещество, которое в данной реакции может выступать в роли донора протона, а основанием – вещество, которое в данной реакции выступает в роли акцептора протона.
Согласно протолитической теории кислота, отдавая протон, превращается в сопряженное основание:
I.Кислота1 Сопряженное основание1 + Н+.
Основание, присоединяя протон, превращается в сопряженную кислоту:
II.Основание2 + Н+ Сопряженная кислота2
Согласно протонной теории имеет место кислотно-основное равновесие, обусловленное переносом протона (сумма процессов I и II по Гессу):
III.Кислота1 + Основание2 Кислота2 + Основание1
Реакции нейтрализации, ионизации, гидролиза с точки зрения протолитической теории являются частными случаями кислотно-основных равновесий.
Реакция I типа протекающая в прямом направлении, представляет ионизацию уксусной кислоты, в обратном направлении - нейтрализацию какого-либо ацетата (например, ацетата натрия сильной кислотой).
CH3COOH + H2O CH3COO- + H3O+,
Реакция II типа протекающая в прямом направлении, представляют гидролиз какой-либо соли аммония, а в обратном - нейтрализацию аммиака сильной кислотой.
NH4+ + H2O NH3 + H3O+,
Протолитические кислотно-основные равновесия III типа имеют место не только в воде, но и в других растворителях, например, в жидком аммиаке:
CH3COOH + NH3 CH3COO- + NH4 ,
в безводном HF:
С2H5OH + HF C2H5OH2+ + F-.
Протолитическая теория подразделяет кислоты на три типа:
1.Нейтральные (HCl, H2SO4, H3PO4 и др.):

103
2. Катионные (NH +, Н О+) – представляют собой положительные
ионы:
3.Анионные (HSO−, H2PO−, HPO2−) – представляют отрицательные
ионы:
Классификация оснований аналогичная: нейтральные (NH3, H2O); анионные, представляют собой отрицательные ионы (Cl-, CH3COO-, OH-); катионные, представляют собой положительные ионы, например, H2N −
3
Растворители типа воды, жидкого аммиака, а также анионы многоосновных кислот могут быть и донорами, и акцепторами протонов, так как являются амфотерными веществами.
Например: вода – типичный амфолит:
Теория Бренстеда, как и теория Аррениуса, не применима к веществам, проявляющим свойства кислоты, но не содержащих иона водорода (галогениды бора, алюминия, кремния, олова). Поэтому более общей является электронная теория кислот и оснований Г. Льюиса:
Кислотой называют вещество, частицы которого (молекулы, ионы) способны присоединять электронную пару (акцептор электронной пары), а основанием называют вещество, частицы которого способны отдавать электронную пару (донор электронной пары).
Коснованиям Льюиса относят галогенид-ионы, аммиак, алифатические
иароматические амины, кислородсодержащие соединения общей формулы

104
R2CO (где R – органический радикал). К кислотам Льюиса относят галогениды бора, алюминия, кремния, олова и др. элементов. Все теории диссоциации (ионизации) кислот и оснований не противоречат, а дополняют друг друга. Кислоты, по теории Бренстеда, можно рассматривать как частный случай Льюисовских кислот, поскольку протон характеризуется большим сродством к электронной паре и может рассматриваться по Льюису как кислота.
1.7.4 Ионное произведение воды. Величина РН – мера активной кислотности среды
Вода является слабым амфолитом. Диссоциация воды согласно протолитической теории Бренстеда идет по уравнению:
Н2О + Н2О Н3О+ + ОН-; Н° = + 56,5 кДж/моль Константа диссоциации воды при 298 К равна
(1.7.34)
Где, [H+], [OH-], [H2O] – равновесные молярные концентрации Н+, ОН-, Н2О, моль/л; (для краткости вместо Н3О+ в кислотно-основных равновесиях пишут Н+).
Вода присутствует в большом избытке, ее концентрация может считаться постоянной и составляет 55,6 моль/л (1000 г : 18 г/моль = 55,6 моль). Подставив в выражение для константы диссоциации воды это значение, получим новое выражение
( 2 ) = [ +] ∙ [ −] =10−14моль2/ л2 |
при 298 К |
(1.7.35) |
К(Н2О) – ионное произведение воды.
Согласно выражению (1.7.35) в чистой воде или любом водном растворе при постоянной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная, называемая ионным
произведением воды.
К(Н2О) зависит от температуры. Так как процесс диссоциации воды эндотермический, при повышении температуры К(Н2О) увеличивается.
В чистой воде концентрация ионов водорода равна концентрации гидроксид-ионов: [ +] = [ −] = 10−7 моль/л
Концентрации [H+], [OH-] – величины сопряженные. Увеличение одной из них вызывает уменьшение другой, следовательно, характер среды можно определять по содержанию ионов H+ или OH-: [H+] = 10-7моль/л – среда нейтральная, [H+] > 10-7моль/л – среда кислая, [H+] < 10-7моль/л – среда щелочная.
105
Поскольку концентрация ионов Н+ и ОН- очень малы и проводить расчеты с такими величинами неудобно, Зёренсен в 1909 г. предложил пользоваться для определения кислотности среды шкалой рН:
= −lg[ +] |
(1.7.36) |
т.е. рН – отрицательный десятичный логарифм концентрации ионов водорода. Аналогично:
= −lg[ −] |
(1.7.37) |
т.е. рОН – отрицательный десятичный логарифм концентрации
гидроксид-ионов.
Величины рН и рОН называются водородным и гидроксильным показателями.
Прологарифмировав выражение для ионного произведения воды
(1.7.37), получим удобное для расчетов соотношение: |
|
−lgK(H2O) = −lg[ +] − lg[ −] = −lg10−14 |
(1.7.38) |
pK(H2O) = pH + pOH = 14 |
(1.7.39) |
Реакцию среды можно охарактеризовать величиной водородного показателя: рН = 7 – в нейтральной среде; рН < 7 – в кислой среде; рН > 7 – в щелочной среде.
Величины рН и рОН в растворах кислот и оснований можно легко рассчитать, если известна концентрация раствора, константа или степень диссоциации кислоты или основания.
В растворах сильных кислот или щелочей величины рН и рОН зависят от активности ионов водорода и гидроксид-ионов:
pH = − lg αH+ = − lg CH+ ∙ H+ |
(1.7.40) |
pH = − lg αOH− = − lg COH− ∙ OH− |
(1.7.41) |
В разбавленных растворах кислот и оснований, при f → 1, активность равна концентрации, тогда
pH = −lg CH+ |
(1.7.42) |
pOH = −lg COH− |
(1.7.43) |
В растворах слабых кислот и оснований для расчета величин рН и рОН помимо концентраций необходимо знать либо степень диссоциации, либо константу диссоциации электролита, т.к. в этом случае количество ионов
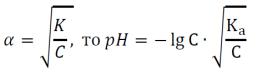
106
значительно меньше концентрации кислоты или основания. Для таких электролитов применяют следующие расчетные формулы:
= −lg CH+ ∙ α |
(1.7.44) |
или, поскольку из закона разбавления Оствальда:
т.е. = −lg√Ka ∙ C = −½lgKa − ½lgC = ½lg Ka − ½lgC |
(1.7.45) |
где, Ка и С – соответственно константа диссоциации и концентрация кислоты;
рКа – показатель константы диссоциации слабой кислоты. Для растворов слабых оснований:
pOH = −lg COH− ∙ α |
(1.7.46) |
= −½lgKb − ½ lg C |
(1.7.47) |
= −½ Kb − ½ lg C |
(1.7.48) |
Где, Кb и С – константа диссоциации и концентрация слабого основания,
рКb – показатель константы диссоциации слабого основания.
Для расчета рН в растворах оснований необходимо пользоваться соотношением:
( 2 ) = + = 14, = 14 − ½ Kb + ½ lg C (1.7.49)
В медико-биологических исследованиях необходимо разграничивать активную, потенциальную (резервную) и общую кислотность.
Активная кислотность измеряется активностью (концентрацией) свободных ионов водорода в растворе.
Потенциальная (резервная) кислотность измеряется количеством ионов водорода, связанных в молекулах кислоты, т.е. представляет собой «запас» недиссоциированных молекул кислоты.
Общую кислотность, которая определяется общей (аналитической) концентрацией кислоты и устанавливается титрованием, определяют как сумму активной и резервной кислотностей. рН данного раствора определяет активная кислотность.

107
1.7.5 Гидролиз солей 1.7.5.1 Типы гидролиза
Водные растворы имеют разные значения рН и показывают различную реакцию среды – кислую, щелочную, нейтральную. Например, водный раствор хлорида железа (III) FeCl3 имеет кислую реакцию среды (рН < 7), раствор карбоната натрия Na2CO3 – щелочную среду (рН > 7), растворы хлорида калия КCl и нитрита свинца Pb(NO2)2 – нейтральную среду (рН = 7). Эти соли не содержат в своем составе ионы водорода Н+ или гидроксид-ионы ОН-, которые определяют среду раствора. Изменение характера среды характеризуется тем, что в водных растворах соли подвергаются гидролизу.
Гидролизом соли называют взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Гидролиз является одним из важнейших химических свойств солей. Сущность гидролиза заключается в химическом взаимодействии катионов или анионов соли с гидроксид-ионами ОН- или ионами водорода Н+ из молекул воды.
В результате этого химического взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо:
поэтому в водном растворе соли появляется избыток свободных ионов Н+ или ОН-, и раствор соли показывает кислую или щелочную среду.
Любую соль можно представить как продукт взаимодействия кислоты и основания. В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
I. Образованы сильным основанием и слабой кислотой (NaCN,
CH3COOK, Ba(NO2)2, Rb2CO3).
II. Образованы слабым основанием и сильной кислотой (CuCl2, NH4Br, FeSO4, Mn(NO3)2, CoI2).
III. Образованы слабым основанием и слабой кислотой
(CH3COONH4, (NH4)2S, Pb(NO2)2, NH4CN).
IV. Образованы сильным основанием и сильной кислотой (NaCl,
K2SO4, Ca(NO3)2, CsBr, BaI2).
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу. Рассмотрим примеры гидролиза различных типов солей:
1. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону.
Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н+ из молекулы воды, образуя слабый электролит (кислоту).
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
108
Соль KNO2 образована слабой одноосновной кислотой НNO2 и сильным основанием КОН.
Молекулярное уравнение: KNO2 + HOH KOH + HNO2
полное ионное уравнение: K+ + NO2− + HOH K+ + OH- + HNO2 Сокращенное ионное уравнение: NO2− + HOH OH- + HNO2
Так как ионы Н+ соединяются в молекулы слабого электролита HNO2, их концентрация уменьшается, и равновесие процесса диссоциации воды по принципу Ле Шателье смещается вправо: Н2О Н+ + ОН-.
В растворе увеличивается концентрация свободных гидроксид-ионов (ОН-). Поэтому раствор соли КNO2 имеет щелочную реакцию (рН > 7).
2.Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону.
Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид - ион ОН- воды, образуя слабый электролит (основание).
Пример: составим молекулярное и ионные уравнения гидролиза иодида
аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой HI:
Молекулярное уравнение: NH4I + HOH NH4OH + HI Полное ионное уравнение: NH+ + I- + НОН NH4OH + H+ + I- Сокращенное ионное уравнение: NH+ + HOH NH4OH + Н+
При растворении в воде соли NH4I катионы аммония NH+ связываются
сгидроксид - ионами ОН- воды, образуя слабый электролит - гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н+. Среда раствора соли NH4I – кислая (рН < 7).
3.Соли, образованные слабым основанием и слабой кислотой, гидролизуются одновременно и по катиону, и по аниону.
Эти соли образованы катионом слабого основания, который связывает ионы ОН- из молекул воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н+ из молекул воды и образует слабую кислоту. Реакция среды этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
Пример: составим уравнение гидролиза ацетата аммония CH3COONH4. Соль образована слабой уксусной кислотой CH3COOН и слабым
основанием NH4ОН.
CH3COONH4 + НОН CH3COOН + NH4ОН СН3СОО- + NH+ + Н2О CH3COOН + NH4ОН
Реакция раствора соли CH3COONH4 - нейтральная (рН = 7), потому что
Кд(CH3COOН) = Кд(NH4ОН).
109
Для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако, некоторые соли полностью разлагаются водой - гидролиз является необратимым. Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, т.е. водный раствор таких солей приготовить нельзя. Пример: составим уравнение гидролиза сульфида алюминия Аl2S3:
Аl2S3 + 6Н2О = 2Al(OH)3↓ + 3H2S↑
Гидролиз Аl2S3 протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S. Поэтому, в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей кислоты (нерастворимой) кислоты.
Например:
3K2S + 2FeBr3 = Fe2S3 + 6KBr Fe2S3 + 6Н2О = 2Fe(OH)3↓ + 3H2S↑
Суммируя эти уравнения, получаем:
3K2S + 2FeBr3 + 6Н2О = 2Fe(OH)3↓ + 3H2S↑ + 6KBr
или в ионном виде:
3S- + 2Fe3+ + 6Н2О = 2Fe(OH)3↓ + 3H2S↑
4. Соли, образованные сильной кислотой и сильным основанием,
не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н+ или ОН- воды, т.е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается.
Среда растворов этих солей – нейтральная (рН = 7), так как концентрации ионов Н+ и ОН- в их растворах равны, как в чистой воде.
1.7.5.2 Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато в следующих случаях:
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности
110
слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSO4, CoI2, Al2(SO4)3, ZnBr3, Fe(NO3)3 и др.
Пример: гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой HCl. Катион Ni2+ связывает гидроксид-ионы ОН- воды. Ni(OH)2 – двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Первая ступень:
NiCl2 + НОН NiOHCl + HCl
Ni2+ + 2Cl- + H2O NiOH+ + Cl- + H+ + Cl-
Ni2+ + H2O NiOH+ + H+
Продуктами первой стадии гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень гидролиза (гидролиз основной соли, которая образовалась в результате гидролиза):
NiOHCl + НОН Ni(OH)2 + HCl
NiOH+ + Cl- + H2O Ni(OH)2 + H+ + Cl-
NiOH+ + H2O Ni(OH)2 + H+
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля(II) и сильная хлороводородная кислота HCl. Cтепень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 – кислая (рН < 7), так как в растворе увеличивается концентрация ионов Н+.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водных растворах таких солей на первых стадиях гидролиза образуется кислая соль вместо кислоты и сильное основание.
Ступенчато гидролизуются соли Na2SO3, Rb2CO3, K2SiO3, Li3PO4 и др. Пример: гидролиз соли K2CO3 протекает по аниону, потому что соль
образована слабой кислотой Н2CO3 и сильным основанием КОН.
Так как Н2CO3 – двухосновная кислота, гидролиз K2CO3 протекает по двум ступеням.
Первая ступень:
K2CO3 + НОН КОН + КНСО3
2К+ + СО32− + Н2О К+ + ОН- + К+ + НСО3− СО32− + Н2О ОН- + НСО3−
Продуктами первой ступени гидролизасK2CO3 являются кислая соль КНСО3 и гидроксид калия КОН.

111
Вторая ступень гидролиза (гидролиз кислой соли, которая образовалась в результате первой ступени):
КНСО3 + НОН КОН + Н2СО3 К+ + НСО3− + Н2О К+ + ОН- + Н2СО3
НСО3− + Н2О ОН- + Н2СО3
Продуктами второй ступени гидролиза K2CO3 являются гидроксид калия КОН и слабая угольная кислота Н2СО3.
Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой.
Среда раствора K2CO3 – щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН-.
1.7.5.3Степень гидролиза. Константа гидролиза
Количественно гидролиз, как кислотно-основное равновесие, характеризуется степенью гидролиза аг и константой гидролиза Кг.
Степень гидролиза измеряется соотношением количества гидролизованного вещества к общему количеству растворенного вещества:
(1.7.50)
Где, nг- количество гидролизованной соли, моль; n0 - общее количество растворенной соли, моль.
Степень гидролиза выражается в долях единицы или в процентах.
Степень гидролиза зависит от природы соли, ее концентрации и температуры.
Согласно закону действующих масс, степень гидролиза возрастает с разбавлением раствора.
Качественно влияние температуры на степень гидролиза можно прогнозировать на основе принципа Ле Шателье. Так как реакция нейтрализации экзотермична ( Нº = -56,5 кДж/моль), то противоположный ей процесс гидролиза является эндотермическим. Поэтому в соответствии с принципом Ле Шателье с повышением температуры степень гидролиза растет.
Влияние природы соли на степень гидролиза легко прогнозировать на основе выражения для константы гидролиза. Закон действующих масс позволяет рассмотреть в общем виде кислотно-основные равновесия, установившиеся в системе при гидролизе солей различных типов.
1. Соль, образованная сильной кислотой и слабым основанием
(NH4Cl, NH4NO3 и т.д.) гидролизуются по катиону:
+ + 2 + +
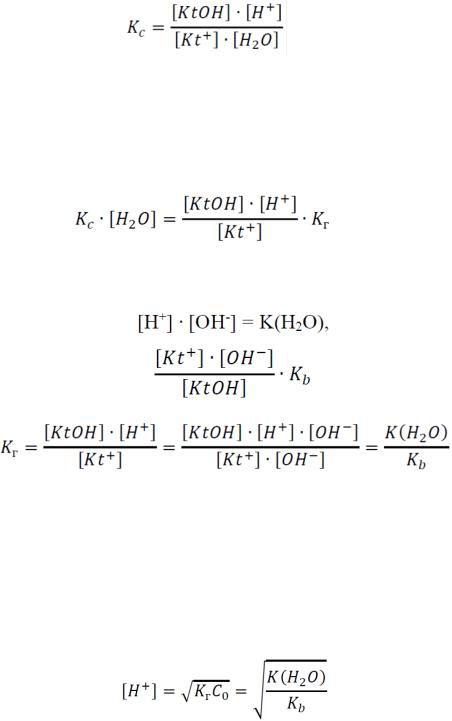
112
В соответствии с ЗДМ константа этого равновесия равна:
(1.7.51)
Концентрация недиссоциированных молекул воды в разбавленных растворах практически постоянна при Т = const, произведение Кс ∙ [H2O] поэтому также будет величиной постоянной. Эта величина обозначается Кг и
называется константой гидролиза.
Тогда
(1.7.52)
Умножая числитель и знаменатель уравнения (1.7.52) на [OH-], с учетом, что,
Получают:
(1.7.53)
Где, К(Н2О) – ионное произведение воды, а Кb – константа диссоциации основания KtOH.
Чем слабее основание, образующее соль, т.е. чем меньше его константа диссоциации Кb, тем больше константа гидролиза соли Кг и сильнее гидролизуется соль.
Из уравнения (1.7.53) выведены формулы: для определения концентрации ионов водорода и рН растворов таких солей:
|
(1.7.54) |
= 1/2( 20 − − lg 0 ) |
|
= 7 − 1/2 − 1/2lg 0 |
(1.7.55) |
= 1/2 − lg 0 |
(1.7.56) |
Где, C0 - исходная концентрация соли KtAn, моль/л; Кг – константа гидролиза соли KtAn; Кb - константа диссоциации слабого основания KtOH; Ка - константа диссоциации кислоты, сопряженной этому основанию.

113
По закону разбавления Оствальда степень гидролиза αг солей этого типа равна:
(1.7.57)
2. Соль KtAn, образованная слабой кислотой НА и сильным основанием KtOH (CH3COONa, NaCN и т.д.).
Для этого типа солей расчетные формулы для констант гидролиза Кг концентрации водород-ионов, рН и степени гидролиза имеют следующий вид:
(1.7.58)
Где, Ка - константа диссоциации слабой кислоты НА.
3. Соль KtAn образована слабой кислотой НА и слабым основанием KtOH (CH3COONa, NH4CN и т.д.).
Расчетные формулы для этих солей имеют вид:
(1.7.59)
Уравнения (1.7.58) и (1.7.59) количественно выражают зависимость гидролиза от разных факторов:
-чем слабее кислота и основание, образующие соль (чем меньше Ка и Кb), тем больше степень ее гидролиза;
-степень гидролиза возрастает при разбавлении раствора.
114
Всвязи с тем, что при увеличении температуры К(Н2О) возрастает в большей степени, чем Ка и Кb на основе уравнений (1.7.57), (1.7.58), (1.7.59), можно прогнозировать, что степень гидролиза растет с температурой.
Согласно выражению (1.7.59) в разбавленных растворах солей 3-го
типа (CH3COONa, NH4CN) величина степени гидролиза практически не зависит от концентрации соли.
Приведенные выше формулы для расчета степени гидролиза и рН растворов приближены и применимы только для слабо гидролизующихся солей.
Вобщем случае справедливы следующие закономерности:
1.Гидролиз соли должен усиливаться с повышением температуры и разбавлением раствора. Для ослабления гидролиза растворы следует хранить концентрированными при низких температурах;
2.При обратимом гидролизе в соответствии с принципом Ле Шателье процесс должен подавляться при подкислении (если эта соль образована сильной кислотой и слабым основанием, накапливаются ионы Н+) или при подщелачивании (если соль образована слабой кислотой и сильным основанием, накапливаются ионы ОН-);
3.Гидролиз солей, в результате которого образуются малорастворимые или газообразные продукты, удаляющиеся из сферы реакции (принцип смещения равновесия), необратим.
Особенно важную роль гидролиз играет в жизнедеятельности живых организмов. Гидролиз характерен для многих классов органических и неорганических соединений. Гидролиз неорганических соединений важен для оценки их токсичности. Обменные реакции между солями и водой широко распространены в природе. Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. Методом гидролиза получают спирты, органические кислоты, глюкозу и т.д. Процессы осахаривания крахмала, переработки древесины и многие другие основаны на реакциях гидролиза. В повседневной жизни мы постоянно сталкиваемся с явлением гидролиза – при стирке белья, мытье посуды, умывании мылом.
1.7.6 Гетерогенные равновесия. Константа растворимости. Условия образования и растворения осадков
Реакции осаждения и растворения относятся к обменным реакциям, протекающим в растворах электролитов.
Реакциями осаждения называют реакции, идущие с выпадением осадков. Способность к осаждению зависит от многих факторов: свойств катионов и анионов; условий, в которых проводят процесс осаждения; рН раствора; температуры; ионной силы раствора; состава и содержания других веществ в растворе, которые не должны принимать прямого участия в образовании осадка, но способны соосаждаться с ним или препятствовать осаждению, например:

115
При смешении растворов хлорида бария BaCl2 и сульфата натрия Na2SO4 выпадает осадок сульфата бария BaSO4:
BaCl2 (р) + Na2SO4 (р) → BaSO4 (т) + 2NaCl (р)
или в сокращенном ионном виде:
Ba2+(p) + SO2−(p) → BaSO4 (т); ΔGº = - 60 кДж/моль
4
BaSO4 выпадает в осадок и в обратной реакции практически не участвует, поэтому равновесие этого процесса смещено вправо (ΔGº = - 60 кДж/моль) и реакция идет до конца.
Реакции, сопровождающиеся растворением осадков, называются реакциями растворения. Например, при добавлении к кристаллическому гидроксиду магния Mg(OH)2 азотной кислоты происходит растворение осадка:
Mg(OH)2 (т) + 2HNO3 (p) → Mg(NO3)2 (p) + 2H2O (ж)
или в сокращенном ионном виде:
Mg(OH)2 (т) + 2Н+(р) → Mg2+(p) + 2H2O (ж); ΔGº = - 96 кДж/моль.
Гидроксид-ионы прочнее связываются в малодиссоциированные молекулы воды, чем в Mg(OH)2, для данного процесса ΔGº = -96 кДж/моль, т.е. равновесие значительно смещено вправо.
Рассмотрим важный для химической и медико-биологической практики случай: растворение - кристаллизация трудно растворимых солей, связанный с возникновением гетерогенного равновесия «твердое тело насыщенный раствор» на примере растворения хлорида серебра в воде. В начале будет происходить только растворение соли, но, по мере возрастания концентрации в растворе хлорида серебра, будет постепенно увеличиваться скорость обратного процесса - кристаллизации (осаждения) этой соли и вскоре наступит равновесие:
AgCl (т) Ag+(р) + Cl-(p).
В соответствии с законом действующих масс константа равновесия имеет следующий вид:
Концентрация твердой фазы AgCl, как постоянная величина, из выражения для константы равновесия исключается. Вследствие этого константа равновесия определяется только произведением концентраций ионов в растворе и называется константой растворимости или
произведением растворимости Кs:
= [Ag+] ∙ [Cl−].
В общем случае для электролита KtnAnm константа растворимости определяется стехиометрическим произведением концентраций ионов:
116
= [Kt +] ∙ [An −] .
Эта величина характеризует растворимость электролита при постоянной температуре в отсутствии посторонних веществ.
Постоянство константы растворимости не означает постоянство концентраций отдельных ионов в растворе. Можно увеличить концентрацию Ag+ в насыщенном растворе AgCl, добавив, например, AgNO3. При этом равновесие по принципу Ле Шателье сместится влево, что приведет к увеличению скорости осаждения ионов. Через некоторое время скорости растворения AgCl и осаждения ионов Ag+ и Cl- сравняются. Вновь установившееся равновесие будет, как и прежде, характеризоваться величиной Кs(AgCl), но равновесныесконцентрации ионов Ag+ и Cl- изменяются [Ag+] будет больше, а [Cl-] меньше по сравнению с прежним состоянием равновесия:
AgCl(т) Ag+(р) + Cl-(p).
Дополнительное осаждение AgCl связано с тем, что при добавлении AgNO3 произведение концентраций ионов стало больше константы растворимости.
Если понизить концентрацию одного из ионов насыщенного раствора, связав, например, ион Ag+ в малодиссоциируемый ион [Ag(CN)2]-, тогда равновесие сместится вправо в соответствии с принципом Ле Шателье, и осадок будет растворяться. Причиной растворения осадка AgCl является то, что при добавлении CN- иона произведение концентраций ионов стало меньше константы растворимости:
С(Ag+) ∙ С(Cl-) < Кs(AgCl).
Таким образом, на основе Кs можно прогнозировать образование и растворение осадков электролитов на основе двух правил:
1. Электролит выпадает в осадок, когда стехиометрическое произведение концентраций его ионов в растворе больше константы растворимости:
С(Ktm+)n ∙ С(Ann-)m+> Ks(KtnAnm).
2. Осадок электролита растворяется, когда стехиометрическое произведение концентраций составляющих его ионов в растворе становится меньше константы растворимости:
3.
С(Ktm+)n ∙ С(Ann-)m+ < Ks(KtnAnm).
Значение константы растворимости для различных солей используется в титриметрическом анализе. Сущность методов, применяемых при данном анализе заключается в том, что к определенному объему раствора,
117
содержащего ионы А, концентрацию которых необходимо определить, приливают по каплям раствор с точно установленной концентрацией В, образующих с ионами А труднорастворимый осадок АВ. Добавление второго раствора прекращают, как только ионы А окажутся полностью связанными с ионами В, что узнают по окраске индикатора.
Так, например, определяя в растворе концентрацию хлорид - ионов, к определенному объему этого раствора постепенно прибавляют раствор AgNO3, пока не произойдет полное осаждение ионов Cl- в виде AgCl, и первая же избыточная капля раствора AgNO3 не вызовет появление кирпично-красного осадка Ag2CrO4 с присутствующими в растворе ионами CrO42− (индикатор).
Впрактике клинических, санитарно-гигиенических и судебноэкспертных исследований, а также при испытании 4 фармацевтических препаратов получил метод аргентометрии, используемый для определения в испытуемом растворе хлоридов, бромидов и йодидов (титрант AgNO3).
Всвязи с дефицитом серебра вместо аргентометрии нередко используют методы меркури- и меркурометрии, в основе которых лежат количественно протекающие реакции хлорид-, роданид- и цианид-ионов с ионами Hg2+ и [Hg2]2+.
Значительное распространение в аналитической практике получил также метод бариеметрии, используемый для определения в испытуемых образцах содержания SO42− ионов, образующих с ионами бария труднорастворимый осадок BaSO4.
118
1.8 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
ПЛАН
1.8.1Электронная теория окисления-восстановления
1.8.2Классификация ОВР
1.8.3Составление уравнений окислительно-восстановительных
реакций
1.8.4Влияние среды раствора на протекание ОВР
1.8.5Гальванический элемент
1.8.6Электродные потенциалы
1.8.7Ряд стандартных электродных потенциалов металлов
1.8.8Вычисление электродных потенциалов при различных концентрациях ионов металлов в растворе
1.8.9Вычисление Э.Д.С. гальванического элемента
1.8.1 Электронная теория окисления-восстановления
Cреди формальных понятий химии важнейшим является понятие степени окисления.
Степень окисления (СО) – условный заряд атома элемента, вычисленный исходя из предположения, что молекула состоит из ионов.
Cтепень окисления кислорода равна: -2.
Исключение: пероксидные соединения, где степень окисления кислорода: -1. Na2O2-1.
И во фториде кислорода OF2 она равна +2. H2O-2, H2O2-1, O 0, O+2F2. Водород имеет степень окисления +1, только в гидридах типа NaH-1 его
степень окисления равна (-1).
Степень окисления щелочных металлов = +1, щелочно-земельных = +2,
Al = +3.
Степень окисления атомов, входящих в состав простых веществ = 0.
N2, Cl2, Ca0, F2 .
В нейтральных4. молекулах алгебраическая сумма всех степеней окисления равна нулю, а в любом ионе равна заряду иона. H+1N+5O-23, H+Cl+7O-24. Важность окислительного числа заключается в том, что номер группы системы указывает высшую положительную степень окисления, которую могут иметь элементы данной группы в своих соединениях.
Исключение: металлы подгруппы меди, кислород, фтор, бром, металлы семейства железа и некоторые другие элементы VIII Б группы.
Все многообразие химических реакций, происходящих в природе, промышленности, сельском хозяйстве, биологических процессах можно разделить на 2 группы:
1. Реакции, протекающие без изменения СО атомов, входящих в состав реагирующих веществ. К ним относятся:
а) реакции обмена, например:

119
Ba2+Cl-2 + K2+S+6 О4-2 = Ba+2S+6O4-2 ↓ + 2K+Cl-
б) некоторые реакции соединения, разложения
NaOH + CO2 = NaHCO3 CaCO3 =t CaO + CO2
Легко установить, что СО атомов в приведенных выше уравнениях до и после реакции осталась без изменения.
2. Реакции, сопровождающиеся изменением СО атомов реагирующих веществ. К данному типу относятся реакции окислениявосстановления
а) реакции замещения
CuSО4(p) + Zn(k) = Cu(k) + ZnSO4(p)
G0298 = -212кДж/моль
Ca + 2H2O = Ca(OH)2 + H2↑
б) некоторые реакции соединения, разложения
Ba + O2 = 2BaO NH4NO2 = N2 +2H2O
2H2S + 3O2 = 2SO2 + 2H2O
S-2- 6e = S+4 |
2 |
O2 + 4e = 2O-2 |
3 |
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно – восстановительными. Другими словами это реакции, связанные с передачей электронов от одних атомов к другим.
Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления при этом повышается.
Ca – 2e- = Ca+2 H20 – 2e- = 2H+
Восстановление – процесс присоединения электронов атомом, молекулой, ионом. Степень окисления при этом понижается.
Fe+3 + e- = Fe2+ Cl02 + 2e- = 2Cl-
Восстановители – молекулы или ионы отдающие электроны, сами при этом восстановители окисляются.
120
Окислители – молекулы или ионы, присоединяющие электроны, во время реакции окислители восстанавливаются.
Окисление и восстановление протекают одновременно.
Cu0 + Hg+2(NO3)2 = Hg0 + Cu+2(NO3)2
Восстановитель |
Cu0 – 2e– = Cu+2 |
процесс окисления |
Окислитель |
Hg+2 + 2e– = Hg0 |
процесс восстановления |
Окислители – к ним относятся те простые вещества, элементы которых обладают высокой электроотрицательностью, т.е. неметаллы,
например, F2, O2, Cl2, Br2, S и т.д.
Из сложных веществ, роль окислителей играют те вещества, которые содержат атомы неметаллов, имеющие высокие степени окисления:
K2Cr+62O7, KMn+7O4, HN+5O3, H2S+6O4, HCl+7O4, K2Cr+6O4.
Окислительные свойства, обусловливает не только атом с высокой степенью окисления, а весь анион. Ионы металлов и (водорода) также являются окислителями: Ag +, Au3+, Cu2+, H+, Fe3+, и т.д.
Восстановители – относятся простые вещества, образованные элементами с низкой электроотрицательностью, т.е. все металлы и некоторые неметаллы (H2, B, C). Наиболее активный восстановитель – франций. Из сложных веществ относятся те, которые содержат атомы с низкими степенями окисления: Fe+2Cl2, Cr2+3(SO4)3, KCl-1, H2S-2, N-3H3, H2S+4O3.
Вещества, содержащие элементы в промежуточных степенях окисления, могут выполнять как функции окислителей, так и восстановителей, т.е. обладают окислительно – восстановительной двойственностью. Например: ряд соединений азота с различными степенями окисления:
N-3H3 – всегда восстановитель;
N2-2H4, N-1H2OH, N20, N2+1O, N+2O, N2+3O3, N+4O2 – обладают окислительно–восстановительной двойственностью;
N2+5O5 – всегда окислитель.
Азот в степени окисления -3 – может быть только восстановителем, т.е. может только повышать степень окисления.
Азот в степени окисления +5 всегда окислитель, повысить степень окисления не может, может только понизить.
Об окислительно–восстановительных свойствах элементов и соединений можно судить, руководствуясь периодической системой Д. И. Менделеева. Растворы кислот более сильные окислители, чем растворы их солей, причем окислительная активность кислот тем значительнее, чем выше их концентрация. Так KNO3(p) почти не проявляет окислительных свойств (необходим очень сильный восстановитель), HNO3разб. является слабым окислителем, а HNO3конц. – один из наиболее энергичных окислителей.

121
1.8.2 Классификация ОВР
Окислительно-восстановительные реакции обычно разделяют на четыре типа (смотрите схему): межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции репропорционирования (конпропорционирование, контрдиспропорционирование).

122
1.8.3 Составление уравнений окислительно-восстановительных реакций
Применяются два вида составления уравнений окислительновосстановительных реакций:
1)Метод электронного баланса (смотрите схему ниже).
2)Метод полуреакций:
1.Написать молекулярную схему реакции;
2.Составить полное ионное уравнение (все растворимые вещества раскладываем на ионы);
3.Составить сокращенное ионное уравнение реакции;
4.Выписать отдельно ионы и молекулы, изменившие свой состав или заряд, и ионы, определяющие среду;
5.Составить для них полуреакции (электронно-ионные уравнения) процессов окисления и восстановления с учетом среды, соблюдая 2 закона: закон сохранения массы и закон сохранения заряда:
а) если реакция протекает в кислой среде (Н+ или Н2О), то в ту часть полуреакции, где не хватает кислорода, добавить Н2О, в противоположную – Н+;
б) если реакция протекает в щелочной среде, то в ту часть полуреакции, где не хватает кислорода, добавить ОН-, в противоположную – Н2О (ОН- и Н2О);
в) если реакция протекает в нейтральной среде, ни ионов Н+, ни ОН- в левой части быть не должно. Однако в правой части среди продуктов реакции они могут появиться;
6. Найти НОК отданных и принятых электронов и множители для каждой полуреакции;

123
7. Умножить каждый член полуреакции и сложить их. Привести подобные члены и полученные коэффициенты перенести в молекулярное уравнение.
По методу электронного баланса сравнивают степени окисления атомов в исходных и конечных веществах, причем число электронов отданных восстановителем, должно ровняться числу электронов, присоединенных окислителем.
Метод полуреакций применяется для реакций между газообразными, твердыми или жидкими веществами, протекающих без электролитической диссоциации.
Например:
1) Метод электронного баланса
+3 +7 +5 +2
H3AsO3 + KMnO4+ H2SO4 →H3AsO4 + MnSO4 + K2SO4+ H2O
Ортомышьяковистая кислота Ортомышьяковая кислота Из схемы реакции видно, что степень окисления атома мышьяка до
реакции +3, после +5, степень окисления марганца изменилась от +7 до +2. Отражаем это изменение степени окисления в электронных
уравнениях. |
|
|
|
|
Восстановитель As+3 – 2e- = As+5 |
|
процесс окисления |
||
5 |
||||
Окислитель |
Mn+7 +5e- = Mn+2 |
2 |
процесс восстановления |
|
или 2) методом полуреакций |
|
|
|
|
|
MnO4- + 8H+ + 5e- = Mn+2 |
+ 4H2O |
2 |
|
|
H3AsO3 + H2O – 2e- = H3AsO4 + 2H+ |
5 |
||
Общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем. Найдя наименьшее общее кратное, определяем, что молекул восстановителя должно быть 5, а молекул окислителя 2, т.е. находим соответствующие коэффициенты в уравнении.
Уравнение будет иметь вид:
5 H3AsO3+ 2 KMnO4 + 3H2SO4= 5 H3AsO4 + 2 MnSO4+ K2SO4+ 3H2O
При составлении уравнений окислительно-восстановительной реакции соблюдают последовательность в исходных веществах, записывают сначала восстановитель, затем окислитель и среду, а в продуктах реакции – продукт окисления восстановителя, продукт восстановления окислителя и побочные продукты.

124
1.8.4 Влияние среды раствора на протекание ОВР
На характер протекания окислительно – восстановительной реакции между одними и теми же веществами влияет среда. Так, например MnO4-
восстанавливается до |
4 |
|
Для создания кислой среды используют серную кислоту. Для создания щелочной среды – растворы гидроксидов калия или натрия.
1.8.5 Гальванический элемент
В 1800 г. был создан электрохимический генератор Вольта – Вольтов столб». Генератор Вольта в дальнейшем был усовершенствован и получил название гальванического элемента.
Гальваническим элементом называется прибор, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую.
Электрический ток в гальваническом элементе возникает за счёт окислительно-восстановительной реакции, протекающей так, что окислительный и восстановительный процессы оказываются пространственно разделёнными: на положительном электроде происходит процесс восстановления, на отрицательном – процесс окисления.
Необходимое условие работы гальванического элемента - разность потенциалов электродов, которая называется электродвижущей силой гальванического элемента – Э.Д.С.
Рассмотрим медно-цинковый гальванический элемент. Он состоит из медной и цинковой пластинок, погруженных соответственно в 1М растворы ZnSO4 и CuSO4. Цинк является более активным металлом: он расположен в ряду напряжений выше меди, имеет более отрицательную величину Е0. Следовательно, пластинка цинка зарядится более отрицательно, т.к. цинк будет растворяться и переходить в раствор в виде ионов. На цинковой пластинке идет процесс окисления, который можно выразить электронным уравнением:
Zn0 – 2 e → Zn2+
Электрод, на котором протекает процесс окисления, называется анодом.

125
На меди, которая имеет более положительную величину Е0 и поэтому зарядится положительно, пойдет процесс восстановления ионов меди:
Cu2+ - 2 e → Cu0
Электрод, на котором протекает процесс восстановления, называется катодом.
Суммируя эти уравнения, получаем ионное уравнение окислительновосстановительного процесса, протекающего в гальваническом элементе:
Zn0 + Cu2+ = Zn2+ + Cu0
Если соединить медный и цинковый электроды проводником, то в гальваническом элементе возникает направленное (от цинка к меди) движение электронов, то есть электрический ток.
При работе гальванического элемента в сосуде с Zn SO4 возникает недостаток ионов SO42- (за счет перехода Zn2+ в раствор), а в сосуде с CuSO4 – их избыток (т.к. часть Cu2+ ушла из раствора). В результате раствор ZnSO4 заряжается положительно, а раствор CuSO4 –отрицательно. Это препятствует работе гальванического элемента. Для восстановления электронейтральности растворов их соединяют электролитическим ключом с раствором K2SO4, по которому свободно перемещаются ионы SO42- .
Для простоты гальванический элемент схематически записывают следующим образом:
(-) Zn / Zn SO4 // Cu SO4 / Cu (+)
1.8.6 Электродные потенциалы
При действии гальванических элементов на электродах возникают электрические потенциалы. Величина этих потенциалов характеризует химическую активность металлов. Измерить непосредственно величину электродного потенциала на границе металл – раствор не представляется возможным.
Для характеристики химической активности металлов вместо отдельных электродных потенциалов измеряют разность потенциалов в гальваническом элементе, образованном электродом, состоящим из изучаемого металла, опущенного в раствор его соли, и стандартным электродом, потенциал которого условно принимается равным нулю.
Примером такого электрода служит платиновая пластина, опущенная в раствор кислоты, через который пропускается газообразный водород. Молекулярный водород, проходя через жидкость, частично растворяется и подходит к поверхности платины. На поверхности металла происходит его адсорбция, сопровождающаяся распадом молекул на атомы. Адсорбированные атомы водорода Hадс ионизируются, а ионы водорода из

126
раствора, находящиеся вблизи электрода, принимают электроны и переходят в адсорбированное состояние:
H адс - e → H+ ;
Таким образом, равновесие в уравнением:
2 H+ + 2
H+ + e → Hадс
водородном электроде выражается
e ↔ H2
Разность потенциалов между металлом, погруженным в раствор его соли, и стандартным водородным электродом называется электродным потенциалом изучаемого металла. Величина электродного потенциала зависит не только от
природы металла, но и от концентрации его ионов в растворе.
В электрохимической практике используются так называемые стандартные электроды. Работа этих электродов протекает при стандартных условиях: температуре 298 К (250 С), давлении 101 325 Па и концентрации ионов в растворе 1 моль / л. Так, в стандартном водородном электроде концентрация ионов водорода в растворе должна равняться 1 моль / л, а давление газообразного водорода –101 325 Па.
Электродные потенциалы, измеренные по отношению к водородному электроду в стандартных условиях, называются стандартными.
1.8.7 Ряд стандартных электродных потенциалов металлов
Если расположить металлы в ряд по убывающим отрицательным нормальным потенциалам, то получим ряд стандартных электродных потенциалов металлов.
Вэтот ряд включен и водород, потенциал которого принимается равным нулю.
Ряд стандартных электродных потенциалов металлов дает много важных указаний относительно химического поведения металлов:
1. Каждый из металлов «вытесняет» все следующие за ним металлы из растворов их солей, т.е. восстанавливает ионы последующих металлов в электронейтральные атомы, отдавая электроны и сам превращаясь в ионы.
2. Только металлы, стоящие в ряду напряжений до водорода, могут вытеснять водород из растворов кислот.
3. Чем выше в ряду напряжений стоит металл, т.е. чем отрицательнее его потенциал, тем легче он отдает электроны (окисляется) и тем труднее его ионы присоединяют обратно электроны (восстанавливаются).
Вряду напряжений восстановительная способность металлов увеличивается снизу в верх, а окислительная способность ионов металлов
увеличивается сверху вниз.

127
1.8.8 Вычисление электродных потенциалов при различных концентрациях ионов металлов в растворе
Вычисление производится по уравнению Нернста, которое в упрощенном виде при температуре 250 С имеет вид:
Е = Е0 + |
lg Cмеn+ |
(1.8.1) |
где, Е0 – стандартный электродный потенциал, n – количество отданных электронов.
Пример 1. Вычислить электродный потенциал цинка, опущенного в раствор его соли с концентрацией Zn2+ 0.001 моль / л.
Решение: По ряду напряжений находим, что Е0 цинка равен - 0,75 В. Отсюда
Е = - 0,76 +
0,059 2
ℓg 10-3 = - 0,76 –
0,059 3 2
= - 0.85 B
Пример 2. Определить, какой из электродов отрицательный, а какой положительный в гальваническом элементе, состоящем из алюминиевого и цинкового электродов, опущенных в молярные растворы их солей.
Решение: Т.к. в ряду напряжений алюминий стоит впереди цинка, то Е0 у алюминия имеет более отрицательное значение. Следовательно, алюминий, опущенный в раствор соли алюминия, является отрицательным электродом (анодом), на нем идет процесс окисления:
Al0 –3 е → Al3+
Цинк, опущенный в раствор соли цинка, является положительным электродом (катодом), на нем идет процесс восстановления:
Zn |
2+ |
+ 2 |
е |
→ Zn |
0 |
|
|||||
|
|
|
1.8.9 Вычисление Э.Д.С. гальванического элемента
Электродвижущая сила гальванического элемента равна разности потенциалов катода и анода:
Э.Д.С. = ЕК – ЕА Пример 1. Рассчитать Э.Д.С. гальванического элемента Якоби –
Даниэля.
EZn2+ / Zn0 = - 0.76 B
ECu2+ / Cu0 = 0.34 B

128
ECu2+ / Cu0 – EZn2+ / Zn0
E = 0.34 – (- 0.76) = 1,1 B.
Для вычисления Э.Д.С. гальванического элемента, работающего при нестандартных условиях, следует установить величину электродных потенциалов обоих электродов, а затем найти разность потенциалов.
Пример 2. Вычислить Э.Д.С. гальванического элемента, образованного электродом из железа, опущенного в 0,1 М раствор Fe (NO3)2, и серебряным электродом, опущенным в 0,01М раствор Ag NO3.
Решение:
EFe = - 0.44 +
0,059 2
g 10-1 = - 0.47 B
EAg = + 0.80 + 0.059 ℓg 10-2 = 0.8 – 0.059 ∙ 2 = 0.682 B
Следовательно, анодом является электрод из железа, катодом—из серебра.
Э.Д.С. EAg – EFe = 0.682 – (- 0.47) = 1.152 B
Пример 3. Вычислить Э.Д.С. концентрационного гальванического элемента, состоящего из никелевых электродов, один из которых опущен в 1М раствор соли никеля, другой – в 0,0001 М раствор той же соли.
Решение: Концентрационными называются гальванические элементы, образованные электродами из одного и того же металла, опущенными в растворы одной и той же соли этого металла с различной концентрацией. Величина электродных потенциалов обоих электродов будет различна. В рассматриваемом примере
E1 = E0 = - 0.22 B
E2 = - 0.22 +
0,059 2
ℓg 10-4 = - 0.22 - 0,059 4 = - 0.338 B
2
Первый электрод – положительный, на нем идет процесс:
Ni |
2+ |
+ 2 |
е |
→ Ni |
0 |
|
|||||
|
|
|
Второй электрод – отрицательный, на нем идет процесс:
Ni0 – 2 е → Ni2+

129
1.9 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
ПЛАН
1.9.1Основные положения координационной теории.
1.9.2Классификация комплексных соединений.
1.9.3Номенклатура комплексных соединений.
1.9.4Характер химической связи в комплексных соединениях.
1.9.5Условия разрушения комплексного иона.
1.9.6. Изомерия комплексных соединений. 1.9.7 Значение комплексных соединений.
1.9.1 Основные положения координационной теории
Комплексное соединение – это вещество, в узлах кристаллической решётки которого находятся сложные частицы (комплексные ионы или молекулы), построенные за счёт координации одним атомом обычных молекул и ионов; эти частицы способны существовать и при переходе вещества в растворённое или расплавленное состояние.
В химии комплексных соединений большая роль принадлежит координационной теории, созданной Альфредом Вернером.
Суть коордиционной теории, предложенной А. Вернером сводится к следующим положениям:
1)Центральное место в комплексном соединении занимает комплексообразователь – обычно положительно заряженный ион (чаще всего металл).
2)Вокруг комплексообразователя расположены или координированы – лиганды, т.е. ионы противоположного знака или нейтральные молекулы.
3)Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения.
4)Ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу комплексного соединения. Внутренняя сфера отделяется от внешней квадратными скобками.
5)Число, показывающее, сколько лигандов удерживает комплексообразователь, называют координационным числом.
Рассмотрим соединение Na2[Zn(OH)4].

130
Как правило, положительный заряд комплексообразователя и отрицательные заряды лигандов не уравновешивают друг друга. Поэтому образующаяся частица имеет заряд (почему и называется комплексным ионом). Заряд комплексного иона можно рассчитать, как сумму зарядов всех входящих в него частиц.
В нашем случае заряд комплексного иона равен -2:
Заряд комплексного иона компенсируется противоположным зарядом присоединенных к нему ионов внешней сферы. В рассматриваемом соединении это ионы Na+. Число ионов внешней сферы определяется их зарядом и зарядом комплексного иона. В нашем случае комплексный ион имеет заряд 2-, ион натрия 1+. Поэтому формула имеет вид Na2[Zn(OH)4].
При написании реакций комплексообразования возникает необходимость определить, какая именно частица будет комплексообразователем, какие – лигандами. Нужно уметь правильно определить координационное число в образующемся комплексном соединении. Рассмотрим эти вопросы более подробно.
Комплексообразователь. Чаще всего комплексообразователями являются положительно заряженные ионы d-элементов. Ими также могут быть и ионы р-элементов. f-элементы редко встречаются сами по себе. S- элементы в качестве комплексообразователей выступают довольно редко.
Лиганды. Так как комплексообразователь имеет положительный заряд, то лигандами обычно бывают отрицательно заряженные ионы (анионы). Кроме того, ими могут быть некоторые нейтральные (не имеющие заряда) полярные молекулы. Наиболее часто встречающиеся нейтральные лиганды – молекулы воды (Н2О) и аммиака (NH3).
Координационное число. Величина координационного числа зависит от размера и заряда комплексообразователя и лигандов.
Чем больше размер комплексообразователя и чем меньше размер лигандов, тем больше координационное число, и наоборот.
Чем больше заряд комплексообразователя и чем меньше заряд лигандов, тем больше координационное число, и наоборот.
Сравним, например, два комплексообразователя с одинаковым зарядом, но с разными радиусами – B3+ и Al3+. В качестве лигандов в обоих случаях используем одинаковые ионы F-.
Как показано на рисунке 1.9, больший размер ионов Al3+ позволяет расположить возле него большее количество лигандов. Поэтому в этих соединениях координационное число алюминия равно 6, а бора – только 4.
Если же в качестве лигандов используются более крупные ионы йода I-, то координационное число алюминия снижается до 4.

131
Рисунок 1.9 – Влияние размера комплексообразователя и лигандов на величину координационного числа
Для самых распространенных комплексообразователей наиболее часто встречающиеся значения координационных чисел приведены в таблице 1.9.
Таблица 1.9 – Часто встречающиеся значения координационных чисел
Если значение координационного числа не известно, в первом приближении можно принять его равным удвоенному заряду комплексообразователя, то есть
К.Ч. = 2Z,
где Z – заряд комплексообразователя.
1.9.2 Классификация комплексных соединений
Существует несколько систем классификации комплексных соединений, которые основываются на следующих принципах:
1) По принадлежности к определенному классу соединений: a) Комплексные кислоты
Н[AuCl4] – хлористозолотая кислота
H2 [SiF6] – кремнефтористоводородная кислота H2 [PtCl6] –хлорплатиновая кислота
H2 [PtCl4] – хлорплатинистая кислота
б) Комплексные основания
132
[Ag (NH3)2]OH – гидроксид диамминосеребра (I) [Cu(NH3)4](OH)2 – гидроксид тетрааммино меди (II)
в) комплексные соли
K2[PtCl4] – хлорплатинит калия K2[PtCl6] – хлорплатинат калия
K3[Fe(CN)6] – гексацианофферат (III) калия, феррицианид калия K4[Fe(CN)6] – гексацианоферрат (II) калия, ферроцианид калия
3)по природе лигандов а) аквокомплексы – лигандами являются молекулы воды.
[Co(H2O)6]SO4; [Cu(H2O)4](NO3)2
б) аммиакаты – лигандами являются молекулы аммиака
[Ag(NH3)2]Cl; [Cu(NH3)4]SO4; [Co(NH3)6]Cl2
в) гидроксокомплексы – соединения с ОН--группами в виде лигандов.
K3[Al(OH)6]; Nа2[Zn(OH)4]
г) ацидокомплексы – содержат в качестве лигандов анионы различных кислот.
Оксалатные H2C2O4 ↔ 2H+ + C2O42- оксалат ион
Карбонатные CO32-
Цианидные CN-
Нитратные NO3-
3) по знаку заряда комплекса а) Комплексные катионы
[Co(NH3)6]2+Cl2; [Zn(NH3)4]2+Cl2
б) Комплексные анионы
K2[HgI4]2-; K3Fe[CN)6]3-
в) нейтральные комплексы – не имеют внешней сферы.
[Fe(CO)5]; [Ni(CO)4]; [Co(NH3)3Cl3]
4.В зависимости от числа видов лигандов в комплексе:

133
а) однородные(один вид лигандов в комплексе) [Cu(NH3)4]2+; б) разнородные [Pt(NH3)2CL2].
5.В зависимости от дентантности лиганда: а) монодентантые б) полидентантные.
Многие комплексные соединения, содержащие полидентантные лиганды, являются хелатами. Лиганды захватывают комплексообразователь подобно клешне рака (греч. Chele – клешня).
Лиганд присоединяется к комплексообразователю одновременно двумя типами связей - ионной и ковалентной, возникшей по донорно-акцепторному механизму (стрелка от донора к акцептору). Комплексообразователь как бы втянут внутрь лиганда, охвачен связями наподобие клешни рака, отсюда и название (хелат).
Пример хелата – это двунатриевая соль этилендиаминтетрауксусной кислоты, известная под названием трилона Б (или комплексон III)
К хелатным соединениям относятся такие важные для жизни вещества, как хлорофилл и гемоглобин. Структурные формулы этих веществ очень сложные, но схематично хлорофилл изображают так:
134
Без хлорофилла жизнь на Земле невозможна. В результате фотосинтеза ежегодно образуется около 10¹² кг крахмала и выделяется в атмосферу примерно столько же кислорода.
Структура гемоглобина идентична, но комплексообразователем является железо.
1.9.3 Номенклатура комплексных соединений
Всоответствии с правилами Международного союза по теоретической
иприкладной химии (ИЮПАК) наименование комплексных соединений образуется следующим образом: независимо от заряда координационной сферы сначала называют анион, а затем – катион. В названии координационной сферы перечисляют все её составные части справа налево при этом сначала называют число лигандов затем сами лиганды и, наконец комплексообразователь с указанием его степени окисления.. Для обозначения числа лигандов используют греческие числительные: моно, 2-ди, 3- три, 4-
тетра, 5 – пента, 6 – гекса , 7 – гепта, 8 –окта (приставка моно часто опускается). Если координационная сфера заряжена положительно, то комплексообразователь называют по-русски в родительном падеже. Если координационная сфера имеет нулевой заряд, то комплексообразователь так же по-русски но в именительном падеже. Если координационная сфера заряжена отрицательно, то комплексообразователь называют по-латыни, при этом латинское окончание -ум отбрасывают и заменяют на -ат. Степень окисления комплексообразователя указывают в скобках римскими цифрами.
Например:
К4[Fe(CN)6] – гексацианоферрат (ІІІ) калия [Аl(H2O)6]Cl –хлорид гексаакваалюминия (ІІІ) [Fe(CO)5] – пентакарбонилжелезо
1.9.4 Характер химической связи в комплексных соединениях
Многообразие свойств комплексных соединений вызвало к жизни, помимо теории Вернера, ещё ряд теорий, объясняющих природу связи между комплексообразователем и лигандами:
1. Теория валентных связей – рассматривая строение электронных оболочек атомов, объясняет природу ковалентной и донорно-акцепторной связей в комплексах, а также определённые значения координационных чисел.
2. Метод молекулярных орбиталей более тонко учитывает электронные взаимодействия в комплексах, показывает механизм образования многоцентровой делокализованной электронной системы.
3. Электростатическая теория, развившаяся в теорию кристаллического поля, рассматривает взаимодействие комплексообразователя и лигандов как заряженных частиц, с учётом конфигурации валентных орбиталей.

135
4. Объединённая теория – теория поля лигандов –наиболее полно освещает характер связи в комплексных соединениях и причины их устойчивости.
Все эти теории согласны в следующем: связи между составными частями комплексного соединения сильно различаются по своей прочности.
Первичная диссоциация комплексных соединений протекает по типу сильных электролитов, т.е. нацело:
[Ag(NH3)2]NO3 → [Ag(NН3)2]+ + NO3-
Связь между комплексообразователем и лигандами значительно прочнее, тем не менее, в растворе имеет место вторичная диссоциация, равновесие которой смещено в сторону комплексного иона, это диссоциация слабого электролита:
[Ag(NH3)2]+ →Ag+ + 2 NH3
В соответствии с законом действия масс, это равновесие характеризуется константой равновесия, называемой константой нестойкости комплексного иона:
Как следует из определения константы равновесия, в выражение константы нестойкости входят равновесные концентрации комплексного иона, комплексообразователя и лигандов.
Кн характеризует прочность данного комплексного иона: чем больше Кн, тем меньше его устойчивость.
Речь идёт об устойчивости только внутренней сферы!
На самом деле диссоциация комплексных ионов всегда протекает по стадиям, аналогично диссоциации многоосновных кислот. Кн учитывает суммарную устойчивость внутренней сферы.
Иногда прочность комплексного иона характеризуют константой
устойчивости:
1.9.5 Условия разрушения комплексного иона

136
Хотя связь комплексообразователя с лигандами прочная, она всё же может быть разорвана. Это означает, что комплексный ион можно разрушить, т.е. заставить его полностью продиссоциировать.
Комплекс разрушается, если при действии соответствующего реагента образуется:
а) ещё более прочный комплекс (т.е. имеющий меньшую Кн) или б)
очень плохо растворимое вещество.
Например,
Поэтому под действием кислот комплекс серебра разрушается, а комплекс платины – нет:
Другой пример: если на раствор, содержащий комплексный ион
[Ag(NH3)2]+ →Ag+ + 2NH3
подействовать раствором какого-нибудь хлорида, то осадка AgCl не образуется. Это означает, что концентрация Ag+ в растворе очень мала, и труднорастворимое соединение AgCl образуется в том количестве, которое позволяет ему ещё находиться в растворе:
С(Ag+) · C(Cl-) < ПР AgCl
При добавлении раствора любого сульфида к тому же комплексу сразу образуется осадок Ag2S, это вещество характеризуется крайне низкой растворимостью:
2[Ag(NH3)2]+ + Na2S → Ag2S↓ + 4NH3 + 2Na+ C2(Ag+) · C(S2-) > ПР(Ag2S)
1.9.6. Изомерия комплексных соединений
137
Изомерами называются вещества, имеющие одинаковый состав, но разное строение. Для комплексных соединений можно отметить следующие виды изомерии:
1. Ионизационная изомерия.
Ионизационными изомерами называются такие соединения, в которых ионы внешней и внутренней сферы меняются местами, например,
[Pt(NH3)4Br2]Cl2 и [Pt(NH3)4Cl2]Br2.
2. Координационная изомерия.
Этот вид изомерии встречается в тех соединениях, где и катион, и анион – комплексные. В этом случае комплексообразователи как бы обмениваются своими лигандами, например, [Co(NH3)6][Fe(CN)6] и
[Co(CN)6][Fe(NH3)6]
3. Гидратная изомерия.
Гидратная изомерия характерна для аквакомплексов. Она заключается в том, что молекулы воды могут обмениваться с ионами внешней сферы своими местами, например, [Cr(H2O)6]Cl3 и [Cr(H2O)5Cl]Cl2·H2O.
1.9.7 Значение комплексных соединений
Комплексные соединения имеют большое значение в народном хозяйстве, в химической промышленности. В настоящее время подавляющее количество химических соединений можно рассматривать как комплексные соединения, а учение о комплексных соединениях пронизывает все отрасли промышленности, сельского хозяйства, медицины.
В сельском хозяйстве – для борьбы с известковым хлорозом растений, для растворения карбонатов и гидроксидов железа для ликвидации цинковой недостаточности. Комплексные соединения выполняют специфические функции (дыхание фотосинтез, ферментативный катализ). К числу природных комплексных соединений относятся гемоглобин и хлорофилл (сходство и отличие их между собой). Гемоглобин выполняет функцию переноса кислорода и доставляет его из лёгких по кровеносной системе ко всем тканям (у беспозвоночных – ионом комплексообразователем является – медь, кровь у них голубая).
Роль комплексных соединений велика в технике – получение гальванических покрытий, при получении металлов электролитическим способом. Например: Na3[AlF6] – криолит – в нём расплавляют оксид алюминия, при получении алюминия в чистом виде. Комплексные соединения применяют при борьбе с коррозией (бензооат натрия используют для получения на поверхности железа защитной плёнки) [Fe(C6H5COOH)6](OH)3. Широко применяются rомплексные соединения в аналитической химии, это даёт возможность открывать новые и новые соединения.
138
РАЗДЕЛ 2 ХИМИЯ ПРОСТЫХ ВЕЩЕСТВ И СОЕДИНЕНИЙ ЭЛЕМЕНТОВ
S-, p-, d- и f-элементы. Элементы в периодической системе (ПС) Менделеева делятся на s-, p-, d- и f-элементы. Это подразделение осуществляется на основе того, сколько уровней имеет электронная оболочка атома элемента и каким уровнем заканчивается заполнение оболочки электронами.
Кs-элементам относят элементы IA-группы – щелочные металлы, водород и гелий. Электронная формула валентной оболочки атомов щелочных металлов и водорода – ns1, у Не – ns2. Устойчивая степень окисления равна +1. Элементы IА-группы обладают сходными свойствами из-за сходного строения электронной оболочки.
При увеличении радиуса в группе Li–Fr связь валентного электрона с ядром слабеет и уменьшаются энергия ионизации, сродство к электрону и электроотрицательноть, усиливаются металлические и восстановительные свойства.
Кp-элементам относятся 30 элементов IIIA–VIIIA-групп ПС. Они расположены во втором и третьем малых периодах, а также в четвертом— шестом больших периодах. Элементы IIIА-группы имеют один электрон на p-орбитали. В IVА-VIIIА-группах наблюдается заполнение p-подуровня до 6 электронов. Общая электронная формула p-элементов ns2np6.
В периодах при увеличении заряда ядра атомные радиусы и ионные радиусы p-элементов уменьшаются, энергия ионизации и сродство к электрону возрастают, электроотрицательность увеличивается, окислительная активность соединений и неметаллические свойства элементов усиливаются. В группах радиусы атомов увеличиваются. От 2pэлементов к 6p-элементам энергия ионизации уменьшается. Усиливаются металлические свойства с увеличением порядкового номера.
Кd-элементам относятся 32 элемента периодической системы IV–VII больших периодов. В IIIБ-группе у атомов появляется первый электрон на d- орбитали, в последующих Б-группах d-подуровень заполняется до 10 электронов. Общая формула внешней электронной оболочки (n-1)dansb, где a=1-10, b=1-2.
С увеличением порядкового номера свойства d-элементов изменяются незначительно. У d-элементов медленно происходит возрастание атомного радиуса, также они имеют переменную валентность, связанную с незавершенностью предвнешнего d-электронного подуровня. В низших степенях окисления d-элементы обнаруживают металлические свойства, при увеличении порядкового номера в группах Б они уменьшаются. В растворах d-элементы с высшей степенью окисления обнаруживают кислотные и окислительные свойства, при низших степенях окисления – наоборот. Элементы с промежуточной степенью окисления проявляют амфотерные свойства.
139
f-Элементы делятся на лантаноиды и актиноиды.
Лантаноиды. Семейство из 14 элементов (4f-элементы), следующих за La, общий символ Ln. Электронные конфигурации Ln отражают внутреннюю периодичность, проявляющуюся в некоторых свойствах Ln3+, у которых 4fорбитали заполняются сначала по одному (подсемейство церия: Ce – Gd), а потом по второму электрону (подсемейство тербия: Tb – Lu). Уменьшение атомных и ионных радиусов приводит к лантаноидному сжатию, вследствие которого элементы, следующие за Lu, по своим свойствам оказываются очень похожими на своих предшественников по группам (Zr и Hf, Nb и Ta, Mo и W, Tc и Re). Cеребристо-белые металлы, тускнеющие во влажном воздухе, при нагревании разлагают воду, взаимодействуют со всеми кислотами (кроме H3PO4 и HF), образуя преимущественно ионы Ln3+, другие степени окисления свойственны Ce, Pr, Tb, Dy (4+), Sm, Eu, Tm, Yb (2+). С H, B, C, N, O, халькогенами, галогенами образуют вполне устойчивые соединения.
По химическим свойствам достаточно схожи, разделяют ионообменной хроматографией и экстракцией. Разделенные Ln3+ используют для получения химических соединений с нужными люминесцентными, спектроскопическими и магнитными свойствами, изготовления неодимовых стекол (лазеры), люминесцентных преобразователей (приборы ночного видения), изготовления постоянных магнитов (SmCo5). Основная доля используется в виде смесей металлов или оксидов и других соединений с природным содержанием Ln для изготовления катализаторов, легирующих добавок в металлургии, полировочных паст, аккумуляторов газообразного водорода (LnNi5) и др.
Актиноиды. Семейство из 14 элементов, следующих за Ac, (5fсемейство), общий символ An. Первые три – Th, Pa, U – встречаются в природе, остальные An были получены ядерным синтезом в лабораториях США и России, все радиоактивны. Делятся на два подсемейства Th – Cm (цискюриды) и Bk – Lr (транскюриды). Первое подсемейство во многом отличается от соответствующих лантаноидов, проявляя помимо An3+ и более высокие степени окисления An4+ (Th, Pa, Am, Cm), An4+, 5+, 6+ (U, Np, Pu) и даже Pu7+. Второе подсемейство по химическим свойствам ближе к лантаноидам.
Распространенность элементов в природе. Различные химические элементы распространены крайне неравномерно. Элемент может быть в сотни и тысячи раз более или менее распространенным, чем его непосредственный сосед по периодической системе. Закономерности распространения химических элементов в космосе и на Земле вначале были установлены чисто эмпирически. Было подмечено, что: а) распространенность быстро падает от элементов с низкими атомными номерами (примерно до номера 30), а затем, для более тяжелых элементов остается приблизительно постоянной; б) только десять элементов – H, He, C, N, O, Ne, Mg, Si, S, Fe, атомные номера которых меньше 27, характеризуются
140
высокой распространенностью; в) из них водород резко преобладает над остальными; г) элементы с четными порядковыми номерами более распространены, чем нечетные (закон Оддо–Гаркинса).
Из всех химических элементов в природе найдено 88; такие элементы, как технеций Tc (порядковый номер 43), прометий Pm (61), астат At (85) и франций Fr (87), а также все элементы, следующие за ураном U (порядковый номер 92), впервые получены искусственно. Некоторые из них в исчезающе малых количествах обнаружены в природе.
Из химических элементов наиболее распространены в земной коре кислород и кремний. Эти элементы вместе с элементами алюминий, железо, кальций, натрий, калий, магний, водород и титан составляют более 99 % массы земной оболочки. В морской воде, помимо кислорода и водорода, высокое содержание имеют такие элементы, как хлор, натрий, магний, сера, калий, бром и углерод.
Содержание элементов в коре Земли отличается от содержания элементов в Земле, взятой как целое, поскольку химсоставы коры, мантии и ядра Земли различны. Так, ядро состоит в основном из железа и никеля.
Наиболее распространённым элементом во Вселенной является водород, за ним идёт гелий.
Рассеянные и редкие элемены. Редкие элементы – условное название группы химических элементов. Среди них выделяют: лёгкие (Li, Rb, Cs, Be), тугоплавкие (Ti, Zr, Hf, V, Nb, Ta, Mo, W), рассеянные (Ga, In, Tl, Ge, Se, Te, Re), редкоземельные (Sc, Y, La и лантаноиды), радиоактивные (Po, Tc, Fr, Ra, Ac, Th, Pa, U, Pu, Np, Cm, Cf, Am и др. трансплутониевые элементы), инертные газы (He, Ne, Ar, Kr, Xe, Rn). Такая классификация условна, поскольку многие элементы могут быть отнесены одновременно к разным группам.
Рассеянные элементы – группа химических элементов (рубидий, кадмий, скандий, галлий, индий, таллий, германий, гафний, ванадий, селен, теллур, рений), встречающихся в природе главным образом в виде примеси в различных минералах и извлекаемых попутно из руд других металлов или полезных ископаемых (углей, солей, фосфоритов и пр.).
Минералы рассеянных элементов в природе встречаются крайне редко.
Круговорот элементов в природе. Между литосферой, гидросферой,
атмосферой и живыми организмами Земли постоянно происходит обмен химическими элементами. Этот процесс имеет циклический характер: переместившись из одной сферы в другую, элементы вновь возвращаются в первоначальное состояние. Круговорот элементов имел место в течение всей истории Земли, насчитывающей 4,5 млрд. лет.
Рассмотрим несколько наиболее важных примеров циклического перемещения и миграции химических элементов.
Углерод – основной элемент жизни – содержится в атмосфере в виде диоксида углерода. В океане и пресных водах Земли углерод находится в двух главных формах: в составе органического вещества и в составе
141
взаимосвязанных неорганических частиц: гидрокарбонат-иона НСО3- , карбонат иона СО32– и растворенного СО2. Большое количество углерода сосредоточено в виде органических соединений в животных и растениях. Много «неживого» органического вещества имеется в почве. Углерод литосферы содержится также в карбонатных минералах (известняк, доломит, мел, мрамор). Часть углерода входит в состав нефти, каменного угля и природного газа.
Современный глобальный цикл углерода состоит из двух меньших циклов. Первый из них заключается в связывании диоксида углерода в ходе фотосинтеза и новом образовании его в процессе жизнедеятельности растений и животных, а также при разложении органических остатков. Второй цикл обусловлен взаимодействием диоксида углерода атмосферы и природных вод.
Впоследнее столетие в углеродный цикл существенные изменения внесла хозяйственная деятельность человека. Сжигание ископаемого топлива
–угля, нефти и газа – привело к увеличению поступления диоксида углерода в атмосферу. Это не очень сильно влияет на распределение масс углерода между оболочками Земли, но может иметь серьезные последствия из-за усиления парникового эффекта.
Азот вследствие исключительной прочности молекулы N2, почти полностью сосредоточен в атмосфере. Часть газообразного азота растворена в природных водах, которые содержат и растворенные азотсодержащие органические вещества и неорганические ионы: катион аммония, нитрит-ион и нитрат-ион. Поскольку азот не образует нерастворимых солей, он только в редких случаях накапливается в литосфере. Элемент является обязательной составной частью белков. Поэтому азот в значительном количестве содержится в живых организмах и «мертвом» органическом веществе. Азот непрерывно перемещается между атмосферой, океаном, живыми организмами и почвой.
Ватмосфере под действием электрических разрядов азот переходит сначала в монооксид азота, а затем в диоксид азота. Влага воздуха и кислород превращают диоксид азота в азотную кислоту: 4NO2 + 2H2O + O2 = 4HNO3.
Соединения азота легко растворяются в атмосферных осадках и
попадают на поверхность Земли.
Большое значение в связывании атмосферного азота имеет жизнедеятельность клубеньковых бактерий, обитающих на корнях бобовых растений. Ферменты этих бактерий превращают молекулярный азот в соединения, которые затем усваиваются растениями. Из растений связанный азот поступает в организмы животных, в основном, в виде аминокислот и белков. После гибели живых организмов органические вещества превращаются в неорганические соединения, снова усваиваемые растениями. Часть азота в почвах превращается в молекулярный азот и переходит в
142
атмосферу. Молекулярный азот образуется также при полном окислении органических веществ.
Соединения азота попадают в атмосферу с выбросами промышленных предприятий и транспорта, а в природные воды – с бытовыми и промышленными отходами.
Биогенные элементы. Биогенные элементы – это элементы необходимые организму для построения и жизнедеятельности клеток и органов.
Биогенность 30 элементов установлена.
Существует несколько классификаций биогенных элементов: По их функциональной роли:
1)органогены, в организме их 97,4% (С, Н, О, N, Р, S);
2)элементы электролитного фона (Na, К, Ca, Mg, Сl). Данные ионы металлов составляют 99% общего содержания металлов в организме;
3)Микроэлементы – это биологически активные атомы центров ферментов, гормонов (переходные металлы).
По концентрации элементов в организме биогенные элементы делят:
1)макроэлементы;
2)микроэлементы;
3)ультрамикроэлементы.
Биогенные элементы, содержание которых превышает 0,01% от массы тела, относят к макроэлементам. К ним отнесены 12 элементов: органогены, ионы электролитного фона и железо.
Элементы К, Na, Mg, Fe, Сl, S относят к олигобиогенным элементам. Содержание их колеблется от 0,1 до 1%.
Биогенные элементы, суммарное содержание которых составляет величину порядка 0,01%, относят к микроэлементам. Содержание каждого из них 0,001%. Большинство микроэлементов содержится в основном в тканях печени – депо микроэлементов. Некоторые микроэлементы проявляют сродство к определенным тканям (йод – к щитовидной железе, фтор – к эмали зубов, цинк – к поджелудочной железе, молибден – к почкам
ит.д.).
Элементы, содержание которых меньше чем 10-5%, относят к ультрамикроэлементам. Данные о количестве и биологической роли многих элементов невыяснены до конца.

143
2.1 ВОДОРОД И ЭЛЕМЕНТЫ ГРУППЫ VІІ А
ПЛАН
2.1.1Общая характеристика и свойства водорода.
2.1.2Галогены.
2.1.3Галогеноводороды.
2.1.4Кислородсодержащие соединения галогенов.
2.1.1 Общая характеристика и свойства водорода
Водород находится в 1-м периоде, I группе, главной (А) подгруппе. Химический знак водорода обычно проставляют и в VII группе. По ряду свойств водород похож на щелочные металлы, но в большей степени проявляет сходства с галогенами.
Признаки, общие у водорода и галогенов: близкие значения энергии ионизации; двухатомность и ковалентность связи молекул H2 и Г2; отсутствие электрической проводимости; полярность связей в большинстве соединений; сходство галогенидов и гидридов активных металлов; закономерное изменение свойств в ряду H-At.
Изотопы водорода. Природный водород имеет стабильные изотопы – протий (1Н), дейтерий (2Н, или D) и радиоактивный – тритий (3Н, или Т).
Строение атома водорода: положительно заряженное ядро (+1), 1 протон и один электрон (Нильс Бор, 1913 г.)
Электронная конфигурация – 1s1. Один валентный электрон. Степени окисления: +1, 0, -1:
(восстановитель) H0 –e →H+; (окислитель) H0 +e →H–.
Характер связей в соединениях водорода: ионные (NaH.CaH2), ковалентные полярные (NH3, H2O, HCl) и неполярные (Н2). Известны также соединения водорода с металлическим типом связи.
Валентность водорода равна I.
Молекулы водорода – Н2 очень прочна. Из газовой среды при повышенных температурах и давлениях в результате термической диссоциации молекул водорода, образуется атомарный водород (при t = 5000°С степень диссоциации достигает 95%).

144
Физические свойства. Водород — газ, без цвета и запаха, легче воздуха. Малорастворим в воде. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине. Нетоксичен, t кип. – 252,6°С, t пл. – 259,1°С.
Химические свойства. При обычных условиях молекулярный водород
малоактивен, взаимодействует лишь с наиболее активными неметаллами. При нагревании он взаимодействует с металлами, многими неметаллами, сложными веществами (восстанавливает металлы из их оксидов, галогенидов, нитратов).
Реакции с простыми веществами
Атомарный водород обладает высокой химической активностью; при обычных условиях непосредственно соединяется со многими неметаллами (N2, P, As, O2, S и др.), восстанавливает многие оксиды металлов. Реакционная способность водорода сильно повышается и в момент его выделения из соединения.
Гидриды – солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Ион водорода и ион гидроксония. Ионы водорода (Н+) отвечают за кислотность, а их концентрация берется для расчета значений pH. Ион гидроксония (H3О+), образуется при протонировании воды. Ион водорода

145
получается удалением электрона из атома водорода. Н+ реактивен, в водной среде он соединяется с Н2О с образованием H3О+.
Нахождение водорода в природе. Водород – самый распространённый элемент во Вселенной. На его долю приходится около 92% всех атомов. Массовая доля водорода в земной коре составляет 1%. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна ~ 52%). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
Способы получения водорода
В промышленности: 1. Электролиз водных растворов солей:
2NaCl + 2H2O = H2↑ + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C: H2O + C = H2 + CO.
3.Из природного газа.
А) Конверсия с водяным паром: CH4 + H2O = CO + 3H2 (1000°C). Б) Каталитическое окисление кислородом: 2CH4 + O2 = 2CO + 4H2.
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории: 1. Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту: Zn + 2HCl = ZnCl2 + H2↑.
2.Взаимодействие кальция с водой: Ca + 2H2O = Ca(OH)2 + H2↑.
3.Гидролиз гидридов: NaH + H2O = NaOH + H2↑.
4.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑,
Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например,
2H3O+ + 2e− → H2↑ + 2H2O
Применение водорода. Водород используется в химической промышленности для получения NH3, НСl, спиртов, альдегидов, кетонов; для гидрогенизации твердого и жидкого топлива, жиров; для очистки продуктов переработки нефти; при сварке и резке металлов кислородно-водородным пламенем (t°~2800°С), при атомарно-водородной сварке (t°~4000°С); в металлургии для восстановления металлов из их оксидов; изотопы водорода — дейтерий и тритий — используются в атомной энергетике.
146
Биологическое значение водорода. Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках (ДНК). В живых клетках по числу атомов на водород приходится почти 50%.
2.1.2 Галогены
Общая характеристика элементов. Галогены – элементы – VIIА
группы: фтор (F), хлор (Cl), бром (Br), йод (I), астат (Аt).
Изотопы галогенов: 19F; 35Cl, 37Cl; 79Br, 81Br; 127I; Аt – стабильных изотопов нет.
Строение атомов галогенов. Электронная конфигурация внешнего энергетического уровня галогенов ns2 np5. Например, 17Cl – 1s2 2s2 2p6 3s2 2p5.
Степени окисления: от -1 до +7 (чаще -1, 0, +1, +3, +5, +7), исключение фтор – только -1 и является самым электроотрицательным элементом.
У галогенов от F к Аt радиус атома увеличивается, энергии ионизации снижается, сродства к электрону уменьшается, электроотрицательность падает.
Характер связей с металлами – ионные (NaCl, CaBr2, KI), с неметаллами
– ковалентные полярные (HF, CCl4, S2Br2) в простых веществах – ковалентные неполярные (F2, Cl2, I2).
Особенности фтора. Ограниченные валентные возможности и степени окисления фтора (атом фтора не имеет d-орбиталей, возможны только две степени окисления: 0 и -1); фтор – безусловный окислитель и восстановителем быть не может; невысокая прочность молекулы фтора обусловлена отсутствием у фтора d - орбиталей.
Свойства простых веществ галогенов. Молекулы галогенов двухатомны: F2, Cl2, Br2, I2. Связь между атомами одинарная. Кристаллическая решетка – молекулярная.
Физические свойства. При н.у. фтор – газ светло-желтого цвета, обладающий резким запахом, не сжижается. Ядовит.
Хлор – газ светло-зеленого цвета, так же как и фтор имеет резкий запах. Сильно ядовит. При повышенном давлении и комнатной температуре легко переходит в жидкое состояние.
Бром – тяжелая жидкость красно-бурого цвета с характерным неприятным резким запахом. Жидкий бром, а также его пары сильно ядовиты.
Йод – твердое вещество темно-серого цвета с металлическим блеском. Пары йода имеют фиолетовый цвет. Йод легко возгоняется.
Температура кипения и плавления в ряду фтор-астат возрастает. Этот факт связан с ростом размеров молекул и усилением межмолекулярного взаимодействия (сил Ван-дер-Ваальса).
Хлор, бром и иод слабо растворимы в воде (фтор энергично взаимодействует с водой), значительно лучше галогены растворимы в неполярных и малополярных органических растворителях (спиртах, простых эфирах и аминах).
Природные соединения галогенов. Фтор встречается в природе в виде фторидов, например, флюорита CaF2. Хлор, в основном, в виде хлоридов,

147
например, галита NaCl, сильвин КСl. Бром, содержащийся в морской воде и буровых водах в виде бромидов. Иод выделяют при сгорании морских водорослей.
Применение галогенов и биологическая роль. F2, С12, Вr2, I2
используются для синтеза ряда галогенорганических соединений, для приготовления органических и неорганических препаратов. F2 необходим для разделения изотопов; С12 находит применение в качестве сильного окислителя в разнообразных отраслях химической промышленности, для стерилизации питьевой воды, получения Вr2; Вr2 — для дезинфекции, I2 — как антисептик в медицине, для получения высо-очистых металлов (Zr).
Фтор входит в состав эмали зубов (0,01%).
Ионы хлора в организме активируют некоторые ферменты, служат источником для образования хлороводородной кислоты, создающей благоприятную среду для действия ферментов желудочного сока, влияют на электропроводность клеточных мембран и т. д.
Йод содержится в щитовидной' железе и надпочечниках. Гормон щитовидной железы тироксин (соединение йода) определяет общий темп процессов жизнедеятельности.
Биологическая роль Вr и At не установлена. Бром очень токсичен, астат токсичен из-за радиоактивности.
Химические свойства галогенов. Химическая активность простых веществ галогенов чрезвычайно высока. Они проявляют сильные окислительные свойства, энергично реагируют с металлами, большинством неметаллов, окисляют ряд сложных веществ.
Окислительная способность повышается в ряду At2-F2. Для Cl2, Br2, I2 характерны реакции диспропорционирования.
В атмосфере фтора «горят» такие вещества, как стекло и вода:
SiO2 + 2F2 = SiF4 + O2↑;
2H2O + 2F2 = 4HF + O2↑.

148
2.1.3 Галогеноводороды
Характер химической связи в молекулах галогеноводородов.
Молекулы образованы ковалентной полярной связью. В ряду Н–F, Н–Cl, Н–Br, Н–I полярностьсвязи падает, т. к. увеличивается радиус атома галогена и, соответственно, длина связи.
Общая характеристика галогеноводородов. НГ – газы (кроме НF),
хорошо растворимы в воде; НF –сильно дымящая на воздухе жидкость с резким запахом, ядовитая, в воде растворяется неограниченно.
Температуры плавления и кипения повышаются в ряду НCl, HBr, HI. Аномальное поведение НF связано с ассоциацией в жидком состоянии (НF)x за счет водородных связей. Термическая устойчивость молекул в ряду HF, HCl, HBr, резко падает, HI – соединение эндотермическое, разлагается при слабом нагревании.
При растворении в воде образуют кислоты: плавиковая кислота HF; соляная кислота НС1; бромистоводородная кислота НВг и иодистоводородная кислота HI. В ряду Н–F, Н–Cl, Н–Br, Н–I кислотные свойства увеличиваются. Это объясняется тем, что с увеличением длины связи возрастает и её поляризуемость под влиянием молекул растворителя и, следовательно, диссоциация протекает легче.
Химические свойства галогеноводородов. Плавиковая кислота – слабая из-за прочности связи Н-F. При повышении концентрации ее сила возрастает из-за образования гидрофторид иона: HF+F=HF2 Химическая активность фтороводорода сильно зависит от присутствия воды: сухой HF не действует на металлы и оксиды, но вода, является катализатором процесса, например:
CaO +2HF = CaF2 + H2O (автокатализ)
149
Особенностью плавиковой кислоты является способность взаимодействовать с SiO2:
SiO2 + 4НF = SiF4 + 2Н2O.
Галогенводородные кислоты проявляют все свойства, характерные для кислот: взаимодействуют с металлами, основными оксидами, основаниями, солями слабых кислот.
Все галогеноводороды – восстановители. HF и HCl с
концентрированной H2SO4 не взаимодействует, но HBr и HI ею окисляются:
2HBr + H2SO4 (конц.) = Br2 + SO2 + 2H2O,
8HI + H2SO4 (конц.) = 4I2 + H2S + 4H2O.
Галогениды. Галогениды щелочных и щелочноземельных металлов – ионные соединения. Соли соляной кислоты называются хлоридами. Большинство их хорошо растворимо в воде. Труднорастворимы хлориды серебра и свинца. Соли бромоводородной кислоты – бромиды, иодоводородной
– иодиды. Растворимость бромидов и иодидов в большинстве случаев подобна растворимости соответствующих хлоридов.
Бромиды и иодиды – восстановители:
2NaBr + 2H2SO4 (конц.) = Br2 + SO2 + 2H2O + Na2SO4
Общие принципы получения галогеноводородов
1.Прямой синтез из простых веществ. F2 с Н2 реагирует со взрывом, что затрудняет синтез. НСl получают сжиганием: Сl2 и Н2: H2 + Cl2 = 2HCl.
Br2 и I2 реагируют обратимо: Н2 + Вr2 ↔ 2HBr.
2.Вытеснение из них солей:
CaF2 + H2SO4 (конц.) = CaSO4 + HF,
NaCl + H2SO4 (конц.) =NaHSO4 + HCl,
NaCl + H2SO4 (конц.) = Na2SO4 + HCl.
Для получения НВг и HI нельзя использовать кислоту окислитель, используют нелетучие кислоты неокислители:
KBr + H3PO4(конц.) = KH2PO4 + HI
3. Гидролиз галогенидов и неметаллов:
SiCl4 + 3H2O = H2SiO3 + 4HCl,
150
2P(крас) + I2 + 6H2O = H3PO4 + 3HI,
Н2S + I2 = S + 2НI.
Соляная кислота – это раствор хлороводорода в воде. Концентрированная соляная кислота является бесценным раствором, сильно дымящая во влажном воздухе, обладающая резким запахом вследствие выделения хлороводорода.
HCl обладает общими свойствами, характерными большинству кислот:
1)Изменение окраски индикаторов.
2)Взаимодействие с металлами, стоящими в ряду активности до водорода: Fe +2HCl = FeCl2 + H2
3)Взаимодействие с основными и амфотерными оксидами:
2HCl + CaO = CaCl2 + H2O; 2 HCl + ZnO = ZnCl2 + H2O
4)Взаимодействие с основаниями: 2HCl + Cu(OH)2 = CuCl2 + 2H2O.
5)Взаимодействие с солями: 2HCl + CaCO3 = H2O + CO2↑ + CaCl2.
Специфические свойства HCl:
1) Взаимодействует с нитратом серебра (качественная реакция на соляную кислоту и ее соли); выпадет осадок белого цвета, который не растворяется в воде, ни в кислотах:
HCl + AgNO3 = AgCl↓ + HNO3
2) Взаимодействие с окислителями (MnO2, KMnO4, KClO3 и др.):
6HCl+ KClO3 → KCl +3H2O + 3Cl2↑
Применение. HCl используют для удаления оксидов железа перед покрытием изделий из этого металла другими металлами (оловом, хромом, никелем); для получения различных хлоридов, хлора.
Вмедицине, раствор соляной кислоты прописывают больным с пониженной кислотностью желудочного сока.
Впищевой промышленности – для регулирования кислотности при производстве лимонной кислоты, желатина или фруктозы (Е 507).
Вгальванопластике и гидрометаллургии (удаление накипи, ржавчины, обработка кожи, химреактивы, в качестве растворителя породы при добыче нефти, при производстве каучуков, глутамината натрия, соды, Сl2).
Ворганическом синтезе – для получения винилхлорида, алкилхлоридов и т.д., в качестве катализатора при получении дифенилолпропана, алкилирование бензола.
Не стоит забывать, что соляная кислота опасна для кожи. Еще большую опасность она представляет для глаз. Воздействуя на человека, она может вызвать разрушение зубов, раздражение слизистых оболочек, удушье.

151
2.1.4 Кислородсодержащие соединения галогенов
Формулы известных гидроксидов галогенов приведены в таблице 2.1. 4
Таблица 2.1.4 – Гидроксиды (кислоты) галогенов
Степени |
Формула |
Агрегатное |
Кислотно- |
Название |
Название |
|
окисления |
состояние |
основные |
||||
гидроксида |
кислоты |
солей |
||||
галогена |
при н.у. Цвет |
свойства |
||||
|
|
|
||||
|
|
существует |
слабая |
хлорно- |
|
|
+1 |
НСlO |
только в |
гипохлориты |
|||
кислота |
ватистая |
|||||
|
|
растворе |
|
|||
|
|
|
|
|
||
|
НВгО |
то же |
слабая |
бромно- |
гипобро- |
|
|
кислота |
ватистая |
миты |
|||
|
|
|
||||
|
НIO |
то же |
амфотер. |
иодно- |
гипо- |
|
|
ватистая |
иодиты |
||||
|
|
|
|
|||
|
|
|
кислота |
|
|
|
+3 |
НСlO2 |
то же |
средней |
хлористая |
хлориты |
|
|
|
|
силы |
|
|
|
+ 5 |
НClO3 |
то же |
сильная |
хлорноватая |
хлораты |
|
кислота |
||||||
|
|
|
|
|
||
|
НВrO3 |
то же |
сильная |
бромно- |
броматы |
|
|
кислота |
ватая |
||||
|
|
|
|
|||
|
|
бесцветные |
кислота |
|
|
|
|
НIO3 |
средней |
йодноватая |
йодаты |
||
|
кристаллы |
|||||
|
|
силы |
|
|
||
|
|
|
|
|
||
+7 |
НСlO4 |
подвижная |
сильная |
хлорная |
перхлораты |
|
жидкость |
кислота |
|||||
|
|
|
|
|||
|
Н5IO6 |
бесцветные |
слабая |
йодная |
перйодаты |
|
|
кристаллы |
кислота |
||||
|
|
|
|
Все гидроксиды хорошо растворимы в воде. НСlO4, НIO3, Н5IO6 известны в свободном виде, остальные гидроксиды в свободном виде нестойки, существуют лишь в разбавленных водных растворах или не получены.
Кислородные кислоты хлора. В ряду НСlО – НСlО4 кислотные свойства кислот усиливаются с увеличением степени окисления хлора.
НСlО, НСlO2, НСlО3 существуют только в разбавленных растворах. НСlO4 – легко разлагаются при нагревании. В зависимости от условий возможны различные типы разложения:
2HClO = 2НСl + O2,
2НСlO = Сl2O + Н2O (при действии водоотнимающего средства),
3НСlО = НСlO3+2НСl,
3НСlO3 = 2СlO2 + НСlO4 + Н2О, 4НСlO4 = 4СlO2 + 3O2 + 2Н2O.
152
Оксокислоты (НСlО – НСlО4) – сильные окислители.
Для HClO, НСlO3 характерны также реакции диспропорционирования:
5НСlO + I2 + Н2O = 2НIO3+5НСl,
НСlO3 + 5НСl = 3Сl2 + 3Н2O.
Получение кислот хлора
1. Разложение гипохлоритов:
КСlO+СО2+ Н2О= КНСО3 + НСlO.
2. Действием сильных кислот на хлораты:
Ва(СlO3)2 + Н2SO4 ВаSO4 +2НСlO3
3. Разложением перхлоратов серной кислотой:
КClО4 + H2SO4 (конц) = KHSO4+HClO4
Получение солей оксокислот
1. Взаимодействием галогенов с холодными растворами щелочей, соды,
поташа: Г2 + 2NaOH NaГO + NaГ + H2O (Г=Сl, Br, I),
Сl2 + 2К2CO3 + Н2O = КСlO + КСl + 2КНСО3
2. Взаимодействием галогенов с нагретыми (t = 60÷70°С) растворами щелочей:
3Сl2 + 6КОН = КСlО3 + 5КСl + 3Н2О
3. Умеренное нагревание соответствующих хлоратов:
4KClO3 = 3KClO4 + KCl
2КСlO3 = 2КСl +3O2 (при >400 C)
КВrO4 — по реакции:
ВrО3 + XeF2 + Н2O = КВrO4 + Хе + 2HF.
Ме15IO6 – окисление йодатов хлором:
KIO3 + Cl2 + 6KOH = K5IO6 + 2KCl + 3H2O.
153
Применение соединений галогенов. Соединения галогенов используются для отбелки бумаги и тканей (гипохлориты, NaClO2, СlO2), дезинфекции (СlO2, гипохлориты), в качестве окислителей ракетных топлив (OF2, BrF5, перхлораты), для борьбы с вредителями сельского хозяйства (NaClO3, соединения фтора), в качестве катализаторов (соединения фтора, АlСl3, AlBr3), для приготовления взрывчатых веществ (КСlO3, NH4ClO3), в медицине (КСlO3, соединения брома и йода), в фотографии (AgBr).
Хлорная известь (белильная известь) — смешанный хлорид-гипохлорит кальция или техническая смесь гипохлорита, хлорида и гидроксида кальция
(Ca(ClO)2, CaCl2, Ca(OH)2).
Получение хлорной извести:
2Cl2 + 2Са(ОН)2 = Ca(ClO)2 + 2Н2О + CaCl2
При обычных условиях хлорная известь медленно разлагается:
2Ca(Cl)OCl + CO2 = CaCl2 + CaCO3 + Cl2O
Под действием влажного воздуха, содержащего углекислый газ, хлорная известь превращается в хлорноватистую кислоту:
2Ca(Cl)OCl + CO2 + H2O = CaCl2 + CaCO3 + 2HClO,
Ca(Cl)OCl + 2HCl = CaCl2 + Cl2 + H2O,
2Ca(Cl)OCl = 2CaCl2 + O2 (термическое разложение).
Бертолетова соль (хлорат калия) – калиевая соль хлорноватой кислоты.
Получение бертолетовой соли:
3Сl2 + 6КОН = КСlО3 + 5КСl + 3Н2О.
При температуре ~ 400 °C разлагается:
4KClO3= 3KClO4 + KCl.
В присутствии катализаторов (MnO2, Fe2O3, CuO.) температура разложения значительно снижается (до ~ 200 °C):
2KClO3 = 2KCl + 3O2.
154
Перхлораты – соли хлорной кислоты. Ранее перхлорат натрия использовался, как гербицид, но сейчас самостоятельного применения практически не находит.
Кислородосодержащие кислоты брома и иода Способы получения
1) НВrО — разложение гипобромитов кислотами:
КВrO + СО2 + Н2О = КНСО3 + НВrO.
НIO — по реакции:
HgO + 2I2 + Н2O = 2HIO + HgI2.
НГO3(Г = Br, I) — 1) действие сильных кислот на броматы, йодаты:
Ва(ВrO3)2 + Н2SO4 = ВаSO4 + 2НВrO3,
NaIO3 + H2SO4 = NaHSO4 + HIO3.
2) окисление галогенов сильными окислителями:
Г2 + 5Cl2 + 6H2O = 2HГO3 + 10HCl (Г=Вr, I), 3I2 + 10HNO3 (конц) = 6HIO3 + 10NO + 2H2O.
Н5IO6 — разложение йодатов H2SO4:
Ва5(IO6)2 + 5H2SO4 = 5BaSO4 + 2H5IO6.
Химические свойства кислородосодержащих кислот брома и иода
НIO – слабый амфотерный электролит с преобладанием основных свойств, Н5IO6 – пятиосновная кислота, образующая средние и кислые соли.
Кислотные свойства одноосновных кислот усиливаются с увеличением степени окисления галогена и уменьшением его атомного номера.
Оксокислоты галогенов неустойчивы. НГО, НСlO2, НГО3 (кроме НIO3) существуют только в разбавленных растворах. НСlO4, НIO3, Н5IO6 легко разлагаются при нагревании. В зависимости от условий возможны различные типы разложения:
3НГО = НГO3 + 2НГ (Г=Сl, Вr, I),
4НВrO3 = 2Вr2 + 5O2 + 2Н2О,
2НIO3 = I2O5 + Н2О.
155
Оксокислоты — сильные окислители:
5НСlO + I2 + Н2O = 2НIO3 + 5НСl,
2НВrО3 + 4SO2+3Н2О = 4H2SO4 + Вr2O,
НIO3 + 5HI = 3I2 + 3Н2O.
Химические свойства солей оксокислот галогенов
Соли оксокислот галогенов более устойчивы, чем соответствующие им кислоты. Устойчивость их возрастает с увеличением степени окисления галогенов. Все хлораты при обычной температуре устойчивы, перхлораты — самые устойчивые из всех кислородных соединений хлора как в твердом виде, так и в растворе. Хлораты и перхлораты разлагаются при нагревании:
4KClO3 = 3KClO4 + KCl (умеренное нагревание),
2КСlO3 = 2КСl + 3O2,
КСlO4 = КCl + 2O2.
Окислительные свойства солей ослабевают с увеличением степени окисления галогена.
NaClO + 2KI + H2O = NaCI +I2 + 2KOH,
NaClO3 + 6KI + 3H2SO4 = NaCl + 3I2 + 3K2SO4 + 3H2O,
NaClO3 + 3MnO2 + 6КОН = 3K2MnO4 + NaCI + 3Н2O.
NаСlO3 + КI + Н2O реакция не идет,
NаСlO4 + КI + Н2SO4 реакция не идет.
156
2.2 ЭЛЕМЕНТЫ VI A ГРУППЫ (ХАЛЬКОГЕНЫ)
ПЛАН
2.2.1Общая характеристика элементов.
2.2.2Свойства простых веществ.
2.2.3Гидриды типа Н2Э.
2.2.4Халькогениды.
2.2.5Оксиды халькогенов.
2.2.6Кислородсодержащие кислоты и их соли.
2.2.1 Общая характеристика элементов
Халькогены – элементы VIA группы: кислород (O), сера (S), селен (Se), теллур (Te), полоний (Po).
Изотопы кислорода и серы: 16О, 17О, 18О, 32S, 33S, 34S, 36S.
Строение атомов. Электронная конфигурация внешнего энергетического уровня галогенов ns2 np4. Например, 8O – 1s2 2s2 2p4, 16S – 1s2 2s2 2p6 3s2 3p4,
34Se – 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4.
Степени окисления:
O |
S |
Se |
Te |
Po |
-1,-2 |
-2,+2,+4,+6 |
-2,+2,+4,+6 |
-2,+2,+4,+6 |
-2,+2,+4 |
У халькогенов от O к Po радиус атома увеличивается, энергии ионизации снижается, сродства к электрону уменьшается, электроотрицательность падает.
Характер связей с металлами – ионные (Na2S, CaО), с неметаллами – ковалентные полярные (H2О, CS4) в простых веществах – ковалентные неполярные (O2).
Особенности кислорода. Ограниченные валентные возможности и степени окисления кислорода (не имеет d-орбиталей, максимальная валентность -IV). Может иметь дробные степени окисления в надпероксидах (КО2−1⁄2) и озонидах (КО3−1⁄3); безусловный окислитель, но не во фторидах О2F2,
ОF2.
2.2.2 Свойства простых веществ
Физические свойства простых веществ Аллотропия кислорода: кислород (O2) и озон (O3).
Кислород – бесцветный газ без запаха и вкуса, конденсируется в светлоголубую жидкость, кристаллы светло-синего цвета. T пл. –218,7°С, T кип. – 186°С. Плотность кислорода выше воздуха в 1,1 раза.
Озон – при н. у. газ голубого цвета со специфическим запахом, в жидком состоянии – синий. Плотность озона при н. у. в 1,5 раза больше плотности кислорода. Температура кипения –111,8 °С. Растворимость в воде в 10 раз выше по сравнению с кислородом. Озон очень токсичен. Токсичность обусловлена его сильной окислительной способностью. Он раздражает и повреждает ткани органов дыхания, при воздействии на организм в результате

157
ряда реакций образуются свободные радикалы кислорода. Тем не менее, именно благодаря этим свойствам озон обладает бактерицидным, противовирусным и противогрибковым действием.
Как правило, исходным веществом для получения озона выступает молекулярный кислород (O2). 3O2 ↔ 2O3. Эта реакция эндотермична.
Трактовка химической связи в молекуле кислорода по методам ВС (валентных связей) и МО (молекулярных орбиталей). Согласно методу ВС,
образование молекулы кислорода О2 описывается как результат создания двух общих электронных пар: О=О (рисунок 2.2.1).
Рисунок 2.2.1 – Образование МО в молекуле кислорода
Как видно из диаграммы, молекула О2 имеет два неспаренных электрона, что объясняет ее парамагнитные свойства.
Электронная конфигурация молекулы О2 может быть записана в виде:
Поскольку электроны первого энергетического уровня (К-слой) у элементов второго периода не принимают участия в образовании связей, они составляют внутренний остов атомов в молекуле, обозначаемый К.

158
Порядок связи в молекуле О2 равен (8 – 4) / 2 = 2.
Отрыв одного электрона от молекулы О2 приводит к увеличению кратности связи в образовавшемся молекулярном ионе О2+ до 2,5. В то же время при превращении О2 в отрицательно заряженный ион О2- кратность связи понижается до 1,5. Это отражается на прочности и длине связи этих структур:
Аллотропия и изоморфизм серы. Сера представляет собой порошок или кристаллы желтого цвета. Ее аллотропные модификации отличаются как составом, так и кристаллической структурой. При н.у. наиболее устойчива ромбическая сера, а выше 95,4 стабильна моноклинная сера. Оба вида серы имеют молекулярную кристаллическую решетку, состав молекул – S8. Плотность ромбической серы больше моноклинной. Если ромбическую или моноклинную серу нагреть до 444,6 и полученную жидкость вылить в холодную воду, то образуется пластическая сера, по свойствам напоминающая резину. Ее молекулы состоят из длинных зигзагообразных цепей.
В воде сера нерастворима и не смачивается ею. Несколько лучше она растворяется в бензине, спиртах и особенно хорошо – в сероуглероде (CS2). Сера очень плохо проводит электрический ток (диэлектрик) и теплоту, при трении приобретает избыточный электрический заряд.
Закономерности изменения температур кипения и плавления простых веществ в ряду кислород-полоний
Ткип. и Тпл. ростут от О к Те, а от Те к Ро падают.
Химические свойства простых веществ. Кислород обладает высокой химической активностью. Он взаимодействует непосредственно со всеми простыми веществами, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, образуя оксиды. Наиболее активные щелочные металлы (K, Rb, Cs) образуют при этом надпероксиды ЭО2, а Na – пероксид Na2O2. Кислород окисляется только при взаимодействии с F2.
Вотличие от кислорода S, Se, Te, Po могут окисляться и восстанавливаться. При умеренном нагревании они активно взаимодействуют со многими простыми веществами (водород, неметаллы), при сплавлении – со многими металлами, довольно легко окисляются кислородом и галогенами.
Вряду от S до Po способность окисляться усиливается, а восстанавливаться уменьшается.
При кипячении в растворах щелочей S, Se, Te диспропорционируют, при
нагревании |
реагируют |
с |
кислотами-окислителями. |
С |
кислотами- |

159
неокислителями не реагируют. Po взаимодействует с кислотами как типичный металл.
4Li + O2 = 2Li2O; |
2H2S + 3O2 = 2SO2↑ + 2H2O; |
2Na + O2 = Na2O2; |
4NH3 + 3O2 = 2N2↑ + 6H2O; |
K + O2 = KO2; |
4NH3 + 5O2 = 4NO↑ + 6H2O (kat); |
2Ca + O2 = 2CaO; |
2PH3 + 4O2 = 2H3PO4; |

|
160 |
|
4Al + 3O2 = 2Al2O3; |
SiH4 + 2O2 = SiO2 + 2H2O; |
|
3Fe + 2O2 = Fe3O4. |
2CO + O2 |
= 2CO2; |
4P + 5O2 = 2P2O5; |
2SO2 + O2 = 2SO3 (kat V2O5); |
|
S+ O2 = SO2; |
2NO + O2 |
= 2NO2; |
N2 + O2 ↔ 2NO – Q. |
4FeO + O2 |
= 2Fe2O3 |
Сравнительная активность молекулярного и атомарного кислорода.
Атомарный кислород характеризуется очень высокой активностью. Является наиболее сильным окислителем по сравнению с O2 и O3. В присутствии атомарного кислорода погибают все бактерии, вирусы, простейшие, плесневые и дрожжеподобные грибы.
Значение фотохимической реакции образования озона. Озон образуется под действием ультрафиолетовых (УФ) лучей с длиной волны менее 180 нм. УФ-свет с большей длиной волны (около 320 нм), наоборот, способствует разложению озона. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов.
Природные соединения халькогенов. Кислород в свободном состоянии находится в атмосферном воздухе; в связанном виде входит в состав Н2О, SiO2, силикатов и алюмосиликатов, и всех веществ, из которых построены живые организмы.
Важнейшие природные минералы серы: железный колчедан, или пирит (FeS2), цинковая обманка (ZnS), свинцовый блеск (PbS), киноварь (HgS), антимонит (Sb2S3); селена – ашавалит (FeSe), клаусталит (PbSe), тиманнит (HgSe); телура – алтаит (PbTe), сильванит (AgAuTe4), калаверит (AuTe2), гессит (Ag2Te); полоний встречается в минералах урана и тория как продукт радиоактивного распада.
Общие принципы получения халькогенов Получение кислорода. В промышленности кислород получают
перегонкой жидкого воздуха.
К основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑,
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 +3O2↑,
2KNO3 = 2KNO2 + O2↑,
2KClO3 = 2KCl +3O2↑.
161
Получение серы. 1) Выплавка самородной серы с последующей очисткой путём плавления и перегонки (основной способ); 2) из газов металлургических и коксовых печей: 2H2S + SO2 = 2H2O + 3S
Получение селена и телура. При переработке отходов производства серной кислоты и анодного шлама.
Получение полония. 1) электрохимическое восстановление растворов соединений, выделенных при переработке урановых руд; 2) облучение висмута в ядерных реакторах.
Применение и биологическое значение халькогенов
Кислород используется в химической промышленности для получения HNO3 и H2SO4, пероксидов металлов, в органическом синтезе, в черной металлургии для выплавки чугуна и стали, для резки и сварки металлов. Жидкий кислород применяется для изготовления взрывчатых смесей. Серу используют в производстве H2SO4, для вулканизации каучука, как инсектицид в сельском хозяйстве, в органическом синтезе. Селен применяют для изготовления фотоэлементов и выпрямителей, оптических и сигнальных приборов, в стеклянной промышленности. Teлур применяется как добавка к различным сплавам, улучающая их механические свойства.
H2SO4 – важнейший продукт химической промышленности. Используется в производстве HCl, CH3COOH, фосфорных удобрений, взрывчатых веществ, органических красителей, лекарственных препаратов, для очистки нефтепродуктов, в гидрометаллургии, органическом синтезе.
Соединения кислорода, серы и ее аналогов используется также в производстве светящихся красок (сульфиды), в целлюлозной промышленности (NaHSO3, Ca(HSO3)2), в органическом синтезе (SeO2), в фотографии (Na2S2O3), в качестве окислителей (пероксиды металлов, H2O2) и восстановителей (Н2S, сульфиды металлов, Na2SO3). Селениды и теллуриды (ZnSe, PbSe, CdTe) применяются как полупроводники.
Кислород входит в состав ДНК. Его биологическая роль в значительной степени определяется способностью прочно связывать электроны. Кислород в виде О2 нетоксичен. Токсичен озон. При концентрации его в воздухе больше чем 1:10-6 он сильно раздражает слизистые оболочки и представляет опасность для жизни.
Сера важна для всех живых организмов. Она входит в состав важнейших аминокислот: цистеина, глютатиона и др. Цистеин является составной частью белковых молекул и играет важную роль в процессах переноса водорода в клетках.
Селен важен для некоторых форм жизни, включая человека. Биологическая роль теллура и полония отсутствует.
Соединения Se, Te, Po токсичны.
2.2.3 Гидриды типа Н2Э
Соединения Н2Э – ядовитые газы, кроме Н2О и Н2Ро, с неприятным запахом. Температуры плавления и кипения повышаются в ряду Н2S–H2Po.
162
Термическая устойчивость молекул в ряду Н2О-Н2Ро падает, реакции разложения обратимы. Температуры плавления и кипения, плотность воды не подчиняются общей закономерности изменения этих свойств в ряду Н2S-H2Po. Аномальные свойства воды связаны с малым размером молекул Н2О и образованием водородных связей между ними.
Все сульфаны – желтые маслянистые жидкости, вязкость которых возрастает с увеличением длины гомо-цепи – S-S- и они весьма реакционноспособны.
Способы получения. Н2S, H2Se – прямой синтез, H2S, H2Se, H2Te –
действие разбавленных кислот или воды на соединения элементов с металлами:
Э + H2 = H2Э (Э = S, Se),
FeS + 2HCl = H2S + FeCl2,
Na2Э + 2HCl = H2Э + 2NaCl (Э = S, Se, Te),
3Al2Э3 + 6Н2О = 2Al(OH)3 + 2Н2Э (Э = S, Se, Te).
H2Po – действие соляной кислоты на магний, содержащий следы полония:
Mg(Po) + HCl = MgCl2 (PoCl2) + H2,
H2 + Po = H2Po.
Химические свойства. Водные растворы Н2Э (Э = S, Se, Te) – слабые двухосновные кислоты. Н2О – очень слабый амфотерный электролит. Н2S и H2Se – образуют кислые и средние соли, Н2Te – только средние соли.
Н2Э, кроме Н2О – сильные восстановители, легко окисляются кислородом воздуха: при обычной температуре в растворах – до простых веществ, при сжигании – до диоксидов:
Н2Э + О2 = 2Э+Н2О,
2Н2Э + 3О2 = 2ЭО2 + 2Н2О (Э = S, Se, Te),
H2S + I2 = S + 2HI,
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O, 3H2S + 4HClO3 = 3H2SO4 + 4HCl.
H2O может окисляться до О2 при действии сильных окислителей (F2, O3, MnO4- и др.) и восстанавливаться до Н2 при действии сильных восстановителей:

163
2H2O + 2F2 = O2 + 4HF,
2H2O + 4KMnO4 = 3O2 + 4MnO2 + 4KOH,
2H2O + Э = H2 + Э(OH)2 (Э = Ca, Sr, Ba).
Молекулы Н2О могут выступать в качестве лигандов в аквакомплексах, образовывать кристалогидраты.
Соединения кислорода с водородом Вода – термодинамически устойчивое соединение. Стандартная энергия
Гиббса образования жидкой воды при температуре 298 К равна – 237,57 кДж/моль, водяного пара – 228,94 кДж/моль. Константа диссоциации водяного пара на водород и кислород очень мала (8,88×10-41).
Агрегатное состояние воды определяется температурой и давлением (рисунок 2.2.2). Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
Электронное строение молекулы воды представленно на рисунке 2.2.3.
Рисунок 2.2.2 – Диаграмма состояния воды |
Рисунок 2.2.3 – Электронное строение |
|
молекулы воды |
Физические и химические свойства воды. Вода – это жидкость (н.у.)
без цвета, запаха и вкуса; обладает высокой теплоёмкостью и низкой электропроводностью; температура плавления 0°C; температура кипения 100°C; максимальная плотность воды при 4°C равна 1 г/см3; хороший растворитель.
Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями:
164
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления. Количество водородных связей зависит от температуры: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии – образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Вода – химически активное вещество.
Химические свойства воды
1. Диссоциация молекул воды на ионы:
H2О = H++OH-, или 2H2О = H3O+
2. Вода реагирует с металлами:
2Na + 2H2O = H2 + 2NaOH
3Fe + 4H2O = 4H2 + Fe3O4 (только при нагревании)
3. Вода реагирует с неметаллами:
C + H2O = H2 + CO (при нагревании)
CH4 + 2H2O = 4H2 + CO2 (при нагревании)
4. Вода разлагается при действии электрического тока:
2H2О = 2H2 + O2.
5. Вода реагирует с оксидами неметаллов:
SO2 + H2O = H2SO3.
6. Вода реагирует с оксидами металлов:
CaO + H2O = Ca(OH)2.
7. Вода образует гидраты и кристаллогидраты:
CuSO4 + 5H2O = CuSO4·5H2O (медный купорос),
H2SO4 + H2O = H2SO4 . H2O (гидрат серной кислоты),
NaOH + H2O = NaOH·H2O (гидрат едкого натра).

165
8. Вода участвует в процессе фотосинтеза:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света).
Растворимость веществ в воде. Хорошо растворимые вещества – в 100
г воды растворяется более 1 г вещества при н.у.; малорастворимые вещества – в 100 г воды растворяется 0,01–1 г вещества; практически нерастворимые вещества – в 100 г водры растворяется менее 0,01 г вещества. Совершенно нерастворимых веществ – не существует.
Воду иногда рассматривают как амфолит – и как кислоту и как основание одновременно (H+ = OH−), pKa = p (1,8 10−16) ≈ 15,74.
Самым универсальным растворителем на нашей планете является вода. Тело среднего человека массой 70 кг содержит примерно 40 кг воды. При этом около 25 кг воды приходится на жидкость внутри клеток, а 15 кг составляет внеклеточная жидкость, в которую входят плазма крови, межклеточная жидкость, спинномозговая жидкость, внутриглазная жидкость и жидкое содержимое желудочно-кишечного тракта. У животных и растительных организмов вода составляет обычно более 50%, а в ряде случаев содержание воды достигает 90–95%. Она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме.
Вода хорошо растворяет ионные и многие полярные соединения. Это свойство воды связано с ее высокой диэлектрической проницаемостью (78,5). Вода вызывает гидролиз веществ, и она же является конечным продуктом биологического окисления веществ, в частности глюкозы.
Пероксид водорода – H2O2. Строение молекулы пероксида водорода
(рисунок 2.2.4).
Рисунок 2.2.4 – Строение молекулы пероксида водорода
Физические и химические свойства H2O2. Бесцветная тяжёлая жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Хороший растворитель. Температура кипения –150,20 С.
Из воды выделяется в виде неустойчивого кристаллогидрата H2O2∙2H2O. В присутствии катализатора (MnO2) пероксид водорода разлагается при комнатной температуре, выделяя в момент разложения атомарный кислород:
Н2О2 = Н2О + [О].
166
Для пероксида водорода характерна окислительно-восстановительная двойственность за счёт атома кислорода в промежуточной степени окисления, равной -1, но окислительные свойства для него более характерны:
PbS + H2O = PbSO4 + H2O
Как восстановитель пероксид водорода реагирует с перманганатом калия в кислой среде:
2KMnO4 + 5H2O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5O2 + 8H2O.
Пероксид водорода может также вступать в реакции без изменения пероксидной группировки О–О:
Ва(ОН)2 + Н2О2 = ВаО2 + 2Н2О.
В лаборатории Н2О2 обычно получают, действуя разбавленной серной кислотой на пероксид бария:
ВаО2 + H2SO4 = ВаSO4 + Н2О2.
В промышленности пероксид водорода изначально получали электролизом серной кислоты или раствора сульфата аммония в серной кислоте. В результате этого процесса образуется надсерная кислота H2S2O8, гидролиз которой приводит к образованию пероксида и серной кислоты:
H2S2O8 + 2H2O = 2H2SO4 + Н2О2
Впоследствии был разработан так называемый ’’антрахиноновый процесс‘‘; в этом процессе формально идёт окисление водорода кислородом воздуха с катализом алкилпроизводными антрахинона.
Работая в лаборатории с концентрированным раствором пероксида водорода, следует соблюдать меры предосторожности по работе с сильными окислителями. Перекись водорода при попадании на кожу и слизистые вызывает сильные ожоги. В высоких концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен.
2.2.4 Халькогениды
Известны два ряда соединений серы с металлами – сульфиды и полусульфиды. Все сульфиды, исключая сульфиды щелочных, щелочноземельных металлов и аммония, нерастворимы в воде. Сульфиды тяжелых металлов окрашены в различные цвета, например: CuS, PbS, Ag2S – черный, ZnS – белый, MnS – телесный, СdS, SnS – желтый, Sb2S3 – оранжевый. Окраска полусульфидов меняется от желтой до красной по мере увеличения длины цепи –S-S-.
167
Способы получения. Растворимые сульфиды – нейтрализация щелочей сероводородной кислотой и восстановления сульфатов углем:
2NaOH + H2S = Na2S + 2H2O,
BaSO4 + 4C = BaS + 4CO.
Нерастворимые сульфиды – синтез из простых веществ, а также обменные реакции:
Zn + S = ZnS,
CuSO4 + H2S = CuS + H2SO4,
FeCl2 + (NH4)2S = FeS + 2NH4Cl.
Полусульфиды активных металлов, имеющие наибольшее практическое значение, – взаимодействие S с соответствующими сульфидами (при спавлении или в концентрированном растворе): Na2S + (х-1)S = Na2Sх;
Химические свойства. В водном растворе сульфиды гидролизуются; некоторые из них, например, сульфиды Al(III), Fe(III), Cr(III), – необратимо:
Na2S + H2O = NaHS + NaOH.
Многие нерастворимые в воде сульфиды (например, ZnS, FeS, MnS) Растворяются кислотах-неокислителях:
ZnS + 2HCl = ZnCl2 + H2S.
Сульфиды, ПР которых очень мало, нерастворимы в кислотахнеокислителях, но растворимы в концентрированной HNO3, например, CuS, NiS, царской водке или крепких растворах сульфидов щелочных металлов или аммония, например HgS:
3CuS + 8HNO3 = 3CuSO4 + 8NO + 4H2O
Различная окраска и растворимость сульфидов в различных средах используется в аналитической химии для обнаружения и раздления катионов в растворе.
Все сульфиды – восстановители. Продуктами окисления в зависимости от условий являются S, SO2, сульфаты:
NiS + 2O2 = NiSO4,
168
SnS2 + 3O2 = SnO2 + 2SO2,
CoS + H2O2 + 2CH3COOH = Co(CH3COO)2 + S + 2H2O.
Полусульфиды могут окисляться и восстанавливаться, способны к реакциям диспропорцианирования:
4FeS + 11O2 = Fe2S3 + 8SO2,
Na2S2 + SnS = Na2SnS3.
2.2.5 Оксиды халькогенов. Степени окисления +4 соответствуют диоксиды ЭО2, степени окисления +6 триоксиды ЭО3. Соединение РоО3 неустойчиво. Известен так же неустойчивый оксид серы SO (несолеобразующий) – бесцветный газ, разлагающийся уже при комнатной температуре: 2SO = SO2 + S
SeO2, TeO2, SeO3 в обычных условиях имеют полимерное строение.
Способы получения
SO2 – промышленный: обжиг сернистых руд или сжигание серы:
S + O2 = SO2 (6000С);
4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
Лабораторный: действие сильных кислот на сульфиты:
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O.
SeO2, TeO2- синтез из простых веществ: Э + O2 = ЭO2
SO3 – окисление SO2 в присутствии катализатора (Pt, V2O5и азота):
2SO2 + O2 = 2SO3.
SeO3 – кипячение K2SeO4 c SO3:
K2SeO4 + SO3 = K2SO4 + SeO3.
TeO3 – обезвоживание гексаоксотеллурата (VI) водорода:
H6TeO6 = TeO3 + 3H2O.
Химические свойства. SO2, SeO2, ЭO3 – кислотные оксиды; TeO2 и PoO2
обладают амфотерными свойствами.
169
Оксиды Te (IV, VI) и PoO2 в воде практически не растворимы, реагируют со щелочами, PoO2 – только при сплавлении, TeO2 и PoO2 реагируют также с кислотами:
ЭO2 + H2O = H2ЭO3 (Э = S, Se),
ЭO2 + 2KOH = K2ЭO3 + H2O (Э = S, Se),
TeO2 + 2KOH + H2O = K2[Te(OH)6],
2TeO2 + H2SO4 = Te2O2SO4 + H2O,
PoO2 + 2H2SO4 = Po(SO4)2 + 2H2О,
ЭO2 + H2О = H2ЭO4 (Э = S, Se).
ЭO2 в зависимости от условий могут окисляться и восстанавливаться;
для них характерны реакции дипропорионирования:
SO2 + Cl2 + H2O = H2SO4 + 2HCl,
SO2 + 2H2S = 3S + 2H2O,
4SO2 + 8KOH = K2S + 3K2SO4 + 4H2O.
Для SeO2 и TeO2 в отличии от SO2 в большей степени выражены окислительные свойства: 2SO2 + ЭO2 = 2SO3 + Э.
ЭO3 – при нагревании: 2ЭO3 = 2ЭO2 + O2. SeO3 и SO3 – сильные окислители:
SO3 + 2KI = K2SO3 + I2,
5SO3 + 2P = P2O5 + 5SO2.
2.2.6 Кислородсодержащие кислоты и их соли. Оксидам ЭО2 и ЭО3
соответствуют гидроксиды состава Н2ЭО3 и Н2ЭО4, ТеО3 – гидроксид Н6ТеО6. Все гидроксиды, кроме Н2ТеО3 и Н6ТеО6, хорошо растворимы в воде, устойчивы, кроме Н2SO3 (сернистая кислота). H2TеO3 и H2SO3 существуют только в разбавленных водных растворах. H2TeO3 (теллуристая кислота) склонен к полимеризации.
Способы получения. H2SO4 в водном растворе – растворение SO2 в воде:
SO2 + H2O = H2SO3
170
H2SeO3, H2TeO3 – окисление Se и Te концентрированной HNO3:
3Se + 4HNO3 + H2O = 3H2SeO3 + 4NO
H2SO4 – технические способы получения основаны на окислении SO2 в SO3 и превращении последнего в кислоту.
Схема получения: FeS2 → SO2 → SO3 → H2SO4 Контактный способ: катализатор – Pt, платинированный асбест или
оксиды ванадия. Кислота получается любой концентрации, с малым содержанием примесей, SO3 поглощается концентрированной H2SO4, образуется олеум. Концентрированную (98%) H2SO4 получают смешиванием олеума с разбавленной H2SO4.
Нитрозный способ: катализатор – оксиды азота. Конечный продукт содержит 78% H2SO4:
2NO + O2 = 2NO2,
SO2 + NO2 + H2 = H2SO4 + NO.
H2SeO4, H6TeO6-окисление сильными окислителями простых веществ или соединений Э(IV):
H2SeO3+H2O2 = H2SeO4+H2O,
Te+NO2+H2O = H6TeO6+HCl.
Химические свойства. Водные растворы гидроксидов Н2ЭО3 (кроме Н2ТеО3), Н2ЭО4, Н6ТеО6 – кислоты. Теллуристая кислота Н2ТеО3 амфотерна. Н2SO4 в разбавленных растворах (t<10-4 моль/л) и H2SeO4 – сильные кислоты; Н2SO3, H2SeO3 – кислоты средней силы; Н2ТеО3, Н6ТеО6 (К1=2*10-8) – слабые кислоты.
H2SO4, H2SeO4, H6TeO6 – сильные окислители; в случае серной кислоты окислительными свойствами обладают ее концентрированные растворы. Окислительные свойства наиболее сильно выражены у H2SeO4.
H2SO4 (разб) + Zn = ZnSO4 + H2,
2H2SO4 (конц) + Cu = CuSO4 + SO2 + 2H2O, 2H2SO4 (конц) + S = 3SO2 + 2H2O,
H2SeO4 + 2HCl = H2SeO3 + Cl2 + H2O.
Смесь H2SeO4 и HCl – сильнейший окислитель, растворяет Au и Pt.
171
H2SO3 проявляет восстановительные свойства; при действии сильных восстановителей восстанавливается:
H2SO3 + I2 + H2O = H2SO4 + 2HI,
H2SO3 + 2H2S = 3S + 3H2O.
Для H2SeO3 H2TeO3 в отличии от H2SO3 в большей степени характерны окислительные свойства: Н2ЭО3+2Н2SO3 = 2H2SO4 + Э + H2О (Э=Se, Te).
Сульфиты и сульфаты. Среди производных гидроксидов наиболее практическое значение имеют соли сернистой кислоты– сульфиты, или триоксосульфаты, и серной кислоты– сульфаты, или тетраоксосульфаты.
Сульфиты и сульфаты, как правило, – бесцветные или белые кристаллические вещества. Сульфиты нерастворимы в воде, исключение составляют сульфиты щелочных металлов и гидросульфиты состава Ме(НSO3)2. Сульфаты, кроме сульфатов Ca, Sr, Ba, Pb, Ag, хорошо растворимы. Расторимые сульфаты из водных растворов обычно выделяются в виде кристаллогидратов, часто окрашенных, например, CuSO4·5H2O.
Способы получения. Сульфиты – взаимодействие SO2 с растворами щелочей или карбонатов:
SO2 + NaOH = NaHSO3,
SO2 + 2NaOH = Na2SO3 + H2O
Сульфаты – окисление металлов Н2SO4; окисление сульфидов; нейтрализация H2SO4 основаниями и оксидами; обменные реакции:
Cu + 2H2SO4 (конц) = CuSO4 + SO2 + 2H2O,
3PbS + 8HNO3 = 3PbSO4 + 8NO + 4H2O,
H2SO4 + KOH = KHSO4 + H2O,
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O,
Sr(NO3)2 + K2SO4 = SrSO4 + 2KNO3.
Химические свойства солей. Растворимые в воде сульфиты, сульфаты слабых оснований гидролизуются:
Na2SO3 + H2O ↔ NaHSO3 + NaOH,
2ZnSO4 + 2H2O ↔ (ZnOH)2SO4 + H2SO4.
172
При действии сильных кислот сульфиты разлагаются:
K2SO3 + H2SO4 = K2SO4 + SO2 + H2O.
Водные растворы сульфитов обладают восстановительными свойствами; при действии сильных восстановителей сульфиты проявляют окислительные свойства:
2NaSO3 + O2 = 2NaSO4,
NaHSO3 + Cl2 + H2O = NaHSO4 + 2HCl,
Na2SO3 + 2Na2S + 3H2O = 3S + 6NaOH.
При нагревании сульфиты диспропорцианируют; сульфиты разлагаются с образованием SO3: 4NaSO3 = Na2S + 3Na2SO4.
При высокой температуре SO3 разлагается на SO2 и O2. Термическая устойчивость сульфатов увеличивается с ростом активности металла.
При термическом разложении гидросульфитов образуется дисульфиты, гидросульфатов – дисульфаты:
2NaHSO3 = Na2S2O5 + H2O.
При растворении в воде дисульфиты переходят в гидросульфиты, дисульфаты – в гидросульфаты:
Na2S2O5 + H2O = 2NaHSO3,
Na2S2O7 + H2O = 2NaHSO4.
При нагревании раствора Na2SO3 c S образуется соль тиосерной кислоты H2S2O3 – тиосульфат натрия: Na2SO3 + S = Na2S2O3.
Na2S2O3 легко разлагается кислотами (H2S2O3 неустойчива), является сильным восстановителем:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S + H2O,
Na2S2O3 + 4Cl2 + 5H2O = 2H2SO4 + 6HCl + 2NaCl.
Другие кислород содержащие кислоты серы. Кроме Н2SO3 и H2SO4
сера образует и ряд других кислот:

173
Способы получения. H2SnO6 – взаимодействие H2SO3 c H2S (является промежуточными продуктами).
H2SO4*nSO3 – растворение SO3 в серной кислоте (олеум):
H2SO4 + SO3 = H2S2O7,
H2SO4 + 2SO3 = H2S3O11.
H2S2O5 – действие 100%-го Н2О2 H2SO4 или H2S2O8:
H2SO4 + H2O2 = H2SO5 + H2O,
H2S2O8 + H2O2 = 2H2SO5.
174
H2S2O8 – электролиз H2SO4 или гидросульфатов:
2HSO4- -2e- = H2S2O8
Химические свойства. Полисерные кислоты и пероксокислоты легко взаимодействуют с водой:
H2S2O7 + H2O = 2H2SO4,
H2SO5 + H2O = H2SO4 + H2O2,
H2S2O8 + 2H2O = 2H2SO4 + H2O2.
Пероксокислоты термически нестойки; кислоты и их соли – очень сильные окислители:
2H2SO5 = 2H2SO4 + O2,
K2S2O8 + Cu = CuSO4 + K2SO4.
Применение и биологическая роль
Кислород используется в химической промышленности для получения HNO3 и H2SO4, пероксидов металлов, в органическом синтезе, в черной металлургии для выплавки чугуна и стали, для резки и сварки металлов. Жидкий кислород применяется для изготовления взрывчатых смесей.
Серу используют в производстве H2SO4, для вулканизации каучука, как инсектицид в сельском хозяйстве, в органическом синтезе.
Селен находит применение для изготовления фотоэлементов и выпрямителей, оптических и сигнальных приборов, в стеклянной промышленности.
Teлур применяется как добавка к различным сплавам, улучающая их механические свойства.
Серная кислота – важнейший продукт химической промышленности. Большинство химических соединений получается при прямом или косвенном ее участии. Серная кислота используется в производстве HCl, CH3COOH, фосфорных удобрений, взрывчатых веществ, органических красителей, лекарственных препаратов, для очистки нефтепродуктов, в гидрометаллургии, органическом синтезе.
Соединения кислорода, серы и ее аналогов используется также в производстве светящихся красок (сульфиды), в целлюлозной промышленности (NaHSO3, Ca(HSO3)2), в органическом синтезе (SeO2), в фотографии (Na2S2O3), в качестве окислителей (пероксиды металлов, H2O2) и восстановителей (Н2S, сульфиды металлов, Na2SO3). Селениды и теллуриды (ZnSe, PbSe, CdTe) применяются как полупроводники.
175
Кислород входит в состав ДНК. Его биологическая роль в значительной степени определяется способностью прочно связывать электроны. В состав пищи организмов входят вещества, в молекулах которых электроны находятся на более высоком энергетическом уровне, чем в кислороде. Поэтому переход электронов от пищевых веществ к кислороду доставляет организму энергию, необходимую для движения, химическим синтезом и др. Кислород в виде О2 нетоксичен. Токсичен озон. При концентрации его в воздухе больше чем 1:10-6 он сильно раздражает слизистые оболочки и представляет опасность для жизни.
Сера важна для всех живых организмов. Она входит в состав важнейших аминокислот: цистеина, глютатиона и др. Цистеин является составной частью белковых молекул и играет важную роль в процессах переноса водорода в клетках.
Селен важен для некоторых форм жизни, включая человека. Биологическая роль теллура и полония отсутствует.
Соединения Se, Te, Po токсичны. Po – радиоактивен.
176
2.3 ЭЛЕМЕНТЫ ГРУППЫ V A
ПЛАН
2.3.1 Общая характеристика элементов. 2.3.2 Свойства простых веществ.
2.3.3 Гидриды типа ЭН3.
2.3.4Кислородсодержащие соединения азота.
2.3.5Кислородсодержащие соединения фосфора, мышьяка, сурьмы и
висмута.
2.3.1 Общая характеристика элементов.
Пниктогены – элементы VA группы: азот (N), фосфор (Р), мышьяк (As), сурьма (Sb), висмут (Bi).
Строение атомов. Электронные конфигурации:
7N – 1s22s22p3
15P – 1s22s22p63s23p3
33As – 1s22s22p63s23p63d104s24p31
51Sb – 1s22s22p63s23p63d104s24p64d105s25p3
83Bi – 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p3
Степени окисления:
N |
Р |
As |
Sb |
Bi |
-3, -2, -1, +1, +2, +3, +4, +5 |
-3,+1,+3, +4, +5 |
-3, +3, +5 |
-3, +3, +5 |
-3, +3, +5 |
У халькогенов от N к Bi радиус атома увеличивается, энергии ионизации снижается, сродства к электрону уменьшается, электроотрицательность падает.
Характер связей: с металлами – ионные (Na3N, Ca3N2), с неметаллами – ковалентные полярные (P2О5), в простых веществах – ковалентные неполярные
(N2).
Особенности азота. В природных условиях встречаются два изотопа азота – 14N и 15N. В невозбуждённом состоянии на внешнем энергетическом уровне находится три электрона, поэтому азот может проявлять две валентности – III и V.
2.3.2 Свойства простых веществ
Азот. :N ≡ N: – электронная формула. В молекуле азота имеется одна σ- связь и две π-связи. Она очень устойчива: энергия диссоциации ее на атомы составляет 942,9 кДж/моль, поэтому даже при температуре 33 000°С степень диссоциации азота составляет лишь около 0,1%.
Физические свойства простых веществ. Азот – бесцветный газ, без вкуса и запаха, не ядовит, плохо растворим в воде. В атмосфере чистого азота животные и человек погибают.
Аллотропия фосфора. Фосфор – неметалл, образует несколько аллотропных модификаций, наиболее известными из которых являются белый, красный и чёрный фосфор. Белый фосфор (Р4)– самая химически активная модификация фосфора. Он имеет молекулярную кристаллическую решётку
177
тетраэдрической формы. По внешнему виду белый фосфор очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий: имеет чесночный запах. В воде белый фосфор не растворяется, но растворим в сероуглероде. На воздухе уже при комнатной температуре белый фосфор медленно окисляется кислородом и светится. Он чрезвычайно ядовит.
При нагревании без доступа воздуха белый фосфор превращается в красный фосфор (Р∞), который представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления красный фосфор имеет оттенки от пурпурно-красного до фиолетового. По своим свойствам красный фосфор очень сильно отличается от белого: он не светится в темноте, не имеет запаха, не растворяется в сероуглероде, не ядовит. Красный фосфор на воздухе не самовоспламеняется, но воспламеняется при трении или ударе. Это свойство используется при изготовлении спичек. При сильном нагревании без доступа воздуха красный фосфор возгоняется и оседает в виде белого фосфора.
Чёрный фосфор (Р∞) – это наиболее устойчивая и химически наименее активная форма фосфора. Чёрный фосфор получается при нагревании белого фосфора под высоким давлением до температуры. Чёрный фосфор имеет слоистую структуру. Чёрный фосфор по внешнему виду похож на графит, имеет чёрный цвет с металлическим блеском, жирный на ощупь, не растворяется в воде и органических растворителях, полупроводник. Чёрный фосфор химически малоактивен.
Мышьяк представляет собой хрупкий полуметалл стального цвета, существует в нескольких аллотропных модификациях. Наиболее устойчив при обычных условиях и при нагревании металлический, или серый мышьяк, который обладает металлической электрической проводимостью.
Сурьма – полуметалл серебристо-белого цвета с синеватым оттенком, грубозернистого строения. Известны четыре металлические аллотропные модификации сурьмы и три аморфные модификации (жёлтая, чёрная и взрывчатая сурьма). Соединения сурьмы похожи по химическим свойствам на соединения мышьяка, но отличаются более выраженными металлическими свойствами.
Висмут – тяжёлый серебристо-белый металл с розоватым оттенком. Со временем покрывается тёмно-серой оксидной плёнкой. Наряду со свинцом и оловом входит в состав большинства легкоплавких припоев и сплавов.
Химические свойства. Молекулярный азот химически малоактивен, при комнатной температуре реагирует только с Li. При активации молекул (нагревание, катализатор, электроразряд и т. д.) азот окисляет многие металлы и неметаллы, образую нитриды; окисляется только при взаимодействии с фтором и кислородом.
P, As, Sb, Bi обладают более высокой химической активностью. Они могут окисляться и восстанавливаться: легко реагируют с рядом неметаллов – кислородом, галогенами, серой и др., многими металлами. С кислотами, не

178
являющимися окислителями, они не взаимодействуют, при нагревании реагируют кислотами-окислителями. При нагревании в воде и в растворах щелочей белый и красный фосфор диспропорционирует. Металлические модификации Sb и Bi устойчивы к воде и щелочам. As в воде не растворяется, щелочами окисляется при кипячении. При переходе от As к Bi стабилизируется более низкая степень окисления – +3; химическая связь в соединениях становится все более ионной; основные свойства оксидов и гидроксидов усиливаются.
Реакции с простыми веществами
Реакции со сложными веществами. Э=P, As, Sb, Bi.

179
Общие принципы получения простых веществ и их применение
N2 – промышленный: ректификация жидкого воздуха. При этом улетучивается N2, поскольку tкип жидких O2 и N2 соответственно равны -183 и
-195,8 С.
Лабораторные: 1) окисления аммиака:
2) реакция внутримолекулярного окисления-востановления соединений
азота:
3) восстановление азотной кислоты:
Р – в электрических печах по реакции:
As – термическое разложение арсенопирита без доступа воздуха:
Sb – сплавление сульфида Sb(III) c Fe:
As, Sb, Bi – из природных сульфидов по схеме

180
Роль азота и фосфора в биохимических процессах. Азот является основным компонентом воздуха (78% по объему). В составе белков и нуклеиновых кислот азот содержится в растениях и организмах животных (около 15%). В природе известны залежи нитратов, называемые селитрами. Фосфор в свободном состоянии в природе не встречается вследствие высокой химической активности, а существует в виде соединений, в основном в форме фосфата кальция. Фосфор важен для формирования костной ткани, он входит в состав нуклеотидов и АТФ.
Азот и фосфор относятся к макроэлементам, которые необходимы для жизнедеятельности растительных и животных организмов.
Круговорот азота и фосфора в природе пердставлен на рисунке 2.3.2
Рисунок 2.3.2 – Круговорот азота и фосфора в природе

181
2.3.3 Гидриды типа ЭН3. Для элементов группы VA известны водородные соединения состава ЭН3, кроме того, для азота – N2H4 (гидразин) и HN3 (азотистоводородная кислота), для фосфора – Р2Н4 (дифосфан).
ЭН3 – ядовитые (кроме NH3) газы с резким неприятным запахом; мало растворимы в воде, за исключением NH3. AsH3, SbH3, BiH3 термически нестойки; BiH3 разлагается уже в момент получения. Температуры плавления и кипения повышаются в ряду РН3, AsH3, SbH3. Аномальное поведение NH3 связано с ассоциацией молекул в жидком состоянии (NH3)х за счет водородных связей.
N2H4, Р2Н4, HN3 – жидкости; их температуры плавления соответственно равны 2; -90; -80 С. N2H4 ядовит, N2H4 и HN3 – взрывчатые соединения; Р2Н4 на воздухе самовоспламеняется.
Способы получения. NH3 – промышленные: 1) синтез из простых веществ в условиях: t≈450 C; p≈30 МПа.
Катализатор – губчатое железо с активирующими добавками (Al2O3, К2О
идр.):
2)действие воды на нитриды активных металлов:
Лабораторный: нагревание солей аммония со щелочами:
N2H4 – окисление NH3 гипохлоритом натрия:
НN3 – 1) по реакции:
2) по схеме:
РН3 – 1) разложение фосфидов водой или кислотами:

182
2) взаимодействие белого фосфора с концентрированным раствором щелочи:
Р2Н4 – побочный продукт при получении РН3 из фосфидов. AsH3, SbH3, BiH3 – действие кислот на соединения элементов с
металлами:
AsH3, SbH3 – восстановление соединений элементов водородом в момент выделения:
Химические свойства. ЭН3, N2H4, P2H4 – сильные восстановители.
N2H4 при действии сильных восстановителей восстанавливается, при нагревании диспропорционирует:
Для NH3 и N2H4 характерны реакции присоединения за счет донорноакцепторного взаимодействия: NH3 и N2H4 входят во многие комплексные соединения в качестве лиганов, реагирует с Н2О, с кислотами, образуя соли аммония и гидрозония:

183
Физико-химическое исследование состояния аммиака и гидразина в водном растворе показала, что собственно молекул NH4ОН и N2H5ОН не существует. В водном растворе имеются соединения NH3 Н2О и N2H4 Н2О, которые переходят в ионную форму и диссоциируют на ионы: NH4+ и ОН , N2H5+ и ОН соответственно.
Поэтому константа равновесия диссоциации аммиака, например, равна:
Наиболее устойчивы аминкомплексы d-элементов. Все соли аммония термически нестойки: одни разлагаются уже на холоде, другие – при нагревании. Устойчивость солей аммония тем меньше, чем слабее кислота, образующая соль.
Различные случаи термического распада солей аммония:
1)Полное разложение солей летучих кислот с образованием летучих
продуктов:
2)Частичное разложение солей нелетучих кислот:
3)Внутримолекулярное окисление-восстановление солей аммония, кислотный остаток которых является окислителем:

184
Соли аммония, как правило, растворимы в воде, в водных растворах гидролизуются. Гидролиз иона NH4+ выражается уравнением:
Кислая среда при этом процессе связана с отнятием иона Н+ от иона NH4+, а не присоединением иона аммония к иону гидроксида.
Способность к реакциям присоединения в ряду NH3, РН3, AsH3, SbH3 ослабевает. AsH3 и SbH3 комплексных соединений не образуют, с Н2О и кислотами не реагируют.
РН3 с Н2О не взаимодействует, но с сильными кислотами образует соли фосфония (РН4+):
РН3 входит в состав некоторых комплексных соединений в качестве лиганда. Соли фосфония и комплексные соединения с ионом [Men+(PH3)x]n+ менее устойчивы, чем соли аммония и аминкомплексы.
Р2Н4 в отличие от N2H4 не образует устойчивых соединений при взаимодействии и Н2О и кислотами.
Для NH3 характерны также реакции замещения водорода на металлы и галогены:
НN3 – слабая кислота ( =10 5). Соли – азиды – растворимы в воде, кроме азидов Ag(I), Pb(II), Hg22+, взрывчаты, за исключением солей щелочных металлов (взравчат только LiN3). НN3 – окислитель; смесь НN3 и HCl по окислительным свойствам аналогична царской водке (см. стр. 339), что обусловлено образованием атомарного хлора:
Сильными окислителями НN3 окисляется:
185
2.3.4 Оксиды элементов группы VА группы. Для азота известны оксиды, отвечающие всем степеням окисления от +1 до +5 (таблица 2.3.4.1), для P, As, Sb, Bi – степеням окисления +3 и +5 (таблица). Все оксиды, кроме N O ядовиты; N O и NO малорастворимы в воде; Sb O , Bi O , Bi O практически нерастворимы.
Таблица 2.3.4.1 – Некоторые свойства оксидов элементов группы VА группы
Степени |
Оксид |
Агрегатное |
Температура |
Стандартная |
Кислотно- |
окисления |
|
состояние при н.у. |
плавления |
энтальпия |
основные свойства |
элемента |
|
Цвет |
|
образования |
|
+1 |
N O |
Бесцветный газ |
-91 |
82,0 |
Несолеобразующий |
|
|
|
|
|
оксид |
+2 |
NO |
Бесцветный газ |
-164 |
90,25 |
Несолеобразующий |
|
|
|
|
|
оксид |
+3 |
N O |
Жидкость. Синий |
-102 |
49,4 |
Кислотный оксид |
|
P O |
Воскообразное |
24 |
-1640 |
Кислотный оксид |
|
|
вещество. Белый |
|
|
|
|
As O |
Бесцветное |
возгоняется |
-1335(куб.) |
Амфотерный оксид |
|
|
кристаллическое |
при 315°С |
|
|
|
|
вещество |
|
|
|
|
Sb O |
Бесцветное |
655 |
-1417(ромб.) |
Амфотерный оксид |
|
|
кристаллическое |
|
|
|
|
|
вещество |
|
|
|
|
Bi O |
Кристаллическое |
817 |
-578 |
Основный оксид |
|
|
вещество. Жёлтый |
|
|
|
+4 |
NO |
Газ. Красно-бурый |
-11 |
33,5 |
Кислотный оксид |
+5 |
N O |
Бесцветные |
возгоняется |
-43 |
Кислотный оксид |
|
|
кристаллы |
при 32°С |
|
|
|
P O |
Порошок. Белый |
-315 |
-2984(гекс.) |
Кислотный оксид |
|
As O |
Стекловидная масса. |
450 |
-926,4 |
Кислотный оксид |
|
|
Белый |
|
|
|
|
Sb O |
Порошок. |
разлагается |
-1007,5 |
Кислотный оксид |
|
|
Желтоватый |
при 160°С |
|
|
|
Bi O |
Порошок. Красно- |
|
|
Кислотный оксид |
|
|
коричневый |
- |
|
|
|
|
|
|
|
|
Кислородсодержащие соединения азота Способы получения. Для всех оксидов азота. Синтезом из простых
веществ при очень высоких температурах можно получить только NO, остальные оксиды азота получают косвенным путем.
N2O – термическое разложение нитрата аммония:
NH NO → N O + 2H O.
186
NO – промышленные способы: 1) каталитическое окисление NH :
4NH + 5O → 4NO + 6H O;
2) синтез из простых веществ: N + O ↔ 2NO;
лабораторные способы: 1) восстановление разбавленной HNO :
3Cu + 8HNO (разб.) → 3Cu(NO ) + 2NO + 4H O;
2) действие восстановителей на нитриты в кислой среде:
NaNO + FeCl + 2HCl → FeCl + NO + NaCl + H O;
N O – по реакции: NO + NO ↔ N O .
NO – промышленный способ: окисление NO кислородом при обычной температуре:
2NO + O → 2NO .
Лабораторные способы: 1) восстановление концентрированнойHNO3 малоактивными металлами:
Cu + 4HNO (конц.) → Cu(NO ) + 2NO + 2H O;
2) термическое разложение нитратов тяжелых металлов:
2Pb(NO ) → 2PbO + 4NO + O ;
3) действие сильных кислот на нитриты:
2NaNO + H SO → Na SO + NO + NO + H O,
2NO + O → 2NO .
N O – 1) дегидратация HNO3 фосфорным ангидридом:
2HNO + P O → 2HPO + N O ;
2) по реакции: N O + 2O → N O + 2O .
Химические свойства. Все оксиды азота, кроме NOтермически неустойчивы. N O и N O легко разлагаются уже при комнатной температуре, остальные оксиды – при умеренном нагревании:
187
N O ↔ NO + NO , 2N O → 4NO + O, 2N O → 2N + O , 2NO → 2NO + O .
При низкой температуре NO димеризуется: 2NO → N O . N O и NO с водой не реагируют; NO при растворении в H O
диспропорционирует, аналогично протекает взаимодействие с щелочами:
2NO + H O → HNO + HNO ,
2NO + 2KOH → KNO + KNO + H O.
Оксиды N (III, V), при взаимодействии с водой образуются соответствующие кислоты. Кислотный характер оксидов выражен тем сильнее, чем меньше атомный номер элемента и выше его степень окисления: N O – наиболее кислотный оксид.
Все оксиды азота – окислители, наиболее сильный их них – N O . Окислительные свойства N O, NO, NO проявляются наиболее сильно при нагревании:
2N O + C → CO + 2N ,
10NO + P → P O + 5N ,
2NO + SO → SO + N O, 2NO + 2S → 2SO + N .
NO, N O , NO окисляются при действии сильных окислителей; характерная особенность NO – легкость взаимодействия с O при обычных условиях: 2NO + Г → 2NOГ (Г=F, Cl, Br, J),
2NO + K Cr O + 4H SO → 2HNO + Cr (SO ) + K SO + 3H O,
2NO + F + 2H O → 2HNO + 2HF.
NO склонен к комплексообразованию, в качестве лиганда входит в состав ряда комплексных соединений:
[Fe(H O) ]SO + NO ↔ [Fe(H O) NO]SO + H O.
188
Гидроксиды элементов VА группы
Для всех элементов VА группы известны гидроксиды, отвечающие степеням окисления +3 и +5 (кроме Bi); для P – также степеням окисления +1 и
+4 (таблица 2.3.4.2).
Таблица 2.3.4.2 – Некоторые свойства гидроксидов элементов VА группы
Степени |
|
Агрегатное |
Кислотно- |
Название водного |
Константа |
||
окисления |
Гидроксид |
состояние |
основные |
диссоциации, |
|||
раствора гидроксида |
|||||||
элемента |
|
при н.у. Цвет |
свойства |
К |
|||
|
|
||||||
+1 |
H PO |
Бесцветные |
Кислота |
Фосфорноватистая |
8,5·10 2 |
||
|
|
кристаллы |
средней |
кислота |
|
||
|
|
|
силы |
|
|
||
+3 |
HNO |
Существует |
Тоже |
Азотистая кислота |
5·10-4 |
||
|
|
только в |
|
|
|
|
|
|
|
растворе |
|
|
|
|
|
|
H PO |
Бесцветные |
» |
» |
(Орто) фосфористая |
8·10-3 |
|
|
|
кристаллы |
|
|
кислота |
|
|
|
H AsO |
Существует |
Амфотеры |
(Мета) мышьяковая |
6·10-10 |
||
|
|
только в |
|
с |
кислота |
|
|
|
|
растворе |
усилением |
|
|
||
|
|
|
основных |
|
|
||
|
|
|
свойств |
|
|
||
|
х Sb O *y |
Твердое |
Слабое |
Гидроксид Sb(III) |
― |
||
|
H2O |
вещество. |
основание |
|
|
||
|
|
Белый |
|
|
|
|
|
|
Bi(OH) |
Тоже |
Тоже |
Гидроксид Bi(III) |
― |
||
+5 |
HNO |
Бесцветная |
Сильная |
Азотная кислота |
― |
||
|
|
жидкость |
кислота |
|
|
||
|
(HPO )ᵣ |
Стекловидная |
Кислоты |
Полиметафосфорные |
― |
||
|
|
масса. Белый |
средней |
|
|
||
|
|
|
силы |
|
|
||
|
H P O |
Бесцветные |
Тоже |
Дифосфорная |
3·10-2 |
||
|
|
кристаллы |
|
|
кислота |
|
|
|
H PO |
Тоже |
» |
» |
(Орто) фосфорная |
7·10-3 |
|
|
|
|
|
|
кислота |
|
|
|
H AsO |
» » |
» |
» |
(Орто) мышьяковая |
6·10-3 |
|
|
|
|
|
|
кислота |
|
|
|
х Sb O *y |
Твёрдое |
Слабая |
Сурьмяная кислота |
― |
||
|
H O |
вещество. |
кислота |
|
|
||
|
|
Белый |
|
|
|
|
|
Все рассматриваемые гидроксиды, кроме гидроксидов Sb(III, V) и Bi(III), хорошо растворимы в воде. Гидроксиды Sb(III, V) имеют неопределённый состав: х Sb O *y H O; x Sb O *y H O; метафосфорная кислота – полимерное соединение. НNO и H AsO неустойчивы, существуют только в разбавленных водных растворах. Висмутовые кислоты в свободном виде не получены.
189
Азотистая кислота, ее соли.
Способы получения. HNO – 1) действие сильных кислот на нитриты:
2NaNO + H SO → Na SO + 2HNO ;
2) по реакции: NO + NO + H O ↔ 2HNO .
Химические свойства. HNO восстанавливается при действии сильных восстановителей:
2HNO + H S → S + 2NO + 2H O,
HNO при нагревании диспропорционируют:
3HNO ↔ HNO + 2NO + H O
Соли азотистой (нитриты) имеют наибольшее практическое значение. Все нитриты, кроме AgNO хорошо растворимы в воде.
Способы получения. Нитриты – 1) действие N O на гидроксиды:
NO + NО + 2NaOH = 2NaNO + H O;
2) восстановление нитратов: NaNО + Pb = PbO + NaNO . Химические свойства. Все нитриты, при прокаливании разлагаются.
Нитриты щелочных металлов разлагаются при температурах выше температуры плавления.
1)Нитриты щелочных металлов:
4LiNO = 2Li O + 4NO + O ;
2)Нитриты других металлов и аммония:
Cd(NO ) = CdO + NO + NO
NH NO2 = N O + 2H O,
3) Нитриты, как и HNO , окисляется и восстанавливается:
6HNO2 + 2KMnO4 + 3H2SO4 → 5HNO3 + 2MnSO4 + K2SO4 + 3H2O, 5NaNO + 2KMnO + 3H SO → 5NaNO + 2MnSO + K SO + 3H O, 2KNO + 2KI + 2H SO → 2NO + I + 2K SO + 2H O,
KNO + 2Al + KOH + 5H O → NH + 2K[Al(OH) ].
HNO при нагревании диспропорционирует:
3HNO ↔ HNO + 2NO + H O.
4) В водных растворах нитриты гидролизуются.
190
Азотная кислота и ее соли
Способы получения. HNO – промышленный способ: аммиачный (основной). Основан на окислении NO, получаемом из NH , в NO и превращении последнего в HNO .
Схема процесса: NH → NO → NO → HNO ,
4NO + 3O + 2H O = 4HNO .
Лабораторный способ: действие H SO конц. на нитрат калия:
2KNO + H SO = 2HNO + K SO .
Химические свойства. HNO – сильная кислота и сильный окислитель. HNO окисляет почти все металлы (кроме благородных) и неметаллы; HNO конц. на холоде «пассивирует» Al, Fe, Cr, Co, Ni в результате образования пленки малорастворимых оксидов; продукты восстановления HNO зависят от ее концентрации, природы восстановителя, температуры; активные металлы восстанавливают разбавленную HNO до NH NO :
4HNO (конц.) + Cu = Cu(NO ) + 2NO + 2H O, 8HNO (разб.) + 3Cu =3Cu(NO ) + 2NO + 4H O, 10HNO (разб.) + 4Zn = 4Zn(NO ) + NH NO + 3H O, 36HNO (разб.) + 10Fe = 10Fe(NO ) + 3N + 18H O, 4HNO (конц.) + C = CO + 4NO + 2H O,
8HNO (разб.) + 3PbS = 3PbSO + 8NO + 4H O.
Смесь HNO и HCl (1:3) – царская водка – растворяет Au и платиновые металлы:
Au + HNO + 3HСl → AuCl + NO + 2H O.
HNO неустойчива, на свету и при нагревании частично разлагается:
4HNO = 4NO + 2H O + O .
Соли азотной кислоты – нитраты.
Способы получения: действие HNO на металлы, оксиды, гидроксиды, карбонаты:
3Ag + 4HNO (разб.) = 3AgNO + NO + 2H O,
191
NiO + 2HNO = Ni(NO ) + H O,
Na CO + 2HNO = 2NaNO + CO + H .
Химические свойства. Все нитраты при прокаливании разлагаются. Нитриты щелочных металлов разлагаются при температурах выше температуры плавления.
Различные случаи термического разложения нитратов:
1)нитраты щелочных металлов:
2NaNO = 2NaNO + O ;
2) нитраты щелочноземельных и тяжёлых металлов (их оксиды термически устойчивы):
2Ni(NO ) → 2NiO + 4NO + O ;
3) нитраты благородных и полублагородных металлов (их оксиды термически нестойки):
2AgNO → 2Ag + 2NO + O ;
4) продукты термического разложения нитрата аммония зависят от температуры:
NH NO → N O + 2H O,
2NH NO → 2N + O + 4H O.
Нитраты в расплавленном состоянии – сильные окислители. В растворах нитраты восстанвливаются активными восстановителями в щелочной среде:
NaNO + 4Zn + 7NaOH + 6H O → NH + 4Na [Zn(OH) ].
2.3.5 Кислородсодержащие соединения фосфора, мышьяка, сурьмы и висмута
Способы получения. P O , P O – синтез из простых веществ:
P + 3O (недост.) →P O , |
P + 5O (изб.) → P O . |
Э O (Э=As, Sb, Bi), As O , Sb O – 1) окисление простых веществ:
4Э + 3O → 2Э O (Э=As, Sb, Bi),
2Sb + 10HNO (конц.) → Sb O +10NO +5H O.
192
2) обжиг сернистых соединений:
2Э S + 9O → 2Э O +6SO (Э=Sb, Bi).
3) прокаливание гидроксидов:
2H AsO → As O +3H O,
2Bi(OH) → Bi O +3H O,
Bi O – по реакции: 2Bi O + 2O → 2Bi O +O .
Химические свойства. Все оксиды P O , Э O (Э=As, Sb, Bi),
термически неустойчивы, легко разлагаются при умеренном нагревании; устойчивость Э О уменьшается при переходе от As к Bi:
P O → (P O )n + P (красн.), n = 2–6,
As O → As O + O ,
Bi O → Bi O + О .
Оксиды P (V), As (V) при взаимодействии с водой образуются соответствующие кислоты.
Sb O , Bi O растворяются в щелочах, Sb O – в щелочах и в кислотах, Bi O – в кислотах:
Sb O + 2KOH + 5H О → 2K[Sb(OH) ],
Sb O + 6NaOH + 3H О → 2Na [Sb(OH) ],
Bi O + 6HNO → 2Bi(NO ) + 3H O.
Bi O обладает основным характером. У амфотерного оксида As O преобладают кислотные свойства, у Sb O – основные:
As O + 6NaOH → 2Na AsO + 3H O,
As O + 6HCl (недост.) →2AsCl + 3H O.
Сильные окислители – Sb O и особенно Bi O . Sb O – сильный окислитель в кислой среде:
Sb O + 10HCl → 2SbCl + 2Cl + 5H O.
193
As O восстанавливается при действии сильных восстановителей:
As O + 4HI + H O ↔ 2H AsO + 2I .
P O – восстановитель, легко окисляется O , S, галогенами; Э O (Э=As, Sb, Bi) окисляются при действии сильных окислителей; способность окисляться Э О уменьшается при переходе от As к Bi:
P O + 2O → P O ,
3As O + 4HNO (конц.) +7 H O → 6H AsO + 4NO,
2Bi O + 2O → 2Bi O + O .
Кислородсодержащие кислоты фосфора и их соли
Способы получения. H PO – по схеме: P → Ba(H PO ) → H PO . H PO – гидролиз хлорида P(III): PCl + 3H O → H PO + 3HCl.
H PO – промышленные способы: 1) разложение фосфорита H SO :
Ca (PO ) + 3H SO → 3CaSO + 2H PO .
2) по схеме: P → P O → H PO ;
лабораторные способы:1) взаимодействие P O с водой:
P O + 6H O → 4H PO .
2) окисление P концентрированной HNO :
3P+5HNO (конц.)+2H O → 3H PO +5NO.
H P O , (HPO )ᵣ ― 1) по схеме: H PO → H P O → (HPO )ᵣ;
2) по реакции:
P O + H O (недост.) → (HPO )ᵣ.
Химические свойства. H PO , H PO , восстанавливаются при действии сильных восстановителей:
H PO + 2Zn + 2H SO → 2ZnSO + PH + 2H O,
H PO + 3Zn + 3H SO → 3ZnSO + PH + 3H O.
H PO , H PО ,– сильные восстановители, H PO – более сильный восстановитель, чем H PO :
194
3H PO + 4BiCl + 6H O → 3H PO + 4Bi + 12HCl,
H PO + HgCl + H O → H PО + Hg + 2HCl.
H PО , H PO при нагревании диспропорционируют:
3H PO → PH + 2H PO , 4H PO → PH + 3H PO .
Производные гидроксидов. Соли фосфорной кислоты (одно-, двух- и трёхзамещённые фосфаты).
Способы получения. Фосфаты являются распространенными природными соединениями.
Химические свойства. Все фосфаты, кроме трёхзамещённых, при прокаливании разлагаются.
Различные случаи термического разложения фосфатов:
1)первичные (однозамещёные) фосфаты:
NaH PO → NaPO + H O;
2)вторичные (двухзамещённые) фосфаты:
2Na HPO → Na P O + H O;
3) третичные (трёхзамещённые) фосфаты. Разлагается только фосфат аммония:
(NH ) PO → 3NH + H PO .
В водных растворах растворимые фосфаты гидролизуются. Реакция среды при гидролизе первичных фосфатов щелочных металлов кислая, вторичных – слабощелочная, третичных – щелочная:
PO 3- + H O ↔ HPO 2- + OH-, pH>7,
HPO 2- + H O ↔ H PO - + OH-, pH>7,
H PO - + H O ↔ H PO + OH-, pH<7.
Кислородсодержащие соединения мышьяка, сурьмы и висмута. Способы получения. H AsO – по реакции: As O +3H О → 2H AsO .
Sb(OH) , Bi(OH) – действие кислот и щелочей на соответствующие соединения Sb(III) и Bi(III):
SbCl + 3NaOH (недост.) → Sb(OH) + 3NaCl,
195
Na [Sb(OH) ] + 3HCl→ Sb(OH) + 3NaCl + 3H O,
Bi(NO ) + 3NaOH → Bi(OH) + 3NaNO .
H AsO , xSb O ·yH O – окисление As, Sb или их соединений сильными окислителями:
2As + 5Cl + 8H O → 2H AsO + 10HCl,
3As O + 4HNO + 7H О → 6H AsO + 4NO,
2Sb + 10HNO (конц.) → Sb O + 10NO + 5H O.
Химические свойства. Bi(OH) – основание, H AsO и Sb(OH) – слабые амфотерные с преобладанием кислотных свойств у H AsO и основных у
Sb(OH) :
H AsO + 3NaOH → Na AsO + 3H O,
H AsO + 3HCl (конц.) → AsCl + 3H O,
Sb(OH) + 3HCl → SbCl + 3H O,
Sb(OH) + 3NaOH (р.) → Na [Sb(OH) ],
Sb(OH) + NaOH → NaSbO + 2H O.
xSb O ·yH O – сильный окислитель:
Sb O + 10HCl → 2SbCl + 2Cl + 5H O.
H AsO восстанавливается при действии сильных восстановителей:
H AsO + 2HI → H AsO + I + 2H O.
H AsO – сильный восстановитель:
H AsO + I + H O → H AsO + 2HI.
196
2.4 ЭЛЕМЕНТЫ ГРУППЫ IVA
ПЛАН
2.4.1 Общая характеристика элементов. 2.4.2 Свойства простых веществ.
2.4.3 Гидриды типа ЭН4.
2.4.4 Кислородсодержащие соединения углерода. 2.4.5 Кислородсодержащие соединения кремния.
2.4.1 Общая характеристика элементов
Элементы IVA группы: углерод (С), кремний (Si), германий (Ge), олово
(Sn), свинец (Pb).
Изотопы углерода и кремния: 12С, 13С, 14C (радиоактивный), 28Si, 29Si,
30Si.
Строение атомов. Электронная конфигурация внешнего энергетического уровня галогенов ns2 np2.
Например, 6С – 1s22s22p2
14Si – 1s22s22p63s23p2
32Ge – 1s22s22p63s23p63d104s24p2
50Sn – 1s22s22p63s23p63d104s24p64d105s25p2
82Pb – 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p2
Степени окисления:
С |
Si |
Ge |
Sn |
Pb |
-4, +2, +4 |
-4, +2, +4 |
+2, +4 |
+2, +4 |
+2, +4 |
У халькогенов от С к Pb радиус атома увеличивается, энергии ионизации снижается, сродства к электрону уменьшается, электроотрицательность падает, неметаллические свойства ослабевают, а металлические усиливаются: углерод и кремний – неметаллы; германий, олово, свинец амфотерные металлы.
Характер связей: с металлами – ионные (СаС2, Ca2Si), с неметаллами
– ковалентные полярные (СН4, CS4) в простых веществах – ковалентные неполярные (С). Углерод способен образовать гомоатомные цепи Э-Э и кратные связи, изучением которых занимается органическая химия.
Вследствие малой прочности гомоатомных связей кремний в отличие от углерода не образует устойчивых гомоцепей. Для него характерно образование гетероцепей, особенно с кислородом:∙− Si − O − Si −.
2.4.2 Свойства простых веществ
Аллотропные модификаций углерода – алмаз, графит, фуллерен,
карбин, графен и нанотрубки (рисунок 2.4.2). Алмаз состоит из атомов углерода с sp3 – гибридизацией валентных электронов. Его кристаллы, образующие кубическую гранецентрированную решетку – одна половина атомов в кристалле расположена в вершинах и центрах граней одного куба, а

197
другая – в вершинах и центрах граней другого куба, смещенного относительно первого в направлении его пространственной диагонали. В полимерной структуре каждый атом связан с четырьмя соседними атомами 4 σ-связями. Алмаз – самый твердый из всех природных веществ, диэлектрик, прозрачный, бесцветный, обладает высокой светопреломляемостью. При сильном нагревании без доступа воздуха алмаз переходит в графит.
Графит – кристаллы темно-серого цвета, со слабым металлическим блеском, маслянистый на ощупь. Характерна для атомов sp2- гибридизация. Каждый атом образует по 3 ковалентных σ- связи с соседними атомами под углом 120° – образуется плоская сетка, состоящая из правильных шестиугольников, в вершинах которых находятся атомы С.
Фуллерены – класс химических соединений, молекулы которых состоят только из углерода, число атомов которого четно, от 32 и более 500, они представляют по структуре выпуклые многогранники, построенные из правильных пяти- и шестиугольников.
Карбин состоит из углеродных фрагментов с тройной –С≡С– С≡С–, или двойной кумулированной =С=С=С=С= связью. Может быть линейным или образовывать циклические структуры. Атомы углерода
находятся в sp-гибридном состоянии.
Рисунок 2.4.2 – Аллотропные модификации углерода
Графен образован слоем атомов углерода толщиной в один атом. Атомы углерода находятся в sp²-гибридизации и соединены посредством σ- и π-связей в гексагональную двумерную кристаллическую решётку.
Нанотрубки (или тубулены) представляют собой полую цилиндрическую структуру диаметром от десятых до нескольких десятков нанометров и длиной от одного микрометра до нескольких сантиметров,
198
состоящие из одной или нескольких свёрнутых в трубку графеновых плоскостей.
Кроме рассмотренных аллотропных модификаций существуют аморфные формы углерода: сажа, кокс, древесный уголь и животный уголь. Сажа и угли представляют собой тонкодисперсный мелкокристаллический графит. К аморфным модификациям углерода относится ещё одна форма углерода – стеклоуглерод, которую получили искусственным путём. Он состоит из связанных между собой фрагментов алмаза, графита и карбина. Стеклоуглерод – очень лёгкий, механически прочный, твердый, электропроводящий, коррозионно-устойчивый (устойчив к действию царской водки) и термостойкий материал. Он выдерживает нагревание до 3700 оС.
Строение и физические свойства кремния, германия, олова и свинца
Кремний – второй элемент по распространенности на Земле после кислорода. В земной коре его – 27,6%. Чистый кремний – кристаллическое сине-серое вещество с металлическим блеском, встречается в структурной форме, которая подобна алмазу (температура плавления 1415оС). В узлах кристаллической решетки находятся атомы Si в sp3 гибридном состоянии с координационным числом 4.
Все металлы IV группы главной подгруппы – белые, блестящие вещества с плотностью выше 5 г/см3. Олово и свинец – мягкие, низкоплавкие
ихорошо проводящие электрический ток металлы. Германий, имея кристаллическую решетку как у алмаза (атомную), обладает необычно высокой для металлов твёрдостью, высокой температурой плавления (9580С)
ипроявляет полупроводниковые свойства. Свинец имеет голубовато-серый цвет и блестит, однако на воздухе быстро тускнеет. Это самый мягкий среди тяжёлых металлов – он оставляет след на бумаге и режется ножом. Теплопроводность и электропроводность свинца невелики. При 7,5 К, он становится сверхпроводником. Металлический свинец хорошо поглощает α-, β - и жёсткое электромагнитное излучение.
Способы получения. Углерод в форме древесного угля известен с древних времен. Он может быть получен при нагревании древесины без доступа воздуха, при обугливании животных остатков, неполном сгорании органических соединений (сажа). Графит и алмаз встречаются в природе, но в последнее время в основном их получают искусственным путём: графит – из смеси кокса и каменноугольной смолы, а алмаз – при очень высоком давлении и температуре из графита. Карбин получают синтетически при каталитическом окислении ацетилена и является наиболее стабильной формой углерода, а алмаз – наименее стабильная форма. В 1990 г. из сажи, образованной при испарении графита в электрической дуге в атмосфере гелия, была выделена еще одна новая форма углерода, так называемые
фуллерены.
t
Si – восстановление из SiO2 магнием: SiO2 + Mg→Si + 2MgO

199
t
или углеродом в электрической печи: SiO2 + 2C→Si + 2CO.
Высокой чистоты Si получают восстановлением SiCl4 цинком или
t
водородом: SiCl4 + 2Zn→Si + 2ZnCl2.
Ge, Sn и Pb – термическое восстановление их оксидных соединений с помощью H2, C, CO:
t
GeO2 + 2H2 →Ge + 2H2O ,
t
SnO2 + 2C→Sn + 2CO ,
t
PbO + CO →Pb + CO2 .
Химические свойства. При обычных условиях все аллотропные модификации углерода весьма инертны, другие элементы группы химически достаточно активны и взаимодействуют со многими веществами, как простыми, так и сложными. При увеличении температуры химическая активность всех веществ, образованных элементами группы, резко возрастает.
Реакции с простыми веществами
ЭС → карбиды; ЭSi → силициды; Ge, Sn, Pb → сплавы
Реакции со сложными веществами
Si + H2O → SiO2 + H2 ,
Si + 2NaOH + H2O → Na2SiO3 + 2H2 ,

200
Sn + NaOH → Na2SnO2 + H2O,
Ge + 4HNO3 (конц) → GeO2 + 4NO2 + 2H2O, 3Pb + 8HNO3 (разб) → 3Pb(NO3)2 + 2NO + 4H2O, Sn + 4H2SO4 (конц) → Sn(SO4)2 + 2SO2 + 4H2O, Pb + 3H2SO4 (конц) → Pb(HSO4)2 + SO2 + 2H2O.
Роль в биологических процессах. Углерод – главный элемент всех органических соединений, известен на земле и в космосе. Благодаря углероду возникло все богатство и разнообразие видов растений и животных. На углеродной основе построена вся жизнь в биосфере.
Кремний играет большую роль в биологической круговороте, никакой организм не может существовать без кремния. Избыток и недостаток кремния в организме болезненно сказывается на его развитии.
Германий и олово являются биологически активными элементами, однако их физические и биохимические свойства изучены пока недостаточно.
Велика также биогенная роль свинца. Он входит в состав многих растений и животных (от тысячных до миллионных долей процента). Вместе с тем соединения свинца ядовиты и при длительном взаимодействии даже следовых количеств может привести к тяжелым заболеваниям, так как избыточный свинец накапливается в организме.
2.4.3 Гидриды типа ЭН4
Водородные соединения типа ЭН4 – газы, устойчивость которых при

201
переходе от СН4 к PbH4 уменьшается, а восстановительная способность увеличивается.
Метан (СН4) химически инертен, остальные газы имеют высокую реакционную способность. Например, силан (SiH4) самовоспламеняется на воздухе: SiH4 + 2O2 = SiO2 + 2H2O.
Вода разлагает SiH4, GeH4 и SnH4 по схеме: ЭН4 + 2Н2О → ЭО2 + 4Н2. Метан содержится в природе, водородные соединения Si, Ge, Sn и Pb образуются на ряду с водородом при разложении кислотами соединений или
сплавов этих элементов с магнием: Mg2Si + 4HCl = SiH4 + 2MgCl2.
2.4.4 Кислородсодержащие соединения углерода.
Оксиды. Известны оксиды типа ЭО и ЭО2.
СО (угарный газ) – бесцветный газ, без запаха, мало растворим в воде. Очень ядовит (предельно допустимая концентрация составляет 3 мг/см3), так как прочно связывается с гемоглобином крови (сильнее, чем О2) и препятствует переносу О2 в токе крови.
Диаграмма молекулярных орбиталей молекулы СO:
Из схемы образования молекулярных орбиталей молекулы СО видно, что атомы углерода и кислорода связаны очень прочной тройной связью:
Химические свойства. Монооксид углерода практически не растворим в воде и с ней не реагирует. Однако формально его можно рассматривать как ангидрид муравьиной кислоты, которая легко разлагается в присутствии концентрированной серной кислоты: НСООН = Н2О + СО.

202
Для молекулы СО наиболее характерны восстановительные свойства. Так уже при комнатной температуре СО восстанавливает соединения некоторых благородных металлов, например:
PdCl2 + CO + H2O = Pd + CO2 + 2HCl.
Однако, ввиду прочности связи в молекуле СО, ее восстановительные свойства проявляются обычно при высокой температуре (от 300 до 1500 оС). Оксид углерода как восстановитель широко используется в металлургической промышленности. Например, Fe2O3 + 3CO = 2Fe + 3CO2.
В присутствии катализатора (активированного угля) СО окисляется хлором при комнатной температуре с образованием дихлороксоуглерода
(фосгена): CO + Cl2 = COCl2.
При нагревании СО реагирует с О2 с образованием диоксида углерода (углекислого газа): 2СО + О2 = СО2 + 256,9 кДж.
СО2 (диоксид углерода, углекислый газ) – бесцветный газ, слегка кисловатый на вкус, в 1,5 раза тяжелее воздуха. Образуется при сгорании любых углеродсодержащих веществ в избытке воздуха. При комнатной температуре СО2 под давлением около 6000 кПа переходит в бесцветную жидкость. При ее охлаждении в результате испарения СО2 образуется твердая снегообразная масса (сухой лед).
Строения молекулы СО2.
Орбитали углерода находятся в состоянии sp-гибридизации и поэтому молекула СО2 имеет линейную конфигурацию.
СО2 является составной частью воздуха (составляет ~0,03 % об.), образуется при различных процессах окисления органических веществ, в частности, при дыхании живых организмов, брожении, горении топлива,
горении лесов и т. д, например, С6Н12О6 + 3О2 = 6СО2 + 6Н2О. Диоксид углерода относится к «парниковым газам». Увеличение
количества СО2 в атмосфере может привести к повышению температуры атмосферы. Коротковолновое излучение Солнца нагревает Землю, а тепловое излучение Земли, более длинноволновое, способно поглощаться молекулами СО2. В результате наблюдается повышение температуры атмосферы, а явление в целом называется «парниковым эффектом».
В промышленности СО2 получают обжигом известняка:
СаСО3 = СаО + СО2

203
В лабораториях используют реакцию, проводимую в аппарате Киппа:
CaCO3 + 2HCl = CaCl2 + CO2 + H2O/
СО2 – кислотный оксид, легко реагирует со щелочами и основными оксидами: NaOH + CO2 = NaHCO3.
Молекулы CО2 – неполярны, поэтому плохо растворяются в воде, при 25 оС его растворимость составляет 0,03 моль/л. Процесс растворения можно представить следующим образом: сначала образуется гидрат Н2О×СО2, а затем идет медленное превращение его в молекулу кислоты Н2СО3.
Угольная кислота и ее соли.
Строение молекулы:
Угольная кислота – очень слабый электролит. Равновесия в водном растворе, насыщенным СО2, можно представить схемой:
СО2 + Н2О = Н2О×СО2 = Н2СО3 = Н+ + НСО3- = 2Н+ + СО32-
Равновесия смещены влево, поэтому большая часть растворенного диоксида углерода находится в растворе в виде гидрата СО2×Н2О, а не молекул кислоты Н2СО3, константы диссоциации которой равны:
Кa1 =  = 4.10-7; Кa2 =
= 4.10-7; Кa2 =  = 4,8×10-11.
= 4,8×10-11.
Константа диссоциации Кa1 – кажущаяся, так как представленная в знаменателе [H2CO3] в действительности представляет сумму [H2CO3]+[CO2×H2O]. Однако применение Кa1 в представленной выше форме в практических расчётах не приводит к ошибкам. Молекулы H2CO3 существуют только в растворе и не выделены в виде индивидуального вещества.
Соли угольной кислоты – карбонаты обычно мало растворимы в воде, хорошо растворимы только соли щелочных металлов и аммония.
При нагревании твердые карбонаты сравнительно легко разлагаются:
СаСО3(кр.) = СаО + СО2(г)/
Температуры разложения карбонатов тем выше, чем более электроположителен металл, образующий катион. Так температуры разложения растут в ряду:
MgCO3 (230 oC) < MnCO3 < FeCO3 < CaCO3 < SrCO3 < BaCO3 (1300 oC).
204
Для щелочных металлов и аммония известны кислые соли – гидрокарбонаты МНСО3 (где М – Na+, K+, Rb+, NH4+), которые отличаются лучшей растворимостью.
Большое практическое значение имеют Na2CO3 – сода и NaHCO3 – питьевая сода.
Получить соли угольной кислоты можно пропусканием СО2 через раствор щелочи: CO2 + 2NaOH = Na2CO3 + H2O.
При избытке СО2 карбонаты переходят в гидрокарбонаты:
Na2CO3 + СО2 + H2O = 2NaHCO3.
В водных растворах карбонат - и гидрокарбонат-ионы подвергаются гидролизу:
CO32- + H2O = HCO3- + OH-
HCO3- + H2O = H2CO3 + OH-.
Действие карбоната натрия на растворы, содержащие гидролизующиеся катионы (Be2+, Mg2+, Zn2+, Co2+ и др.), приводит к образованию основных карбонатов, например, (ZnOH)2CO3. В присутствии сильно гидролизующихся катионов (Al3+, Cr3+, Fe3+) протекает реакция взаимного усиления гидролиза с выделением осадков гидроксидов:
2AlCl3 + 3Na2CO3 + 6H2O = 2Al(OH)3 + 3H2CO3 + 6NaCl
Наличием гидрокарбонатов Са(НСО3)2 и Mg(HCO3)2 объясняется жесткость природной воды. При нагревании растворов гидрокарбонатов они разлагаются: Са(НСО3)2 = СаСО3 + СО2 + Н2О
2.4.5 Кислородсодержащие соединения кремния
Оксиды. SiO и SiO2 – твердые, практически нерастворимые в воде вещества с преимущественно атомной структурой.
SiO (оксиид креемния(II), монооксиид кремния) – смолоподобное аморфное вещество, при обычных условиях устойчиво к действию кислорода. Относится к несолеобразующим оксидам. T°пл. = 1702 °C, t°кип. = 1880 °C. При нагревании на воздухе оксид кремния(II) частично окисляется. При 500 °C взаимодействует с водяным паром и СО2, с образованием водорода Н2 и СО.
При 800 °C реагирует с хлором, образуя тетрахлорид кремния SiCl4. Получение. SiO можно получить, нагревая кремний в недостатке
кислорода при температуре выше 400 °C:
2Si + O2 = 2SiO.

205
Также SiO образуется при восстановлении SiO2 кремнием при высоких температурах (например, на поверхности тигеля):
SiO2 + Si= 2SiO.
Применение. Моноксид кремния — материал для изолирующих, защитных, пассивирующих, оптических слоев в полупроводниковых устройствах, волоконной оптике. Слои наносятся напылением в вакууме, реактивным распылением кремния в кислородной плазме.
SiO2 (диоксид кремния, оксид кремния (IV)), обладает полимерным строением:
Т.к. кремний обладает большим сродством к электроотрицательным элементам, чем углерод, то прочность связи Si-Si малая по сравнению с С-С связью. Прочностью Si-O-Si (силоксановая связь) очень прочная.
Физические и химические свойства диоксида кремния
SiO2 – бесцветные кристаллы с t°пл.= 1728 °C, t°кип.= 2590 °C, нелетучи, практически не растворимы в воде, обладающие высокой твёрдостью и прочностью. Из кремнезёма и силикатов состоит 87 % массы литосферы. В крови и плазме человека концентрация кремнезёма составляет 0,001% по массе.
SiO2 – кислотный оксид, не реагирующий с водой.
Химически стоек к действию кислот, но реагирует с газообразным фтороводородом:
плавиковой кислотой:
SiO2 + 6HF → H2[SiF6] + 2H2O
(реакции лежат в основе процесса травления стекла)
При сплавлении взаимодействует с основными оксидами, щелочами, а также с карбонатами щелочных и щелочноземельных металлов с образованием солей – силикатов:
SiO2 + CaO → CaSiO3,
SiO2 + 2NaOH → Na2SiO3 + H2O,

206
SiO2 + CaCO3 → CaSiO3 + CO2,
SiO2 + K2CO3 → K2SiO3 + CO2.
Окислительно — восстановительные реакции. Окислительные свойства не характерны, и проявляются лишь в реакциях с сильными восстановителями: углём, алюминием, магнием, кальцием.
Взаимодействие с металлами. При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний: SiO2 + 2Mg
= Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg = Mg2Si + 2MgO.
Взаимодействие с неметаллами. Реагирует с водородом:
SiO2 + 2Н2 → Si + 2Н2O.
Взаимодействует с углеродом:
|
SiO2 + 3С → SiС + 2СO. |
|
|
Кремниевые кислоты и их соли (таблица 2.4.5). |
|
||
Таблица 2.4.5 – Кремниевые кислоты и их соли |
|
||
Название кислоты |
Формула кислоты |
|
Соли кремниевых |
|
кислот |
||
|
|
|
|
Метакремниевая |
H2SiO3 |
|
метасиликаты |
|
|
|
|
Ортокремниевая |
H4SiO4 |
|
ортосиликаты |
|
|
|
|
Дикремниевые |
H2Si2O5 и H10Si2O9 |
|
дисиликаты |
|
|
|
|
Пирокремниевая |
H6Si2O7 |
|
пиросиликаты |
|
|
|
|
Поликремниевые |
nSiO2 mH2O. |
|
полисиликаты |
|
|
|
|
Кремниевые кислоты получают из растворов калиевых (натриевых) солей кремневых кислот воздействуя на них более сильной кислотой (вплоть до угольной), либо гидролизом сульфита кремния:
K2SiO3 + 2HCl = H2SiO3↓ + 2KCl,
Na2SiO3 + H2O + CO2 = H2SiO3↓+Na2CO3 (качественная реакция на силикаты),
SiS2 + 4H2O = H4SiO4 + 2H2S.
207
При длительном стоянии или при нагревании кремниевые кислоты разлагаются на воду и оксид кремния (ангидрид кремниевой кислоты, более известный, как селикагель):
H2SiO3 = SiO2 + H2O.
Селикагель является великолепным адсорбентом, применяется в качестве очистителя веществ от примесей.
Кремниевые кислоты являются слабыми электролитами, диссоциируя в незначительной степени:
H2SiO3 ↔ HSiO3- + H+
Силикаты – это соли кремниевых кислот. Они твердые тугоплавкие вещества, не имеющие окраски.
Силикаты построены из цепочек, колец, димеров SiO4 (имеющих структуру тетраэдра), которые, в свою очередь, могут образовывать еще более длинные соединения в виде лент или сеток, которые при помощи катионов металлов могут объединяться между собой, образуя самые разнообразные структуры, например, волокнистую (асбест) или слоистую (слюда).
Все силикаты, за исключением силикатов щелочных металлов, являются нерастворимыми в воде соединениями.
В природе чаще встречаются нерастворимые силикаты, входящие в состав таких горных пород, как, например, гранит или базальт. Одними из самых распространенных силикатов являются полевой шпат
(K2O·3Al2O3+6SiO2+2H2O) и слюда (K2O·Al2O3·6SiO2), в состав которых входит оксид алюминия – это алюмосиликаты, входящие в состав каолинита
(глина Al2O3·2SiO2·2H2O).
Из не алюмосиликатов распространены такие природные силикаты, как
асбест (3MgO·4SiO2·H2O) и тальк (3MgO·2SiO2·2H2O).
С течением времени под воздействием природных факторов полевой шпат, присутствующий в гнейсе и граните, превращается в глину и песок:
K2O·Al2O3·6SiO2 + CO2 + 2H2O = Al2O3·2SiO2·2H2O + 4SiO2 + K2CO3
Стекло. Полимерное соединение силиката натрия и силиката кальция называется стеклом – Na2O·CaO·6SiO2. Оно является твердым, прозрачным, химически стойким материалом, который может приобретать новые свойства, если при изготовлении стекла использовать различные добавки:
химическую стойкость и механическую прочность стекла обеспечивает добавка оксида магния MgO;
твердость, химическую и термическую устойчивость дает Al2O3;
оптические свойства улучшают B2O3, TiO2;
замена натрия на калий, а кальция – на свинец дает хрусталь.
208
Особым видом стекла является кварцевое стекло, в состав которого входит чистый кремнезём – такое стекло обладает ценными оптическими свойствами, а также химически и термически устойчиво.
Для стекла характерна высокая хрупкость, однако, изменив режим его затвердевания, было получено стекло с мелкокристаллической однородной структурой, благодаря которой, стекло приобрело прочность чугуна –
ситаллы.
Сырьем для производства стекла являются сода (Na2CO3), известняк (CaCO3), кварцевый песок (SiO2).
На первом этапе производства в печах при высокой температуре (14001500°C) сплавляют компоненты, в результате чего получаются силикаты:
SiO2 + Na2CO3 = Na2SiO3 + CO2↑; SiO2 + CaCO3 = CaSiO3 + CO2↑
На втором этапе полученные силикаты вступают в реакцию с кремнезёмом, в результате чего получается классическое "оконное" стекло:
Na2SiO3+CaSiO3+4SiO2 = Na2O·CaO·6SiO2
Цвет стекла можно изменять добавлением: оксидов кобальта (синее стекло), оксида хрома (зеленое стекло), оксида меди (голубое стекло).
Цемент. Смесь, состоящая из силикатов (оксид кальция, оксид кремния IV, оксиды алюминия и железа III) и алюминатов кальция, носит название цемента.
Цемент – это мелкозернистый порошок серого цвета, который постепенно затвердевает на воздухе при взаимодействии с водой.
Кремний и алюминий, входящие в состав цемента, образуют полимерные цепочки -Si-O-Si- и -Al-O-Al-. В процессе производства цемента тонкоизмельченные компоненты подвергаются обжигу при температуре 1400-1600°C, в результате чего некоторая часть таких полимерных цепочек разрушается с образованием более простых по строению силикатов и алюмосиликатов кальция. Затем, когда цемент соединяют с водой, происходит образование высокомолекулярных полимерных силикатов и алюминатов кальция – по мере высыхания раствор цемента твердеет, превращаясь в камнеобразную массу. Для повышения прочностных свойств цемента в его водный раствор добавляют песком с гравием или щебнем – так получают бетон.
209
2.5 ОБЩИЙ ОБЗОР МЕТАЛЛОВ
ПЛАН
2.5.1Общая характеристика металлов.
2.5.2Значение и роль металлов.
2.5.1 Общая характеристика металлов
Положение в периодической системе. Металлы в ПСХЭ Д.И. Менделеева находятся в левом нижнем углу по диагонали B-At, а далее в побочных подгруппах (более 80%).
Восстановительные свойства в периоде ослабевают, радиус атома уменьшается, т.к. количество электронов на внешнем слое увеличивается. Увеличивается заряд ядра.
Восстановительные свойства в группе усиливаются. Число электронов на внешнем электронном уровне не изменяется. Радиус атома увеличивается, следовательно, металлические свойства усиливаются.
Металлы проявляют только положительные степени окисления. Значения энергии ионизации, сродства к электрону и электроотрицательности низкие.
Особенности строения атомов. У металлов на последнем электронном слое от 1 до 3 электронов, следовательно, степень окисления от +1 до +3 . Могут иметь степень окисления: +4, +5, +6, +7 металлы главных (IV–VI) и побочных подгрупп.
Кристаллические решетки. Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела. Типы кубических решеток металлов (таблица 2.5.1.1): объемно центрированная (ОЦК) и гранецентрированная (ГЦК). Основу ОЦК-решетки составляет элементарная кубическая ячейка, в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы. У ГЦК-решетки элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости

210
между основаниями. Гексагональные решетоки имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки – это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряется в нанометрах (1 нм = 10-9 м = 10 Å). Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
Таблица 2.5.1.1 – Основные типы кристаллических решеток металлов
|
|
|
|
кубическая |
объемно- |
гранецентрированная |
гексагональная |
(1 атом на ячейку) |
центрированная |
кубическая (ГЦК) |
плотноупакованная |
кубическая (ОЦК) |
|
(ГПУ) |
|
|
(4 атома на ячейку) |
||
|
|
|
|
|
(2 атома на ячейку) |
|
(6 атомов на ячейку) |
|
|
|
|
Физические и химические признаки металличности. Поскольку для металлов характерна однотипная (металлическая) связь, то они обладают рядом общих физических свойств, но особенности строения кристаллических решеток обуславливает некоторые различия в свойствах металлов.
Общие физические свойства металлов
1)Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2)Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3)Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4)Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
