
- •1.Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2.Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4.Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5.Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8.Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10.Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа)
- •11.Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13.Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14.Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15.Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •17.Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18.Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20.Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •22.Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23.Номенклатура, классификация, изомерия диеновых углеводородов.
- •25.Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26.Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27.Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28.Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова)
- •29.Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30.Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами:
- •60. Реакции енольных форм карбонильных соединений: a-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных a-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
75. Классификация аминокислот. Основные представители природных a-аминокислот, их стереохимия.
Существуют три типа классификации:
I. ФИЗИКО-ХИМИЧЕСКАЯ – основана на различиях в физико-химических свойствах аминокислот.
1) Гидрофобные аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы, где равномерно распределена электронная плотность и нет никаких зарядов и полюсов. В их составе могут присутствовать и электроотрицательные элементы, но все они находятся в углеводородном окружении. 2) Гидрофильные незаряженные (полярные) аминокислоты. Радикалы таких аминокислот содержат в своем составе полярные группировки. Эти группы взаимодействуют с дипольными молекулами воды, которые ориентируются вокруг них.
3) Отрицательно заряженные аминокислоты. Сюда относятся аспарагиновая и глутаминовая кислоты. Имеют дополнительную СООН-группу в радикале - в нейтральной среде приобретают отрицательный заряд.
4) Положительно заряженные аминокислоты: аргинин, лизин и гистидин. Имеют дополнительную NH2-группу в радикале - в нейтральной среде приобретают положительный заряд.
II. Биологическая классификация.
а) Незаменимые аминокислоты. Они не могут синтезироваться в организме человека и должны обязательно поступать с пищей. Их 8 и еще 2 аминокислоты относятся к частично незаменимым (метионин, треонин, лизин, лейцин, изолейцин, валин, триптофан, фенилаланин). Частично незаменимые: аргинин, гистидин.
б) Заменимые. Их 10: глутаминовая кислота, глутамин, пролин, аланин, аспарагиновая кислота, аспарагин, тирозин, цистеин, серин и глицин.
III. Химическая классификация - в соответствии с химической структурой радикала аминокислоты (алифатические, ароматические).
76. Свойства аминокислот: амфотерность, изоэлектрическая точка.
Реакции по карбоксильной и аминогруппе. Отношение к нагреванию.
Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т.е. являются амфотерными соединениями. Подобно аминам, они реагируют с кислотами с образованием солей аммония: H2N–CH2–COOH + HCl = Cl- [H3N–CH2–COOH]+
Как карбоновые кислоты они образуют функциональные производные:
а) соли H2N–CH2–COOH + NaOH = H2N–CH2–COO- Na+ + H2O
б)
сложные эфиры
![]()
Кроме того, возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция), так и принадлежащих разным молекулам (межмолекулярная реакция).
Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда.
Превращения аминокислот при нагревании зависят от взаимного расположения карбоксильной и аминогруппы и определяются возможностью образования термодинамически стабильных 5-ти- 6-тичленных циклов
a -Аминокислоты вступают в реакцию межмолекулярного самоацилирования. При этом образуются циклические амиды – дикетопиперазины.
b -Аминокислоты при нагревании переходят a ,b -непредельные кислоты.
77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
-аминокислоты вследствие взаимодействия амино- и карбоксильных групп способны к поликонденсации. образующиеся полиамиды называют пептидами:
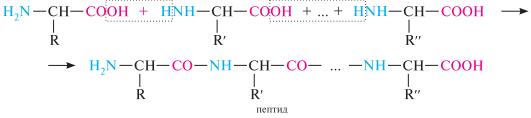
Группу —C(O)—NH— между двумя -аминокислотными фрагментами называют пептидной группой. связь с—N, посредством которой остатки -аминокислот соединены в пептидах и белках, называют пептидной связью. атом углерода пептидной группы (рис. 35.1) находится в sp2-гибридизованном состоянии. неподеленная пара электронов атома азота вступает в сопряжение с -электронами карбонильной группы, в результате чего двойная связь C=O несколько удлиняется (124 нм вместо 121 нм обычной связи), а связь C—N несколько укорачивается (0,132 нм вместо 0,146 нм) и, следовательно, приобретает в значительной мере характер двойной связи, вращение вокруг которой затруднено. таким образом, электронное строение обусловливает жесткую плоскостную структуру пептидной группы.
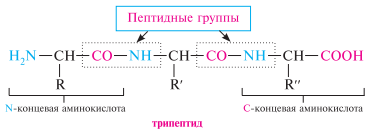
Определенную последовательность -аминокислот, входящих в данную полипептидную цепь, называют первичной структурой пептида или белка
Вторичной структурой белка называют пространственное расположение (пространственную укладку) атомов основной полипептидной цепи.
Полипептидная цепь, имеющая тот или иной тип вторичной структуры, способна определенным образом скручиваться в пространстве, что и определяет третичную структуру белка, то есть общую форму полипептидной цепи.
Четвертичная структура белка относится к макромолекулам, в состав которых входят несколько полипептидных цепей (субъединиц), связанных между собой нековалентными связями
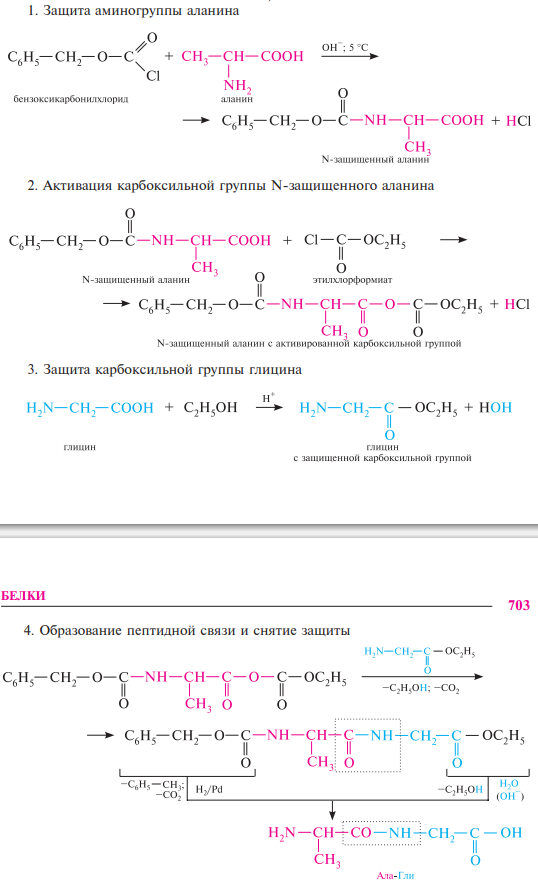
в зависимости от структуры белки делят на простые (протеины) и сложные (протеиды). Последние, кроме белка, содержат в своей структуре химически связанную с ним простетическую группу — небелковую часть молекулы. По природе простетической группы протеиды делят на липопротеиды, нуклеопротеиды, гликопротеиды, хромопротеиды, фосфопротеиды и металлопротеиды.
в зависимости от пространственной формы молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют сферическую или эллипсоидную форму, фибриллярные — состоят из вытянутых нитевидных макромолекул, называемых протеноидами
Под влиянием многих факторов (повышенная температура, изменение рн среды, уф- и -излучение и др.) происходит разрушение пространственной формы белков при сохранении первичной структуры. Этот процесс называется денатурацией белка. денатурация является, как правило, необратимым процессом и приводит к потере биологических функций белков. Примером тепловой денатурации является «свертывание» яичных белков при варке яиц. При денатурации происходит разрыв водородных связей, стабилизирующих пространственную форму белка. денатурированный белок теряет растворимость, в результате чего первоначальная пространственная форма его не может быть восстановлена. денатурация может быть также вызвана образованием нерастворимых солей белков. Это происходит при отравлении солями тяжелых металлов (ртути, свинца и др.). в качестве противоядия в таких случаях применяют белки с повышенным содержанием кислотных групп, например, яичный альбумин. выступая в качестве конкурента, эти белки связывают металлы с образованием нерастворимых солей, которые выводятся из организма.
78. Классификация и номенклатура гетероциклов. Пятичленные гетероциклы с одним или несколькими гетероатомами: фуран, тиофен, пиррол, индол, их строение (участие неподеленной электронной пары в создании ароматической системы). Особенности протекания реакций электрофильного замещения в этих гетероциклах.
Гетероциклическими называют соединения циклического строения, содержащие в цикле не только атомы углерода, но и атомы других элементов.Гетероциклические соединения – самая распространенная группа органических соединений. Они входят в состав многих веществ природного происхождения, таких как нуклеиновые кислоты, хлорофилл, гем крови, алкалоиды, пенициллины, многие витамины. Гетероциклические соединения играют важную роль в процессах метаболизма, обладают высокой биологической активностью.
Для классификации гетероциклических соединений используют следующие признаки.
1)по размеру цикла: трех-, четырех-, пяти-, шести- и семичленными.
2)по типу элемента, входящего в состав цикла: атомамы азота, кислорода или серы.
3)по числу гетероатомов, входящих в цикл, наиболее распространены гетероциклы с одним и двумя гетероатомами.
4)по природе и взаимному расположению гетероатомы могут занимать различные положения относительно друг друга.
5)по степени насыщенности: ароматическими, ненасыщенными и насыщенными.
6)по числу циклов различают моноциклические, полициклические.
Главную сложность в номенклатуре гетероциклических соединений представляет огромное разнообразие гетероциклических структурных типов.
В систематической номенклатуре моноциклических соединений, содержащих один или несколько гетероатомов в цикле название гетероцикла образуют путем сочетания соответствующего префикса: окса- для атома кислорода, тиа- для атома серы, аза- для атома азота – с корнями, отражающими размер цикла (число атомов в цикле) и степень его насыщенности. Для удобства произношения буква «а» в префиксах опускается, так как корень начинается обычно с гласной буквы.
Пятичленные гетероциклы с двумя гетероатомами, один из которых азот, имеют общее название азолы. Важнейшими из них являются имидазол, пиразол и тиазол. Эти соединения, в отличие от пятичленных гетероциклов с одним гетероатомом, не разрушаются при действии кислот, а образуют с ними соли. Важнейшим представителем пятичленных гетероциклов с одним гетероатомом является пиррол.
Фуран — органическое соединение с формулой C4H4O. Пятичленный гетероцикл с одним атомом кислорода. Представляет собой бесцветную жидкость с характерным запахом, напоминающим хлороформ. Фуран является ароматическим соединением с шестью p-электронами. Тиофе́н — ароматический пятичленный гетероцикл, содержащий один атом серы в цикле. Тиофен представляет собой бесцветную жидкость с запахом бензола. Тиофен хорошо растворяется в углеводородах и в других органических растворителях. В воде нерастворим. Молекула тиофена является плоской.
Пиррольное кольцо входит в структуру многих важных природных соединений, таких как гемин, хлорофил и др. Пиррол представляет собой бесцветную темнеющую на воздухе жидкость с т. кип. 131оС. Характерной для соединений ряда пиррола является их способность окрашивать в красный цвет смоченную в соляной кислоте сосновую лучину.
Индо́л — гетероциклическое конденсированное ароматическое соединение. Бесцветные кристаллы с запахом, напоминающим запах капусты. Индольное ядро входит во множество биохимических природных соединений. Как индивидуальное вещество содержится в каменноугольной смоле и в некоторых эфирных маслах, например, в масле жасмина.
