
- •1.Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2.Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4.Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5.Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8.Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10.Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа)
- •11.Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13.Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14.Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15.Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •17.Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18.Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20.Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •22.Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23.Номенклатура, классификация, изомерия диеновых углеводородов.
- •25.Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26.Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27.Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28.Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова)
- •29.Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30.Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами:
- •60. Реакции енольных форм карбонильных соединений: a-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных a-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
Акриловая кислота H2C=CH—COOH. Бесцветная жидкость с резким запахом (т. пл. 13 °с, т. кип. 141 °с), хорошо растворяется в воде. акриловая кислота легко полимеризуется с образованием полиакриловой кислоты. важное практическое значение имеют полимеры на основе сложных эфиров акриловой кислоты (полиакрилаты):

в медицине полиакрилаты находят применение при изготовлении зубных протезов.
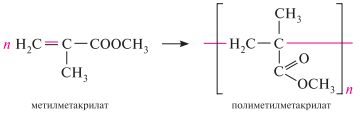
Метакриловая кислота (2-метилпропеновая кислота). Бесцветная жидкость (т. кип. 160,5 °с). Метакриловая кислота легко полимеризуется. важное значение имеет метиловый эфир метакриловой кислоты, полимеризацией которого получают полиметилметакрилат — органическое стекло (плексиглас):
![]()
68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
Щавелевая кислота HOOC—COOH. Белое кристаллическое вещество (т. пл. 189 °с), легко растворяется в воде и спиртах. Содержится в виде солей во многих растениях (щавель, ревень и др.). Соли и сложные эфиры щавелевой кислоты называют оксалатами. кристаллы кальция оксалата трудно растворимы в воде и могут откладываться при патологических состояниях в почках в виде камней (почечно-каменная болезнь). в промышленности щавелевую кислоту получают из натрия формиата:

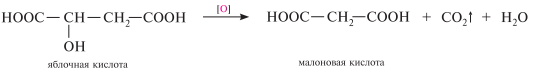
Малоновая кислота HOOC—CH2—COOH. Белое кристаллическое вещество (т. пл. 135 °с), растворимое в воде, этаноле, эфире. Содержится в соке сахарной свеклы. впервые была получена при окислительном декарбоксилировании яблочной кислоты:
Адипиновая кислота HOOC(CH2)4COOH. белое кристаллическое вещество (т. пл. 152 °с), малорастворимое в воде. Соли и сложные эфиры адипиновой кислоты называют адипинатами. Применяется главным образом в производстве синтетического волокна — найлона. входит в состав противоглистного средства — пиперазина адипината. используется также в пищевой промышленности и органическом синтезе.
69. Классификация углеводов. Биологическая роль и распространенность углеводов.
Углеводы - обширный класс органических соединений. В клетках живых организмов углеводы являются источниками и аккумуляторами энергии, в растениях и некоторых животных выполняют роль опорного материала, входят в состав многих важнейших природных соединений, выступают в качестве регуляторов ряда важнейших биохимических реакций. В соединении с белками и липидами углеводы образуют сложные высокомолекулярные комплексы, представляющие основу субклеточных структур, и следовательно, основу живой материи. Они входят в состав природных биополимеров - нуклеиновых кислот, участвующих в передаче наследственной информации. В соответствии с традиционной классификацией углеводы подразделяются на 3 класса: моносахариды, олигосахариды и полисахариды.
Моносахариды: Углеводы с приятным вкусом, которые не способны расщепляться на более простые виды. Этот вид углеводов включает группу многоатомных спиртов с карбонильной группой (альдоза или кетоза). Преимущественно находятся в составе растений и животных. Простые сахара представляют собой порошковые вещества, хорошо впитывающие воду, но плохо растворимые в спирте. Известные представители этого класса: глюкоза и фруктоза.
Олигосахариды: Низкомолекулярные углеводы, которые содержат от 2 до 10 остатков моносахаридов, соединенных гликозидными связями. Поэтому по количеству простых сахаров они могут быть дисахаридами, трисахаридами, тетрасахаридами, пентасахаридами и т.д. Наряду с полисахаридами, являются наиболее концентрированным источником калорий в кслассификации углеводов. Олигосахариды растительной природы более разнообразны по составу, чем представители животного происхождения. Классификация углеводов выделяет среди дисахаридов лактозу, мальтозауи сахарозу.
Полисахариды: Высокомолекулярные (несахароподобные) соединения из большого количества моносахаридов и гликозидных связей между ними. Данные углеводы различаются не только составом простых сахаров, но и молекулярной массой и структурными особенностями (линейные или разветвленные). Поэтому и обладают отличительными свойствами друг от друга. Классификация углеводов выделяет гомополисахариды и гетерополисахариды.
В живых организмах углеводы выполняют следующие функции:
Структурная и опорная функции. Углеводы участвуют в построении различных опорных структур. Так целлюлоза является основным структурным компонентом клеточных стенок растений, хитин выполняет аналогичную функцию у грибов, а также обеспечивает жёсткость экзоскелета членистоногих.
Защитная роль у растений. У некоторых растений есть защитные образования (шипы, колючки и др.), состоящие из клеточных стенок мёртвых клеток.
Пластическая функция. Углеводы входят в состав сложных молекул (например, пентозы), участвуют в построении (АТФ, ДНК и РНК).
Энергетическая функция. Углеводы служат источником энергии: при окислении 1 грамма углеводов выделяются 4,1 ккал энергии и 0,4 г воды.
Запасающая функция. Углеводы выступают в качестве запасных питательных веществ: гликоген у животных, крахмал и инулин — у растений.
Осмотическая функция. Углеводы участвуют в регуляции осмотического давления в организме. Так, в крови содержится 100—110 мг/% глюкозы, от концентрации глюкозы зависит осмотическое давление крови.
Рецепторная функция. Олигосахариды входят в состав воспринимающей части многих клеточных рецепторов или молекул-лигандов.
70. Моносахариды (рибоза, дезоксирибоза, глюкоза, фруктоза). Стереохимия моносахаридов, D- и L-ряды. Кольчато-цепная таутомерия. Пиранозные и фуранозные формы. a- и b-аномеры. Мутаротация. Эпимеризация.
Моносахариды (монозы) — полигидроксильные соединения, содержащие альдегидную или кетонную группы.
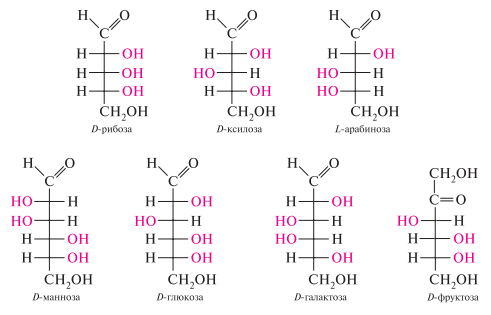
Изомеры моносахаридов подразделяют на D- и L-стереохимические ряды, принадлежность к которым определяется по конфигурации асимметрического атома углерода, максимально удаленного от карбонильной группы (для пентоз — с-4, для гексоз — с-5). если конфигурация этого хирального атома углерода совпадает с конфигурацией D-глицеринового альдегида, то моносахарид относят к D-ряду, если же с конфигурацией L-глицеринового альдегида — то к L-ряду:

Большинство природных моносахаридов относится к D-ряду. Важнейшие представители природных моносахаридов:
внутримолекулярное образование полуацеталя приводит к тому, что углеродный атом карбонильной группы превращается в асимметрический. Этот новый хиральный центр называется аномерным, а соответствующие ему два новых стереоизомера — - и -аномерами. образовавшаяся в процессе циклизации моносахарида гидроксильная группа при аномерном центре называется полуацетальной или гликозидной
Аномеры — диастереомеры, отличающиеся конфигурацией аномерного атома углерода.
При взаимодействии оксогруппы с гидроксильной группой при с-5 альдогексоз или с-6 кетогексоз образуется пиранозный шестичленный цикл (от названия шестичленного гетероцикла пиран + окончание -оза).
При взаимодействии оксогруппы с гидроксильной группой при с-4 альдогексоз или с-5 кетогексоз образуется фуранозный пятичленный цикл (от названия пятичленного гетероцикла фуран + окончание -оза).
Таутомерия. Моносахариды являются таутомерными веществами. в кристаллическом состоянии они имеют циклическое строение. так, D-глюкоза, полученная дробной кристаллизацией из этилового спирта или воды, находится в форме -D-глюкопиранозы. в водном растворе циклическая форма под влиянием растворителя превращается через открытую оксоформу в другие циклические формы — пиранозные и фуранозные с - и -конфигурацией аномерного центра. таким образом, в водном растворе моносахариды существуют в виде пяти таутомерных форм — открытой, - и -пиранозных и - и -фуранозных.
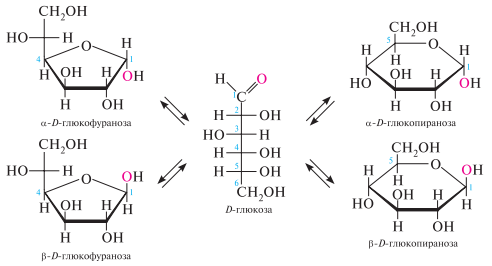
такой вид таутомерии называется кольчато-цепной, или цикло-оксо-таутомерией.
Мутаротация — самопроизвольное изменение величины оптического вращения свежеприготовленных растворов оптически активных соединений
71. Гликозиды. Особые свойства гликозидного гидроксила. Реакции окисления и восстановления глюкозы. Глюконовая, глюкаровая и глюкуроновая кислоты. Глюцит (сорбит), ксилит. Реакции алкилирования и ацилирования моносахаридов. Аскорбиновая кислота (витамин С).
Окисление в кислой и нейтральной среде. При использовании слабых окислителей (бромной воды или разбавленной азотной кислоты) альдозы окисляются с образованием одноосновных полиоксикислот, получивших общее название «альдоновые кислоты». D-Глюкоза в этих условиях дает D-глюконовую кислоту, D-галактоза — D-галактоновую кислоту и т. д.
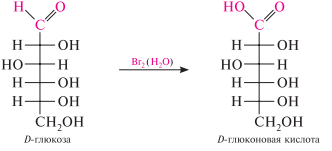
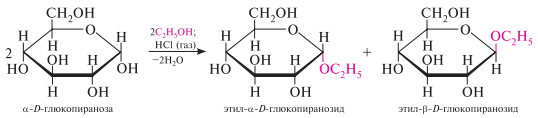
Образование гликозидов. Моносахариды, являясь циклическими полуацеталями, реагируют в присутствии кислотного катализатора со спиртами и фенолами. реакция протекает с участием полуацетальной гидроксильной группы и приводит к образованию циклических ацеталей, получивших название «гликозиды». независимо от исходной формы моносахарида в процессе реакции образуется смесь - и -гликозидов.
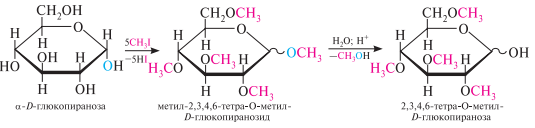
Алкилирование (образование простых эфиров). При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу. При использовании более сильных алкилирующих средств (йодистый метил или диметилсульфат), подобное превращение затрагивает все гидроксильные группы моносахарида.
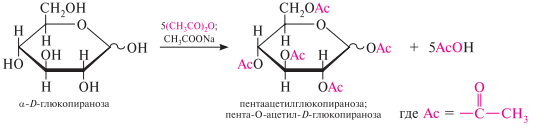
Ацилирование (образование сложных эфиров). При действии на глюкозу уксусного ангидрида образуется сложный эфир – пентаацетилглюкоза.
Аскорби́новая кислота — органическое соединение с формулой C6H8O6, является одним из основных веществ в человеческом рационе, которое необходимо для нормального функционирования соединительной и костной ткани. Выполняет биологические функции восстановителя и кофермента некоторых метаболических процессов, является антиоксидантом. Биологически активен только один из изомеров — L-аскорбиновая кислота, который называют витамином C. В природе аскорбиновая кислота содержится во многих фруктах и овощах. Авитаминоз аскорбиновой кислоты приводит к цинге. По физическим свойствам аскорбиновая кислота представляет собой белый кристаллический порошок кислого вкуса. Легко растворим в воде, растворим в спирте. Температура плавления L-аскорбиновой кислоты — 190—192 °C(с разложением).
Из-за наличия двух асимметрических атомов существуют четыре диастереомера аскорбиновой кислоты. Две условно именуемые L- и D- формы хиральны относительно атома углерода в фурановом кольце, а изо- форма является D-изомером по атому углерода в боковой этиловой цепи.
