
- •1.Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2.Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4.Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5.Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8.Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10.Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа)
- •11.Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13.Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14.Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15.Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •17.Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18.Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20.Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •22.Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23.Номенклатура, классификация, изомерия диеновых углеводородов.
- •25.Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26.Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27.Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28.Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова)
- •29.Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30.Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами:
- •60. Реакции енольных форм карбонильных соединений: a-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных a-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
Тиолами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены меркаптогруппой —SH.
Взаимодействие галогеналканов с гидросульфидами щелочных металлов. При действии на первичные и вторичные галогеналканы калия или натрия гидросульфида образуются тиоспирты. реакция протекает по механизму SN
![]()
Взаимодействие спиртов с сероводородом. При обработке спиртов сероводородом в присутствии катализатора Al2O3 при температуре 350—400 °с образуются тиоспирты:
![]()
Образование тиолятов (меркаптидов). тиолы, как более сильные кислоты, чем аналогичные OH-кислоты, легко образуют соли — тиоляты (меркаптиды) не только со щелочными металлами, но также и с ионами тяжелых металлов:
![]()
Взаимодействие тиолов с алкенами. в присутствии пероксидов или под действием уф-излучения тиолы присоединяются к алкенам по месту разрыва двойной связи с ориентацией против правила Марковникова. реакция протекает по механизму AR:
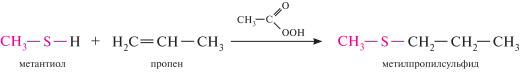
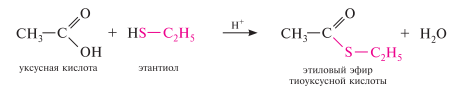
Ацилирование тиолов. реакция тиолов с карбоновыми кислотами катализируется сильными кислотами и приводит к образованию тиоэфиров карбоновых кислот:
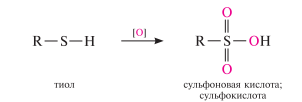
Окисление тиолов. в отличие от спиртов, тиолы окисляются не по атому углерода, а по атому серы. Продукты реакции зависят от условий окисления. При окислении тиолов в мягких условиях (H2O2, CuCl2 и др.) образуются диалкилдисульфиды:
При фотолизе тиолов образуются соответствующие дисульфиды. При фотолизе тиолов в смеси с дисульфидами получаются смешанные дисульфиды:
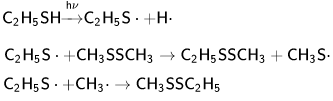
Действие мягких окислителей (иод, пероксид водорода, трихлорид железа и др.) на тиолы приводит к дисульфидам:
![]()
Тиолы окисляются в дисульфиды также при окислении кислородом воздуха в присутствии ионов металлов переменной валентности в качестве катализаторов, действии УФ-излучения и радикальных инициаторов:
![]()
Органические дисульфиды применяются в органическом синтезе, для получения красителей, лекарственных средств и пестицидов. Некоторые дисульфиды используются для ускорения вулканизации каучуков, как регуляторы радикальной полимеризации.
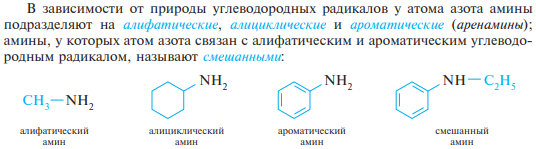
54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
Аминами называют производные аммиака, в молекуле которого один, два или три атома водорода замещены углеводородными радикалами.
Соответственно числу углеводородных остатков различают первичные, вторичные и третичные амины.
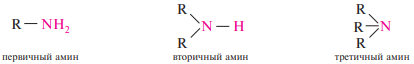
По заместительной номенклатуре IUPAC названия первичных аминов образуют путем добавления к названию углеводорода суффикса -амин, указывая положение аминогруппы в углеродной цепи. При составлении названий вторичных и третичных аминов их рассматривают как производные первичного амина с заместителями при атоме азота. За исходный первичный амин в этом случае принимается связанный с атомом азота наиболее сложный по структуре радикал. Остальные углеводородные заместители при атоме азота перечисляют в алфавитном порядке с указанием локанта N-:

Простейшие амины чаще всего называют по радикало-функциональной номенклатуре. Согласно этой номенклатуре, названия аминов образуют из названий углеводородных радикалов, перечисляемых в алфавитном порядке, и суффикса -амин:
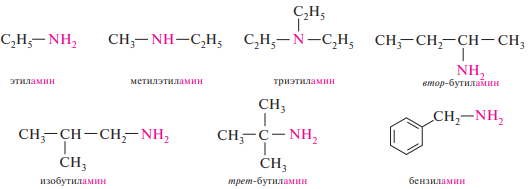
Изомерия аминов обусловлена разной структурой углеводородных радикалов, разным положением аминогруппы и метамерией. Сущность метамерии состоит в том, что амины с одной и той же брутто-формулой могут быть первичными, вторичными и третичными. Приведенные соединения являются метамерами
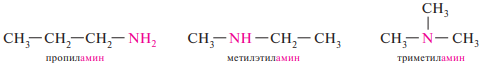
55. Электронное строение аминов. Роль неподеленной электронной пары азота в проявлении основных и нуклеофильных свойств алкил- и ариламинов. Реакции ацилирования и алкилирования аминов. Аммониевые соли.
Температуры кипения третичных аминов значительно ниже, чем первичных и вторичных с тем же числом атомов углерода. Это связано со способностью первичных и вторичных аминов образовывать, подобно спиртам, водородные связи:
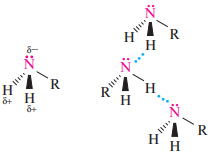
Атом азота в аминах находится в sp3-гибридизации, а неподеленная пара электронов занимает sp3-гибридную орбиталь
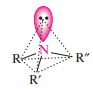
Реакционная способность алкиламинов определяется главным образом наличием у атома азота неподеленной пары электронов. За счет пары электронов атома азота амины, с одной стороны, способны присоединять протон от кислоты, проявляя при этом осно вные свойства, а с другой — могут атаковать в молекуле реагента электрофильный центр (чаще атом углерода, несущий частичный или полный положительный заряд) и образовывать химическую связь с ним, проявляя нуклеофильные свойства.
«Реакция алкилирования». При взаимодействии с галогеналканами первичные амины превращаются во вторичные, вторичные — в третичные, а третичные — образуют четвертичные аммониевые соли:
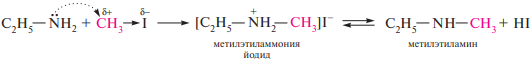

Ацилирование. Первичные и вторичные алкиламины вступают в реакцию с функциональными производными карбоновых кислот — галогенангидридами, ангидридами или сложными эфирами, образуя соответствующие амиды
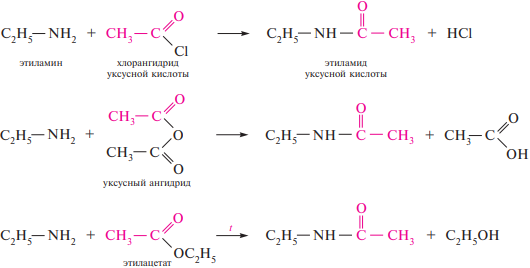
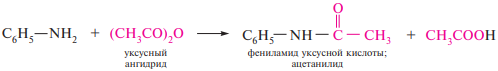
56. Особенности свойств ариламинов. Реакции электрофильного замещения в бензольном ядре ариламинов и их производных. Реакции диазотирования, соли арилдиазония. Реакции солей арилдиазония с выделением азота (замещение диазогруппы) и без выделения азота (азосочетание). Азокрасители.
Ариламинами называют производные аммиака, в молекуле которого один, два или три атома водорода замещены остатками ароматических углеводородов.
В обычных условиях ариламины представляют собой бесцветные высококипящие жидкости или твердые кристаллические вещества со слабым неприятным запахом. Они малорастворимы в воде, сильно токсичны, окисляются кислородом воздуха, из-за чего при хранении приобретают желтоватую окраску.
Для ариламинов характерны реакции с участием аминогруппы и реакции с участием атомов углерода ароматического ядра.
Галогенирование. Анилин легко реагирует с галогенами (Cl2, Br2) в отсутствие катализатора, образуя 2,4,6-тригалогенопроизводные ариламины. Так, при обработке анилина бромной водой практически с количественным выходом образуется осадок 2,4,6-триброманилина:
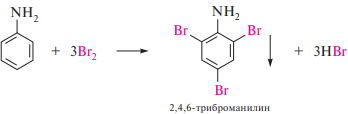
Нитрование. Нитрование ариламинов в отличие от аренов имеет ряд особенностей. Прямое нитрование ароматических аминов концентрированной азотной кислотой осуществить невозможно, так как они легко окисляются. При использовании в качестве нитрующего реагента нитрующей смеси ариламины, наряду с частично протекающими окислительными процессами, превращаются в ариламмонийные соли. Аммонийная группа, являясь электроноакцепторным заместителем, затрудняет нитрование и способствует образованию преимущественно мета-изомера:
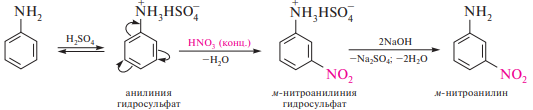
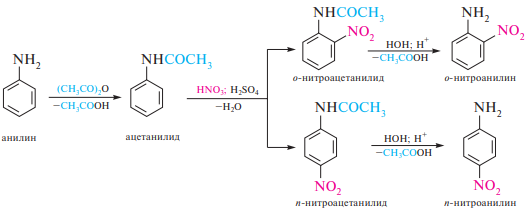
Сульфирование. При нагревании анилина с концентрированной серной кислотой в среде высококипящего растворителя образуется п-аминобензолсульфокислота, которую чаще называют сульфаниловой кислотой. Реакция протекает через стадию образования N-фенилсульфаминовой кислоты, которая перегруппировывается в п-аминобензолсульфокислоту:

Взаимодействие с азотистой кислотой. Первичные, вторичные и третичные ароматические амины при взаимодействии с азотистой кислотой образуют разные продукты. При действии азотистой кислоты на первичные ароматические амины в присутствии сильной минеральной кислоты образуются соли диазония. Эта реакция получила название «реакции диазотирования».
![]()
