
- •1.Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2.Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4.Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5.Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8.Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10.Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа)
- •11.Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13.Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14.Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15.Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •17.Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18.Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20.Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •22.Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23.Номенклатура, классификация, изомерия диеновых углеводородов.
- •25.Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26.Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27.Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28.Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова)
- •29.Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30.Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами:
- •60. Реакции енольных форм карбонильных соединений: a-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных a-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
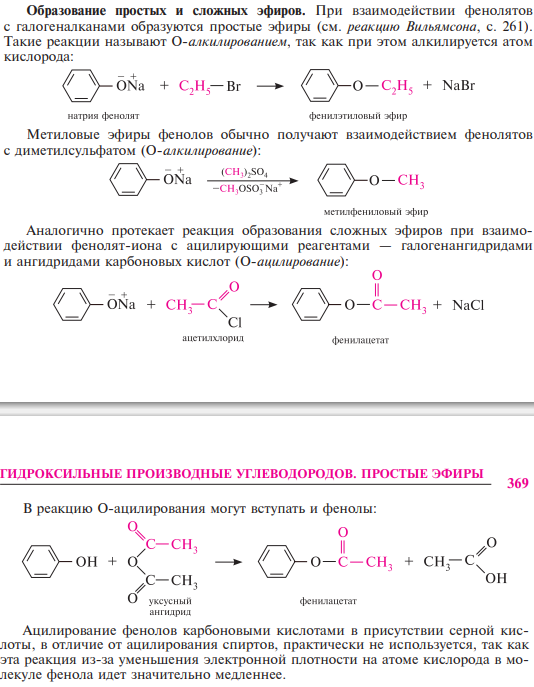
Галогенирование. обычно для введения атома галогена в бензольное кольцо требуются катализаторы — кислоты льюиса. реакция галогенирования фенолов, учитывая их высокую реакционную способность, протекает очень легко в отсутствие катализатора. они обесцвечивают бромную воду, причем происходит замещение всех атомов водорода в о- и п-положениях:
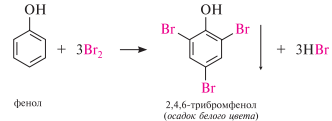
Нитрование. реакция нитрования фенола происходит при комнатной температуре уже при обработке разбавленной азотной кислотой, тогда как для нитрования бензола используют нитрующую смесь. При этом образуется смесь о- и п-нитрофенолов:
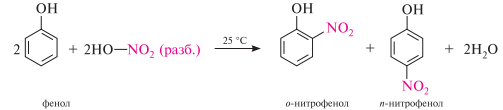
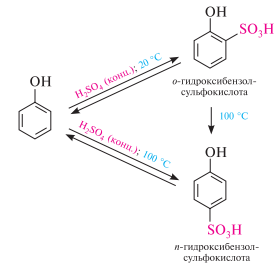
Сульфирование. сульфирование фенола проходит очень легко и в зависимости от температурного режима приводит к образованию орто- или пара-изомеров:
Алкилирование фенолов можно проводить по реакции фриделя—крафтса (с-алкилирование). однако выходы в этой реакции, как правило, невысокие. наиболее часто для алкилирования используют спирты и алкены в присутствии кислот (H2SO4, H3PO4 или BF3):

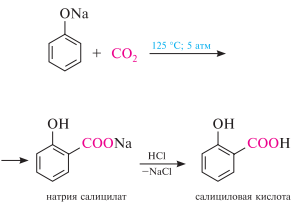
49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
Карбоксилирование (синтез фенолокарбоновых кислот). При нагревании натрия фенолята в токе углерода (IV) оксида образуется натрия салицилат (реакция кольбе— Шмитта, 1860 г.), который под действием минеральных кислот превращается в салициловую кислоту. углерода (IV) оксид со2 — очень слабый электрофил, поэтому реакцию проводят с натрия фенолятом, как более активным субстратом.
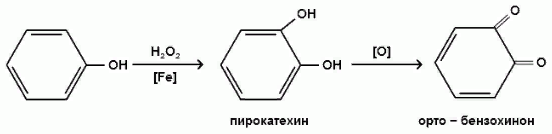
Повышенная электронная плотность в ядре фенола делает его чувствительным к воздействию окислителей.
В зависимости от природы окислителя и условий проведения реакции образуются различные продукты окисления фенола.
1) При окислении фенола пероксидом водорода в присутствии железного катализатора получается орто-бензохинон через промежуточное образование пирокатехина:
2) Сильные окислители, такие как хромовая смесь (K2Cr2O7 + H2SO4), броматы (KBrO3, H2SO4) окисляют фенол до пара-бензохинона через промежуточное образование гидрохинона:
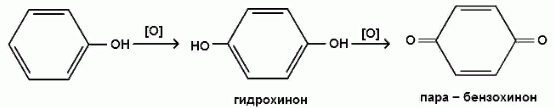
3) При более энергичном действии окислителей происходит разрушение бензольного ядра.
Благодаря склонности к окислению фенолы могут окрашиваться при хранении на воздухе.
50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
Это класс соединений, тесно связанный с фенолами, так как они легко образуются окислением фенолов (особенно двух- и трех-атомных) и, в свою очередь, легко восстанавливаются до фенолов. Классифицируются хиноны по двум структурным признакам: по ароматическому углеводороду, к которому они привязаны углеродным скелетом (бензохиноны, нафтохиноны, антрахиноны) и по взаимному положению карбонильных групп в молекуле (орто-бензохиноны, пара-бензохиноны).
Хиноны являются структурной основой пигментов. Важнейший краситель — ализарин (1,2-диоксиантрахинон). Ализариновые красители светоустойчивы, применяются в лакокрасочной промышленности, полиграфии. Но из-за большой стоимости используются реже, чем азокрасители. Окислительные свойства хинонов проявляются в биохимических реакциях. Убихиноны (коферменты Q) распространены в животном и растительном мире, участвуют в переносе электронов и протонов в дыхательной цепи. Хинон содержат четыре сопряженные хромофорные группы и могут рассматриваться как особый случай ненасыщенных кетонов. Некоторые грибы выделяют пигменты, являющиеся производными хинона, и некоторые из них можно найти в древесине, пораженной грибом. Хиноны же не только уничтожают возбудителей болезней в семенах, но и предохраняют от заражения вырастающие из этих семян молодые побеги, находящиеся в почве. Хиноны считаются очень эффективными для борьбы с возбудителями болезней, вызывающими выпревание.
Соединения группы витамина E представляют собой светло-желтые вязкие жидкости. Не растворимы в воде, хорошо растворимы в хлороформе, эфирах, гексане, хуже — в ацетоне и этаноле.
Растворы интенсивно флуоресцируют (максимум поглощения 295 нм, максимум излучения — 320—340 нм).
Устойчивы к действию минеральных кислот и щелочей. При взаимодействии с O2 и другими окислителями превращаются в хиноны.
Сложные эфиры этих веществ значительно более устойчивы к окислению. Разлагаются при действии ультрафиолетового излучения. В атмосфере инертного газа стабильны при нагревании до 100 °C[5].
Важнейшие биологически активные соединения, относящиеся к группе витамина E: токоферолы и токотриенолы.
Флавоноиды — крупнейший класс растительных полифенолов. С химической точки зрения, флавоноиды представляют собой гидроксипроизводные флавона (собственно флавоноиды), 2,3-дигидрофлавона (флаваноны) изофлавона (изофлавоноиды), 4-фенилкумарина (неофлавоноиды), а также флавоны с восстановленной карбонильной группой (флаванолы). Зачастую к флавоноидам относят и другие соединения С6-С3-С6 ряда, в которых имеются два бензольных ядра, соединенных друг с другом трёхуглеродным фрагментом — халконы, дигидрохалконы и ауроны
