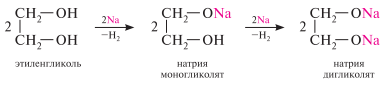- •1.Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2.Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4.Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5.Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8.Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10.Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа)
- •11.Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13.Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14.Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15.Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •17.Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18.Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20.Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •22.Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23.Номенклатура, классификация, изомерия диеновых углеводородов.
- •25.Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26.Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27.Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28.Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова)
- •29.Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30.Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами:
- •60. Реакции енольных форм карбонильных соединений: a-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных a-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
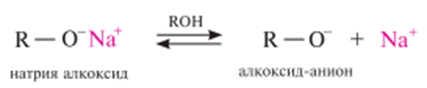
Кислотно-основные свойства. Спирты проявляют слабые кислотные и слабые основные свойства, то есть они являются амфотерными веществами. их кислотные свойства обусловлены подвижностью атома водорода гидроксильной группы.
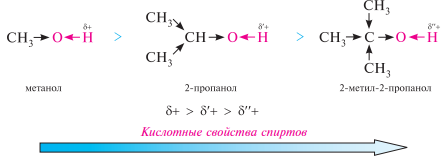
Полярность связи о–н в спиртах определяет её склонность к гетеролитическому разрыву. спирты как кислоты реагируют со щелочными металлами, образуя алкоголяты (алкоксиды):
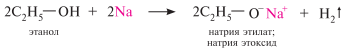
из-за низкой кислотности спирты почти не вступают в реакцию со щелочами.
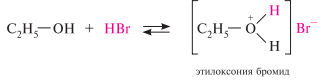
Основные свойства спиртов обусловлены наличием на атоме кислорода гидроксильной группы неподеленной пары электронов, способной присоединять протон. так, с сильными кислотами первичные спирты образуют на холоде неустойчивые соли алкилоксония:
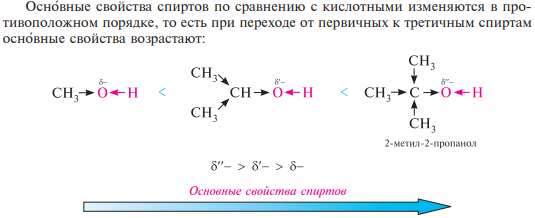
Алкоголяты широко используются в органическом синтезе в качестве сильных оснований и сильных нуклеофильных реагентов. алкоголяты легко разлагаются под действием воды до исходных спиртов, что подтверждает более низкую кислотность спиртов по сравнению с водой:
![]()
В спиртовой среде алкоголяты подвергаются ионизации с образованием алкоксид-аниона, проявляющего сильные нуклеофильные и сильные основные свойства:
44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
Взаимодействие с минеральными и органическими кислотами. спирты реагируют с минеральными кислотами (серной, азотной, азотистой и др.) и органическими кислотами с образованием сложных эфиров.
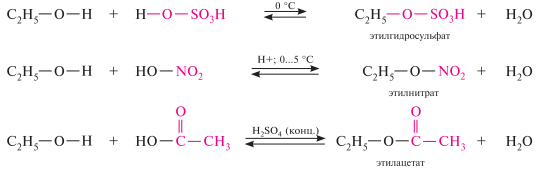
Эфиры фосфорной кислоты в обычных условиях — достаточно стабильные соединения, но в кислой или щелочной среде могут подвергаться гидролизу. Эти реакции являются типичным нуклеофильным замещением у атома углерода эфирной связи, причём гидролиз кислых фосфатов обычно ускоряется в кислой, а полных — в щелочной среде:

45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
Дегидратация спиртов. При нагревании спиртов в присутствии концентрированной серной кислоты, безводной фосфорной кислоты или при пропускании паров спирта над катализатором алюминия оксидом Al2O3 спирты отщепляют воду, то есть подвергаются дегидратации. в зависимости от природы спирта и условий проведения реакции дегидратация может протекать межмолекулярно и внутримолекулярно. При межмолекулярной дегидратации спиртов образуются простые эфиры:
![]()
в результате внутримолекулярной дегидратации образуются алкены:
![]()
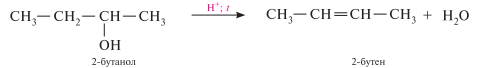
Внутримолекулярная дегидратация в ряду вторичных и третичных спиртов протекает согласно правилу Зайцева: протон отщепляется от соседнего, менее гидрогенизированного атома углерода:
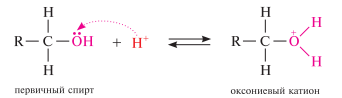
Межмолекулярная дегидратация спиртов протекает по механизму SN2 или SN1. При этом вначале молекула спирта под действием минеральной кислоты протонируется с образованием оксониевого катиона, а затем происходит замещение группы —OH:
Межмолекулярная и внутримолекулярная дегидратации спиртов представляют собой два конкурирующих процесса, из которых каждый в определенных условиях может стать доминирующим. отщепление воды от двух молекул спирта с образованием простых эфиров — межмолекулярная дегидратация — становится преобладающим процессом при нагревании спиртов в присутствии каталитических количеств минеральной кислоты (спирт в избытке) при температуре 140—160 °С. Внутримолекулярная дегидратация, то есть превращение спирта в алкен, становится доминирующей при нагревании спиртов с избытком минеральной кислоты при температуре выше 170 °С. особенно легко она протекает в ряду третичных спиртов.
Окисление. Первичные, вторичные и третичные спирты по-разному относятся к действию окислителей. Первичные спирты при окислении первоначально образуют альдегиды, которые могут окисляться далее, превращаясь при этом в карбоновые кислоты:
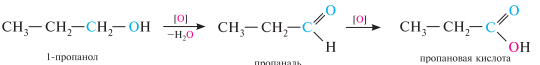
вторичные спирты при окислении образуют кетоны:
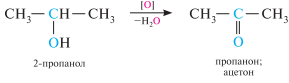
Третичные спирты устойчивы к окислению, однако в жестких условиях они окисляются с разрывом углеродного скелета молекулы и образованием смеси кетонов и карбоновых кислот.
В качестве окислителей для окисления спиртов используют хрома (VI) оксид, калия дихромат в серной кислоте (хромовая смесь), калия перманганат в серной кислоте и др. в промышленности для окисления первичных спиртов в альдегиды используют метод каталитического дегидрирования. сущность метода состоит в пропускании паров спирта над катализатором (мелкораздробленная медь) при 280—300 °с. Происходит отщепление молекулы водорода от молекулы спирта и образуется альдегид. Преимуществом каталитического дегидрирования является то, что предотвращается более глубокое окисление альдегида до кислоты:
![]()
в условиях данной реакции из вторичных спиртов синтезируют и многие кетоны.
46. Многоатомные спирты. Этиленгликоль, глицерин, пентаэритрит, инозит. Химические свойства 1,2-диолов: кислотность, образование хелатных комплексов, окислительное расщепление 1,2-диолов (йодной кислотой), образование циклических простых и сложных эфиров азотной кислоты.
Двухатомные спирты (содержат две гидроксильные группы) называют диолами, или гликолями.
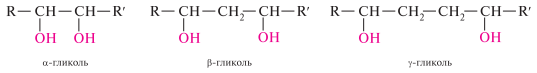
Трехатомные спирты (содержат три гидроксильные группы) называют триолами, или глицеринами.
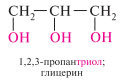
Многоатомные спирты содержат более трех гидроксильных групп и их называют полиолами.
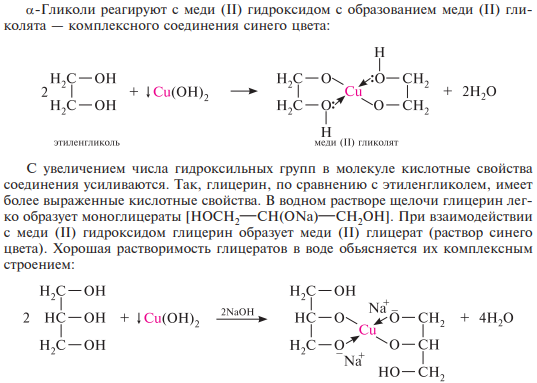
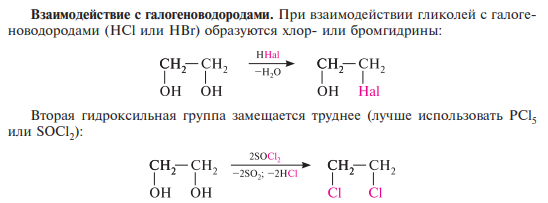
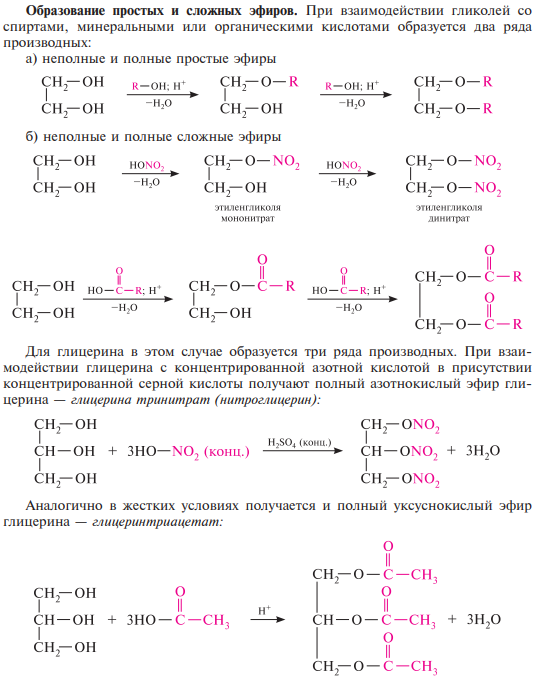
Образование алкоголятов. Гликоли являются более сильными он-кислотами, чем одноатомные спирты, поэтому они образуют алкоголяты (гликоляты) не только со щелочными металлами, но и с другими активными металлами (Al, Mg и др.), а также со щелочами и гидроксидами тяжелых металлов.