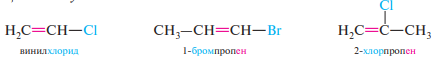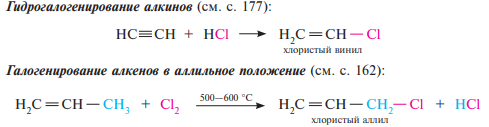- •1.Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2.Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4.Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5.Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8.Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10.Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа)
- •11.Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13.Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14.Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15.Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •17.Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18.Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20.Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •22.Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23.Номенклатура, классификация, изомерия диеновых углеводородов.
- •25.Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26.Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27.Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28.Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова)
- •29.Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30.Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами:
- •60. Реакции енольных форм карбонильных соединений: a-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных a-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
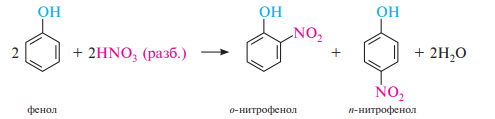
По влиянию на направление реакций электрофильного замещения и реакционную способность бензольного кольца заместители можно разделить на две группы — заместители I рода (орто-, пара-ориентанты) и заместители II рода (мета-ориентанты). К заместителям I рода относятся атомы и атомные группы, проявляющие положительный индуктивный или положительный мезомерный эффекты: —O–, —NR2, —NHR, —NH2, —OH, —OR, —NHCOR, —OCOR, —SR, —F, —Cl, —Br, —I, —Alk и др. Заместители I рода (за исключением галогенов) увеличивают электронную плотность в бензольном кольце и тем самым активируют его в реакциях электрофильного замещения. Заместители I рода направляют замещение преимущественно в орто- и параположения:
К заместителям II рода относятся группы, проявляющие отрицательный индуктивный или отрицательный мезомерный эффекты: —N + R3, —N + H3, —NO2, —SO3H, —CN, —CHO, —COR, —COOH, —COOR, —CONH2, —CCl3 и др. Заместители II рода уменьшают электронную плотность в бензольном кольце и снижают скорость реакции электрофильного замещения по сравнению с незамещенным бензолом. Заместители II рода направляют замещение преимущественно в мета-положение:
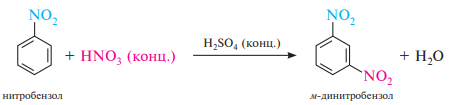
36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
Окисление гомологов бензола. Алкилбензолы, в отличие от незамещенного бензола, окисляются значительно легче. При действии сильных окислителей (KMnO4, K2Cr2O7 и др.) окислению подвергаются боковые углеродные цепи. Продуктами окисления являются ароматические карбоновые кислоты. Причем каждый алкильный радикал в бензольном кольце, независимо от длины углеродной цепи, окисляется в карбоксильную группу.
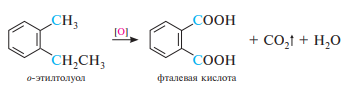
Взаимодействие гомологов бензола с галогенами (хлором или бромом) в условиях свободнорадикального замещения осуществляется с участием боковой цепи. При этом на атом галогена замещается, как правило, атом водорода при атоме углерода, непосредственно связанном с бензольным кольцом (α-положение):
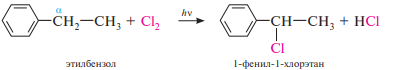
37. Классификация, номенклатура, изомерия галогенуглеводородов.
Галогенопроизводными углеводородов называют продукты замещения в углеводородах одного или нескольких атомов водорода атомами галогенов. Галогенопроизводные углеводородов в зависимости от природы углеводородного радикала подразделяют на алифатические, алициклические и ароматические. В ряду алифатических галогенопроизводных углеводородов различают насыщенные (галогеналканы) и ненасыщенные (галогеналкены, галогеналкины). Ароматические галогенопроизводные углеводородов делят на соединения, в которых атом галогена непосредственно связан с ароматическим ядром (галогенарены), и вещества, содержащие атом галогена в боковой цепи (арилалкилгалогениды). В соответствии с природой атома галогена галогенопроизводные углеводородов подразделяют на фтор-, хлор-, бром-, йодпроизводные. По числу атомов галогена в молекуле различают моно-, ди-, три- и полигалогенопроизводные углеводородов.
По заместительной номенклатуре IUPAC названия галогенопроизводных углеводородов составляют аналогично названиям соответствующих углеводородов. Входящие в их состав атомы галогенов обозначают в названии в виде префикса, к которому прибавляют название родоначальной структуры. За родоначальную структуру в алифатических галогенопроизводных углеводородов принимается главная углеродная цепь, в алициклических и ароматических — цикл:
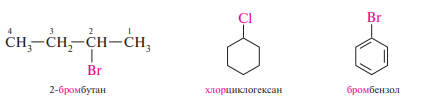
Для простейших галогенопроизводных углеводородов широко используют радикало-функциональную номенклатуру, согласно которой название составляют из названия углеводородного радикала, связанного с атомом галогена и суффикса -фторид, -хлорид, -бромид или -йодид:
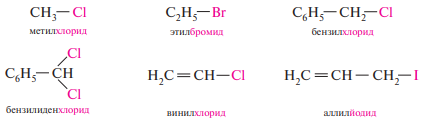
Для галогенопроизводных углеводородов характерны структурная, геометрическая и оптическая изомерии.
Структурная изомерия обусловлена разной структурой углеродного скелета молекулы и разным положением атомов галогенов в цепи.
Дигалогенопроизводные углеводородов с атомами галогенов у одного и того же атома углерода называют геминальными (сокращенно гем), у соседних атомов углерода — вицинальными (сокр. виц).
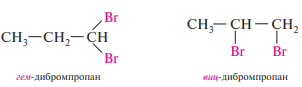
Для галогеналкенов, имеющих разные заместители при атомах углерода, образующих двойную связь, наряду со структурной изомерией возможна геометрическая изомерия:

Для галогеналканов, содержащих в своей структуре асимметрический атом углерода, характерна оптическая изомерия. Так, 2-хлорбутан CH3CH2C * HClCH3 существует в виде двух зеркальных изомеров (энантиомеров):
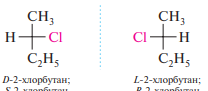
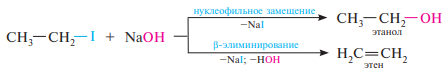
38. Реакции нуклеофильного замещения атома галогена, их использование в синтезе органических соединений различных классов (спиртов, простых и сложных эфиров, аминов, тиолов и сульфидов, нитроалканов, нитрилов). Представление об идеализированных механизмах SN1 и SN2.
Галогеналканы являются весьма реакционноспособными веществами. Наиболее характерны для них реакции нуклеофильного замещения (SN ) и отщепления (E ). Они также способны к взаимодействию с металлами и восстановлению.
Гидролиз галогеналканов. Галогеналканы при гидролизе образуют спирты. Реакция с водой протекает медленно и является обратимой:
![]()
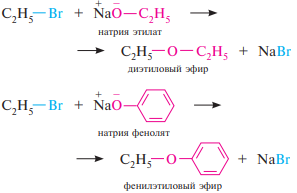
Взаимодействие с алкоголятами и фенолятами (реакция Вильямсона). При действии на галогеналканы алкоголятов и фенолятов образуются простые эфиры. Третичные галогеналканы образуют в качестве побочных продуктов алкены:
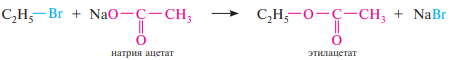
Взаимодействие с солями карбоновых кислот. При действии на галогеналканы солей карбоновых кислот в среде апротонного полярного растворителя (диметилформамид, диметилсульфоксид) с высокими выходами образуются сложные эфиры (по механизму SN2):
Взаимодействие с аммиаком, алкил- и аренаминами. При взаимодействии галогеналканов с избытком аммиака образуется смесь первичных, вторичных и третичных аминов, а также соли четвертичных аммониевых оснований (описание реакции см. на с. 294). Образование первичного амина происходит по схеме:
![]()
Взаимодействие с солями циановодородной кислоты. Поскольку цианид-ион является амбидентным нуклеофилом, при взаимодействии галогеналканов с солями циановодородной кислоты образуются нитрилы или изонитрилы (изоцианиды) в зависимости от условий проведения реакции. Первичные и вторичные галогеналканы с солями щелочных металлов циановодородной кислоты (KCN, NaCN) в среде апротонного полярного растворителя с хорошими выходами образуют нитрилы (механизм SN2):
![]()
Взаимодействие с солями азотистой кислоты. Взаимодействие галогеналканов с солями азотистой кислоты, содержащими амбидентный нитрит-ион, протекает в зависимости от условий проведения реакции с образованием нитросоединений или эфиров азотистой кислоты. Первичные и вторичные галогеналканы с натрия нитритом в условиях реакции SN2 образуют преимущественно нитросоединения:
![]()
Взаимодействие с гидросульфидами и сульфидами щелочных металлов. При действии на первичные и вторичные галогеналканы гидросульфидов щелочных металлов образуются тиоспирты (меркаптаны), при действии сульфидов — тиоэфиры.
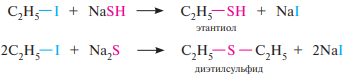
Механизм SN1 (мономолекулярное нуклеофильное замещение). В отличие от механизма SN 2, где разрыв связи C—Hal и образование связи С—Nu происходит синхронно, в механизме SN1 разрыв связи C—Hal предшествует образованию связи C—Nu. По механизму SN 1 реакция протекает в две стадии:

Факторы, способствующие протеканию реакций по механизму SN1. Протеканию реакций по механизму SN1 способствуют следующие факторы: пространственные препятствия для атаки нуклеофилом электронодефицитного атома углерода галогеналкана; способность соединений образовывать весьма устойчивые карбокатионы; высокая ионизирующая и сольватирующая способность растворителя.
Механизм SN2 (бимолекулярное нуклеофильное замещение). По механизму SN2 реакция происходит в одну стадию через образование переходного состояния, в построении которого принимает участие как молекула галогеналкана, так и нуклеофильный реагент.
Факторы, способствующие протеканию реакций по механизму SN2. Реакционная способность галогеналканов по механизму SN2 тем выше, чем больше частичный положительный заряд на атоме углерода, связанном с атомом галогена. Поэтому среди первичных галогеналканов активность повышается в ряду:
![]()
Первичные галогеналканы обычно реагируют по механизму SN2, третичные — по механизму SN1. Вторичные галогеналканы, в зависимости от природы нуклеофила и растворителя, могут реагировать как по механизму SN2, так и по механизму SN1.
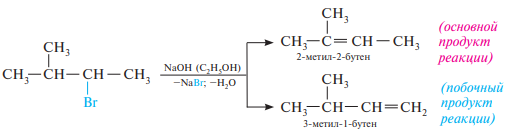
39. Соединения с повышенной подвижностью атома галогена. (аллил- и бензилгалогениды). Соединения с пониженной подвижностью атома галогена (винилхлорид и хлорбензол). Реакции элиминирования галогеноводорода. Правило Зайцева.
Реакции отщепления, в которых уходящие группы — анион галогена Нal– и протон Н+ — отщепляются от соседних атомов углерода с образованием π-связи между ними, называют β-элиминированием.
Правило Зайцева: если в молекуле галогеналкана имеется несколько альтернативных путей отщепления галогеноводорода, то преимущественно реализуется из них тот, при котором двойная связь образуется у наиболее замещенного атома углерода; то есть вместе с галогеном уходит водород от наименее гидрогенизированного соседнего атома углерода.
Аллилгалогениды — соединения, в которых атом галогена находится в α-положении к атому углерода, образующему двойную связь:

Винилгалогениды — соединения, содержащие атом галогена у атома углерода, образующего двойную связь: