
GT_-VOPROSY-I-ZADAChI-2024
.pdfПатогенез (КРАТКО):
Аргинин в синовиальной жидкости; в ответ на триггер идет его замена на белок ЦИТРУЛЛИН, который запускает активацию иммунокомпетентных клеток.
Носительство HLA-DR4 обуславливает нарушение толерантности иммунокомпетентных клеток к модифицированным белкам.
Идет выработка провоспалительных цитокинов синовиоцитами, развивается экссудативно-пролиферативное воспаление синовиальной оболочки с образованием паннуса. Этот паннус выделяет протеолитические ферменты, разрушающие хрящ.
Развитие остеопороза с последующей узурацией в ответ на активацию цитокинами остеокластов.
АутоАТ (АЦБ, РФ) инициируют иммунокомплексный васкулит.
Патогенез (НЕ КРАТКО):
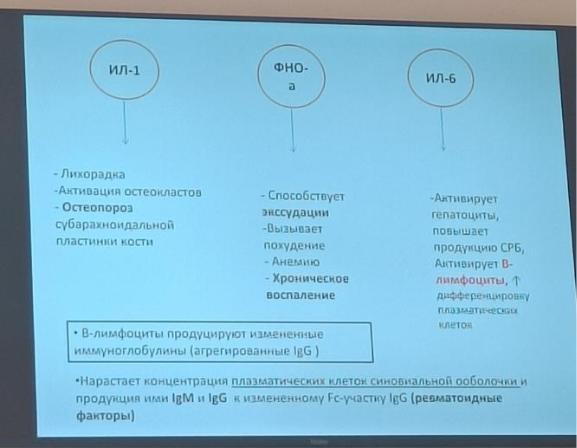
Эволюция РА включает несколько последовательно развивающихся стадий: преклиническая, симптоматическая, завершающуюся формированием клиниколабораторного симптомокомплекса, характерного для раннего, а затем развернутого РА. РА — классическое В-клеточное аутоиммунное заболевание, наиболее характерным проявлением которого является синтез широкого спектра аутоантител с различной специфичностью, которые обнаруживаются более чем у 90% пациентов, страдающих РА. Кроме того, В-клетки участвуют в ко-стимуляции Т-клеток, вызывают активацию остеокластов и синтезируют широкий спектр «провоспалительных» цитокинов — ФНОα, лимфотоксин, интерлейкин ИЛ-6 и др.
Наиболее характерными для РА аутоантителами являются ревматоидные факторы (РФ) IgG, IgM и IgA изотипов, реагирующие с Fс-фрагментом молекулы IgG, и аутоантитела, реагирующие с антигенными эпитопами.
Главное на что эти эпитопы способны: цитруллинирование - биохимический процесс, опосредованный ферментом петидил-аргинин дезаминазой (ПАД) 2 и 4, заключающийся в конверсии положительно заряженной аминокислоты аргинин в аминокислоту цитруллин, обладающую нейтральным зарядом.
Гиперпродукция антител к цитрулинированным белкам (АЦБ) (особенно в комбинации с IgM и IgA РФ) ассоциируется с активностью заболевания, прогрессированием деструкции суставов, системными) проявлениями, риском общей летальности.
Выделяют два основных клинико-иммунологических субтипа РА: АЦБ-позитивный и АЦБнегативный. Они отличаются по молекулярным механизмам патогенеза, факторам генетической предрасположенности и внешней среды, тяжести течения и эффективности проводимой терапии. При АЦЦП-негативе преобладает пролиферация, в патогенезе большую роль играет Т-клеточное звено (СD4+ Т-ЛФ). Для этого типа менеее выражен эрозивный процесс, но воспалительная активность мб как при позитивном варианте.
IgM РФ и АЦБ выявляются не только в сыворотках пациентов с РА, а также у пациентов с артралгией или неспецифическими мышечно-скелетными симптомами за много лет до развития РА, что рассматривается как важное доказательство существования «преклинической» системной «аутоиммунной» фазы этого заболевания.
К цитруллинированию может приводить: курение (образуются эти белки в ткани легких), ткань десен также любимое место их образования (боимся периодонтита в анамнезе).
Внутренний (выстилающий) слой синовиальной ткани содержит 2 основных типа клеток: макрофагоподобные (тип А) и фибробластоподобные (тип В) синовиоциты.
МПС: гемопоэтическое происхождение. Синтезируют широкий спектр «провоспалительных» медиаторов, активируя ФПС ФПС (доминанты над МПС!): мезенхимальное происхождение. Начинают синтезировать
«провоспалительные» медиаторы и матриксные металлопротеиназы (ММП) после активации медиаторами МПС. Этот процесс способствует хронизации синовита и деструкции компонентов сустава. Также могут экспрессировать молекулу адгезии кадгерин-11, синтезировать ММП, в первую очередь коллагеназу и стромелизин.
Идет нарушение взаимодействия клеток иммунки: синовиоциты приобретают черты макрофагов, выделяются провоспалительные цитокины и активируются Т1-хелперы. Их много в синовиальной жидкости и оболочке сустава, они выделяют гамма-интерферон, из-за чего активируются макрофаги. Они + моноциты продуцируют ИЛ-1,6,8 и нарастает концентрация нейтрофилов. Реализация эффекта цитокинов.
Выделяется эндотелиальный фактор роста, активируя ангиогенез капилляров синовиальной ткани, пролиферацию фибробластов, синовиоцитов, из-за чего образуется паннус (агрессивная ткань со свойствами опухолеподобного роста).
Образование ИК в результате взаимодействия IgG и РФ, далее активация комплемента, далее повреждение МЦР, далее висцеральные проявления.
Клиника
50% случаев: постепенное (в течение месяцев) нарастание болей и скованности преимущественно в мелких суставах кистей и стоп. В дебюте заболевания клинические проявления бывают выражены умеренно. Иногда заболевание дебютирует как острый моноартрит крупных суставов, напоминающий септический или микрокристаллический артрит.

Для большинства пациентов характерно симметричное поражение суставов кистей проксимальных межфаланговых, пястно-фаланговых и лучезапястных, а также плюснефаланговых суставов.
Наиболее частый и характерный признак воспаления синовиальной оболочки суставов при РА — утренняя скованность. Ее длительность обычно тесно связана с выраженностью синовита и составляет не менее 1 ч.
Поражения суставов при РА можно разделить на 2 категории: потенциально обратимые (обычно ранние), связанные с развитием синовита, и необратимые структурные, развивающиеся на поздних стадиях болезни.
DAS28: ЧБС (число болезненных суставов) из 28 (проксимал.межфаланговых, пястнофаланговых, лучезап, плечевых, локтевых,коленных) + общая оценка здоровья в мм по 100 мм по ВАШ+СОЭ:
Внесуставные проявления наблюдаются уже в дебюте заболевания. Факторы риска развития системных проявлений: тяжелое поражение суставов, высокие титры РФ, АЦБ. Связаны проявления в основном с васкулитом и гиперпродукцией цитокинов:
Сердце: миокардит, коронариит, адгезивный перикардит, ускоренное развитие атеросклероза).
Легкие: пульмонит типа фиброзирующего альвеолита, плеврит со спайками в плевре. Почки: гломерулонефрит, амилоидоз.
Глаза: склерит, эписклерит.
ЩЖ, печень, ГМ, ЖКТ, Анемия хрон.заб (АХЗ).
Критерии диагностики:
При постановке диагноза РА необходимо учитывать три основных фактора:
1.Выявить у пациента хотя бы один припухший сустав при клиническом обследовании.
2.Исключить другие заболевания, которые могут проявляться воспалением суставов.
3.Набрать не менее 6 баллов из 10 возможных по 4 позициям, характеризующим поражение суставов и лабораторные нарушения, характерные для РА.

Основное значение имеет определение числа воспаленных суставов, которое учитывает, как припухлость, так и болезненность сустава, выявляемых при объективном исследовании.
Оценка статуса пациента основывается на выделении 4 категорий суставов.
Суставы исключения: не учитываются изменения дистальных межфаланговых суставов, первых запястно-пястных суставов и первых плюсне-фаланговых суставов.
Крупные суставы: плечевые, локтевые, тазобедренные, коленные, голеностопные. Мелкие суставы: пястно-фаланговые, проксимальные межфаланговые, 2–5-й плюснефаланговые, межфаланговые суставы больших пальцев кистей, лучезапястные суставы.
Другие суставы: суставы, которые могут быть поражены при РА, но не включены ни в одну из перечисленных выше групп (например, височно-нижнечелюстной, акромиальноключичный, грудинно-ключичный и др.
Особые клинические формы (думаю надо):
Синдром Фелти — очень редкая (1%) клиническая форма длительно протекающего серопозитивного РА, чаще встречается у женщин (соотношение женщин и мужчин 3:1) старше 40–50 лет. Симптомокомплекс включает стойкую гранулоцитопению (менее 2000/мм3), спленомегалию, гепатомегалию, тяжелое поражение суставов, внесуставные
проявления (васкулит, нейропатия, легочный фиброз, синдром Шегрена), гиперпигментацию кожи нижних конечностей, сопровождается высоким риском инфекционных осложнений.
Болезнь Стилла взрослых — заболевание, характеризующееся рецидивирующей фебрильной лихорадкой, артритом, нейтрофильным лейкоцитозом, макулопапулезной сыпью, высокой лабораторной активностью, серонегативностью по РФ и АЦЦП.
Лабораторные диагностические исследования:
Определение содержания антител к циклическому цитруллиновому пептиду в крови (АЦЦП) и определение содержания РФ в крови рекомендуется всем пациентам с недифференцированным артритом и подозрением на РА. Определение содержания РФ в крови в высоких титрах служит для прогнозирования быстропрогрессирующего деструктивного поражения суставов и развития внесуставных проявлений при РА.
Цитологическое исследование синовиальной жидкости рекомендуется в качестве дополнительного метода обследования всем пациентам с моноартритом и подозрением на РА с целью дифференциальной диагностики РА с микрокристаллическими или септическими артритами. Для пациентов с РА характерно снижение вязкости синовиальной жидкости, рыхлые муциновые сгустки, зернистый осадок, цитоз (3,0– 75,0×109/л), преобладание полиморфно-ядерных нейтрофилов (до 85%), повышение уровня общего белка (30– 60 мг/л), увеличение уровня глюкозы (1,0–2,0 ммоль/л), уровня СРБ и РФ.
Определение содержания антинуклеарных антител к Sm-антигену в сыворотке крови (уровня антител к Ro/SS-А и Lа/SS-В) рекомендуется всем пациентам с РА с подозрением на синдром Шегрена.
Перед назначением противоревматических препаратов у всех пациентов с РА важно выявлять факторы риска нежелательных лекарственных реакций или осложнений фармакотерапии. К ним относятся маркеры или факторы риска хронических инфекций (туберкулез, инфекции вирусом гепатита В и С, вирус иммунодефицита человека — ВИЧ и др.); сердечно-сосудистых заболеваний; нарушение функции почек, прием алкоголя, статус вакцинации, планирование беременности; вираж туберкулиновой пробы Манту. На фоне лечения ГИБП и тсБПВП всем пациентам эти исследования проводятся каждые 6 месяцев.
Перед назначением ингибиторов ИЛ-6 и ингибиторов янус-киназ рекомендуется проводить биохимический анализ крови для оценки нарушений липидного обмена в связи с риском развития дислипопротеинемии на фоне терапии.
Рекомендуется проводить общий анализ крови и исследование уровня СРБ в сыворотке крови для оценки эффективности терапии не реже 1 раза в 3 месяца до достижения ремиссии/ низкого уровня активности РА. После достижения ремиссии/низкого уровня активности РА — не реже 1 раза в 6 месяцев.
Инструментальные диагностические исследования:
1.Рентген
Для РА характерно множественное и симметричное поражение мелких суставов кистей и стоп. При остром начале и активном воспалении при РА околосуставной остеопороз и единичные кисты могут быть обнаружены в течение 1 месяца заболевания. Множественные кисты, сужение суставных щелей и единичные эрозии через 3 и до 6 месяцев от начала заболевания, особенно в отсутствии лечения. Ранние
рентгенологические признаки артрита обнаруживаются: во 2-х и 3-х пястно-фаланговых суставах; 3-х проксимальных межфаланговых суставах; в суставах запястий; лучезапястных суставах; шиловидных отростках локтевых костей; 5-х плюснефаланговых суставах.
Типичными для РА являются симметричные рентгенологические изменения в пястнофаланговых суставах, проксимальных межфаланговых суставах; в суставах запястий; плюснефаланговых суставах и 1-х межфаланговых суставах стоп.
2.КТ ОГК по показаниям (интерстициальное или очагового-ревматоидные узлы) и проведения дифференциальной диагностики.
3.МРТ суставов кистей рекомендуется использовать у пациентов с ранним РА в качестве дополнительного метода выявления синовита. МРТ признаки артрита неспецифичны.
4.УЗИ суставов кистей и стоп рекомендуется назначать как дополнительный метод мониторинга активности заболевания и эффективности проводимой терапии.
Доп: ЭГДС, ЭКГ, ЭхоКГ. Рентгеноденситометрия поясничного отдела позвоночника и шейки бедра рекомендуется всем пациентам с РА каждые 12 месяцев при наличии следующих показаний: – возраст старше 50 лет для женщин и 60 лет для мужчин; – ранняя менопауза у женщин; – высокая активность заболевания (стойкое увеличение СРБ более 20 мг/л); – рентгенологическая стадия Ш–IV по Штейнброкеру; – масса тела менее 60 кг; – прием ГК (более трех месяцев в дозе более 5 мг в сутки).
Лечение РА:
Основная цель фармакотерапии — достижение ремиссии или низкой активности заболевания, а также снижение риска коморбидных заболеваний, подавление симптоматики, предотвращение деструкции и деформации суставов и связанной с ними потери функции, улучшение качества жизни, увеличение продолжительности жизни до популяционного уровня.
Снижение активности РА на фоне лечения в течение первых 3 месяцев ассоциируется с развитием ремиссии через 12–24 месяца.
Для лечения сейчас используют следующие группы препаратов:
1) синтетические базисные противовоспалительные препараты (сБПВП): метотрексат, сульфасалазин, лефлуномид, гидроксихлорохин; 2) генно-инженерные биологические препараты (ГИБП): ингибиторы фактора некроза
опухоли-α (иФНОα), ингибиторы интерлейкина (иИЛ), моноклональные антитела, селективные иммунодепрессанты; 3) таргетные синтетические базисные противовоспалительные препараты (тсБПВП):
селективные иммунодепрессанты: барицитиниб, тофацитиниб, упадацитиниб; 4) нестероидные противовоспалительные препараты (НПВП); 5) глюкокортикостероиды (ГК).
Контроль над состоянием пациента с момента постановки диагноза осуществляется каждые 3 месяца до достижения ремиссии, каждые 6 месяцев после достижения ремиссии.
Для уменьшения болей в суставах рекомендуется применять НПВП, которые оказывают симптоматический анальгетический эффект. Эти препараты не влияют на прогрессирование деструкции суставов. При умеренной вероятности развития

осложнений со стороны ЖКТ рекомендуется использовать селективные НПВП или неселективные НПВП+ингибиторы протонного насоса.
Всем пациентам с РА с момента постановки диагноза рекомендуется назначать синтетические базисные противовоспалительные препараты (сБПВП). Метотрексат - препарат «первой линии» терапии. Следует начинать с дозы 10– 15 мг/нед с быстрым увеличением дозы (по 2,5–5 мг каждые 2–4 нед) до 25 мг/нед в зависимости от эффективности и переносимости.
При стойком увеличении уровня АСТ и/или АЛТ более 3 норм следует снизить дозу МТ, а при сохранении этого увеличения после снижения дозы препарат следует отменить.
На фоне лечения МТ рекомендуется прием фолиевой кислоты (не менее 5 мг/нед).
При наличии противопоказаний к назначению метотрексата или плохой переносимости препарата рекомендуется назначить лефлуномид в дозе 20 мг в день или сульфасалазин в дозе 2–3 г в день.
Рекомендуется, чтобы назначение и терапию ГК при РА проводили только врачиревматологами. При РА лечение ГК следует проводить в комбинации с метотрексатом или другими сБПВП, можно коротким курсом при обострении заболевания в любой стадии РА. ГК следует отменить через 3–6 месяцев от начала терапии, а при необходимости более длительного применения, поддерживающая доза ГК не должна превышать 7,5 мг в сутки.
Рекомендуется проводить профилактику (препараты кальция и витамина D) и, при необходимости, лечение глюкокортикоидного остеопороза у всех пациентов РА, принимающих ГК более 3 месяцев в дозе более 5 мг/день. При обострении моно/олигоартрита на фоне лечения сБПВП рекомендуется внутрисуставное или периартикулярное введение ГК не чаще 1 раза в 3 месяца.
При наличии противопоказаний к назначению и плохой переносимости метотрексата и других сБПВП рекомендовано проведение монотерапии ГИБП, которые официально зарегистрированы для монотерапии РА, в первую очередь ингибиторами интерлейкина (тоцилизумаб, сарилумаб, олокузумаб) или тсБПВП (селективные иммунодепрессанты: барицитиниб, тофацитиниб, упадацитиниб).
В случае достижения ремиссии (длительность не менее 12 месяцев на фоне терапии) рекомендуется постепенное тщательно контролируемое снижение («титрование») дозы или отмена ГИБП.
Показания к госпитализации: • диагностика РА и подбор терапии; • высокая степень клинической и лабораторной активности РА; • подбор и коррекция дозы сБПВП; • решение вопроса о назначении ГИБП и тсБПВП и инициация данных методов терапии; • развитие осложнений РА или тяжелых НЛР у пациента, получающего ГК, сБПВП, ГИБП и тсБПВП, при необходимости коррекции терапии; • программная терапия (курсовое лечение) с применениемГИБП и тсБПВП в условиях круглосуточного и дневного стационара.
Профилактическую противовирусную терапию (энтекавир, тенофовир) рекомендовано назначать всем пациентам, являющимся носителями хронической инфекции вирусом гепатита В, которые нуждаются в терапии ГИБП или тБПВП. У пациентов с излеченной инфекцией вирусом гепатита В профилактическое лечение показано при планировании применения ритуксимаба.
У пациентов, не получающих противовирусную терапию, рекомендуется назначать сульфасалазин и гидроксихлорохин, а не метотрексат и лефлуномид.
Всем пациентам с РА до начала лечения рекомендуется проведение вакцинации инактивированными вакцинами против гриппа и пневмококковой инфекции. Эндопротезирование или артродез суставов рекомендуется при наличии выраженных структурных изменений, сопровождающихся стойкой болью и нарушениями функции суставов. Проведение лаважа с использованием артроскопии или синовэктомии рекомендуется пациентам с РА при наличии стойкого синовита сустава и отсутствии эффекта от консервативной терапии.
Для первичной профилактики прогрессирования РА пациентам рекомендуется избегать факторов, которые могут провоцировать обострение болезни (интеркуррентные инфекции, стресс), отказ от курения и ограничение приема алкоголя, поддержание нормальной массы тела, соблюдение гигиены полости рта.
60. Подагра. Определение, патогенез, клиническая картина. Критерии диагностики. Лечение. Профилактика и прогноз. (Жидков)
Подагра — системное тофусное заболевание, характеризующееся отложением в различных тканях кристаллов моноурата натрия и развивающимся в связи с этим воспалением у лиц с гиперурикемией, обусловленной внешне средовыми и/или генетическими факторами Стойкое повышение уровня мочевой кислоты в сыворотке крови (гиперурикемия) —
обязательный фактор риска развития подагры. Европейская лига по борьбе с ревматизмом рекомендует считать гиперурикемией уровень мочевой кислоты в сыворотке крови выше 360 мкмоль/л (6 мг/дл).. Гиперурикемия может длительное время протекать без симптомов, часто ассоциируется с нарушениями жирового и углеводного обмена, а также приводит к уратной нефропатии Облигатным фактором развития подагры является гиперурикемия, повышение
сывороточного уровня мочевой кислоты выше 420 мкмоль/л, при котором у части пациентов происходит образование кристаллов моноурата натрия. Чем выше сывороточный уровень мочевой кислоты, тем выше риск развития подагры. Формирование кристаллов возможно и при более низком уровне показателя (360 мкмоль/л), прежде всего, у женщин
Этиология и патогенез
Основными причинами гиперурикемии являются генетические факторы, приводящие к повышению реабсорбции и снижению экскреции мочевой кислоты с мочой либо к ее гиперпродукции; избыточная масса тела и ожирение, повышение артериального давления, прием алкоголя, потребление большого количества животного белка, прием мочегонных препаратов, заболевания и состояния, характеризующиеся гиперурикемией.
Кристаллы моноурата натрия, формирующиеся в синовиальной жидкости и близлежащих тканях, выступают в качестве триггера острого подагрического артрита, запуская каскад иммунных реакций. Исходно происходит фагоцитоз кристаллов, благодаря высокой в клетках повышается концентрация натрия, вследствие этого происходит компенсаторный приток воды в цитоплазму и набухание клеток, параллельно резко уменьшается содержание калия, индуцируя активацию внутриклеточных инфламмасом, в результате которого синтезируется широкий спектр провоспалительных цитокинов, хемокинов (прежде всего интерлейкина-1 (ИЛ-1), а также ИЛ-6, ИЛ-8, ИЛ-18, фактора некроза опухоли- (ФНО- ) и др.). Их продукция способствует развитию острой массивной воспалительной реакции, вазодилатации, быстрой миграции к месту воспаления иммунных клеток, преимущественно нейтрофилов Клинически это проявляется острым приступом артрита.
Хронический, вялотекущий воспалительный процесс, связанный с наличием в суставах и окружающих тканях кристаллов моноурата натрия, протекает и вне острого приступа артрита Выделяют первичную и вторичную подагру. В основе первичной подагры лежит
семейно-генетическая аномалия пуринового обмена, детерминированная несколькими генами. Исследования уратного гомеостаза показали аутосомно-доминантный тип наследования таких аномалий. В частности, это наблюдается при врожденных нарушениях в содержании энзимов, занимающих ключевое положение в метаболизме пуринов. Вторичная подагра является одним из синдромов другого заболевания и встречается чаще всего при хронической почечной недостаточности
Клиническая картина
●Острый подагрический артрит Острый подагрический артрит характеризуется внезапным, быстрым нарастание интенсивных болей, как правило, в одном суставе, гиперемией кожных покровов, припухлостью и нарушением функции пораженного сустава. Приступ чаще развивается в ночное время или в ранние утренние часы. В начале болезни длительность атаки варьирует от 1 до 10 дней и протекает с полным, иногда спонтанным выздоровлением и отсутствием каких-либо симптомов между приступами. Провоцирующими факторами являются: травма, погрешности в диете, прием алкоголя, хирургические процедуры, прием диуретиков. Первая подагрическая атака у большинства больных проявляется поражением первого плюснефалангового сустава стопы. Высокая специфичность этого признака доказана рядом исследований. При отсутствии лечения более чем у половины больных повторный приступ развивается в течение первого года. В дальнейшем наблюдают учащение атак, сокращение продолжительности бессимптомного периода, затяжное течение артрита. Несмотря на
проводимую противовоспалительную терапию, в патологический процесс вовлекаются новые суставы, поражения приобретают олиго- и полиартикулярный характер.
●Хроническая тофусная подагра Образование отложений кристаллов моноурата натрия в виде тофусов — характерный признак болезни, наблюдаемый при подагре практически во всех органах и тканях. Развитие видимых тофусов, 76 чаще подкожных или внутрикожных в области пальцев кистей и стоп, коленных суставов, на локтях и ушных раковинах свойственно хронической стадии болезни. Иногда отмечают изъязвление кожи над тофусами со спонтанным выделением содержимого в виде пастообразной белой массы. Тофусы могут образовываться практически в любых участках тела и внутренних органах, в том числе внутрикостно (рентгенологический симптом «пробойника»).
●Нефролитиаз при подагре также относят к одной из тофусных форм, поскольку компонентами камней являются ураты. Тофусы могут появляться и в самой ранней стадии болезни, что зависит от выраженности гиперурикемии и скорости кристаллообразования. Часто это наблюдают при хронической почечной недостаточности; у женщин пожилого возраста, принимающих диуретики; при некоторых формах ювенильной подагры, миелопролиферативных заболеваниях и при посттрансплантационной (циклоспориновой) подагре. Обычно наличие тофусов любой локализации сочетается с хроническим подагрическим артритом, при котором отсутствует бессимптомный период, а поражение суставов носит
олигоили полиартикулярный характер
Лечение
1.Лечение острого подагрического артрита В качестве «первой линии» терапии острого артрита рекомендуется назначать НПВП или колхицин, или ГК. Выбор конкретного препарата должен определяться исходя из наличия и отсутствия противопоказаний, с учетом лекарственных взаимодействий. Лечение, особенно колхицином, необходимо начинать как можно раньше: в течение 24 часа от начала артрита
2.НПВП — препараты первой линии. Применяют в полных терапевтических дозах нимесулид (100 мг 2 раза в день), диклофенак (25–50 мг 4 раза в день), индометацин (25–50 мг 4 раза в день).
3.Колхицин. Большие дозы колхицина приводят к побочным эффектам (диарея, тошнота), поэтому в настоящее время его применяют редко. Колхицин не следует назначать пациентам с тяжелым поражением почек, ЖКТ и сердечно-сосудистой системы из-за увеличения риска тяжелых побочных эффектов. Относительное показание к назначению колхицина — противопоказания к назначению НПВП. Возможно применение низких доз (0,5–1,5 мг в сутки) в начале антигиперурикемической терапии для профилактики обострений артрита. Комбинированная терапия колхицином и НПВП 83 не имеет преимуществ перед монотерапией
4.Антигиперурикемическая терапия эффективно предотвращает рецидивы подагрического артрита и развитие осложнений, связанных с гиперурикемией. Терапия показана больным с повторными атаками, хроническим артритом и тофусными формами.. Целевой уровень мочевой кислоты при проведении
