
- •Дефект межпредсердной перегородки
- •Дефект межжелудочковой перегородки
- •Открытый артериальный проток
- •Аномалия Эбштейна
- •2. Аортальные пороки сердца: этиология, патогенез, клиническая картина, диагностика, классификация по степени тяжести, дифференциальный диагноз, лечение.
- •Определение степени ас
- •3.Митральные пороки сердца: этиология, патогенез, клиническая картина, диагностика, классификация по степени тяжести, дифференциальный диагноз, лечение.
- •1. Консервативное лечение:
- •4.Кардиомиопатии – определение, этиопатогенез. Классификация кардиомиопатий.
- •5. Клиническая картина при гипертрофической кардиомиопатии, причины развития. Инструментальная диагностика.
- •6.Клиническая картина при дилятационной кардиомиопатии, причины развития. Инструментальная диагностика.
- •I. Дилатационная кардиомиопатия (6 вопрос)
- •II. Гипертрофическая кардиомиопатия (5 вопрос)
- •7.Клиническая картина при аритмогенной дисплазии правого желудочка, причины развития. Инструментальная диагностика.
- •27.Миокардиты – определение, распространенность. Классификация. Клинические проявления. Диагностика миокардитов. Лечение.
- •1) По течению (зависит от гистологии):
- •2)Варианты течения (от клиники):
- •3)По распространенности воспалительного процесса
- •8.Перикардиты – определение, этиология и патогенетические механизмы развития перикардитов. Классификация. Клиническая картина при сухом, выпотном и констриктивном.
- •9.Критерии диагностики, лечение, профилактика и прогноз перикардитов.
- •10.Диагностика и врачебная тактика при тампонаде сердца, констриктивном перикардите.
- •2. Экссудативный перикардит и тампонада сердца
- •3. Констриктивный перикардит
- •Классификация артериальных и симптоматических артериальных гипертензий
- •Обязательные исследования при выявлении артериальной гипертензии
- •Характеристика основных вторичных артериальных гипертензий почечные артериальные гипертензии
- •Вазоренальная артериальная гипертензия
- •Эндокринные артериальные гипертензии
- •1.Акромегалия
- •2.Болезнь и синдром Иценко–Кушинга
- •3.Феохромоцитома
- •5.Диффузный или диффузно-узловой токсический зоб
- •6.Гиперпаратиреоз
- •Гемодинамические артериальные гипертензии
- •1.Болезнь Такаясу:
- •2.Склеротическая (старческая) или изолированная:
- •3.Коарктация аорты:
- •Церебральные артериальные гипертензии
- •Таблички из клинических рекомендаций очень нужные, в вопросе их просят.
- •Лабораторные методы исследования
- •Биомаркеры некроза (в часах)
- •Дополнительные инструментальные методы обследования
- •1.Эхокардиография:
- •2.Медикаментозное лечение:
- •23.Осложнения инфаркта миокарда.
- •Классификация типов инфаркта миокарда
- •Клинические формы:
- •24.Острая сердечная недостаточность – определение, причины развития, диагностика и неотложная помощь.
- •25.Кардиогенный шок – определение, причины развития. Клинические и гемодинамические критерии. Неотложная терапия.
- •26.Отек легких – определение, причины развития. Клинические и гемодинамические критерии. Неотложная терапия.
- •Классификация острой сердечной недостаточности при инфаркте миокарда
- •1.Сердечная астма.
- •2.Альвеолярный отек легких.
- •Дифференциальная диагностика
- •2.Рефлекторная форма
- •А.Повышенный автоматизм:
- •Механизм re-entry
- •Определения
- •1)Электрокардиография
- •1)Медикаментозное лечение:
- •1)Установка имплантируемого кардиовертера-дефибриллятора
- •16.Клиническая картина, электрокардиографическая диагностика при наджелудочковых тахикардиях. Лечебная тактика.
- •17.Клиническая картина, электрокардиографическая диагностика при трепетании предсердий. Лечебная тактика.
- •18.Клиническая картина, электрокардиографическая диагностика при фибрилляции предсердий. Лечебная тактика
- •Классификация антиаритмических препаратов
- •Подходы к профилактике тромбоэмболических осложнений у больных с фибрилляцией предсердий (шкала cha2ds2-vaSc)
- •21.Синдром слабости синусового узла – критерии диагностики, врачебная тактика. Синдром Морганьи–Адамса–Стокса: причины, диагностика и лечение.
- •20.Атрио–вентрикулярные блокады – определение, этиология, классификация, критерии диагностики и врачебная тактика.
- •Синдром Фредерика
- •Синдром Морганьи–Адамса (Эдемса)–Стокса(мэс)
- •Обновленный единый код экс — номенклатура nbg-naspe/bpeg (2001) Табличка из руководства,но прочитайте инфу ниже!
- •Электрокардиостимуляция спасибо методе олесина за инфу!
- •I класс (абсолютные показания).
- •II класс (относительные показания).
- •III класс (кардиостимуляция не показана).
- •Кодирование имплантируемых систем электрического воздействия на ритм сердца (электрокардиостимуляторы, кардиовертеры)
- •28. Гемолитические анемии – понятие, этиопатогенез. Классификация. Клиническая картина при гемолитических анемиях (наследственных и приобретенных). Критерии диагностики гемолитических анемий.
- •Наследственные:
- •3.Дефекты структуры гемоглобина.
- •2 Типа кризов у больных с ска:
- •Приобретенные:
- •29. Дифференциальный диагноз при гемолитических анемиях. Лечение гемолитических анемий. Профилактика и прогноз.
- •30. Апластические анемии и парциальные аплазии – определение, этиология и патогенез. Критерии диагностики. Клиническая картина при апластических анемиях. Лечение больных с апластическими анемиями.
- •31. Дифференциальный диагноз при анемиях.
- •32. Агранулоцитоз-определение, этиология, патогенез. Особенности клинической картины. Критерии диагностики агранулоцитоза. Врачебная тактика при агранулоцитозе. Профилактика и прогноз.
- •34.Принципы терапии лимфогранулематоза и других лимфом.
- •35.Критерии диагностики лимфом. Лечение ходжкинской и неходжскинских лимфом. Профилактика и прогноз.
- •37. Хронический миелолейкоз, идиопатический миелофиброз, полицитемия.
- •1. Хронический миелолейкоз (хмл)
- •2. Идиопатический миелофиброз
- •3. Истинная полицитемия (болезнь Вакёза)
- •38. Хронический лимфолейкоз. Лимфопролиферативные заболевания.
- •39. См. 69 вопрос
- •40. Нефротический синдром – определение, этиология, патогенетические механизмы, клинические проявления.
- •41. Критерии диагностики. Врачебная тактика. Прогноз.
- •44. Понятие о хронической болезни почек (хбп), классификации хбп, врачебная тактика.
- •45. Основные заболевания пищевода.
- •Ахалазия кардии-
- •Дискинезии пищевода
- •Дивертикулы пищевода
- •Рак пищевода
- •Грыжи пищеводного отверстия диафрагмы (хиатальные грыжи)
- •1. Болевой абдоминальный синдром.
- •49.Заболевания толстого и тонкого кишечника Критерии диагностики хронических энтеритов и колитов
- •I. Этиопатогенез
- •II. Патоморфология
- •III. Классификация
- •IV. Клиническая картина
- •V. Диагностика
- •2) Жалобы
- •7) Инструментальная диагностика
- •VI. Лечение
- •2) Консервативное лечение
- •3) Хирургическое лечение
- •VII. Профилактика
- •VIII. Прогноз
- •I. Этиология и патогенез
- •II. Патоморфология
- •III. Классификация
- •IV. Клиника
- •V. Диагностика
- •2) Инструментальная диагностика:
- •VI. Лечение
- •2) Консервативная терапия
- •3) Хирургическое лечение
- •VII. Профилактика
- •VIII. Прогноз
- •Дифференциальная диагностика желтух.
- •I. Обмен билирубина
- •II. Этиология желтух
- •III. Классификация желтух
- •1) Гемолитические (надпеченочные) желтухи:
- •2) Паренхиматозные (печеночные) желтухи:
- •3) Конституциональные желтухи:
- •4) Механические (подпеченочные) желтухи:
- •IV. Надпеченочная (гемолитическая) желтуха
- •V. Печеночная (паренхиматозная) желтуха
- •VI. Внутрипеченочный холестаз
- •VII. Подпеченочная (механическая) желтуха
- •I. Функциональные расстройства билиарного тракта
- •III. Хронический холецистит
- •54.Хронический гепатит – определение, этиология, патогенез. Классификация. Клиническая картина. Критерии диагностики (лабораторные и инструментальные). Лечение. Профилактика и прогноз.
- •I. Этиология
- •II. Патогенез
- •1. Гепатиты
- •III. Классификация
- •1. По этиологии и патогенезу:
- •2. По клинико-биохимическим и гистологическим критериям
- •IV. Клиническая картина
- •1. Портальная гипертензия:
- •2. Хроническая печеночная недостаточность:
- •V. Диагностика
- •VI. Лечение
- •Понятие о системных заболеваниях соединительной ткани. Механизмы развития. Классификация. Основные клинические проявления. Принципы диагностики. Принципы лечения.
- •Системная красная волчанка – определение, этиология, патогенез. Клиническая картина. Критерии диагностики (лабораторные и инструментальные). Лечение. Профилактика и прогноз.
- •I. Этиология
- •1. Генетические факторы:
- •2. Факторы окружающей среды
- •II. Патогенез
- •III. Классификация
- •IV. Клиника
- •2. Поражение кожи
- •3. Поражение ногтей и волос
- •4. Поражение слизистых оболочек
- •5. Поражение опорно-двигательного аппарата
- •6. Поражение сердечно-сосудистой системы
- •8. Поражение органов пищеварения
- •10. Поражение нервной системы:
- •VI. Лечение
- •1. Немедикаментозное лечение:
- •2. Медикаментозное лечение
- •3. Экстракорпоральные методы лечения
- •4. Хирургическое лечение
- •VII. Профилактика и прогноз
- •I. Этиология
- •1. Генетические факторы:
- •2. Другие экзогенные и эндогенные факторы:
- •II. Патогенез
- •4. Внесуставные (системные) признаки:
- •5. Инструментальная характеристика
- •7. Функциональный класс (фк):
- •8. Осложнения:
- •IV. Клиника
- •V. Диагностика
- •VI. Лечение
- •1. Немедикаментозное лечение:
- •2. Медикаментозное лечение
- •3. Хирургическое лечение
- •VI. Прогноз и профилактика
- •Подагра – определение, этиопатогенез. Клиническая картина. Критерии диагностики. Лечение подагры. Профилактика и прогноз.
- •I. Этиология
- •II. Патогенез
- •III. Классификация
- •IV. Клиника
- •V. Диагностика
- •VI. Лечение
- •1. Немедикаментозное лечение:
- •2. Медикаментозное лечение
- •VII. Профилактика и прогноз
- •Остеоартроз – определение, этиопатогенез. Клиническая картина. Критерии диагностики.
- •I. Этиология
- •II. Патогенез
- •III. Классификация
- •IV. Клиническая картина
- •V. Диагностика
- •VI. Лечение
- •1. Немедикаментозное лечение
- •2. Медикаментозное лечение
- •3. Хирургическое лечение
- •VI. Прогноз
- •60.Дифференциальный диагноз поражения суставов при подагре, остеоартрозе и ревматоидном артрите
- •61.Системные васкулиты – определение. Классификация. Общие признаки системных васкулитов. Методы исследования.
- •I. Классификация:
- •II. Общие признаки
- •III. Диагностика
- •62.Узелковый полиартериит. Этиология и патогенез. Клиническая картина. Основные клинические синдромы. Лабораторные изменения. Клинические варианты. Дифференциальный диагноз. Лечение. Профилактика.
- •I. Этиопатогенез
- •II. Клиническая картина
- •III. Диагностика
- •IV. Лечение
- •V. Дифференциальный диагноз
- •63.Эритроцитоз – понятие, причины первичных и вторичных эритроцитозов. Диагностика. Врачебная тактика.
- •2. В соответствии с патогенетическими механизмами:
- •64.Эритремия – определение. Этиопатогенез. Клиника, диагностика, лечение.
- •I. Этиопатогенез
- •II. Клиника
- •III. Диагностика
- •IV. Лечение
- •65.Хобл: этиология, патогенез, классификация, клинические проявления, течение, осложнения и исходы. Лечение. Профилактика.
- •I. Этиология
- •II. Патогенез
- •1. Воспаление дыхательных путей:
- •2. Классификация хобл по gold
- •IV. Клиника
- •V. Диагностика
- •1. Анамнез
- •2. Физикальное обследование:
- •3. Спирометрия с бронхолитической пробой
- •4. Лабораторные методы
- •VI. Лечение
- •1. Терапия хобл стабильного течения
- •2. Обострение
- •II. Патогенез
- •III. Классификация
- •IV. Клиника
- •V. Диагностика
- •VI. Лечение
- •1. Лечение стабильной ба
- •2. Обострение
- •VII. Дифференциальный диагноз при бронхообструктивном синдроме
- •67. Пневмонии: классификация, этиология, патогенез, клинические проявления. Осложнения. Критерии диагностики. Принципы лечения.
- •I. Классификация
- •II. Этиология
- •III. Патогенез
- •IV. Клиника
- •V. Диагностика
- •1. Физикальное обследование:
- •2.Лабораторные данные:
- •VI. Лечение
- •1. Антибактериальная терапия
- •VII. Осложнения
- •68.Интерстициальные и диссеминированные заболевания легких.
- •Инструментальные исследования:
- •Патогенез: три процесса (интерстициальный отёк, интерстициальное воспаление (альвеолит) и интерстициальный фиброз). Выделяют острую и хроническую стадии заболевания:
- •Лабораторные исследования: в острую фазу лейкоцитоз до 20×109/л, повышение соэ, повышение содержания эозинофилов. Инструментальные исследования:
- •4. Пневмокониозы
- •II. Саркоидоз
- •III. Васкулиты
- •IV. Редкие заболевания
- •69.Дифференциальный диагноз при синдроме округлых образованиях в легочной ткани.
- •70.Плевральный выпот: этиология, патогенез, классификация, клинические проявления. Характеристика экссудата и транссудата. Диагностика, дифференциальный диагноз. Лечение.
- •I. Классификация
- •II. Клиника
- •III. Диагностика
- •IV. Лечение
- •71.Острое и хроническое легочное сердце: этиология, патогенез. Клинические проявления острого и хронического легочного сердца, диагностика, течение и лечение.
- •I. Острое легочное сердце
- •II. Хроническое легочное сердце
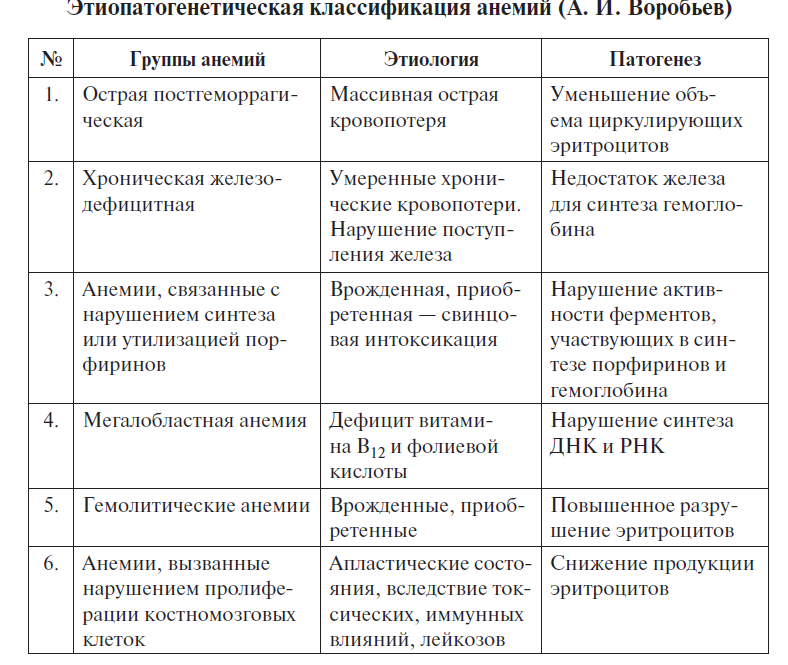
31. Дифференциальный диагноз при анемиях.
Диф диагноз по лабораторным показателям:

Ниже смотрите схему диф.диагноза
Анемия — состояние, характеризующееся уменьшением количества эритроцитов и (или) снижением содержания гемоглобина в единице объема крови. В соответствии с критериями, принятыми
ВОЗ, диагноз анемии устанавливается при снижении гемоглобина до 110 г/л и ниже.
По цветовому показателю:
1. Гипохромные (железодефицитные).
2. Гиперхромные (В12 и фолиеводефицитные).
3. Нормохромные (при хронических воспалительных заболеваниях и др.).
По уровню регенерации (уровень ретикулоцитов):
1. Гипорегенераторные.
2. Норморегенераторные.
3. Гиперрегенераторные.
По степени тяжести, в зависимости от уровня гемоглобина (Hb):
– легкая — Hb > 90 г/л;
– средняя — Hb 70–90 г/л;
– тяжелая — Hb < 70 г/л.
Диагностика
Для диагностики анемии необходимо:
– клинический развернутый анализ крови
– размеры эритроцитов (макроцитоз, микроцитоз, анизоцитоз), форма эритроцитов (возможен пойкилоцитоз, акантоцитоз, сфероцитоз и др.);
– определение в сыворотке крови железа, ферритина, железосвязывающей способности сыворотки крови, витамина В12, фолиевой кислоты;
– стернальная пункция с оценкой миелограммы;
– трепанбиопсия с гистологическим анализом костного мозга.
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ
Железодефицитная анемия — клинико-гематологический синдром, характеризующийся нарушением синтеза гемоглобина из-за развивающегося вследствие различных патологических (физиологических) процессов дефицита железа и проявляющийся симптомами анемии и сидеропении.
Основные этапы метаболизма железа:
• всасывание железа в гемовой и негемовой формах, поступающего с пищей;
• реутилизация железа из разрушенных эритроцитов;
• транспорт железа в составе трансферрина;
• поступление железа в клетки тканей и органов;
• сохранение запасов железа в виде ферритина и гемосидерина.
Основные регуляторы метаболизма железа:
• гепсидин — блокирует выход железа из клеток (энтероцитов, макрофагов и др.); избыток железа стимулирует синтез гепсидина, недостаток железа его подавляет;
• ферритин — определяет объем запасов железа;
• степень насыщения трансферрина железом.
Этиология ЖДА
Основным механизмом ЖДА является несоответствие между поступлением и расходами железа. Выделяют следующие причины ЖДА:
1. Острые и хронические кровопотери.
2. Повышенная потребность в железе: беременность, расходы в период лактации, донорство и др.
3. Нарушенное всасывание: гастрэктомия, обширные резекции тонкой кишки, различные энтеропатии.
4. Железодефицитные анемии вторичные, развивающиеся при инфекционных, воспалительных или опухолевых болезнях. Анемии в этих случаях развиваются в результате больших потерь железа при гибели клеток опухолей, распаде тканей, микро- и макрогеморрагий, повышения потребности в железе в очагах воспаления, гиперпродукции гепсидина.
5. Ювенильная железодефицитная анемия — анемия, развивающаяся у молодых девушек (и чрезвычайно редко у юношей). Данная форма железодефицитного малокровия связана с генетическими или фенотипическими дисгормональными явлениями.
6. Алиментарные причины.
Клиническая картина ЖДА
Выделяют два этапа в развитии ЖДА: латентный (снижение запасов железа при сохранении тканевого фонда и железа гемоглобина) и период клинических проявлений (обусловлен дефицитом тканевого и гемоглобинового фондов).
Латентный дефицит железа определяется по снижению уровня сывороточного железа и ферритина, уменьшению насыщения трансферрина железом, нормальному уровню гемоглобина и эритроцитов. Клинические проявления анемии в этот период отсутствуют.
Клинические проявления железодефицитной анемии обусловлены, с одной стороны, наличием анемического синдрома, а с другой — дефицитом железа, к которому чувствительны различные органы и ткани (сидеропения).
Сидеропенический синдром. Отмечаются сухость кожи, нарушение целостности эпидермиса. В углах рта появляются изъязвления, трещины с воспалительным валом, ломкость и слоистость ногтей, появление поперечной исчерченности, ложкообразных ногтей (койлонихий). Волосы выпадают и секутся. Некоторые больные отмечают чувство жжения языка. Возможны извращения вкуса в виде неуемного желания есть мел, зубную пасту, пепел и т. д., а также пристрастие к некоторым запахам (ацетон, бензин, лаки, краски).
Одним из признаков сидеропении является затруднение глотания сухой и твердой пищи — синдром Пламмера–Винсона. У девочек, реже у взрослых женщин, возможны дизурические расстройства, иногда недержание мочи при кашле, смехе, возникающие из-за слабости мышечных сфинктеров, мышечная слабость, связанная не только с анемией, но и с дефицитом железосодержащих ферментов.
Анемический синдром проявляется хорошо известными и неспецифическими симптомами. Основные жалобы больных сводятся к слабости, повышенной утомляемости, головокружению, шуму в ушах, мельканию мушек перед глазами, сердцебиению, одышке при физической нагрузке
Объективно: бледные с зеленоватым оттенком (старое название хлороз). Синева склер,субфебрилитет. Cor тоны приглушены, тахикардия,систолический шум на верхушке
Диагностика ЖДА
1. Гипохромная микроцитарная, анизоцитоз и пойкилоцитоз, норморегенераторная.
2.Содержание железа в сыворотке крови снижено, часто значительно. Нормальные показатели содержания сывороточного железа составляют 13–30 мкмоль/л у мужчин и 12–
25 мкмоль/л у женщин.
3. исследование общей железосвязывающей способности сыворотки (ОЖСС),
В норме ОЖСС составляет 30– 85 мкмоль/л. У больных железодефицитной анемией отмечаются повышение
ОЖСС, снижение степени насыщения трансферрина.
4. снижение ферретина. Содержание ферритина в норме составляет в среднем 15–150 мкг/л.
Диагностика причины ЖДА основывается на тщательном сборе анамнеза
(признаки кровотечений из различных отделов ЖКТ, гинекологический анамнез и др.), проведение эндоскопических обследований (ФГДС, ректосигмоидоскопия, фиброколоноскопия), гинекологическое обследование, анализ мочи (гематурия).
Существует группа гипохромных анемий, при которых содержание железа в организме и его запасы в депо находятся в пределах нормы или даже повышены, однако в связи с нарушением включения его в молекулу гемоглобина железо не используется для синтеза гема. Такие анемии обозначаются как сидероахрестические (ахрезия — неиспользование). Выделяют следующие формы:
– наследственные (аутосомные и рецессивные, чувствительные и рефрактерные к применению пиридоксина);
– связанные с дефицитом фермента гемсинтетазы, обеспечивающего включение железа в молекулу гема;
– приобретенные формы (алкогольная интоксикация, хроническая свинцовая интоксикация, воздействие некоторых медикаментов, миелопролиферативные заболевания, кожная порфирия, идиопатические формы).
Важное диагностическое значение при сидероахрестических анемиях имеет исследование порфиринового обмена. Эти исследования должны проводиться в специализированных лабораториях у больных с неясными гипохромными анемиями при отсутствии эффекта от препаратов железа.
Лечение
Существуют три этапа в лечении ЖДА.
Первый этап — купирующая терапия, восполняющая уровень гемоглобина.
Второй этап — терапия, восстанавливающая тканевые запасы (обычно в течение нескольких месяцев) до нормализации ферритина.
Третий этап — противорецидивное лечение.
При проведении купирующей терапии используется пероральное или парентеральное введение железа.
В подавляющем большинстве случаев препараты железа следует назначать внутрь. В качестве пероральной терапии используются препараты солей железа и железосодержащие комплексы.
Препаратами солей железа являются: сорбифер дурулес, тардиферон, фенюльс, ферроградумет и др.
К железосодержащим комплексам относятся мальтофер, феррум-лек.
Для парентерального введения применяются: венофер, феринжект.
Оценка эффективности назначенного препарата основывается на величине и темпах прироста гемоглобина каждую неделю.
В течение двух-трех месяцев после нормализации показателей клинического анализа крови проводится терапия для восстановления запасов железа с последующим контролем уровня ферритина.
МЕГАЛОБЛАСТНЫЕ АНЕМИИ (В12- И ФОЛИЕВОДЕФИЦИТНЫЕ)
Мегалобластные анемии — группа заболеваний, характеризующихся ослаблением синтеза ДНК, в результате чего нарушается деление всех быстропролиферирующих клеток (гемопоэтических, клеток кожи, ЖКТ, слизистых оболочек).
Основной причиной мегалобластной анемии является дефицит цианкобаламина и/или фолиевой кислоты. И цианокобаламин, и фолиевая кислота принимают участие в синтезе ДНК клеток. При их недостатке нарушается гемопоэз, формируется мегалобластический тип кроветворения.
В12-дефицитная анемия
Витамин В12-дефицитная анемия характеризуется появлением в костном мозге мегалобластов, внутрикостномозговым разрушением эритрокариоцитов, гиперхромией, тромбоцитопенией и нейтропенией, атрофическими изменениями слизистой оболочки желудочно-кишечного тракта, изменениями нервной системы в виде фуникулярного миелоза.
Чаще этой анемией болеют лица старше 40–50 лет.
Метаболизм витамина В12. Цианкобаламин содержится в пищевых продуктах животного происхождения: печени, почках, яйцах, молоке. Запасы его в организме взрослого человека (главным образом в печени) велики — около 5 мг, и если учесть, что суточная потеря витамина составляет 5 мкг, то полное истощение наступает только через несколько лет после нарушений поступления и усвоения витамина.
После поступления с пищей цианкобаламин в желудке связывается с белками, так называемыми R-факторами, присутствующими в слюне и желудочном соке. Эти комплексы предохраняют цианкобаламин от разрушения при транспорте по ЖКТ. Комплекс R-фактор–В12 транспортируется в тонкую кишку.
Туда же поступает внутренний фактор — гликопротеин, продуцируемый париетальными клетками желудка. В тонкой кишке при щелочном значении рН под влиянием протеиназ панкреатического сока цианкобаламин отщепляется от R-протеинов и соединяется с внутренним фактором. В подвздошной кишке комплекс внутреннего фактора с цианкобаламином связывается со специфическими рецепторами на поверхности эпителиальных клеток. Освобождение цианкобаламина из клеток кишечного эпителия и транспорт к тканям происходят с помощью особых белков плазмы крови — транскобаламинов 1, 2, 3, причем транспорт цианкобаламина к гемопоэтическим клеткам осуществляется преимущественно транскобаламином 2.
Этиология В12-дефицитной анемии
1. Нарушение поступления цианкобаламина с пищей (нередко у вегетарианцев).
2. Нарушения всасывания, обусловленные:
– патологией желудка — атрофический гастрит, резекция желудка, опухоли, токсическое воздействие на слизистую;
– патологией кишечника — энтерит, резекция кишки, опухоли;
– заболеваниями поджелудочной железы.
3. Конкурентное поглощение витамина В12:
– инвазия широким лентецом;
– дивертикулез кишки, синдром слепой кишки (повышенная утилизация витамина В12 бактериями при их избыточном росте).
Патогенез В12-дефицитной анемии
Существуют два кофермента цианкобаламина: метилкобаламин и дезоксиаденозилкобаламин. Метилкобаламин участвует в реакции образования активной формы фолиевой кислоты, которая в свою очередь способствует включению тимидина в ДНК. Недостаток ->нарушениt синтеза ДНК и деления клеток. Клетки растут, а поделиться не могут, в результате чего образуются крупные клетки эритроидного ростка — мегалобласты. В костном мозге происходит накопление полисегментированных нейтрофилов, крупных мегакариоцитов (предшественников тромбоцитов), возникает их раннее внутрикостномозговое разрушение и укорочение жизни в периферической крови. В результате гемопоэз оказывается неэффективным, развивается анемия, сочетающаяся с тромбоцитопенией и лейкопенией.
Кроме того, цианкобаламин (его кофермент дезоксиаденозилкобаламин) участвует в превращении метилмалонил-КоА в сукцинил-КоА. Эта реакция необходима для метаболизма миелина в нервной системе, в связи с чем при дефиците цианкобаламина наряду с мегалобластной анемией отмечается поражение нервной системы (фуникулярный миелоз).
Клиническая картина В12-дефицитной анемии
Анемия развивается относительно медленно и может быть малосимптомной.
Для В12-дефицитной анемии характерна триада:
– анемия;
– поражение ЖКТ;
– поражение нервной системы (фуникулярный миелоз).
Клинические признаки анемии неспецифичны: слабость, быстрая утомляемость, одышка, головокружение, сердцебиение. В результате внутрикостного разрушения патологических клеток возможно повышение непрямого билирубина и желтушное окрашивание кожи, умеренное увеличение печени и селезенки, иногда лихорадка. Больные бледны, субиктеричны.
Поражение желудочно-кишечного тракта проявляется развитием глоссита (описан Гунтером), когда слизистая языка розовая, сосочки сглажены, язык полированный, сопровождается болями, жжением, пощипыванием. Атрофический гастрит может быть не только причиной, но и следствием болезни. Возникает отрыжка, чувство тяжести в эпигастральной области.
Фуникулярный миелоз. Отмечаются дистальные парестезии, периферическая полиневропатия, расстройства чувствительности, повышение сухожильных рефлексов. Симптоматика чаще бывает со стороны нижних конечностей: мышечная слабость, ползанье мурашек, «ватные» ноги, шаткость и не уверенность походки (потеря проприоцептивной чувствительности). Поражение чаще симметричное. Верхние конечности поражаются редко. Нарушаются обоняние, слух и функции тазовых органов, появляются психические изменения.
Диагностика В12-дефицитной анемии
1. Клинический анализ крови:
– снижение количества эритроцитов;
– снижение гемоглобина;
– повышение цветового показателя (выше 1,05);
– макроцитоз (эритроциты диаметром боле 8 мкм);
– повышение MCV, MCH, MCHC;
– базофильная пунктация эритроцитов, наличие в периферической крови телец Жолли и колец Кебота (остатки ядер эритроцитов);
– снижение ретикулоцитов;
– лейкопения;
– тромбоцитопения;
– снижение моноцитов;
– гиперсегментация ядер нейтрофилов;
– пойкилоцитоз, анизоцитоз.
2. Уровень билирубина в сыворотке повышен за счет непрямой фракции.
3. Снижение уровня витамина В12 в крови.
4. Обязательна пункция костного мозга, так как такая панцитопения на периферии может быть при лейкозе, апластических и гипопластических состояниях.
Костный мозг — клеточный, число ядросодержащих эритроидных элементов увеличено в 2–3 раза против нормы, однако эритропоэз неэффективный, о чем свидетельствует снижение числа ретикулоцитов и эритроцитов на периферии и укорочение их продолжительности жизни (в норме эритроцит живет 120–140 дней). Находят типичные мегалобласты — главный критерий постановки диагноза В12-дефицитной анемии. Это большие клетки с «ядерно-цитоплазматической диссоциацией» (при зрелой гемоглобинизированной цитоплазме нежное ядро имеет сетчатое строение с нуклеолами); также обнаруживаются клетки гранулоцитарного ряда большого размера и гигантские мегакариоциты.
Лечение В12-дефицитной анемии
Диета: ограничение жиров, так как они тормозят кроветворение в костном мозге. Повышение содержания белков в пище, а также витаминов и минеральных веществ.
Витамин В12 в виде цианкобаламина и оксикобаламина. Эти препараты отличаются по усвояемости. Цианкобаламин усваивается быстро. Оксикобаламин —более медленно.
Этапы терапии:
1) насыщение витамином В12;
2) поддерживающая терапия;
3) профилактическое лечение.
Чаще используют цианкобаламин в дозе 500 мкг в сутки. Данная доза применяется, если нет осложнений (фуникулярный миелоз, анемическая кома). При наличии осложнений — 1000 мкг. Инъекции продолжаются около 10 дней. Затем, в течение 1 мес еженедельно вводят 500 мкг. После этого делается 1 инъекция ежемесячно. При невозможности устранения причины анемии введение витамина В12 проводится пожизненно.
Критерии оценки эффективности терапии:
– выраженный ретикулоцитоз (ретикулоцитарный криз) после 5–6 инъекций; если его нет, то имеется ошибка диагностики;
– полное восстановление показателей крови происходит через 1,5–2 мес, а ликвидация неврологических нарушений в течение полугода.
Фолиеводефицитная анемия (ФДА)
Фолиеводефицитная анемия (ФДА) — заболевание, обусловленное истощением запасов фолиевой кислоты в организме, что приводит к нарушению синтеза
ДНК в клетках и проявляется развитием гиперхромной (макроцитарной) анемии.
Этиология ФДА
1. Недостаточное содержание фолиевой кислоты в пищевом рационе (основные источники ее — печень и зелень).
2. Хроническая алкогольная интоксикация.
3. Повышенная потребность в фолиевой кислоте (во время беременности, при злокачественных опухолях, гемолизе, некоторых дерматитах).
4. Нарушения всасывания при целиакии, под действием лекарственных средств (метотрексат, триамтерен, противосудорожные средства, барбитураты, метморфин и др.).
5. Повышенное выведение фолиевой кислоты из организма (при заболеваниях печени, гемодиализе).
Патогенез ФДА
При дефиците фолиевой кислоты нарушается включение тимидина в ДНК, происходит блокирование синтеза ДНК и нарушение клеточного деления.
В костном мозге задерживается размножение и созревание эритроцитов, укорачивается продолжительность их жизни.
Клинические проявления ФДА неспецифичны. Больных беспокоят утомляемость, сердцебиение, головокружение, слабость (анемический синдром). В отличие от В12-дефицитной анемии нет поражения ЖКТ и неврологических нарушений.
Диагностика ФДА основывается на выявлении гиперхромной макроцитарной анемии, снижении содержания фолиевой кислоты в сыворотке крови.
Лечение осуществляется препаратами фолиевой кислоты в дозе 5–10 мг/сут.
Профилактика ФДА анемии должна проводиться у беременных женщин, имеющих риск развития этого дефицита

