
Презентации / ФХОТ Все Презентации
.pdf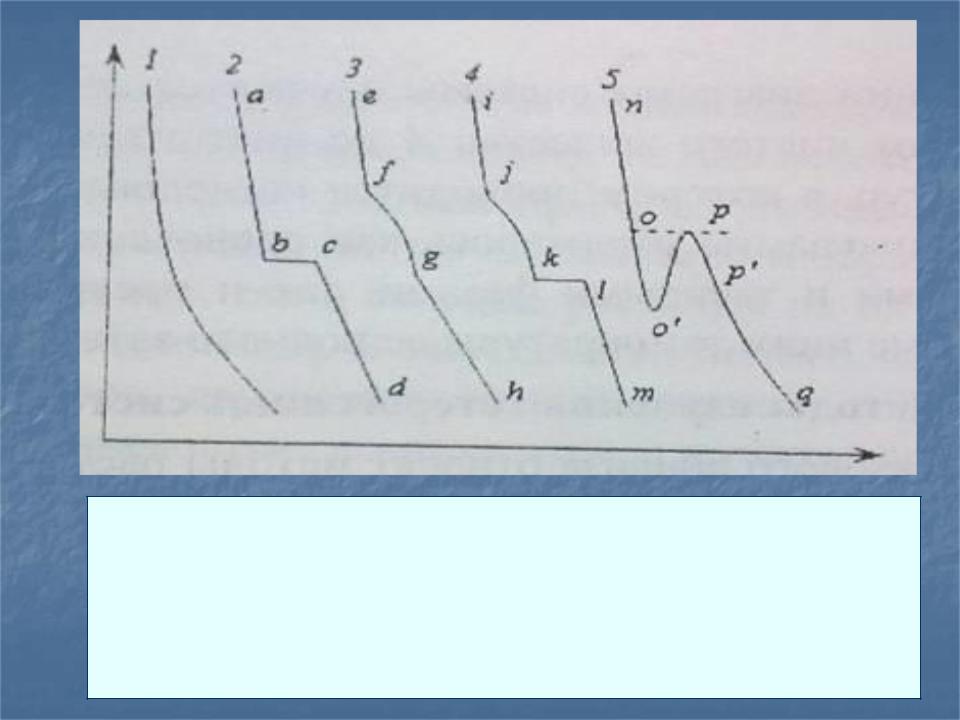
Кривые охлаждения:
1 - при отсутствии фазовых превращений; 2 - кристаллизация при постоянной температуре; 3,4-
кристаллизация в температурном интервале; 5 - кристаллизация с переохлаждением

3. УПРАВЛЕНИЕ ХИМИЧЕСКИМИ ПРЕВРАЩЕНИЯМИ ВЕЩЕСТВ
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции).
Химические реакции происходят при смешении или физическом контакте реагентов как самопроизвольно так и под воздействием внешних факторов
|
|
участие |
|
действие света |
|
действие |
|
нагрев |
|||||||
|
катализаторов |
|
(фотохимические |
|
электрического |
||
|
|
|
|
||||
|
|
(катализ) |
|
реакции) |
|
тока |
|
|
|
|
|
|
|
|
|
|
действие ионизирующих |
механического воздействие |
|
|
|
|
|
(механохимические реакции) |
|
излучений (радиационно- |
|
|
|
|
|
химические реакции) |
|
|
|
|
|
|

Фазовый состав реагирующей системы
Гомогенные реакции.
Реакционная смесь является гомогенна, а реагенты и продукты принадлежат
одной и той же фазе.
NaOH(раств.) + HCl(раств.) → NaCl(раств.) + H2O(жид.)
Гетерогенные реакции.
Реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии.
Реакционный процесс протекает на границе раздела фаз. СаCO3(тв.) + 2HCl(раств.) →СаCl2(тв.) + CO2(газ) + H2O(жид.)
Изменение степени окисления реагентов
Окислительно-восстановительные реакции, в которых атомы одного элемента
(окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления.
2H2 + O2 = 2H2O
Не окислительно-восстановительные реакции — реакции, в которых не
происходит изменения степеней окисления атомов, например, реакция
нейтрализации:
NaOH(раств.) + HCl(раств.) → NaCl(раств.) + H2O(жид.)

Тепловой эффект реакции
экзотермические реакции, которые идут с выделением тепла, (положительный тепловой эффект) например, горение водорода ΔH < 0
эндотермические реакции в ходе которых тепло поглощается (отрицательный тепловой эффект) из окружающей среды ΔH > 0
Тип превращения реагирующих частиц
соединения: 2Cu + O2 → 2CuO
разложения: 2HgO → 2Hg + O2
замещения: Fe + CuSO4 → FeSO4 + Cu
обмена (тип реакции - нейтрализация): NaOH + HCl → NaCl + H2O

3.1 Закон действия масс и константы хим. равновесия
нАн |
|
к Ак , |
|
||
н |
|
к |
|
|
|
условие равновесия реакции:
н н к к
н к
Установим соотношение между равновесными концентрациями (парциальными давлениями) веществ, участвующих в химической реакции
Гомогенные химические реакции (газофазные)
|
|
|
|
н н |
|
к к |
0 |
(T) RT ln pi |
|
||||
i i |
|
|
|
|||
|
|
|
н |
|
к |
|
|
|
1 |
|
|
|
|
|
|
к ln pк н ln pн |
к к0 |
(Т ) н н0 |
(Т ) |
f (T ) |
||||
|
||||||||
к |
н |
RT |
к |
н |
|
|
||

|
|
1 |
|
|
|
|
|
|
к ln pк н ln pн |
к к0 |
(Т ) н н0 |
(Т ) |
f (T ) |
||||
|
||||||||
к |
н |
RT |
к |
н |
|
|
||
Заменим сумму логарифмов логарифмом произведения и введём новую функцию Кр(Т)
Kp(T ) = exp f (T )
константа химического взаимодействия
|
|
|
|
|
|
pк к |
|
|
|
|
к |
K p (T ) |
|
|
|
|
закон действия масс |
||
|
pн н |
|
||
|
|
|
|
|
|
н |
|
|
|

|
2СО2 |
2СО + О2 |
|
|
|
p 2 |
|
|
|
|
2 CO O2 |
2 CO2 |
и |
CO2 |
K p (T ) |
|||
p 2 |
p |
O2 |
|||||
|
|
|
|
||||
|
|
|
CO |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cк к |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
рi = ci RT |
|
|
к |
Kc (T ) |
|
|
|
|
|||||
|
|
|
cн н |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
г |
|
кг |
|
|
нг |
||
Kc (T ) K p (T )(RT ) |
г |
|
где |
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
к |
|
|
|
н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆νг - изменение числа молей в газовой фазе, происходящее при одном пробеге реакции слева направо
представим парциальное давление в виде: рi = xiP
|
|
|
|
|
|
|
|
|
|
|
pк к |
|
|
|
xк к |
|
|
|
|
|
|
|
|
|
где |
K x (T ) K p (T )P |
г |
||
|
к |
K p (T ) |
|
|
к |
K x (T ) |
|||
|
pн н |
|
|
xн н |
|
|
|||
|
|
|
|
|
|
|
|
||
|
н |
|
|
|
н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Гетерогенные химические реакции
Рассмотрим реакцию между конденсированной смешанной фазой, содержащей твердые и жидкие растворы и газовой фазой, которую считаем идеальной
|
ai = i xi |
|
|
|
|
|
|
|
|
( нг Анг нк Анк ) |
|
( кг Акг кк Акк ) |
||
н |
|
|
к |
|
|
|
|
|
|
|
|
г |
к |
|
|
|
|
|
|
|
|
|
|
|
к |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
pк |
к |
aк |
к |
|
|
|
Для чистых |
|
|
pк |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
к |
|
|
|
|
|
|
конденсированных |
|
|
к |
|
|
|||||
|
|
|
|
|
K pa (T ) |
|
|
|
фаз |
|
|
|
|
|
K p (T ) |
|||
|
|
p нг a нк |
|
|
|
|
|
|
|
|
p н |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
н |
|
н |
|
|
|
|
a |
= |
= x |
= 1 |
|
|
|
н |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
н |
|
|
|
|
|
|
|
i |
i |
i |
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||

