
Лабы КОЭ / ФОТОЛЮМИНЕСЦЕНЦИЯ
.pdfФОТОЛЮМИНЕСЦЕНЦИЯ ПОЛУПРОВОДНИКОВЫХ ТВЁРДЫХ РАСТВОРОВ
Целью работы является исследование фотолюминесценции и определе-
ние компонентного состава материалов на основе полупроводниковых твер-
дых растворов.
2.1 Понятие фотолюминесценции
Люминесценция – это излучение, избыточное над тепловым при данной температуре и обладающее длительностью, значительно превышающей пе-
риод световых колебаний. Люминесценция возникает вследствие квантовых переходов из верхнего возбужденного энергетического состояния в нижнее с испусканием электромагнитного излучения, т. е. определяется процессами, об-
ратными поглощению света. Для наблюдения люминесценции вещество прин-
ципиально необходимо вывести из состояния термодинамического равнове-
сия, т. е. возбудить.
Для большинства твердых тел люминесцентные свойства выражены очень слабо. Легирование вещества специальными примесями с целью повы-
шения эффективности люминесценции называется активацией, а сами при-
меси активаторами люминесценции. Активированные диэлектрики, обладаю-
щие высокой эффективностью люминесценции в видимой области спектра,
называются кристаллофосфорами или люминофорами. Элементарными про-
цессами, обусловливающими люминесценцию в таких веществах, обычно яв-
ляются внутрицентровые оптические переходы, т. е. электронные переходы между энергетическими уровнями, принадлежащими иону (или атому) акти-
ватора. Такую люминесценцию иногда называют мономолекулярной. Люмино-
форы активно используются в лампах и светодиодах с переизлучением, в
первую очередь в белых светодиодах.
Существует несколько видов люминесценции в зависимости от способа возбуждения (фотолюминесценция, катодолюминесценция и др.) В большин-
стве полупроводниковых излучателей используется электролюминесценция –
1
люминесценция, возбуждаемая внешним электрическим полем. Наиболее эф-
фективным методом электрического возбуждения является инжекция неос-
новных носителей заряда через р–n-переход при приложении к нему прямого напряжения U. Такая люминесценция называется инжекционной.
По способу возбуждения атома или молекулы выделяют следующие виды люминесценции:
1. Фотолюминесценция – возбуждение происходит в результате погло-
щения электромагнитной энергии (обычно видимого или ультрафиолетового диапазонов).
2. Катодолюминесценция – возбуждение производится электронным ударом по атому или молекуле вещества (наблюдается в кинескопах, элек-
тронно-лучевых трубках и т.п..).
3. Электролюминесценция – возбуждение атомов и молекул произво-
дится электрическим полем.
4. Рентгенолюминесценция – возбуждение производится рентгенов-
скими лучами.
5. Хемилюминесценция – возбуждение происходит в результате хими-
ческой реакции, по схеме: А + В → АВ* → АВ + hν (квант люминесценции). 6. Биолюминесценция - возбуждение молекул происходит в результате
биохимических реакций, происходящих в живом организме.
Существуют и другие разновидности люминесценции по способу воз-
буждения. Заметим, что благодаря люминесценции различные виды энергии преобразуются в электромагнитное излучение, часто видимого диапазона спектра и это широко используется на практике (экраны кинескопов, рентге-
нолюминесцентные экраны, электронно-оптические преобразователи и др.).
По длительности все случаи люминесценции делят на флуоресценцию – свечение вещества, прекращающееся практически одновременно с прекраще-
нием возбуждения, и фосфоресценцию – свечение, продолжающееся значи-
тельное время после прекращения возбуждения. Однако следует принять во внимание, что определения вышеуказанных процессов иногда связывают не с
2
длительностью, а с природой свечения. Тогда флуоресценция – это самостоя-
тельное свечение молекул, а фосфоресценция – рекомбинационное свечение кристаллов.
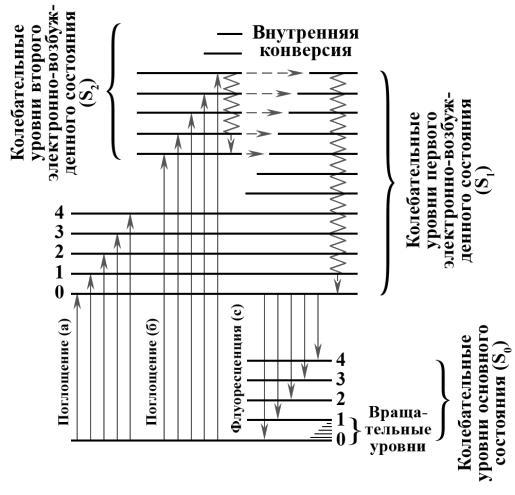
Возможные энергетические состояния молекулы можно представить в виде схемы энергетических уровней. На рисунке 2.1 изображена такая схема.
Каждый электронный уровень расщепляется на серию колебательных, а каж-
дый колебательный – на серию тесно расположенных вращательных уровней
(на рисунке 2.1 изображены вращательные уровни лишь у низшего колеба-
тельного уровня основного электронного состояния).
Рисунок 2.1 – Переходы, при которых возникают спектры поглощения и спектры испускания флуоресценции
При комнатной температуре большинство молекул находится на самом нижнем колебательном уровне основного электронного состояния (на рисунке
3
2.1 уровень 0 состояния S0). Переходы с поглощением света – это переходы с указанного уровня на вышележащие (на рисунке 2.1 обозначены буквами а и б). Вращательные уровни расположены столь близко друг к другу, что спек-
трально не различимы, потому, можно иметь в виду, что каждая линия коле-
бательного уровня – есть набор вращательных.
Флуоресценция происходит при переходе с уровня 0 состояния S1 на лю-
бой колебательно-вращательный уровень основного состояния. На рисунке 2.1
такие переходы обозначены буквой c. Такие переходы являются возвращени-
ями электрона в невозбуждённое состояние и сопровождаются быстрыми из-
лучениями фотонов. Эмиссионные характеристики флуоресценции приблизи-
тельно 108 с-1, типичное время жизни флуоресценции – 10 нс.
В отличие от флуоресцентного, фосфоресцентное вещество излучает по-
глощённую энергию не сразу. Большие времена свечения связывают с «запре-
щёнными» энергетическими переходами в веществе. Испускание поглощён-
ного излучения проходит с более низкой интенсивностью, и в течение дли-
тельного времени (до нескольких часов). Как было отмечено выше, фосфорес-
ценция связана с рекомбинационным свечением кристаллов. Такое свечение возникает при воссоединении двух частей центра свечения, которые были от-
делены друг от друга при возбуждении. Таким способом рекомбинируют элек-
трон и ион, образовавшиеся в результате ионизации, или две части диссоции-
рованной молекулы, разъединённые при возбуждении. Энергия, которая вы-
деляется при таком воссоединении, идёт на возбуждение частицы люмино-
фора, что приводит к высвечиванию возбуждённой частицы – молекулы или иона. Такое возбуждение может быть либо самостоятельным, либо вынужден-
ным; при этом любой из указанных типов высвечивания возникает в зависи-
мости от состояния, в котором частица оказалась в результате возбуждения: в
обычном или метастабильном. Характерная особенность рекомбинационного свечения состоит в том, что две частицы, полученные в результате возбужде-
ния, могут вернуться не друг к другу, а к другим частицам, образовавшимся в другом акте возбуждения.
4
Фотолюминесценция – это один из видов люминесценции. Различие за-
ключается лишь в виде возбуждения, из-за которого происходит процесс лю-
минесценции. В случае с фотолюминесценцией возбуждающим фактором яв-
ляется оптическое излучение (инфракрасный, видимый, ультрафиолетовый свет).
2.1.1 Применение фотолюминесценции
Люминесцентные методы включают в себя исследования с использова-
нием флуоресценции (флуориметрия) и фосфоресценции (фосфориметрия).
Наиболее широко люминесцентные измерения используются как методы ана-
лиза и контроля за протеканием химических и биохимических реакций, а
также для кинетических исследований быстрых реакций электронно-возбуж-
денных молекул.
Применение люминесценции для аналитических целей включает широ-
кую область использования ее для идентификации веществ, для обнаружения малых концентраций веществ, для контроля изменений, претерпеваемых ве-
ществом, для определения степени чистоты веществ. Широко применяются измерения люминесценции при изучении кинетики обычных химических ре-
акций. Высокая чувствительность метода позволяет фиксировать малую сте-
пень превращения веществ, а иногда по люминесценции промежуточных со-
единений становится возможным установить механизм химической реакции.
2.1.2 Полупроводниковые твёрдые растворы
Большое значение для оптической электроники и лазерной техники имеют материалы, свойства которых можно плавно изменять в заданных пре-
делах. К таким материалам относятся твёрдые растворы.
Твёрдые растворы – фазы переменного состава, в которых атомы раз-
личных элементов расположены в общей кристаллической решётке. Могут быть неупорядоченными (с хаотическим расположением атомов), частично или полностью упорядоченными. Экспериментально упорядоченность опре-
деляют, главным образом, рентгеновским структурным анализом. Способ-
ность образовывать твёрдые растворы свойственна всем кристаллическим
5
твёрдым телам. В большинстве случаев она ограничена узкими пределами концентраций, но известны системы с непрерывным рядом твёрдых растворов
(например, Cu-Au, Ti-Zr, GaAs-GaP).
Твёрдые растворы делятся на растворы замещения, внедрения и вычита-
ния. Идеальным твёрдым раствором замещения считается кристалл с идеаль-
ной решёткой, по соответствующим узлам которой статистически независимо распределены различные атомы составляющих твёрдый раствор компонен-
том. Непрерывный ряд твёрдых растворов замещения образуется, как правило,
между соединениями, постоянные решёток которого различаются не более чем на 7-8%. Чем меньше разница ∆a/a, тем ближе твёрдый раствор к идеаль-
ному. Как правило, используют изовалентные твёрдые растворы замещения, в
которых замещаемый и замещающий атомы находятся в одном столбце Пери-
одической таблицы элементов, а образующие твёрдый раствор компоненты принадлежат к одной группе соединений. Твёрдые растворы между различ-
ными группами материалов, например АIIIBV – AIIBVI, называются гетерова-
лентными. Период идентичности идеального твёрдого раствора замещения
AxB1-x образованного соединениями А и В, линейно изменяется от aA к aB (закон Вегарда): a 1−= А + (1 - ) В. Каждый из составляющих его атомов располагается в своём узле решётки. Поэтому в идеальном твёрдом растворе трансляционная симметрия в геометрии решётки сохраняется.
В системах, в которых принимают участие преимущественно металлы,
твёрдые растворы образуются лишь теми элементами, которые, во-первых,
имеют один и тот же тип кристаллической решётки, во-вторых, имеют близкие по размерам атомные радиусы (отличающиеся не более чем на 15 %) и, в-тре-
тьих, находятся не слишком далеко друг от друга в электрохимическом ряду напряжений. В твёрдых растворах на основе полупроводников и диэлектри-
ков, благодаря более «рыхлым» кристаллическим решёткам образование твёр-
дых растворов замещения возможно и при большем различии атомных радиу-
сов.
6
При более существенном различии компонентов по размерам или элек-
тронной структуре, возможно внедрение атомов одного элемента в междоуз-
лия решётки, образованной другим элементом. Подобные твёрдые растворы часто образуются при растворении неметаллов (B, H2, O2, N2, C) в металлах.
Для нестехиометрических соединений характерны твёрдые растворы вычита-
ния. Они возникают за счёт появления вакантных узлов в кристаллической ре-
шётке, которые образуются при растворении одного из компонентов в хими-
ческом соединении.
Возможность изменения состава полупроводниковых твёрдых раство-
ров привела к повсеместному их использованию. Изменение содержания од-
ного из компонентов в растворе позволяет плавно и довольно в широких пре-
делах регулировать основные параметры материала, такие как параметры ре-
шётки, ширину запрещённой зоны, показатель преломления, диэлектрическую проницаемость, теплопроводность и т. п. Эти параметры для элементарных полупроводников являются фиксированными. Это позволяет получать мате-
риал с точно заданным набором основных характеристик, что особенно важно при создании приборов оптоэлектроники, интегральной оптики, приборов на основе гетеропереходов и варизонных структур. Спрос на материалы с воз-
можностью влияния на указанные параметры привёл к повсеместному иссле-
дованию различных твёрдых растворов, их производству и применению.
2.1.3 Характеристики твёрдых растворов AIIIBV
Для оптоэлектроники большое значение имеют твёрдые растворы полу-
проводников группы AIIIBV. Такие растворы образуются при замещении как в анионной, так и в катионной подрешётках, либо в обеих одновременно. Для образования трёхкомпонентного твёрдого раствора замещение происходит только в одной из двух подрешёток. Из трёхкомпонентных растворов наиболее близки к идеальным системы типа GaAs-AlAs, поскольку разница между ко-
валентными радиусами атомов Al и Ga не превышает 0,5%, и они близки по электроотрицательности.
7
Параметры зонной структуры плавно изменяются с изменением состава твёрдого раствора. Так как валентная зона в полупроводниках AIIIBV имеет схожую структуру, то основные изменения в энергетическом спектре их твёр-
дых растворов определяются различием в структуре зон составляющих их компонентов. Основное значение имеют ширины различных энергетических зазоров Г, , . Характер их изменения зависит от состава твёрдого рас-
твора. В зависимости от значения того или иного минимума зоны проводимо-
сти, определяется минимальная ширина запрещенной зоны и делается вывод о характере зонной структуры. Зависимость их отклонения от линейности в данной точке зоны Бриллюэна может быть представлена квадратичной функ-
цией состава x в виде:
|
( ) = (0) + |
[ |
(1) − (0)] ∙ − ∙ ∙ (1 − ) ≡ |
(2.1) |
|
|
|
|
|
|
≡ ∙ (1) |
+ (1 − ) ∙ (0) − ∙ ∙ (1 − ) |
|
|
|
|
|
|
|
Коэффициент нелинейности c положительный и тем больше, чем больше отличаются по своим свойствам атомы замещаемых и замещающих компонент. Значения коэффициента нелинейности с и некоторые параметры наиболее часто используемых для создания гетеропереходов материалов при-
ведены в таблицах 2.1, 2.2 для различных твёрдых растворов AIIIBV.
Таблица 2.1 – Параметры нелинейности для некоторых твёрдых растворов на основе соединений AIIIBV.
Твердый раствор |
Г |
|
|
|
∆ |
|
|
(Г) |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
AlGaAs |
-0,127+1,310x |
0,55 |
0 |
0 |
- |
|||
|
|
|
|
|
|
|
|
|
GaInAs |
0,477 |
1,4 |
0,33 |
|
0,15 |
|
0,0091 |
|
AlInAs |
0,70 |
0 |
- |
0,15 |
0,049 |
|||
|
|
|
|
|
|
|||
GaAsP |
0,19 |
0,24 |
0,16 |
|
- |
|
- |
|
GaInP |
0,65 |
0,20 |
1,03 |
0 |
0,051 |
|||
|
|
|
|
|
|
|||
AlInP |
-0,48 |
0,38 |
- |
|
-0,19 |
|
0,22 |
|
AlGaP |
0 |
0,13 |
- |
- |
- |
|||
|
|
|
|
|
|
|||
AlAsP |
0,22 |
0,22 |
0,22 |
|
- |
|
- |
|
InAsP |
0,19 |
0,24 |
0,16 |
- |
- |
|||
|
|
|
|
|
|
|||
GaInSb |
0,415 |
0,33 |
0,4 |
|
0,1 |
|
0,0092 |
|
AlInSb |
0,43 |
- |
- |
0,25 |
- |
|||
|
|
|
|
|
|
|||
AlGaSb |
-0,044+1,22x |
0 |
0 |
|
0,3 |
|
- |
|
|
|
8 |
|
|
|
|
|
|
Продолжение таблицы 2.1
GaAsSb |
1,43 |
1,2 |
1,2 |
0,6 |
- |
|
|
|
|
|
|
InAsSb |
0,67 |
0,6 |
0,6 |
1,2 |
0,035 |
AlAsSb |
0,8 |
0,28 |
0,28 |
0,15 |
- |
|
|
|
|
|
|
GaPSb |
2,7 |
2,7 |
2,7 |
- |
- |
AlPSb |
2,7 |
2,7 |
2,7 |
- |
- |
|
|
|
|
|
|
InPSb |
1,9 |
1,9 |
1,9 |
0,75 |
- |
|
|
|
|
|
|
Таблица 2.2 – Некоторые параметры наиболее часто используемых для созда-
ния гетеропереходов материалов
|
Параметр |
Si |
Ge |
GaAs |
AlAs |
InAs |
GaP |
InP |
GaSb |
AlSb |
InSb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a, нм |
0,5431 |
0,5658 |
0,5653 |
0,5660 |
0,6058 |
0,5451 |
0,5869 |
0,6096 |
0,6136 |
0,6479 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ħ , мэВ |
|
64 |
37 |
36 |
50 |
30 |
51 |
43 |
29 |
42 |
24 |
|
(300 К), эВ |
1,12 |
0,66 |
1,42 |
2,15 |
0,35 |
2,27 |
1,34 |
0,75 |
1,62 |
0,18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(0 К), эВ |
|
1,17 |
0,74 |
1,52 |
2,23 |
0,42 |
2,35 |
1,42 |
0,81 |
1,69 |
0,23 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
с( ) |
X |
L |
Г |
X |
Г |
X |
Г |
Г |
X |
Г |
|
|
Г, эВ |
|
3,5 |
0,80 |
- |
3,02 |
- |
2,78 |
- |
- |
2,30 |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆, эВ |
0,044 |
0,29 |
0,34 |
0,28 |
0,38 |
0,08 |
0,11 |
0,75 |
0,67 |
0,98 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, эВ |
|
4,01 |
4,13 |
4,07 |
3,51 |
4,92 |
4,3 |
4,38 |
4,06 |
3,65 |
4,59 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,54 |
0,28 |
0,5 |
0,5 |
0,41 |
0,67 |
0,6 |
0,28 |
0,4 |
0,4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,15 |
0,044 |
0,082 |
0,15 |
0,026 |
0,17 |
0,12 |
0,050 |
0,11 |
0,02 |
|
Г |
- |
- |
0,067 |
0,150 |
0,022 |
- |
0,077 |
0,04 |
- |
0,014 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,92 |
1,64 |
1,3 |
1,1 |
- |
4,8 |
- |
- |
1,0 |
- |
|
|
0,19 |
0,082 |
0,23 |
0,19 |
- |
0,25 |
- |
- |
0,26 |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11,9 |
16,2 |
13,2 |
10,1 |
15,1 |
11,1 |
12,6 |
15,7 |
12,0 |
16,8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
, м2В−1с−1 |
0,15 |
0,39 |
0,92 |
- |
3,3 |
0,02 |
0,5 |
0,77 |
0,02 |
8 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, м2В−1с−1 |
|
0,045 |
0,19 |
0,04 |
- |
0,05 |
0,012 |
0,01 |
0,1 |
0,04 |
0,13 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Если при изменении х не происходит смены абсолютного минимума зоны проводимости, то характер зонной структуры не меняется. Например,
твердые растворы GaxIn1-xAs и InAsxSb1-x во всём диапазоне изменения 0≤х≤1
обладают прямой структурой энергетических зон. Если при изменении состава положение минимума зоны проводимости меняется, то в зависимости ( )
наблюдается излом. На рисунке 2.2 представлены изменения энергетических зазоров в трёхкомпонентных твёрдых растворах, часто применяемых в каче-
стве основных рабочих материалов оптоэлектронных устройств.
9
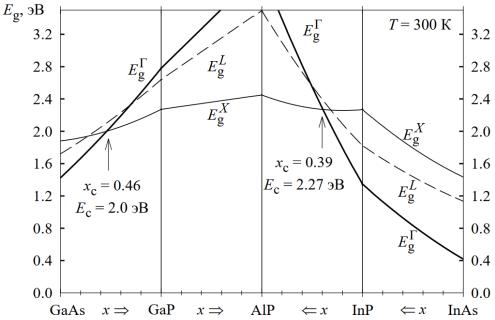
Рисунок 2.2 – Изменение энергетических зазоров в трёхкомпонентных твёр-
дых растворах полупроводников группы AIIIBV
Для точного определения ширины запрещённой зоны и типа энергети-
ческой структуры в твёрдом растворе с известным значением x необходимо провести сравнение зависимостей энергетических зазоров от состава. В систе-
мах с разными структурами зон (когда один компонент прямозонный, а другой непрямозонный) существующий переходный состав – это такое значение кон-
центрации одного из компонентов, когда происходит переход из прямой структуры зон в непрямую.
Особенность зонной структуры соединения GaAs1-xPx заключается в из-
менении положений минимумов, которые расположены в направлениях (000)
и (100), зоны проводимости относительно друг друга с изменением состава. В GaAs, чья ширина запрещённой зоны 1,38 эВ при 300 К, два минимума разде-
лены энергетическим зазором 0,36 эВ, и в направлении (000) минимум зоны проводимости наиболее низкий (рисунок 2.3).
10
