
Лабы 1 Семестр / 0207_ЛР2-отчет_Маликов
.docxМИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра физической химии
отчет
по лабораторной работе №2
по дисциплине «Химия»
Тема: Определение молярной массы эквивалента металла
Студент гр. 0207 |
|
Маликов Б.И. |
Преподаватель |
|
Кириллова С.А. |
Санкт-Петербург
2020
Цель работы.
Определить молярную массу эквивалента металла методом вытеснения водорода из раствора кислоты; установить, какой это металл.
Приборы и принадлежности.
Схема прибора для определения молярной массы эквивалента металла методом вытеснения водорода из раствора кислоты, где обозначены: 1 штатив для эвдиометра; 2 эвдиометр; 3 кристаллизатор; 4 газоотводная трубка; 5 штатив для пробирки; 6 пробирка.
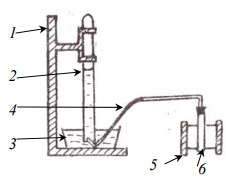
Основные теоретические положения.
Основными структурными единицами вещества являются атомы, молекулы, ионы, эквиваленты.
Эквивалент – реальная частица (атом, молекула, ион) или условная частица (доля атома, молекулы, иона), равноценная одному иону водорода Н+ в кислотно-основных реакциях или одному электрону e- в окислительно-восстановительных реакциях. Обозначается Э (вещество).
Молярная масса эквивалента вещества – масса 1 моль (6 1022) эквивалентов данного вещества. Обозначается Мэк (вещество). Выражается в граммах на моль [г/моль].
Для окислительно-восстановительной реакции, идущей в работе, закон эквивалентов можно записать как m1/Mэк1=V2/Vэк2, где m1 и Мэк1 масса и молярная масса вещества 1; V2 и Vэк2 объем и молярный объем эквивалентов газообразного вещества 2.
Молярная масса эквивалента металла-восстановителя имеет вид:
MЭк=Мат/z , где Мат молярная масса атомов металла [г/моль]; z – число электронов, отданных атомом металла в ходе окислительно-восстановительной реакции:
Ме0 zе¯ Меz
Протокол наблюдений
Лабораторная работа № 2
«Определение молярной массы эквивалента металла»
Вариант: 11
Температура опыта – 23°С
Атмосферное давление опыта – 759 мм рт. ст.
Навеска металла, m , кг (г) |
Температура опыта, T1 , К |
Атмосферное давление опыта, Pатм , Па |
Парциальное давление водяного пара, PH2O , Па |
Объем выделившегося водорода, V1, м3 (л) |
Парциальное давление водорода, P1 Pатм-PH2O , Па |
0,0252 |
296 |
101192 |
2338,1 |
0,0347 |
98853,9 |
Обработка результатов измерений.
Приведите объем выделившегося водорода к нормальным условиям (н. у.):
По формуле:
 , где T0
= 273 К; p0
= 101 325 Па
, где T0
= 273 К; p0
= 101 325 Па
V0=0,0315 [л]
Рассчитаем молярную массу эквивалента металла, используя закон эквивалентов:
По формуле:
 ,
где Vэ (H2)
= 11,2 л/моль (н. у.)
,
где Vэ (H2)
= 11,2 л/моль (н. у.)
Мэ=9 [г/моль]
Определим молярную массу атомов металла:
Мат = zМЭ
z=1: Мат1 = 9 [г/моль]
z=2: Мат2 = 18 [г/моль]
z=3: Мат3 = 27 [г/моль] Al - Алюминий
Вычислим абсолютную и относительную погрешности определения молярной массы эквивалента металла:
Абсолютная погрешность: (Мэктеор – Мэкпр)=0,02 [г/моль]
Относительная погрешность: │Мэктеор Мэкпр │ / Мэктеор 100%=0,07%
Уравнение окислительно-восстановительной реакции:
2Al0+6H+Cl-→2Al+3Cl-3+3H20↑
Al0-3e¯→Al+3 │2
2H++2e¯→H20│3
Al0→Al+3 – восстановитель
2H+→H20 – окислитель
Вывод.
Реакцией взаимодействия металла с соляной кислотой была
определена молярная масса эквивалента металла. Было установлено, что данным
металлом является алюминий.
