
Лабы 1 Семестр / 0207 Маликов Отчет Лабораторная работа №9
.docxМИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра физики
ОТЧЕТ
по лабораторной работе №9
ИССЛЕДОВАНИЕ ТЕРМОДИНАМИЧЕСКИХ ЦИКЛОВ
Выполнил: Маликов Б.И.
Группа № 0207
Преподаватель: Попов Ю.И.
Вопросы |
Задачи ИДЗ |
Даты коллоквиума |
Итог |
|||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
||||||||||
|
||||||||||
|
||||||||||
|
||||||||||
Санкт-Петербург
2020

Цель работы.
Исследование политропно-изохорно-изотермического (nVT) и адиабатно-изохорно-изотермического (SVT) циклов.
Приборы и принадлежности.
Баллон с воздухом, манометр, микрокомпрессор, лабораторные термометр и барометр.
Используемая
в работе установка изображена на рис.
9.1. Баллон А объёмом V1 может сообщаться
либо с насосом H, либо с атмосферой.
Внутрь баллона помещён манометр М,
измеряющий избыточное давление. Одно
деление шкалы равно 4 мм вод. ст., что
составляет 40 Па. Рабочим газом является
воздух. В исходном состоянии параметры
состояния воздуха следующие: внешнее
давление p2 и комнатная температура T1.
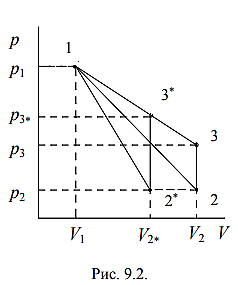
Диаграмма исследуемого цикла в координатах
(p,V) показана на рис. 9.2. 
Исследуемые закономерности.
В работе изучается политропно-изохорно-изотермический (nVT) цикл. Для сравнения с nVT циклом используется адиабатно-изохорноизотермический (SVT) цикл, отличающийся тем, что процесс расширения газа на участке 12* рассматривается как адиабатический.
Первое начало термодинамики для политропного процесса имеет вид:
![]()
где C – теплоемкость воздуха в политропном процессе, CV = Cv C.
Уравнение Пуассона для политропного процесса TVn1 = const или рVn = const, где n – показатель политропы:
![]()
где Сp и Cv теплоемкости газа в изобарном и изохорном процессах.
При относительно малых изменениях p и V угловые коэффициенты политропы 12 и изотермы 13 (см. рис. 9.2) рассчитывается по формулам:
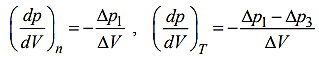
где V = V2 V1. Из этих и приведенных выше соотношений получаем формулу:

Зная n, можно определить мольную теплоемкость газа в политропном процессе:
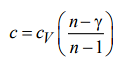
Работа расширения (сжатия) газа в политропическом A12 и изотермическом A13 процессах может быть рассчитана по формулам:
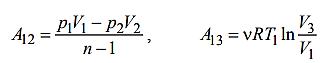
Для SVT-цикла холодильный коэффициент равен:

А для nVT –цикла:
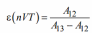
Получим:

Функция состояния, дифференциалом которой является отношение Q / T, называется энтропией:

В политропном процессе (на участке 1-2) изменение энтропии S равно:
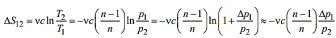
В изохорном процессе (на участке 23) изменение энтропии равно:
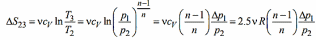
В изотермическом процессе (на участке 31):
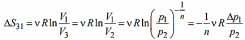
Для SVT-цикла изменение энтропии в адиабатном процессе (на участке 12 * ) равно нулю. С учетом, что изменение энтропии в цикле также рано нулю, заключаем, что изменения энтропии в изохорном и изотермическом процессах равны по величине, но различаются знаком:
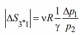
Обработка результатов измерений.
Рассчитаем в делениях шкалы манометра избыточные давления p1
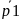
(
( с P=95%.
с P=95%.
Упорядочим выборку в порядке возрастания:
p1 ={650; 700; 710; 720; 720; 720; 730; 730; 740; 750} [Па]
1.2 Проверим выборку на наличие промахов.
Определим размах выборки: R=750-650=100
По таблице определим коэффициент Up,N при P=95% и N=10:
Up,N=0,41
Оценим на промахи каждую пару значений в выборке и сравним с Up,N:
p11=0,5>0,41 – промах
p12=0,1<0,41 – не промах
p13=0,1<0,41 – не промах
p14=0<0,41 – не промах
p15=0<0,41 – не промах
p16=0,1<0,41 – не промах
p17=0<0,41 – не промах
p18=0,1<0,41 – не промах
p19=0,1<0,41 – не промах
Вывод: в данной выборке присутствует один промах.
1.3 Рассчитаем среднее выборочное значение:
=724,4 [Па]
1.4 Рассчитаем СКО среднего:
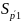 =5,03
=5,03
1.5 Определим случайную погрешность по коэффициенту Стьюдента при N=9 и P=95%: tp,N=2,3 – по таблице;
(p1)=11,6 [Па]
1.6 Рассчитаем полную погрешность результатов измерений:
( =11,6 [Па]
1.7 Запишем результат измерений в округлённой форме:
p1=72412 [Па]
Рассчитаем в делениях шкалы манометра избыточные давления p3
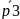
(
)
c
P=95%
(
)
c
P=95%
1.1.1 Упорядочим выборку в порядке возрастания:
p3 ={110; 110; 120; 120; 120; 130; 130; 130; 140; 160} [Па]
1.1.2 Проверим выборку на наличие промахов.
Определим размах выборки: R=160-110=50
По таблице определим коэффициент Up,N при P=95% и N=10:
Up,N=0,41
Оценим на промахи каждую пару значений в выборке и сравним с Up,N:
p31=0<0,41 – не промах
p32=0,2<0,41 – не промах
p33=0<0,41 – не промах
p34=0<0,41 – не промах
p35=0,2<0,41 – не промах
p36=0<0,41 – не промах
p37=0<0,41 – не промах
p38=0,2<0,41 – не промах
p39=0,4<0,41 – не промах
Вывод: в данной выборке промахи отсутствуют.
1.1.3 Рассчитаем среднее выборочное значение:
=127 [Па]
1.1.4 Рассчитаем СКО среднего:
 =4,7
=4,7
1.1.5 Определим случайную погрешность по коэффициенту Стьюдента при N=10 и P=95%: tp,N=2,3 – по таблице;
(p3)=10,8 [Па]
1.1.6 Рассчитаем полную погрешность результатов измерений:
( =10,8
[Па]
=10,8
[Па]
1.1.7 Запишем результат измерений в округлённой форме:
p3=12711 [Па]
Рассчитаем показатель политропы n

с Р = 95% на участке 1–2 nVT цикла.
с Р = 95% на участке 1–2 nVT цикла.
2.1
По формуле: n=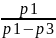
= =
=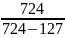 =1,21
=1,21
2.2
 =
= =
=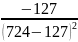 =-0,0003
=-0,0003
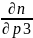 =
=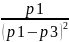 =0,002
=0,002
2.3
=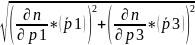 =0,02
=0,02
2.4
Запишем результат измерений в округленной форме:
n=1,210,02
Рассчитаем давления p1 и p3 , выразив их в Па.
p1=p2+p1=101900+724=102624 [Па]
p3=p2+p3=101900+127=102027 [Па]
Рассчитаем параметры состояния (p,V,T) в точках 1, 2 и 3 nVT-цикла, а также в точках 1* , 2* и 3* SVT-цикла, используя уравнения политропического и адиабатического процессов.
Состояние 1:
p1=102624 [Па]
V1=22,4 [л]=22,4∙10-3 [м3]
T1=297 [К]
Состояние 1*:
p1*=p1=102624 [Па]
V1*=V1 =22,4 [л]=22,4∙10-3 [м3]
T1*=T1 =297 [К]
Состояние 2:
p2=101900 [Па]
Уравнение политропы:
p1V1n=p2V2n
n=1,2
V2=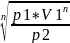 =
=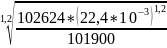 =0,02252
[м3]
=0,02252
[м3]
 =
=
T2=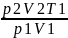 =296,6
[К]
=296,6
[К]
Состояние 2*:
p2*=p2=101900 [Па]
ɣ= =1,4,
при
i=5
=1,4,
при
i=5
p1V1*=p2*V2*
V2*=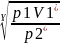 =
=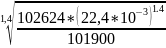 =0,02251
[м3]
=0,02251
[м3]
T2*= =
=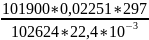 =296,4
[К]
=296,4
[К]
Состояние 3:
p3=102027 [Па]
T3=297 [К]
V3= =
=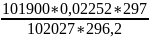 =0,02252
[м3]
=0,02252
[м3]
Состояние 3*:
T3*=297 [К]
p3*V3*=p1V1
V3*=V2*
p3*=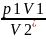 =102123
[Па]
=102123
[Па]
 =
=
V3*= =
= =0,02251
[м3]
=0,02251
[м3]
-
1
1*
2
2*
3
3*
p, Па
102624
102624
101900
101900
102027
102123
V, м3
0,0224
0,0224
0,02252
0,02251
0,02252
0,02251
T, К
297
297
296,6
296,4
297
297
Построим nVT- и SVT-циклы в координатах (р, V):


Рассчитаем изменения внутренней энергии, величину работы газа и поглощаемое (отдаваемое) им количество теплоты для всех процессов nVT цикла.
Изменение внутренней энергии:
1-2: U12=υCυ(T2-T1)
υ=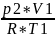 =0,925
[моль]
=0,925
[моль]
Cυ= =20,78
[
=20,78
[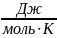 ]
]
U12=-15,38 [Дж]
2-3: U23=-U12=15,38 [Дж]
3-1: U31=0
Работа газа:
1-2:
A12= =19,8
[Дж]
=19,8
[Дж]
2-3: A23=0
1-3:
A31=υRT1ln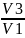 =12,2
[Дж]
=12,2
[Дж]
Количество теплоты:
1-2: Q12=4,42 [Дж]
2-3: Q23=15,38 [Дж]
3-1: Q31=12,2 [Дж]
Рассчитаем холодильные коэффициенты для nVT- и SVT-циклов;
ε(nVT)=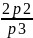 =1604
=1604
ε(SVT)= =
= =914
=914
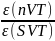 =
=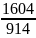 =1,8>1
=1,8>1
Обратимый цикл Карно:
T1,T2:
εк=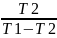 =742
=742
T1,T2*:
ε
k*= =494
=494
 =
=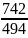 =1,5>1
=1,5>1
Холодильные коэффициенты для nVT- и SVT-циклов больше холодильных коэффициентов цикла Карно.
Используя уравнения состояния идеального газа, найдем число молей воздуха в сосуде по известным значениям p2, V1, T1:
υ= =0,925 [моль]
Рассчитаем мольную теплоемкость cV воздуха при постоянном объеме и его мольную теплоёмкость c в политропном процессе:
Cυ=
=20,78
[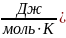
C= Cυ( )
)
ɣ= =1,4
C=-20,78 [
Рассчитаем изменение энтропии всех процессов в nVT- и SVT- циклах:
nVT:
Политропа
1-2: S12=
υ∙C∙(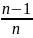 )∙ln
)∙ln =22,7∙10-3
[
=22,7∙10-3
[
Изохора
2-3: S23=
2,5υ∙R∙(
)∙ =22,8∙10-3
[
=22,8∙10-3
[
Изотерма
3-1: S31=-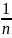 υ∙R∙
=-45,5∙10-3
[
υ∙R∙
=-45,5∙10-3
[
SVT:
Aдиабата 1*-2*: S12=0
Изохора
2*-3*:
S23=
υ∙R∙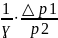 =40,1∙10-3
[
=40,1∙10-3
[
Изотерма 3*-1*: S31= -υ∙R∙ =-40,1∙10-3 [
Вывод.
В ходе данной лабораторной работы мы получили ряд данных, на основании которых смогли определить значения показателя политропы, параметры состояния (p,V,T) в точках 1, 2 и 3 nVT-цикла, и в точках 1* , 2*, 3* SVT-цикла, а также смогли определить значения холодильных коэффициентов. Мы выяснили, что холодильные коэффициенты для nVT- и SVT-циклов больше холодильных коэффициентов цикла Карно.
