
- •ИСПОЛЬЗОВАНИЕ ДНК- ТЕХНОЛОГИЙ В МЕДИЦИНЕ: МЕТОДЫ ПЦР И СЕКВЕНИРОВАНИЯ. ГЕННАЯ ТЕРАПИЯ
- •Полимеразная цепная реакция (ПЦР)
- ••Благодаря ПЦР стало возможным быстрое получение участков ДНК в чистом виде и достаточном
- •Классическая ПЦР
- •Праймеры для ПЦР
- •ОСНОВЫ СИНТЕЗА ОЛИГОНУКЛЕОТИДОВ ФОСФОРАМИДИТНЫМ МЕТОДОМ
- •ФОСФОРАМИДИТЫ НУКЛЕОЗИДОВ
- •Стадия 1 – отщепление DMTr
- •Стадия 2 - конденсация
- •Стадия 3 - окисление
- •Стадия 4 – детритилирование 2
- ••Поскольку праймеры должны быть комплементарны к участкам ДНК, ограничивающим амплифицируемый фрагмент, ПЦР можно
- •Состав реакционной смеси ПЦР
- •Схема 1-го цикла ПЦР
- •Амплификация целевых фрагментов ДНК в ходе ПЦР
- •ДНК-полимеразы
- ••Tth-полимераза (эубактерия Thermus thermophilus) - это также высокопроцессивный фермент, амплифицирующий до 3000 п.
- ••Pwo-полимераза (архебактерия Pyrococcus woesei) - молекулярная масса фермента около 90 кДа. Это процессивный
- •Визуализация результатов ПЦР
- •Применение ПЦР
- •Получение геномных (А) и кДНК (Б) копий с помощью ПЦР
- •Использование метода ПЦР для диагностики инфекционных заболеваний
- •ПЦР-анализ одного STR-локуса
- •Анализ трех STR-локусов методом ПЦР
- •Оборудование и материалы для ПЦР
- •Примеры обычного (А) амплификатора С1000 Touch, BioRad (США) и детектирующего амплификатора (Б)
- •Формат пробирок для проведения ПЦР
- •"Горячий старт" (Hot Start)
- •Добавление одного из компонентов реакции при высокой температуре
- •Разделение барьером
- •Ингибирование полимеразы антителами
- •Использование химически модифицированной полимеразы
- •Использование ингибиторов ДНК-полимеразы
- •ПЦР в реальном времени (Real-Time-PCR, qPCR, qRT- PCR)
- •Детекция кинетики ПЦР в реальном времени с помощью флуоресцентных зондов.
- •Амплификация ДНК происходит экспоненциально:
- •Прологарифмировав обе части уравнения (1) получим:
- •Детекция амплификации ДНК в режиме реального времени
- •Правило Стокса
- •Визуализация результатов ПЦР в реальном времени
- •Существует несколько систем детекции амплификации ДНК в режиме реального времени, которые принято подразделять
- •Неспецифические системы детекции
- •Кривая плавления продуктов ПЦР (сплошная линия). Прерывистой линией показан график первой производной. Значения
- •Меченные праймеры с адаптерной последовательностью (амплифлюры)
- •Специфические системы детекции
- •Кспецифическим системам детекции относятся:
- •Праймеры-пробы ("скорпионы")
- •Линейные разрушаемые пробы (TaqMan)
- •Пробы с инвертированными концевыми повторами (ИКП) (молекулярные "маячки", molecular beacons)
- •Метки, работающие на основе метода флуоресцентного резонансного переноса энергии (fluorescent resonance energy transfer,
- •Определение эффективности амплификации
- •Обработка данных ПЦР в реальном времени
- •Метод калибровочного графика
- •Прямое сравнение данных
- •Мостиковая ПЦР
- ••При повторных циклах ПЦР, из точки синтеза первого фрагмента колония фрагментов ДНК будет
- •Эмульсионная ПЦР (emulsion PCR, ePCR)
- •Принцип действия эмульсионной ПЦР
- •Цифровая капельная ПЦР (цПЦР, ddPCR)
- ••Данный метод незаменим для решения таких задач, как:
- •Преимуществами цифровой ПЦР по сравнению с ПЦР в реальном времени являются:
- •Методы секвенирования нуклеиновых кислот
- •Метод химической деградации (Максама- Гилберта)
- ••На первом этапе образец ДНК, обычно представляющий собой сравнительно короткий (100 - 1000
- •Принцип метода Максама-Гилберта
- ••Псевдоу́зел— элемент вторичной структуры нуклеиновых кислот (в основном РНК), состоящий из двух шпилек,
- •Метод Сэнгера (остановка синтеза ДНК ферментом на дидезоксинуклеотидах (ddNTP))
- •Структурные формулы нуклеотидов,
- ••Фрагмент ДНК, последовательность которого требуется определить, добавляется в реакцию аналогичную ПЦР: реакционная смесь
- •Принцип метода Сэнгера
- ••Удлинение цепи ДНК ферментом происходит до момента включения ddNTP. Разделение полученных фрагментов методом
- •Капиллярный автоматический секвенатор ABI
- •Спектрограмма, полученная в результате секвенирования по методу Сэнгера на автоматическом секвенаторе
- •Метод гибридизации на твердой фазе
- •Принцип метода секвенирования на чипе
- ••Однако, невозможно подобрать условия, при которых с олигонуклеотидами будут гибридизоваться только полностью комплементарные
- •Секвенирование с помощью масс-спектрометрии MALDI-TOF (Matrix-assisted laser desorption/ionization- time-of-flight) (определение нуклеотида по массе
- •Принцип секвенирования ДНК на основе метода MALDI-TOF
- •Секвенирование лигированием (принцип комплементарности цепей ДНК)
- •Секвенирование методом лигирования
- •Пиросеквенирование (регистрация акта присоединения нуклеотида по образующемуся пирофосфату)
- •Принцип метода пиросеквенирования
- •Метод обратимых терминирующих нуклеотидов (регистрация каждого присоединенного нуклеотида по отщепляемой метке)
- ••Сначала любым методом создают иммобилизованную на твердой фазе клональную библиотеку одноцепочечных фрагментов ДНК
- •Метод обратимых терминирующих нуклеотидов
- •Полупроводниковое секвенирование (регистрация акта присоединения нуклеотида по образующимся ионам водорода)
- •Полупроводниковое секвенирование
- ••Как и в случае пиросеквенирования, у полупроводникового секвенирования есть трудности с детекцией гомополимерных
- •Нанопоровое секвенирование
- •Принцип нанопорового секвенирования
- ••В настоящее время, технологии Nanopore позволяют осуществлять:
- •Проект «Геном человека» Human Genome Project (HGP) 1990 - 2004
- ••Проект начался в 1990 году, под руководством Джеймса Уотсона под эгидой Национальной организации
- •Принцип секвенирования методом "дробовика"
- •Повторяющиеся участки затрудняют правильную сборку последовательности
- •Метод «клон за клоном» (clone-by-clone)
- •Расположение индивидуальных клонов фрагментов генома, содержащихся в BAC, на физической карте генома определяется
- ••Знание расположения сайтов рестрикции в каждом из клонов позволило определить их местоположение на
- •Генная терапия
- ••Генная терапия, в широком смысле, означает лечение путем введения в ткани или клетки
- •Генная терапия ex vivo
- •Генная терапия in vivo
- •Методы генетической трансфекции в генной терапии
- •Векторные системы на основе вирусов
- •Ретровирусные векторы
- •Конструкции ретровирусных векторов
- •Пакующая клеточная линия
- •Аденовирусные векторы
- •Векторы на основе аденоассоциированных вирусов (ААВ)
- •Векторы на основе вируса простого герпеса (HSV)
- •Образование HSV-вектора с помощью рекомбинации
- •Невирусные системы трансфекции
- •Антисмысловые нуклеиновые кислоты
- •Расщепление мРНК под действием рибозимов
- •Коррекция сплайсинга РНК с помощью антисмысловых олигонуклеотидов
- •мкРНК-интерференция
- •Рекомендуемая литература
- •Благодарю за внимание!
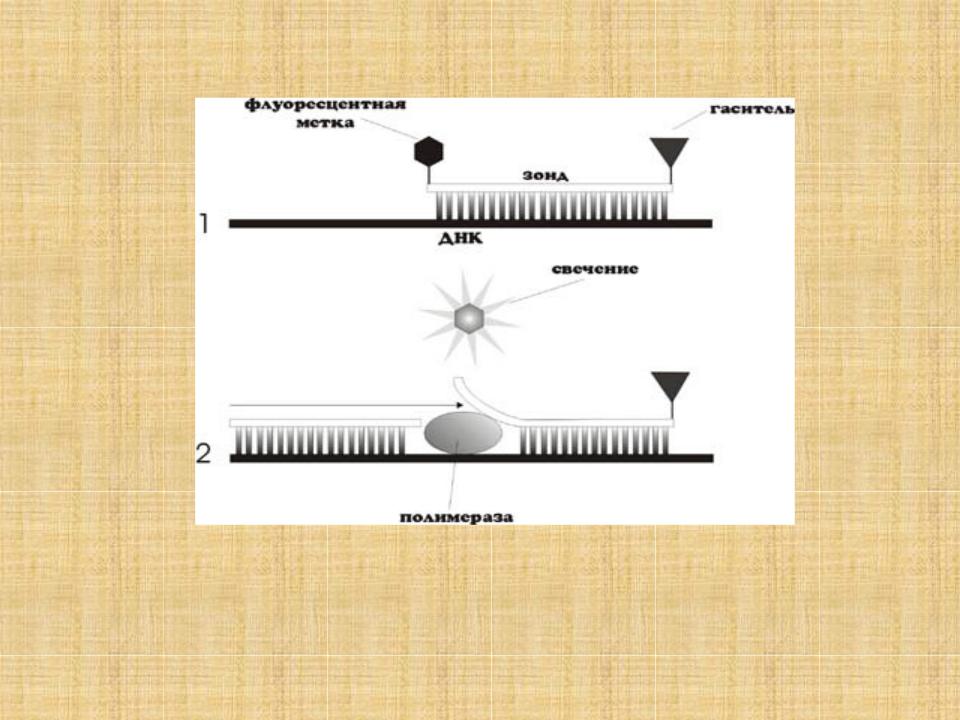
Линейные разрушаемые пробы (TaqMan)
•В данном подходе, олигонуклеотид, комплементарный продукту ПЦР, метят флуорофором и гасителем флуоресценции. В отсутствии мишени флуорофор и гаситель сближены и флуоресценция подавлена. При накоплении соответствующего продукта реакции, проба гибридизуется на ампликон, что ведет к ее разрушению за счет 5ʹ-экзонуклеазной активности Taq-полимеразы
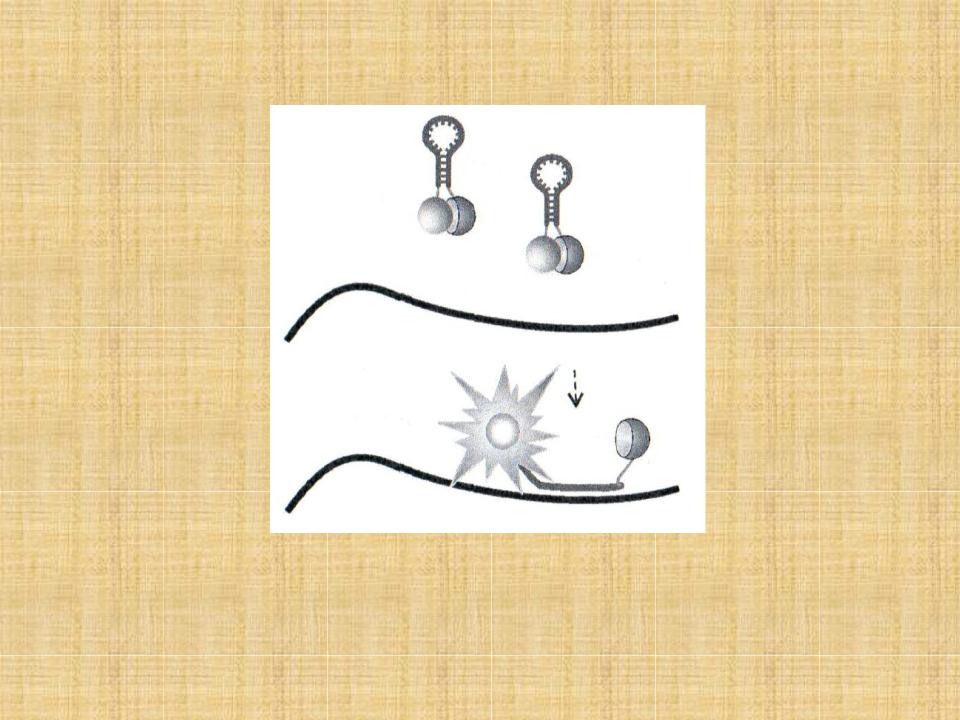
Пробы с инвертированными концевыми повторами (ИКП) (молекулярные "маячки", molecular beacons)
•В данной методике флуорофор и гаситель располагают на противоположных концах олигонуклеотида. Зонды, находящиеся в растворе при температуре ниже 55-60°С образуют структуру типа "стебель-петля" с очень низким уровнем флуоресценции. При гибридизации с ампликоном зонд разворачивается, что ведет к увеличению уровня флуоресценции
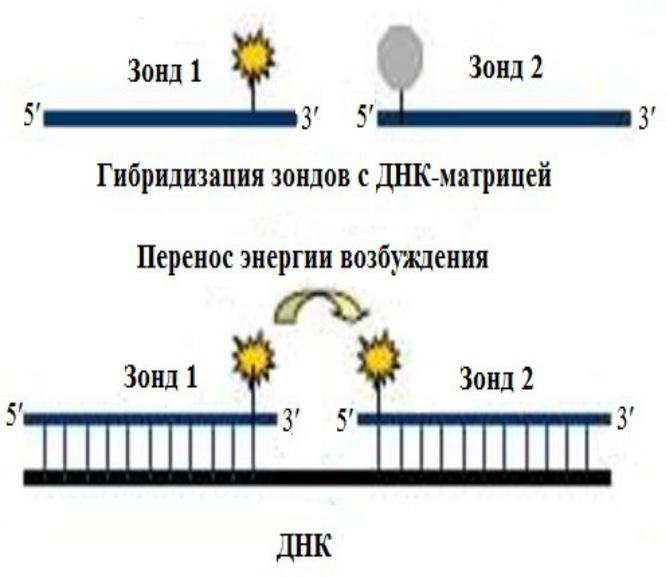
Метки, работающие на основе метода флуоресцентного резонансного переноса энергии (fluorescent resonance energy transfer, FRET)

Определение эффективности амплификации
•Эффективность реакции можно рассчитать как E=10-1/k,
где k берется из уравнения прямой Ct = k·log P0 + b, полученного путем линейной аппроксимации экспериментальных данных. При E=2 (максимально теоретически возможном значении) k ~ -3.32;
•Значения k < -3.32 соответствуют более низкой эффективности реакции. Желательно добиваться таких условий реакции, в которых эффективность амплификации составляет, по меньшей мере, 1.7 - 1.8 (k не больше -4 — - 4.2);
•Иногда k оказывается больше, чем -3.32, что соответствует теоретически невозможной ситуации E > 2. Небольшое превышение (-3.32 < k < -2.8) наблюдается относительно часто и может быть отнесено на счет погрешности измерений

Обработка данных ПЦР в реальном времени
•Методы обработки данных ПЦР в реальном времени основаны на применении уравнения (3). Существует два основных метода обработки данных ПЦР в реальном времени:
•- Метод калибровочного графика.
•- Прямое сравнение данных.

Метод калибровочного графика
•Этот метод предполагает построение
калибровочного графика в координатах Ct - log P0 с серией разведений ДНК-стандарта, из которого находят концентрацию субстрата (P0) в экспериментальных образцах.
•График подчиняется уравнению: Ct = k·log P0 + b
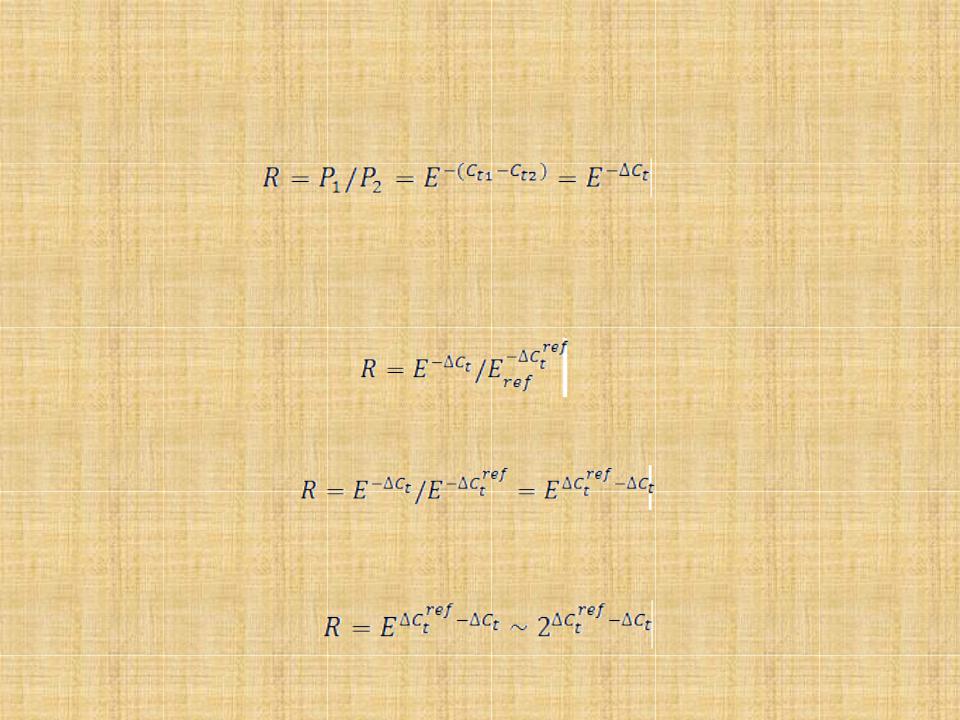
Прямое сравнение данных
•Из уравнения (3) следует, что при равной эффективности реакции E в образцах 1 и 2, относительная концентрация субстрата (R) будет равна:
Проведем нормализацию этих результатов по данным амплификации с контрольной последовательностью REF (соответствующей, например, гену домашнего хозяйства). Пусть реакция REF в обоих образцах протекает с эффективностью Eref. Тогда:
Если эффективности "контрольной" и "опытной" реакций сходны, то можно записать:
Если обе реакции протекают со сходной эффективностью, близкой к 2, уравнение упрощается до вида:

Мостиковая ПЦР
•В случаях, когда поставленные задачи требуют проведения высокоэффективного секвенирования, 1536-ти луночного планшета (или даже сотни таких планшетов) для ПЦР оказывается недостаточно. В таких случаях требуются миллионы отдельных реакций, в каждой из которых будет получен гомогенный продукт ПЦР;
•Одним из методов, позволяющих решить данную задачу, является мостиковая ПЦР (bridge PCR).
•Принцип данного метода заключается в проведении ПЦР с праймерами, прикрепленными к твердой подложке, наподобие предметного стекла.
•С пришитого к поверхности праймера синтезируется фрагмент ДНК.
•После этапа денатурации, фрагмент снова взаимодействует с праймером на поверхности, образуя дугу (мостик) между двумя точками на подложке
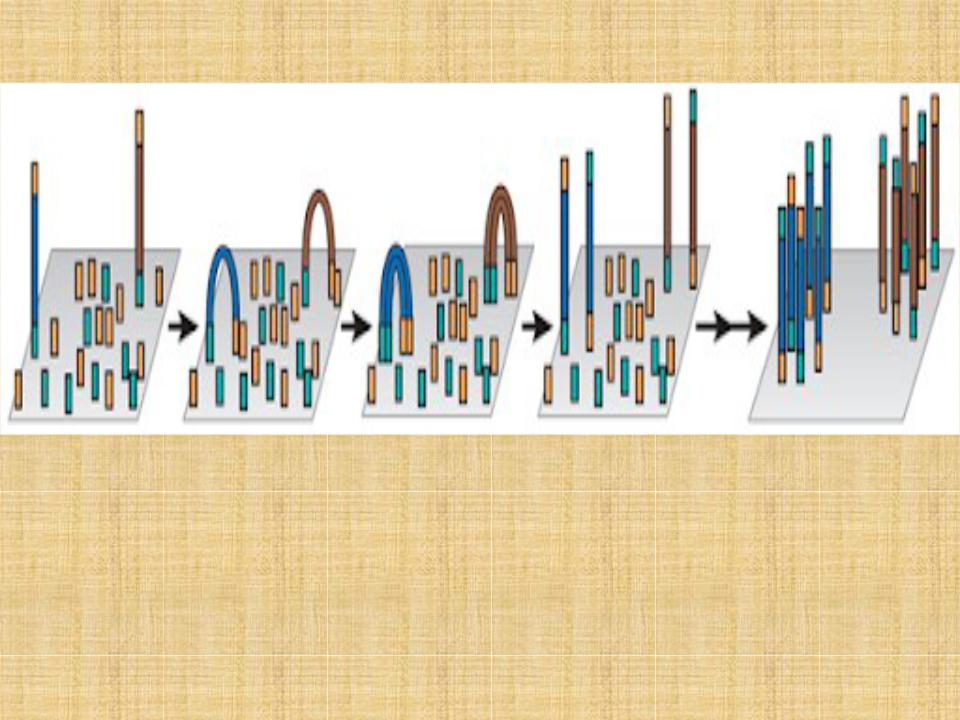
•При повторных циклах ПЦР, из точки синтеза первого фрагмента колония фрагментов ДНК будет быстро расти.
•Технология мостиковой ПЦР используется для создания клональных библиотек фрагментов ДНК в приборах компании Illumina.

Эмульсионная ПЦР (emulsion PCR, ePCR)
•Эмульсионная ПЦР представляет собой распространенный вариант клонирования фрагментов ДНК in vitro. Эта методика позволяет амплифицировать ДНК на покрытых праймерами микросферах, так что каждая микросфера оказывается "облеплена" фрагментами только одного типа. Для этого создают библиотеку фрагментов ДНК с адаптерами по концам, а затем смешивают полученные фрагменты с покрытыми праймерами микрофсерами, свободным праймером, и остальными необходимыми для ПЦР компонентами в условиях мелкодисперсной водно-масляной эмульсии так, чтобы в каждую микрокаплю воды попали в среднем одна микросфера и один "стартовый" фрагмент ДНК. В ходе ПЦР, праймеры на микросфере инициируют синтез фрагментов, начиная с единственной матрицы, а с праймера, находящегося в растворе, достраивается вторая цепь. В итоге получают миллионы микросфер, каждая из которых несет миллионы идентичных фрагментов ДНК
