- •ИСПОЛЬЗОВАНИЕ ДНК- ТЕХНОЛОГИЙ В МЕДИЦИНЕ: МЕТОДЫ ПЦР И СЕКВЕНИРОВАНИЯ. ГЕННАЯ ТЕРАПИЯ
- •Полимеразная цепная реакция (ПЦР)
- ••Благодаря ПЦР стало возможным быстрое получение участков ДНК в чистом виде и достаточном
- •Классическая ПЦР
- •Праймеры для ПЦР
- •ОСНОВЫ СИНТЕЗА ОЛИГОНУКЛЕОТИДОВ ФОСФОРАМИДИТНЫМ МЕТОДОМ
- •ФОСФОРАМИДИТЫ НУКЛЕОЗИДОВ
- •Стадия 1 – отщепление DMTr
- •Стадия 2 - конденсация
- •Стадия 3 - окисление
- •Стадия 4 – детритилирование 2
- ••Поскольку праймеры должны быть комплементарны к участкам ДНК, ограничивающим амплифицируемый фрагмент, ПЦР можно
- •Состав реакционной смеси ПЦР
- •Схема 1-го цикла ПЦР
- •Амплификация целевых фрагментов ДНК в ходе ПЦР
- •ДНК-полимеразы
- ••Tth-полимераза (эубактерия Thermus thermophilus) - это также высокопроцессивный фермент, амплифицирующий до 3000 п.
- ••Pwo-полимераза (архебактерия Pyrococcus woesei) - молекулярная масса фермента около 90 кДа. Это процессивный
- •Визуализация результатов ПЦР
- •Применение ПЦР
- •Получение геномных (А) и кДНК (Б) копий с помощью ПЦР
- •Использование метода ПЦР для диагностики инфекционных заболеваний
- •ПЦР-анализ одного STR-локуса
- •Анализ трех STR-локусов методом ПЦР
- •Оборудование и материалы для ПЦР
- •Примеры обычного (А) амплификатора С1000 Touch, BioRad (США) и детектирующего амплификатора (Б)
- •Формат пробирок для проведения ПЦР
- •"Горячий старт" (Hot Start)
- •Добавление одного из компонентов реакции при высокой температуре
- •Разделение барьером
- •Ингибирование полимеразы антителами
- •Использование химически модифицированной полимеразы
- •Использование ингибиторов ДНК-полимеразы
- •ПЦР в реальном времени (Real-Time-PCR, qPCR, qRT- PCR)
- •Детекция кинетики ПЦР в реальном времени с помощью флуоресцентных зондов.
- •Амплификация ДНК происходит экспоненциально:
- •Прологарифмировав обе части уравнения (1) получим:
- •Детекция амплификации ДНК в режиме реального времени
- •Правило Стокса
- •Визуализация результатов ПЦР в реальном времени
- •Существует несколько систем детекции амплификации ДНК в режиме реального времени, которые принято подразделять
- •Неспецифические системы детекции
- •Кривая плавления продуктов ПЦР (сплошная линия). Прерывистой линией показан график первой производной. Значения
- •Меченные праймеры с адаптерной последовательностью (амплифлюры)
- •Специфические системы детекции
- •Кспецифическим системам детекции относятся:
- •Праймеры-пробы ("скорпионы")
- •Линейные разрушаемые пробы (TaqMan)
- •Пробы с инвертированными концевыми повторами (ИКП) (молекулярные "маячки", molecular beacons)
- •Метки, работающие на основе метода флуоресцентного резонансного переноса энергии (fluorescent resonance energy transfer,
- •Определение эффективности амплификации
- •Обработка данных ПЦР в реальном времени
- •Метод калибровочного графика
- •Прямое сравнение данных
- •Мостиковая ПЦР
- ••При повторных циклах ПЦР, из точки синтеза первого фрагмента колония фрагментов ДНК будет
- •Эмульсионная ПЦР (emulsion PCR, ePCR)
- •Принцип действия эмульсионной ПЦР
- •Цифровая капельная ПЦР (цПЦР, ddPCR)
- ••Данный метод незаменим для решения таких задач, как:
- •Преимуществами цифровой ПЦР по сравнению с ПЦР в реальном времени являются:
- •Методы секвенирования нуклеиновых кислот
- •Метод химической деградации (Максама- Гилберта)
- ••На первом этапе образец ДНК, обычно представляющий собой сравнительно короткий (100 - 1000
- •Принцип метода Максама-Гилберта
- ••Псевдоу́зел— элемент вторичной структуры нуклеиновых кислот (в основном РНК), состоящий из двух шпилек,
- •Метод Сэнгера (остановка синтеза ДНК ферментом на дидезоксинуклеотидах (ddNTP))
- •Структурные формулы нуклеотидов,
- ••Фрагмент ДНК, последовательность которого требуется определить, добавляется в реакцию аналогичную ПЦР: реакционная смесь
- •Принцип метода Сэнгера
- ••Удлинение цепи ДНК ферментом происходит до момента включения ddNTP. Разделение полученных фрагментов методом
- •Капиллярный автоматический секвенатор ABI
- •Спектрограмма, полученная в результате секвенирования по методу Сэнгера на автоматическом секвенаторе
- •Метод гибридизации на твердой фазе
- •Принцип метода секвенирования на чипе
- ••Однако, невозможно подобрать условия, при которых с олигонуклеотидами будут гибридизоваться только полностью комплементарные
- •Секвенирование с помощью масс-спектрометрии MALDI-TOF (Matrix-assisted laser desorption/ionization- time-of-flight) (определение нуклеотида по массе
- •Принцип секвенирования ДНК на основе метода MALDI-TOF
- •Секвенирование лигированием (принцип комплементарности цепей ДНК)
- •Секвенирование методом лигирования
- •Пиросеквенирование (регистрация акта присоединения нуклеотида по образующемуся пирофосфату)
- •Принцип метода пиросеквенирования
- •Метод обратимых терминирующих нуклеотидов (регистрация каждого присоединенного нуклеотида по отщепляемой метке)
- ••Сначала любым методом создают иммобилизованную на твердой фазе клональную библиотеку одноцепочечных фрагментов ДНК
- •Метод обратимых терминирующих нуклеотидов
- •Полупроводниковое секвенирование (регистрация акта присоединения нуклеотида по образующимся ионам водорода)
- •Полупроводниковое секвенирование
- ••Как и в случае пиросеквенирования, у полупроводникового секвенирования есть трудности с детекцией гомополимерных
- •Нанопоровое секвенирование
- •Принцип нанопорового секвенирования
- ••В настоящее время, технологии Nanopore позволяют осуществлять:
- •Проект «Геном человека» Human Genome Project (HGP) 1990 - 2004
- ••Проект начался в 1990 году, под руководством Джеймса Уотсона под эгидой Национальной организации
- •Принцип секвенирования методом "дробовика"
- •Повторяющиеся участки затрудняют правильную сборку последовательности
- •Метод «клон за клоном» (clone-by-clone)
- •Расположение индивидуальных клонов фрагментов генома, содержащихся в BAC, на физической карте генома определяется
- ••Знание расположения сайтов рестрикции в каждом из клонов позволило определить их местоположение на
- •Генная терапия
- ••Генная терапия, в широком смысле, означает лечение путем введения в ткани или клетки
- •Генная терапия ex vivo
- •Генная терапия in vivo
- •Методы генетической трансфекции в генной терапии
- •Векторные системы на основе вирусов
- •Ретровирусные векторы
- •Конструкции ретровирусных векторов
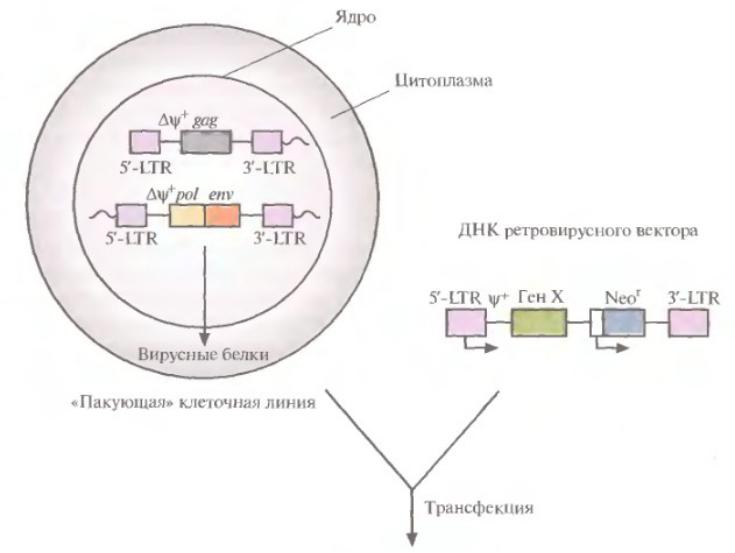
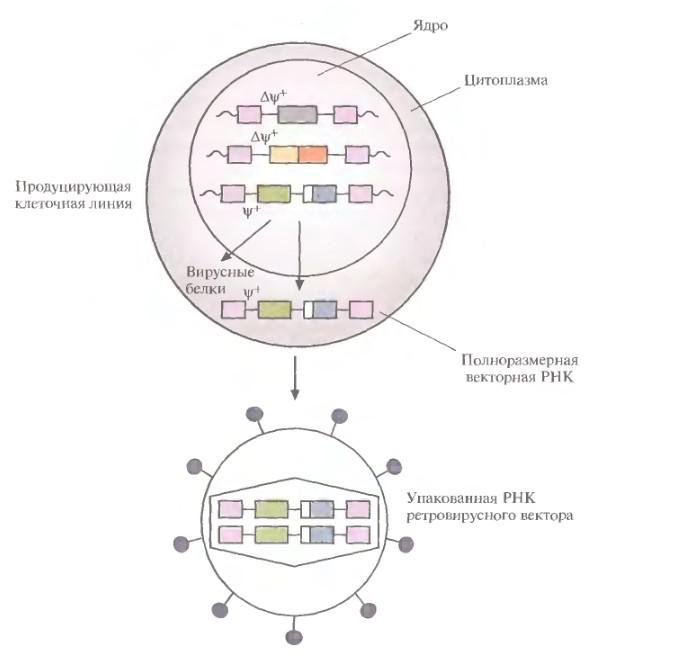
- •Пакующая клеточная линия
- •Аденовирусные векторы
- •Векторы на основе аденоассоциированных вирусов (ААВ)
- •Векторы на основе вируса простого герпеса (HSV)
- •Образование HSV-вектора с помощью рекомбинации
- •Невирусные системы трансфекции
- •Антисмысловые нуклеиновые кислоты
- •Расщепление мРНК под действием рибозимов
- •Коррекция сплайсинга РНК с помощью антисмысловых олигонуклеотидов
- •мкРНК-интерференция
- •Рекомендуемая литература
- •Благодарю за внимание!
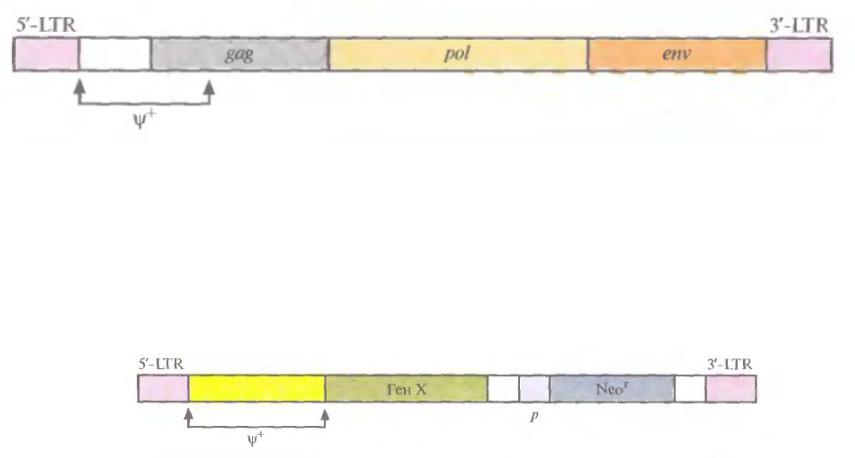
Конструкции ретровирусных векторов
Генетическая карта типичного ретровируса: ψ+-последовательность, ответственная за упаковку; gag, pol и env – области, кодирующие соответственно белок капсида, белок, обладающий активностью обратной транскриптазы и интегразы, и белок оболочки. 5ʹ-LTR
– long terminal repeat (содержит сигналы инициации транскрипции, причем весь геном транскрибируется как одна молекула РНК). 3ʹ-LTR – содержит сигнал полиаденилирования.
Генетическая карта ретровирусного вектора, несущего 2 гена. Транскрипция терапевтического гена Х контролируется 5ʹ-LTR-промотором. Транскрипция селективного маркерного гена Neor - внутренним промотором р. ψ+-последовательность, ответственная за упаковку; Максимальный размер ДНК-вставки ~ 8000 п. н.
Пакующая клеточная линия

Аденовирусные векторы
•Для получения аденовирусного вектора проводят котрансфекцию клеточной линии, синтезирующей продукты аденовирусного гена Е1 двумя участками генома аденовируса.
•Один из них может существовать в виде плазмиды в E. Coli и содержит вместо Е1-области «терапевтический» ген, фланкированный нуклеотидными последовательностями аденовируса.
•Второй представляет собой молекулу ДНК аденовируса, которая лишена 5ʹ-концевого участка, включающего Е1-область, и имеет перекрывающийся участок с несущей «терапевтический» ген плазмидой.
•Рекомбинация между двумя трансфецирующими фрагментами ДНК в области их перекрывания приводит к восстановлению полноразмерного аденовирусного гена, в котором вместо Е1-области находится терапевтический ген.
•Продукты гена Е1, поставляемые клеткой-хозяином, инициируют образование вирусных частиц, высвобождающихся из клетки в результате лизиса.
•Клонирующая ёмкость аденовирусного вектора составляет ~ 7,5 тыс. п.н.
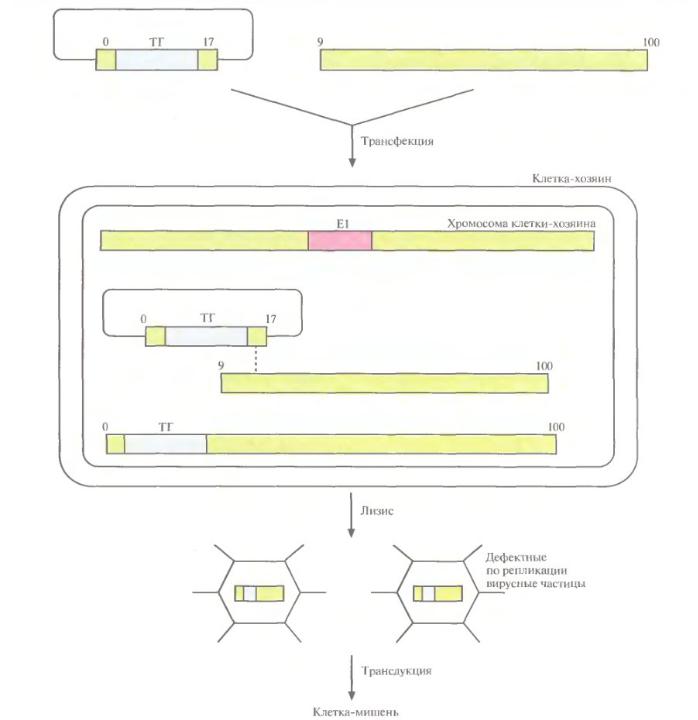

Векторы на основе аденоассоциированных вирусов (ААВ)
•ААВ – это небольшие непатогенные вирусы человека с одноцепочечным ДНК-геномом (4,7 тыс. п.н.), который может интегрировать в специфический сайт 19-й хромосомы.
•Для продуктивной инфекции им необходимы белки другого вируса (помошника), например, аденовируса.
•После того, как ААВ попадает в ядро, его геном с помощью полимераз клетки-хозяина преобразуется в 2-х цепочечную ДНК и транскрибируется.
•Рекомбинантный ААВ получают с помощью котрансфекции клетки-хозяина, инфицированной вирусом-помошником (аденовирусом) двумя плазмидами:
•1) Одна из них несет «терапевтический» ген, фланкированный инвертированными концевыми повторами (ITR) ААВ;
•2) Вторая плазмида несет 2 гена ААВ – rep и cap, ответственные соответственно за репликацию генома и синтез капсида;
•После лизиса инфицированных клеток рекомбинантные ААВ отделяют от аденовируса с помощью центрифугирования и диализа, а оставшиеся в образце аденовирусы инактивируют нагреванием.
•Клонирующая ёмкость ААВ – 4,5 тыс. п.н.
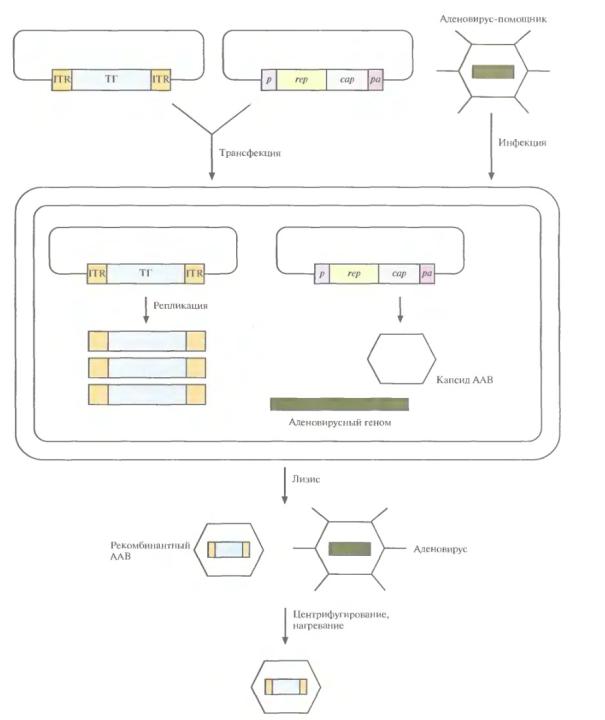
Векторы на основе вируса простого герпеса (HSV)
•Геном HSV представлен 2-х цепочечной ДНК (152 тыс. п.н.).
•Капсид вируса сливается с мембраной нейрона и его ДНК транспортируется в ядро.
•Репродуктивный цикл вируса состоит из литической (репликация ДНК и сборка вирусных частиц) и латентной (конденсация вирусного генома и активация как минимум 2-х так называемых латентно-ассоциированных промоторов) фаз.
•Для получения HSV-векторов в плазмиду E. Coli, которая способна переносить до 8 тыс. п.н. чужеродной ДНК, встраивают усеченный геном HSV, состоящий из точки инициации репликации (ori-сайт) и последовательности, ответственной за упаковку, а также «терапевтический» ген (ампликон-плазмида).
•Ампликон-плазмиды трансфецируют в инфицированную вирусом-помошником клетку-хозяин.
•ДНК ампликона реплицируется по типу «катящегося кольца»: внутренняя кольцевая цепь играет роль матрицы, а во внешней происходит разрыв и к свободной 3ʹ-концевой ОН-группе ковалентно присоединяются нуклеотиды.
•10 ампликонов, соответствующие полноразмерному геному HSV упаковываются в капсид, который поставляет HSV-помошник, геном которого лишен последовательности, ответственной за упаковку.
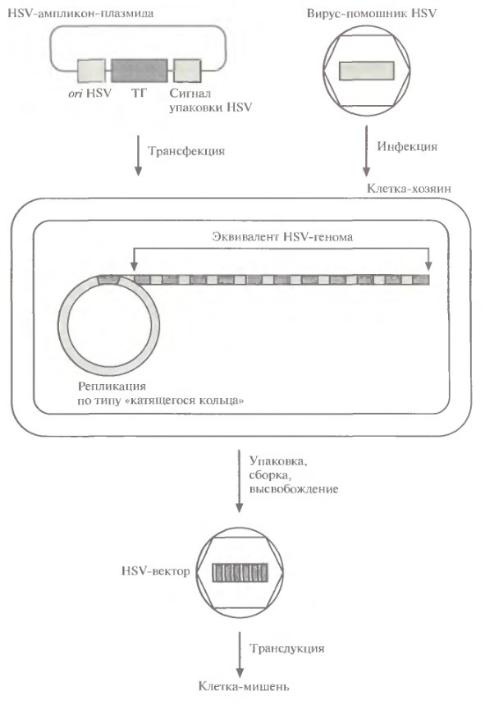

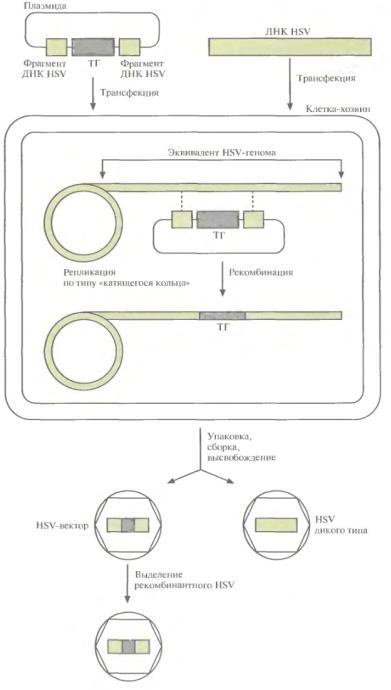
Образование HSV-вектора с помощью рекомбинации
•Проводят котрансфекцию клетки-хозяина плазмидой, которая содержит «терапевтический» ген, фланкированный последовательностями ДНК из вспомогательных областей HSV-генома, и ДНК HSV дикого типа.
•HSV-геном реплицируется в ядре по типу «катящегося кольца». При этом между фрагментами ДНК HSV, входящими в состав плазмиды и ДНК HSV дикого типа может произойти рекомбинация.
•Молекулы ДНК HSV дикого типа и рекомбинантного HSV упаковываются в вирусные частицы, высвобождающиеся из клетки после лизиса.
•Вирусы размножают и проводят скрининг бляшек для идентификации рекомбинантных HSV.