
- •Основные этапы развития патофизиологии (Гиппократ, Гален, Демокрит, Вирхов, Селье). Гуморальная и солидарная теория патологии, ятрофизическое и ятрохимическое направления в медицине.
- •6. Роль причины и условий в возникновении болезней, их диалектическая связь. Анализ некоторых представлений общей этиологии (монокаузализм, конституционализм, теории факторов и т.Д.).
- •8. Саногенез. Компенсаторные функции организма и их роль в механизмах выздоровления. Роль нервной, эндокринной и иммунной систем в выздоровлении.
- •9. Патологические процессы, связанные с механическими факторами – растяжением, разрывом, синдромом длительного раздавливания.
- •10. Патогенное действие повышенной температуры внешней среды на организм. Патогенез теплового и солнечного ударов. Ожоги и ожоговая болезнь.
- •11. Патогенное действие на организм низкой температуры. Общее охлаждение, отморожение, простудные заболевания. Применение искусственной гипотермии и гибернации с лечебной целью.
- •12. Повреждающее действие на организм ионизирующих излучений. Лучевая болезнь: классификация, стадии развития, патогенез и отдаленные последствия. Экологические аспекты данного вопроса.
- •13. Механизмы нарушения функций и причины смерти от электротравм. Первая помощь.
- •14. Роль наследственности в патологии, методы ее изучения. Сходство и различия приобретенных, врожденных, наследственных и семейных форм патологии. Их этиология.
- •17. Учение о конституции организма. Конституциональные типы: их классификация, различия и механизмы формирования. Значение конституции в патологии.
- •18. Понятие реактивности. Виды и механизмы реактивности. Формы индивидуальной реактивности и факторы, определяющие ее.
- •19. Резистентность организма – пассивная и активная, первичная и вторичная. Взаимосвязь реактивности и резистентности.
- •20. Определение понятия и общая характеристика гипоксии. Типы гипоксии. Устойчивость различных органов и тканей к гипоксии.
- •21. Этиология и патогенез основных видов гипоксии. Экстренные и долговременные адаптивные реакции при гипоксии, их механизмы.
- •22. Артериальная гиперемия, ее причины, признаки, механизмы развития. Особенности микроциркуляции, исходы и последствия различных видов артериальной гиперемии.
- •23. Венозная гиперемия, ее причины, признаки, механизмы развития. Особенности микроциркуляции. Последствия венозной гиперемии, патофизиологическое обоснование лечебного применения ее.
- •24. Местное малокровие, стаз. Причины и механизмы ее развития, последствия для организма. Коллатеральное кровообращение и его значение.
- •25. Тромбоз. Тромбогенные факторы и механизмы тромбообразования. Виды тромбов. Исходы тромбозов.
- •26. Эмболия. Причины и механизмы образования эмболов. Виды эмболий. Механизмы расстройств, возникающих при эмболиях.
- •27. Кровотечения, виды. Компенсаторно-приспособительные и патологические реакции при кровопотере. Методы экстренной остановки кровотечений и оказания помощи.
- •28. Определение понятия воспаление, его этиология. Основные компоненты воспалительного процесса. Общие и местные признаки воспаления.
- •29. Первичная и вторичная альтерация при воспалении. Особенности изменения обмена веществ, патохимические и физико-химические изменения в очаге воспаления.
- •30. Медиаторы воспаления. Их виды и происхождение, роль в развитии вторичной альтерации, общей динамике воспалительного процесса.
- •31. Эмиграции лейкоцитов при воспалении, ее механизмы, факторы хемотаксиса.
- •32. Фагоцитоз, его виды, стадии и механизмы. Патология фагоцитоза.
- •33. Реакция сосудов микроциркуляторного русла при воспалении. Динамика изменения кровотока, стадии и механизмы.
- •34. Экссудация. Механизмы возникновения воспалительных отеков. Состав и виды экссудатов.
- •35. Теории воспаления. Принципы классификации воспаления. Биологическое значение воспаления. Диалектическая взаимосвязь повреждения и защитно-приспособительных реакций в воспалительном процессе.
- •36. Лихорадка, определение, причины возникновения. Пирогенные вещества, их химическая природа и источники образования. Отличие лихорадки от экзогенного перегревания и других видов гипертермии.
- •39. Аллергические реакции 1 типа (реагиновые). Стадии, медиаторы аллергии 1 типа, механизмы их действия. Клинические проявления (анафилактический шок, атопические реакции).
- •40. Аллергические реакции 2 типа (цитотоксические). Стадии, медиаторы, механизмы их действия, клинические проявления.
- •41. Аллергические реакции 3 типа (иммунокомплексные). Стадии, медиаторы, механизмы их действия, клинические проявления (сывороточная болезнь, феномен Артюса).
- •42. Аллергические реакции 4 типа (клеточно-опосредованные). Стадии, медиаторы, механизмы их действия.
- •44. Этиология и патогенез различных видов шока, их сходства и различия (септический, гемотрансфузионный, кардиогенный). Основные принципы профилактики и терапии.
- •45. Шоковые реакции (коллапс, обморок). Определение, классификация, патогенез. Сходство и различия шока и коллапса.
- •46. Кома, определение, классификация, стадии или степени; неврологическая первичная кома, принципы терапии.
- •47. Нарушения энергетического и основного обмена. Роль нервной и эндокринной систем в патогенезе этих нарушений.
- •Нарушения основных этапов белкового обмена. Положительный и отрицательный азотистый баланс.
- •Нарушения углеводного обмена, гипо- и гипергликемия, их причины и виды. Экспериментальные модели недостаточности инсулина.
- •Сахарный диабет, его виды. Нарушения углеводного и других видов обмена и физиологических функций при сахарном диабете.
- •Нарушение основных этапов жирового обмена. Жировая инфильтрация и дистрофия. Гиперкетонемия. Виды ожирения.
- •Нарушение холестеринового обмена. Гиперхолестеринемия. Роль нарушений липидного обмена в развитии атеросклероза.
- •Патогенез нарушений водно-солевого обмена. Положительный и отрицательный водный баланс. Экспериментальное воспроизведение дегидратации и гипергидрии.
- •Отеки. Патогенетические факторы отеков: механический, мембраногенный, онкотический, осмотический. Патогенез сердечных, почечных, воспалительных, токсических, аллергических, голодных отеков.
- •Основные виды и причины обезвоживания организма. Изменения в организме при обезвоживании, последствия.
- •Нарушения электролитного обмена (натрия, кальция, магния). Основные причины и механизмы нарушений электролитного гомеостаза.
- •Жирорастворимые витамины и патологические процессы, связанные с их избытком и недостатком.
- •Водорастворимые витамины и патологические процессы, связанные с их избытком и недостатком.
- •Виды и стадии голодания. Изменения обмена веществ и функций организма при голодании.
- •61. Понятие о недостаточности кровообращения, ее формы и основные гемодинамические показатели и проявления. Сердечная недостаточность, ее виды, причины возникновения.
- •63. Патогенез недостаточности сердца и общих расстройств кровообращения при нарушениях внутрисердечной гемодинамики. Пороки клапанов сердца, их основные виды.
- •64. Нарушения коронарного кровообращения, этиология, патогенез ибс. Инфаркт миокарда.
- •65. Патология сердечного ритма, связанная с нарушением автоматизма. Виды, причины, механизмы возникновения и электрокардиографические проявления.
- •66. Патология сердечного ритма, связанная с нарушением возбудимости миокарда. Виды, причины, механизмы возникновения и электрокардиографические проявления. Фибрилляция и дефибрилляция сердца.
- •67. Патология сердечного ритма, связанная с нарушением проводимости миокарда. Виды, причины, механизмы возникновения и электрокардиографические проявления.
- •68. Первичная артериальная гипертензия (гипертоническая болезнь), ее этиология, патогенез, формы и стадии.
- •69. Вторичные (симптоматические) артериальные гипертензии. Их виды, причины, механизмы развития.
- •70. Артериальная гипотония. Гемодинамические механизмы гипотензивных состояний. Конституциональная гипотензия. Острые и хронические патологические гипотензии.
- •71. Характеристика понятия дыхательной недостаточности. Одышка, механизм ее возникновения. Асфиксия как проявление острой дыхательной недостаточности.
- •72. Нарушения регуляции внешнего дыхания. Патологические формы дыхания (периодическое дыхание, терминальное дыхание). Виды, этиология, патогенез.
- •73. Вентиляционные формы дыхательной недостаточности. Этиология, патогенез нарушения вентиляции легких по обструктивному типу.
- •74. Этиология, патогенез нарушения вентиляции легких по рестриктивному и смешанному типу. Пневмоторакс, этиология, виды, патогенез.
- •75. Диффузионные формы дыхательной недостаточности. Причины, проявления.
- •76. Нарушения легочного кровотока (перфузионные формы недостаточности), их причины, последствия. Соотношение вентиляции и перфузии в норме и при патологии.
- •77. Изменения общего количества циркулирующей крови: нормо-, гипо- и гиперволемии, их виды, механизмы возникновения и последствия для организма.
- •78. Нарушения регуляции эритропоэза. Регенеративные и дегенеративные формы эритроцитов, как показатели функционального состояния костного мозга.
- •79. Анемии, определение, причины их развития. Основные принципы классификации различных видов анемии.
- •80. Постгеморрагические анемии (острые и хронические). Этиология, патогенез, картина периферической крови и костного мозга, принципы терапии.
- •81. Анемии, связанные с нарушением синтеза гемоглобина (железодефицитные анемии). Этиология, патогенез, картина периферической крови и костного мозга.
- •83. Гипо- и апластические анемии. Этиология, патогенез, картина периферической крови и костного мозга, принципы терапии.
- •84. Первичные (наследственные) гемолитические анемии, этиология, патогенез, картина периферической крови и костного мозга, принципы терапии.
- •85. Вторичные гемолитические анемии, этиология, патогенез, картина периферической крови и костного мозга, принципы терапии. Гемолитическая болезнь новорожденных, ее патогенез.
- •86. Механизмы нарушения регуляции лейкопоэза. Лейкоцитарная формула и ее изменения. Лейкоцитозы и лейкопении, их типы, причины, механизмы развития.
- •87. Лейкемоидные реакции, их виды. Этиология, патогенез. Отличия от лейкозов, значение для организма.
- •89. Нарушение механизмов коагуляционного гемостаза. Гемофилия, этиология, патогенез. Принципы терапии.
- •90. Синдром диссеминированного внутрисосудистого свертывания крови. Этиология, патогенез, стадии, принципы терапии.
- •Патогенез и последствия нарушения аппетита, глотания, жевания. Гипер и гипосаливация. Кариес, пародонтоз.
- •Нарушения пережёвывания пищи.
- •Язвенная болезнь желудка и двенадцатиперстной кишки. Теории ульцерогенеза. Принципы лечения язвенной болезни.
- •Последствия удаления различных отделов желудочно-кишечного тракта. Патофизиология оперированного желудка.
- •Виды расстройства кишечного пищеварения, значение повреждения энтероцитов, панкреатической недостаточности, ахолии для кишечного пищеварения. Синдром мальабсорбции.
- •Взаимоотношения между желудочно-кишечным трактом и поджелудочной железой. Нарушения секреторной функции поджелудочной железы, острые и хронические панкреатиты, их патогенез.
- •Недостаточность печени. Этиология и патогенез. Основные проявления нарушений функций печени при ее недостаточности. Роль алкоголя и экологических факторов в этиологии заболеваний печени.
- •Печеночная кома. Этиология, патогенез, стадии.
- •Механическая желтуха. Этиология, патогенез, проявления, последствия.
- •Паренхиматозная желтуха. Этиология, патогенез, проявления, последствия.
- •Гемолитическая желтуха. Этиология, патогенез, проявления, последствия.
- •Желчекаменная болезнь. Причины и механизмы образования желчных камней, их виды. Последствия желчекаменной болезни для организма.
- •Патология мочеобразования и мочеотделения; изменение состава, удельного веса, количества мочи при патологии почек, механизмы их возникновения, последствия для организма.
- •Почечнокаменная болезнь, причины и механизмы образования почечных камней.
- •Основные проявления нарушений клубочкового аппарата почек (гломерулопатии), причины и последствия для организма.
- •Основные проявления нарушений канальцевого аппарата почек (проксимальной и дистальной реабсорбции, канальцевой секреции, экскреции).
- •Нефротический синдром, виды, патогенез.
- •Острая почечная недостаточность. Формы, этиология, патогенез, стадии, принципы лечения. Значение гемодиализа в лечении острой почечной недостаточности.
- •Хроническая почечная недостаточность. Этиология, стадии. Уремия, механизмы и проявления. Принципы лечения.
- •Патология, связанная с недостаточностью и избыточной секрецией гормонов передней доли гипофиза. Основные принципы классификации заболеваний гипофиза.
- •Гормоны задней доли гипофиза: патология, связанная с недостаточностью и избыточной секрецией их.
- •Патология, связанная с недостаточностью и избыточной секрецией гормонов коры надпочечников.
- •Патология околощитовидных желез. Значение нарушения функций околощитовидных желез для детского организма.
- •Патология щитовидной железы: влияние на обмен веществ, на состояние сердечно-сосудистой и нервной систем, влияние на рост и общее развитие.
- •Эндемический, спорадический и аутоиммунный зоб. Механизмы развития. Основные клинические проявления.
- •Патология половых желез. Гипо- и гиперфункция. Изменения в организме при нарушении деятельности мужских и женских половых желез.
- •Преждевременное половое созревание девочек.
- •Гипофункция (эндокринная недостаточность) яичников.
- •Гиперфункция яичников
- •Преждевременное первичное половое развитие мальчиков.
- •Задержка полового созревания мальчиков
- •Мужской гипогонадизм (тестикулярная недостаточность).
- •119. Боль, механизмы боли: рецепторный, проводниковой, центральный. Биологическое значение боли. Профилактика боли.
- •120. Неврозы у человека. Причины, компоненты невротического состояния. Роль типов высшей нервной деятельности в возникновении неврозов. Экспериментальные неврозы.
- •121. Нарушения функций вегетативной нервной системы, их виды и механизмы.
- •122. Нарушения движений: парезы, параличи, гиперкинезы. Их виды, причины, последствия для организма.
- •123. Нарушения различных видов чувствительности, их этиология и последствия для организма
Взаимоотношения между желудочно-кишечным трактом и поджелудочной железой. Нарушения секреторной функции поджелудочной железы, острые и хронические панкреатиты, их патогенез.
Взаимосвязь ЖКТ и панкреас основана на функциях железы: экзокринная (секреция панкреатического сока, содержащего пищеварительные ферменты), экскреторная (выделение мочевины и ЛС через ЖКТ), эндокринная (участие в обмене макронутриенов, всасывающихся в ЖКТ).
Причины нарушения секреторной функции: закрытие протока поджелудочной железы, панкреатиты, повреждение ткани поджелудочной железы (опухоль, инфаркт, атеросклероз).
Нарушения пищеварения при расстройствах экскреторной функции определяются ролью ее ферментов в пищеварительном процессе: амилаза, трипсин, липаза. Функции амилазы и трипсина могут компенсироваться пепсином и амилазой кишечного сока, в отличие от липидного обмена → поносы (нерасщепленный жир стимулирует прохождение пищевого комка по кишечнику), стеаторея, нарушение всасывания жирорастворимых витаминов (авитаминозы).
Последствия: синдром мальдигестии, синдром мальабсорбции, перемещение больших масс непереваренных пищевых веществ в толстую кишку, аутоагрессивное действие ферментов поджелудочной.
К развитию тяжелого для организма состояния ведет массивная потеря панкреатического сока (фистулы протока) → состояние негазового выделительного ацидоза (панкреатический сок имеет резко щелочную реакцию).
П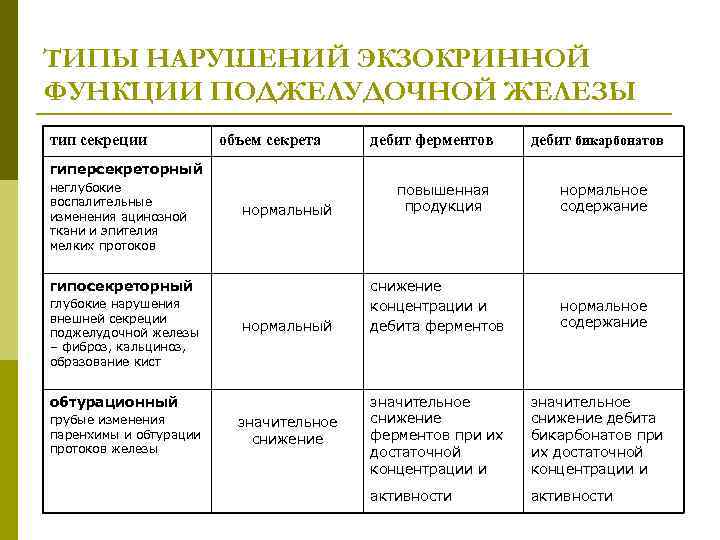 анкреатиты
- это воспалительные заболевания
поджелудочной железы различной этиологии,
но характеризующиеся общими
патогенетическими механизмами.
анкреатиты
- это воспалительные заболевания
поджелудочной железы различной этиологии,
но характеризующиеся общими
патогенетическими механизмами.
Этиология: злоупотребление алкоголем; травма (в том числе и при хирургических операциях); холециститы и ЖКБ, ведущие к рефлюксу желчи в вирсунгиеров проток; инфекции (вирусы гепатита, коксаки); лекарства (диуретики, некоторые антибактериальные и противовоспалительные препараты); пенетрация язвы двенадцатиперстной кишки в ткань.
Главное патогенетическое звено острых пакреатитов - самопереваривание поджелудочной железы преждевременно активированными панкреатическими ферментами + активный трипсин запускает внутренний путь коагуляционного гемостаза → тромбоз мелких сосудов → разрыв стенки сосудов и развитие геморрагий.
Три основных сценария преждевременной активации трипсиногена:
1. Закупорка панкреатического протока (желчные камни) → ↑ внутрипанкреатического давления, что приводит к застою секрета, богатого ферментами, и выходу в интерстициальное пространство. Поврежденная ткань начинают высвобождать провоспалительные медиаторы → ↑ проницаемость капилляров и развивается отек. Отек ухудшает кровообращение, способствует ишемическому повреждению ацинарных клеток (вторичное повреждение). Впоследствии высвобожденные из клеток лизосомальные гидролазы активируют трипсиноген с соответствующими последствиями.
2. Первичное повреждение ацинарных клеток (вирусы, ЛС, травмы, ишемия и шок).
3. Нарушение транспорта проферментов в ацинарных клетках. Пищеварительные ферменты и лизосомальные гидролазы в нормальных ацинарных клетках не встречаются друг с другом ни в каком компартменте клетки, их пути перемещения не скрещиваются, но может произойти сбой.
Соответственно патогенезу в клинике острого панкреатита различают стадии:
Энзимная токсемии;
Временная ремиссия (включение защитно-приспособительных механизмов);
Секвестрация и гнойные осложнения.
Клинически острый панкреатит проявляется сильной болью, локализующейся в эпигастральной области или около пупка; она может иррадиировать в спину или иметь опоясывающий характер; сосудистая гипотония; лейкоцитоз, гипергликемия, значительное повышение амилазы в крови. Вследствие отека головки поджелудочной железы и сдавления им общего желчного протока может развиться механическая желтуха.
Принципы патогенетической терапии острого панкреатита: ↓функциональной активности поджелудочной железы (голод, откачивание через зонд желудочного содержимого, чтобы оно не попадало в кишечник); препараты, ↓ протеолитическую активность; антибиотики в качестве профилактики инфекционных осложнений. Для снятия болевого синдрома - аналгезирующие препараты. В крайних случаях осуществляется хирургическое вмешательство с вскрытием капсулы и ее дренированием.
Хронический панкреатит (ХП) характеризуется развитием хронического воспаления в поджелудочной железе, необратимым разрушением экзокринной паренхимы, фиброзом, а на более поздней стадии болезни - деструкцией эндокринной части. Патогенез ХП полностью не выявлен. Ведущими механизмами развития хронического панкреатита являются:
Закупорка протоков (белковые пробки при употреблении алкоголя → кальцификация → обтурация протоков).
Токсическое действие. Различные токсины в том числе алкоголь и его метаболиты могут непосредственно повреждать ацинарные клетки.
Оксидативный стресс, опосредованный алкоголем, характеризующийся усилением продукции свободных радикалов, активацией перекисного окисления липидов мембранных структур + может способствовать слиянию лизосомальных и энзимогенных гранул, некрозу ацинарных клеток, воспалению и фиброзу.
Хронический панкреатит проявляется в основном приступами болей в животе, характеризуется развитием классической триады: панкреатические кальцификаты, мальабсорбция, сахарный диабет. Терапия хронического панкреатита: диетотерапия и лечение нарушений всасывания пищи в тонком кишечнике.
Общая этиология и патогенез заболеваний печени. Экспериментальное изучение функции печени (прямая и обратная фистула, полное и частичное удаление печени, ангиостомия, функциональные пробы печени).
В основе различных заболеваний печени чаще всего лежат такие патологические процессы, как воспаление, нарушения периферического кровообращения, обмена веществ, опухоли. Воспалительные поражения печени называются гепатитами, первичное изменение обмена веществ гепатоцитов с развитием дистрофии — гепатозами и обменными заболеваниями печени (например, жировой гепатоз или жировая дистрофия печени; гликогеноз), а диффузное разрастание соединительной ткани на фоне дистрофии, некроза паренхимы и перестройки структуры органа — циррозом печени.
К этиологическим факторам, вызывающим болезни печени и синдромы, относятся следующие:
1) инфекционные
2) токсические вещества — экзогенного (алкоголь; лекарственные препараты — ПАСК-натрий, сульфаниламиды, биомицин, тетрациклин, цитостатики) и эндогенного происхождения (продукты распада тканей при ожоге, некрозе; токсикоз беременности);
3) физические факторы — ионизирующая радиация (лучевой гепатит), механическая травма;
4) алиментарные факторы — белковое, витаминное голодание, жирная пища;
5) аллергические реакции — при введении вакцин, сывороток, пищевых и лекарственных аллергенов;
6) нарушение кровообращения в печени местного (ишемия, венозная гиперемия, тромбоз, эмболия) и общего характера (при сердечно-сосудистой недостаточности);
7) эндокринные и обменные нарушения в организме (сахарный диабет, гипертиреоз, ожирение);
8) опухоли — первичные (гепатокарцинома) и метастатические (при раке желудка, легких, молочной железы, лейкозные инфильтраты);
9) генетические дефекты обмена (наследственные ферментопатии), врожденные пороки анатомического положения и структуры печени вследствие нарушения внутриутробного развития.
В патогенезе поражений печени различной этиологии две разновидности патологических реакций:
1) прямое повреждение печени этиологическим фактором (вирусы, химические вещества, нарушение кровотока), проявляющееся дистрофическими изменениями в ней вплоть до некроза;
2) аутоиммунное повреждение печени вследствие появления аутоантигенов (патологически измененные компоненты гепатоцитов, образовавшиеся при прямом поражении печени) и развития аутоаллергических реакций гуморального и клеточного типа. Последние углубляют повреждение печени в результате микроциркуляторных нарушений (под влиянием БАВ, активированных при реакции антиген — антитело) и иммунного цитолиза при участии Т-киллеров.
Компенсаторные реакции: усиление метаболических процессов в печени, фагоцитоза, увеличение экскреции токсических веществ, перераспределение крови, развитие анастомозов. Печень обладает выраженной способностью к регенерации, что проявляется как при резекции, так и диффузном поражении печеночной ткани (регенерационная гипертрофия печени). При этом происходит пролиферация гепатоцитов с полным или частичным восстановлением структуры печени.
Прямая и обратная фистула.
Прямая фистула Экка - создание у собак соустья между нижней полой и воротной венами с одновременной перевязкой воротной вены выше соустья. После этой операции вся кровь, оттекающая от органов брюшной полости, начинает поступать, минуя печень, в нижнюю полую вену. В итоге создается возможность оценивать антитоксическую функцию печени. Появление симптомов, связанных с выключением этой функции, зависит от состава потребляемой пищи животными. Через 3-4 дня при кормлении мясной пищей или через 10-12 дней при использовании молочно-растительной диеты у животных появляются атаксия, «манежные» движения, периодически возникают клонические и тонические судороги. Снижается синтез белка, нарушается образование желчи и холестерина, нарастает содержание аммиака в крови.
Обратная фистула Экка-Павлова. Суть: после наложения порто- кавального анастомоза он предложил перевязывать нижнюю полую вену выше соустья. При этом в печень устремляется кровь не только из желудочно-кишечного тракта, но и из задней половины туловища, что приводит к повышению давления в воротной вене с развитием портальной гипертензии. Через 3-4 недели после наложения обратной фистулы формируются достаточно развитые кава-кавальные и порто-кавальные коллатерали, что позволяет удалить печень без серьезных нарушений системного кровообращения. Однако полное удаление печени несовместимо с жизнью, поскольку уже в ближайшие 5-8 часов после этой операции у собак появляется мышечная слабость, адинамия, гипогликемия с развитием гипогликемической комы, вызывающей гибель животного. Если собакам после экстирпации печени вводить глюкозу, то их жизнь можно продлить до 12-15 часов. В этой ситуации гибель животных наступает на фоне неуклонного нарастания в крови аммиачных соединений и снижения содержания мочевины.
Полное и частичное удаление печени. Печеночно-клеточная недостаточность моделируется хирургическим удалением печени.
Полное удаление печени производят в несколько этапов:
I — накладывают обратную фистулу Экка-Павлова (анастомоз между воротной и НПВ и перевязка последней выше соустья) для того, чтобы переполнение печени кровью от всей нижней половины туловища привело к развитию мощных коллатералей, отводящих кровь, минуя печень, в верхнюю полую вену (через v. thoracicae internae);
II — через 4-6 нед перевязывают воротную вену выше анастомоза;
III — удаляют печень.
Через 3-8 ч после операции собаки погибают от гипогликемической комы. Введение глюкозы удлиняет им продолжительность жизни до 40 ч; смерть наступает при симптомах недостаточности кровообращения и дыхания. На основании обнаруженных при этом изменений биохимического состава крови было установлено участие печени в обмене веществ, свертывании крови и дезинтоксикационных процессах.
Частичное удаление печени позволяет изучить особенности регенерации этого органа. Экстирпация даже 75 % массы печени не вызывает функциональной недостаточности ее, и в течение 4-8 нед она полностью восстанавливает свою массу за счет гиперплазии оставшихся частей.
А нгиостомия
по Лондону. У собак в
стенку крупных вен (воротной и печеночной)
вшивают канюли, дающие возможность в
хроническом опыте получать кровь,
притекающую к печени и оттекающую от
нее. С помощью этого метода удалось
исследовать участие печени в различных
нарушениях межуточного, белкового,
углеводного, солевого обмена и
билирубинообразования. Метод ангиостомии
позволяет также получить в эксперименте
данные о барьерной и обезвреживающей
функциях печени.
нгиостомия
по Лондону. У собак в
стенку крупных вен (воротной и печеночной)
вшивают канюли, дающие возможность в
хроническом опыте получать кровь,
притекающую к печени и оттекающую от
нее. С помощью этого метода удалось
исследовать участие печени в различных
нарушениях межуточного, белкового,
углеводного, солевого обмена и
билирубинообразования. Метод ангиостомии
позволяет также получить в эксперименте
данные о барьерной и обезвреживающей
функциях печени.
Определение дезинтоксикационной функции печени с помощью пробы Квика на синтез гиппуровой кислоты. При этой пробе больному внутривенно вводится бензойнокислый натрий, из которого в печени синтезируется гиппуровая кислота, а затем определяется её количество в моче. При поражении гепатоцитов синтез гиппуровой кислоты снижается до 20 - 10% от должного.
