
4 курс / ВПХ ВПТ / ВУЦ РостГМУ / vpt_fpv
.pdf131
При преимущественном облучении конечностей течение и исход болезни зависят от степени тяжести и распространенности радиационного поражения кожи и подкожных тканей конечностей.
Главное проявление периода первичной реакции — первичная эритема, которая при воздействии больших доз может сопровождаться отеком и болью и сохраняться до 4–5 сут. Тошнота, рвота, головная боль выражены чрезвычайно слабо. Для этого периода типична стойкая лимфопения и характерные биохимические сдвиги (повышение активности креатинфосфокиназы и диастазы в крови, креатинурия), свидетельствующие о деструктивных изменениях в тканях.
Продолжительность скрытого периода зависит от дозы и площади поражения; чем они больше, тем период короче.
Период разгара характеризуется выраженной болью в пораженных конечностях, обусловленной поражением сосудов, нарушением микроциркуляции, развитием язвеннонекротического процесса и тяжелой эндогенной интоксикацией.
Для периода восстановления характерна более быстрая нормализация гематологических показателей, чем местных изменений. Полное восстановление возможно лишь при поражениях легкой степени. У остальных пострадавших возникают атрофические и склеротические процессы в коже, подкожной клетчатке и мышцах, дистрофические изменения в суставах, приводящие в большинстве случаев к инвалидности.
2.2.2.2. Диагностика и лечение радиационных поражений от неравномерного облучения.
При диагностике поражений, вызванных неравномерным облучением следует учитывать все их особенности, о которых говорилось выше: отсутствие характерной периодизации и последовательности появления различных симптомов, несоответствие выраженности некоторых проявлений болезни и ее тяжести в целом и др. Надо также иметь в виду, что при неравномерных лучевых поражениях существенно снижается информативность дозиметрических показателей. Поэтому важное место в диагностике этих поражений имеет сопоставление ранних симптомов болезни со сведениями о местонахождении или положении пострадавшего в момент облучения, сравнение характера и степени выраженности местных и общих проявлений (наличие первичной эритемы, минимальные гематологические изменения при общем тяжелом состоянии, наличие орофарингеального синдрома при умеренных диспептических нарушения и т. д.).
Основные принципы лечения лучевых поражений от неравномерного облучения такие же, как при «классической» ОЛБ. Однако в каждом отдельном случае может вставать вопрос о лечебных мероприятиях, необходимых в связи с определенной локализацией максимального поражения. Появление в ранние сроки после облучения первичной эритемы требует назначения анальгетиков, глюкокортикоидных мазей или аэрозолей, а также других средств, уменьшающих боль и воспалительный процесс в коже. Показаны десенсибилизирующие средства, препараты, улучшающие кровообращение и микроциркуляцию. Сохранность значительных долей кроветворной ткани, как правило, исключает необходимость трансплантации костного мозга, в то же время оправдано применение гемопоэтических ростовых факторов, особенно в случаях поражения кишечника. Потребность в эритро- и тромбомассе может оказаться больше, чем при соответствующей тяжести равномерного облучения, так как тяжелые некротические изменения в тканях и их инфицирование часто приводят к развитию очень глубокой и стойкой анемии, увеличению угрозы геморрагических проявлений. Необходимо более раннее, чем при равномерном облучении, применение антибиотиков, при этом назначение антибактериальной терапии должно базироваться не только и не столько на тяжести гематологических изменений, сколько на выраженности
132
поражений кожи и других мягких тканей. Большое значение имеет контроль микрофлоры в очагах местных поражений с определением ее чувствительности к антибиотикам.
Довольно часто пострадавшим от неравномерного облучения необходимо хирургическое лечение (резекция кишечника, обширная некрэктомия с последующей пластикой, ампутация пораженной конечности и т. д.).
2.2.3. Радиационные поражения от внутреннего радиоактивного заражения (внутреннего облучения)
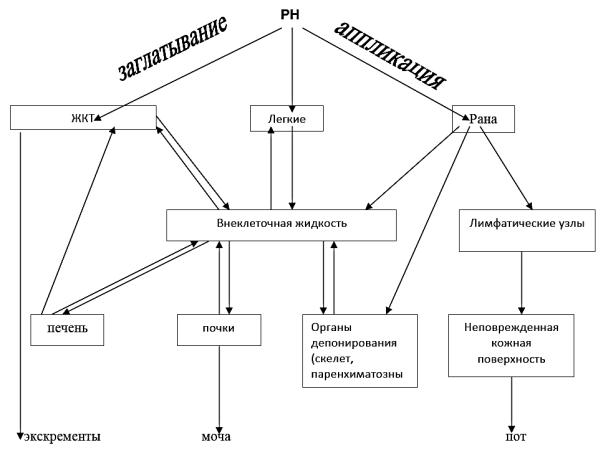
При попадании и задержке внутри организма радиоактивных веществ в количествах, превышающих предельно допустимые уровни, также может развиться лучевая болезнь, которая имеет ряд особенностей по сравнению с заболеванием, возникшим от внешнего воздействия ионизирующих излучений. Они связаны с физико-химическими свойствами радионуклидов, путями проникновения их в организм, особенностями распределения по органам и тканям, путями и временем выведения во внешнюю среду (рис. 2.14).
Рисунок 2.14. Схема поступления и циркуляции радионуклидов (РН) в организме
По способности преимущественно накапливаться в тех или иных органах и тканях выделяют следующие группы радиоактивных веществ:
—равномерно распределяющиеся в организме (диффузный тип) — цезий, рубидий, полоний, калий, натрий и др.;
—избирательно откладывающиеся в костях (скелетный тип) — барий, кальций, радий, стронций и др.;
—избирательно накапливающиеся в органах, богатых элементами ретикулоэндотелиальной системы (ретикулоэндотелиальный тип), — лантан, церий, празеодим;
133
— избирательно накапливающиеся в щитовидной железе — йод. Заражение радиоактивными веществами может произойти при их вдыхании, заглатывании, попадании на раневые и ожоговые поверхности и крайне редко — через неповрежденную кожу.
Основные группы распределения радиоактивных элементов в организме представлены в таблице 2.21.
Таблица 2.21
Основные группы распределения радиоактивных элементов в организме
Группа |
Радиоизотопы |
Тип распределения |
I |
Стронций, уран, радий иттрий, цир- |
Преимущественно накапливаются |
|
коний, плутоний и др. |
в скелете (скелетный тип) |
|
|
|
II |
Прометий, актиний, торий, амери- |
Преимущественно накапливаются |
|
ций, четырехвалентный плутоний и |
в печени (ретикулоэндотелиальный |
|
др. |
тип) |
|
|
|
III |
Цезий, инобий, рутений, полоний, |
Распределяются равномерно |
|
теллур, сурьма и др. |
(диффузный тип) |
IV |
Йод |
Накапливается в щитовидной железе |
Радионуклиды, поступающие различными путями, взаимодействуют с различными средами и тканями организма, при этом происходят их метаболические преобразования, для которых наряду с их физико-химической структурой имеют большое значение размеры и растворимость частиц, период циркуляции, влияние средств, применяемых для их выведения.
В боевых условиях лучевое поражение от внутреннего облучения возникает крайне редко, лишь в случаях поступления в организм в течение короткого времени большого количества радионуклидов при условии их равномерного распределения по органам и тканям. Оно, как правило, будет встречаться в сочетании с внешним облучением, при этом решающим явится внешнее облучение. Более типична для внутреннего радиоактивного заражения хроническая лучевая болезнь.
Проявления болезни складываются из симптомов общего и избирательного поражения организма. Больных беспокоят снижение работоспособности, эмоциональная лабильность, расстройства сна и аппетита, неустойчивость гемодинамических показателей. В дальнейшем выявляются признаки поражения внутренних органов, кроветворной, нервной, костной и других систем.
Существует ряд закономерностей в развитии заболевания:
—отсутствие в течение относительно длительного времени какихлибо субъективных и объективных признаков заболевания;
—несоответствие между субъективными и объективными данными, в частности между самочувствием больного и гематологическими показателями;
—отсутствие четких границ между периодами;
—наиболее ранние клинические признаки поражения со стороны критических орга-
нов;
—замедление процессов восстановления.
При инкорпорации радионуклидов, равномерно распределяющихся в организме, заболевание во многом сходно с лучевой болезнью от общего внешнего равномерного облучения: доминирующими будут гематологический и геморрагический синдромы и синдром инфекционных осложнений.
134
В случаях попадания внутрь тела радионуклидов, избирательно откладывающихся в костях, наиболее ранние изменения выявляются в костной и кроветворной системах. Для этого варианта ОЛБ характерны упорные боли в конечностях, ребрах, грудине, поясничнокрестцовом отделе позвоночника, возможны новообразования в костях и патологические переломы. Выраженное угнетение кроветворения, в дальнейшем — развитие системных заболеваний крови.
Поступление в организм радионуклидов, избирательно накапливающихся в органах, богатых элементами ретикулоэндотелиальной системы, приводит прежде всего к поражению печени, исходом которого может стать цирроз и образование опухолей, а также проксимальных отделов кишечника. В случаях инкорпорации нефротропных радионуклидов (уран, полоний) развиваются поражения почек.
При поступлении в организм йода (как ингаляционным, так и алиментарным путем) поражается щитовидная железа, что проявляется развитием лабораторного гипотиреоза, а в ряде случаев преходящей гиперфункции щитовидной железы, развитием аутоиммунного тиреоидита. В отдаленные сроки возможно возникновение аденомы и рака щитовидной железы (таб. 2.22).
|
|
|
|
|
|
Таблица 2.22 |
|
|
|
Характеристика некоторых радионуклидов |
|
||
Элементы |
|
Виды |
Период |
Период |
Пути |
|
|
|
излучения |
полураспада |
полувыведения |
выведения |
|
Радон – 222 |
α- |
и γ - |
3, 82 дня |
3,0 суток |
легкие |
|
|
|
|
|
|
|
|
Йод – 131 |
|
β- и γ - |
8,1 дней |
7,6 суток |
почки |
|
|
|
|
|
|
|
|
Стронций –89 |
β- |
и γ - |
51 день и 27 лет |
51 сутки |
кишечник, почки |
|
и 90 |
|
|
|
|
|
|
|
|
|
|
|
||
Цезий – 137 |
β- и γ - |
30 лет |
140 суток |
кишечник, почки |
||
|
|
|
|
|
|
|
Торий – |
232, |
α- |
и γ - |
Несколько лет |
вечно |
кишечник, почки |
230, 228 |
|
|
|
|
|
|
Плутоний |
– |
α- |
и γ - |
86 лет и 25000 |
46,7 лет; 99,6 суток |
почки |
238, 239 |
|
|
|
лет |
|
|
|
|
|
|
|
|
|
Полоний |
– |
α- |
и β- |
несколько ми- |
Сутки |
кишечник, почки |
218, 214, 210 |
|
|
нут, 138 суток |
|
|
|
|
|
|
|
|
|
|
При всех вариантах ОЛБ от внутреннего облучения выявляют существенное снижение иммунологической реактивности, выраженные метаболические расстройства, кахексию.
Исход заболевания зависит в первую очередь от характера и количества инкорпорированного радионуклида. Отдаленные последствия принципиально не отличаются от таковых при других видах радиационных поражений (рис. 2.15).

135
Рисунок 2.15 Вероятные осложнения при инкорпорации РВ в разные сроки заболевания.
В 70-х годах в клинике военно-полевой терапии проходили лечение больные с острой лучевой болезнью вызванной инкорпорацией бромистого радия. В диагностике этих форм лучевого поражения применялись спектрометрические и спектрографические методы, а в лечении – осмотические диуретики, комплексоны и другие, эффективные в то время средства. Опыт этих наблюдений описан в 1972 году в монографии Сафронова Е.И. «Лучевая болезнь от внутреннего облучения» (рис. 2.16).
Рисунок 2.16. Опыт лечения острой лучевой болезни от внутреннего облучения.
136
Диагностика лучевой болезни от внутреннего облучения строится на основании данных анамнеза (условия и возможный источник облучения, пути поступления в организм и др.), клинических проявлений, результатов дозиметрического, радиометрического и лабораторного обследования.
Обследование пораженных начинают с наружной радиометрии с помощью радиомет- ров-рентгенометров. С учетом того, что при наружном радиоактивном заражении регистрируют бета- и гамма-, а при внутреннем — только гамма-излучение, наружную радиометрию проводят до и после раздевания, а затем — до и после санитарной обработки.
При подтверждении факта внутреннего облучения оценивают активность радионуклида внутри тела либо методом прямого измерения с помощью счетчика излучения человека (СИЧ), либо методом косвенной оценки по данным радиометрии (спектрометрии) биосред. Последнее осуществляется для измерения активности радионуклидов, недоступных для исследования СИЧ.
Окончательный диагноз внутреннего радиоактивного заражения устанавливается после сопоставления результатов клинического и радиометрического исследований.
Лечение проводят по общим принципам комплексной терапии лучевой болезни от внешнего облучения, дополняя его средствами и методами, направленными на предупреждение дальнейшего проникновения радионуклидов внутрь и ускорение их выведения из организма.
Первые мероприятия по ограничению поступления радиоактивных веществ внутрь включают надевание респираторов и средств защиты кожи, удаление пострадавших из зоны радиоактивного загрязнения, проведение частичной санитарной обработки.
При поступлении РВ в желудочно-кишечный тракт используют средства, ограничивающие их всасывания и ускоряющие выведение из организма (таб. 2.23).
|
|
Таблица 2.23 |
Препараты для селективной сорбции и выведения радионуклидов |
||
Название |
Что выводит |
Способ применения |
препарата |
|
|
Абсорбар |
барий, стронций |
- 25 г препарата в полстакане воды сов- |
|
|
местно со слабительным |
|
|
|
Альгисорб |
стронций |
- по 5 г 3 раза в день при приеме пищи |
Пентацин |
плутоний, америций, |
- ингаляции 5% и 10% -го растворов по 20-30 |
|
иттрий, церий, цинк, |
мин; |
|
свинец |
- 5 мл 5%-го р-ра внутривенно; |
|
|
- по 1 таб (0,25) 2 раза в день через 1-2 дня |
|
|
|
Полисурьмин |
барий, стронций |
- 4 г в полстакане воды 3 р в день во время |
|
|
приема пищи в течение 7 суток |
Тримефацин |
уран, бериллий, плуто- |
- ингаляции 0,9 г препарата, растворенного |
|
ний, цирконий, ниобий |
в 20 мл хлорида кальция 15-20 мин; |
|
|
- 40,0 мл 5%-го р-ра внутривенно |
Унитол |
полоний |
- 5% р-р унитиола (из расчета 1 мл на 10 кг |
|
|
массы тела) через 6-8 часов внутримышечно |
|
|
|
Ферроцин |
цезий, рубидий |
- по 1 г (таб. 0,5) 3 раза в день в течение 2-4 |
|
|
недель |
|
|
|
Цинкацин |
плутоний, америций |
- ингаляции 10-20 мл 5%-го раствора; |
|
|
- 5 мл 5%-го р-ра внутривенно |
137
Назначение перечисленных препаратов сочетают с промыванием желудка, назначением клизм и приемом слабительных средств, водных нагрузок и приемом диуретиков. При ингаляционном поступлении РВ используют муколитики и отхаркивающие средства.
Для устранения эффектов инкорпорации радиоактивного йода применяют препараты стабильного йода, который препятствует фиксации радионуклида в щитовидной железе. К ним относится калия йодид (таблетки по 125 мг принимают один раз в сутки в течение недели); спиртовый раствор йода (2,5 или 5%) или раствор Люголя по 20 капель на стакан воды или молока 2 раза в сутки. Надо помнить, что защитный эффект препаратов йода значительно снижается в случаях его позднего применения (более чем через 2 ч после поступления в организм радиоактивного йода).
Отечественная медицина столкнулась с проблемой диагностики инкорпорации радионуклидов у большого контингента пострадавших при ликвидации последствий аварии на Чернобыльской АЭС в 1986 году.
Врезультате аварии на Чернобыльской АЭС сотни тысяч людей подверглись низкоинтенсивному воздействию ионизирующих излучений в дозах, не вызывавших развитие острой или хронической лучевой болезни. Тем не менее, вопрос о характере, масштабе ме- дико-социальных последствий и их связи с комплексом неблагоприятных факторов аварии оказался в центре внимания международной научной общественности и государств, непосредственно пострадавших от аварии. Это стало мощным стимулом для дальнейшего изучения биологических эффектов так называемых «малых доз радиации» и кафедральный коллектив активно включился в работу, направленную на всестороннее исследование возникшей проблемы. Научные исследования в этой области стали проводиться уже в 1986 году и продолжались много лет.
Участие сотрудников кафедры военно-полевой терапии в ликвидации последствий аварии на Чернобыльской АЭС началось с 29 апреля 1986 г. В этот день в клинику поступило 100 пострадавших. Оперативно, в течение короткого времени был налажен дозиметрический контроль и специальная обработка пострадавших, их обследование и лечение. Подавляющее большинство госпитализированных в той или иной степени нуждались в оказании психологической помощи.
Впервых числах мая для уточнения обстановки и координации работы представителей медицинской службы Вооруженных сил и органов здравоохранения к месту аварии выехал начальник кафедры ВПТ – главный радиолог МО СССР Г. И Алексеев, он находился
вЧернобыле 5 дней. Сотрудники кафедры работали в течение 32 дней в зоне Чернобыльской аварии в составе научной группы, в которую входили специалисты НИИ военной медицины МО СССР и НИИ зоологии им. И.И Шмальгаузена АН Украины. Научная группа занималась изучением различных аспектов состояния здоровья военнослужащих, работавших непосредственно на атомной электростанции (рис. 2.17).

138
Рисунок 2.17. Участие сотрудников кафедры военно-полевой теарпии в ликвидации последствий аварии на Чернобыльской АЭС.
Учитывая многочисленность военнослужащих, участвовавших в ликвидации последствий Чернобыльской аварии и подвергшихся радиационному многофакторному воздействию и возможную опасность развития неблагоприятных изменений в их организме, необходимо было разработать систему диспансерного наблюдения за ними. С целью формирования объединенной базы данных о состоянии здоровья военнослужащих, направленных в зону Чернобыльской катастрофы в 1986 году создается Всеармейский регистр Министерства обороны СССР, который впоследстви был включен в состав кафедры военно-полевой терапии как НИЛ «Медицинский регистр» (рис. 2.18). На регистр возлагались следующие задачи:
-персональный автоматизированный учет военнослужащих (членов их семей), пенсионеров и лиц гражданского персонала МО, подвергшихся радиационному воздействию в результате Чернобыльской аварии и других радиационных инцидентов;
-автоматизированный учет полученных ими доз радиоактивного облучения;
-учет результатов диспансерного динамического наблюдения за указанными категориями граждан, анализ изменений в состоянии их здоровья в последующие годы жизни;
-контроль сроков и объема ежегодных диспансерных наблюдений указанных категорий граждан.

139
Рисунок 2.18. Создание на кафедре военно-полевой терапии НИЛ «Медицинский регистр».
В базе данных регистра накоплена информация о состоянии здоровья 35 490 человек, подвергшихся радиационному воздействию, среди которых:
32302 ликвидатора аварии на ЧАЭС,1094 ликвидатора аварий на корабельных атомных энергетических установках,
998 участников испытаний ядерного оружия.
В настоящее время на активном учёте находится более 12 600 лиц, подвергшихся воздействию радиации из числа военнослужащих проходящих службу по контракту, членов их семей, пенсионеров МО и лиц гражданского персонала ВС РФ.
У ликвидаторов последствий аварии и лиц, длительно находившихся на радиоактивно загрязненной местности оценивалось влияние комплекса факторов аварии на их физическую и умственную работоспособность, изучалась патология сердечно-сосудистой системы
ивозможности ее коррекции, особенности патологических изменений слизистой оболочки ЖКТ, характер аллергических заболеваний, оценивалась эффективность применения антиоксидантов в качестве средств ранней терапии пострадавших. В ходе исследований были получены научные данные, способствующие формированию единого представления о роли малых доз ионизирующих излучений в развитии соматической патологии, как в ранний, так
ив отдаленный период после их воздействия.
В1990 году при кафедре под руководством Ю.Н. Шишмарёва создается научно-ис- следовательский центр клинической радиологии, а на территории клиники располагается Всероссийский центр экологической медицины (ВЦЭМ), который возглавил А.М. Никифоров (рис. 2.19). Эти центры изначально были предназначены для изучения медицинских и
140
экологических аспектов аварии на ЧАЭС. В этот период 75% пациентов клиники составляли участники ликвидации последствий Чернобыльской катастрофы. Это были не только военнослужащие, но и гражданские лица, направляемые городским радиологическим центром.
Рисунок 2.19. Cоздание научно-исследовательского центра клинической радиологии.
Сотрудниками кафедры и ВЦЭМ была разработана и осуществлялась комплексная научная программа, предусматривающая углубленное клиническое обследований ликвидаторов Чернобыльской аварии и других лиц, подвергшихся радиационному воздействию.
2.2.4 Местные радиационные поражения кожи и слизистых оболочек
Местные радиационные (лучевые) поражения (МЛП) относят к числу наиболее частых вариантов воздействия ионизирующих излучений на человека. Они возникают в результате локального или крайне неравномерного облучения при применении ядерного оружия, радиационных авариях или при несчастных случаях с источниками ионизирующих излучений. Степень локального облучения может быть очень велика, но несмотря на высокую поглощенную дозу, поражения в большинстве случаев оказываются совместимыми с жизнью благодаря ограниченности объема облученных тканей. Лишь в отдельных случаях, когда глубокому поражению подвергаются жизненно важные органы или большие объемы мягких тканей, МЛП может стать причиной смерти (таб. 2.24).
