
Какие-то билеты / Билет 11
.pdf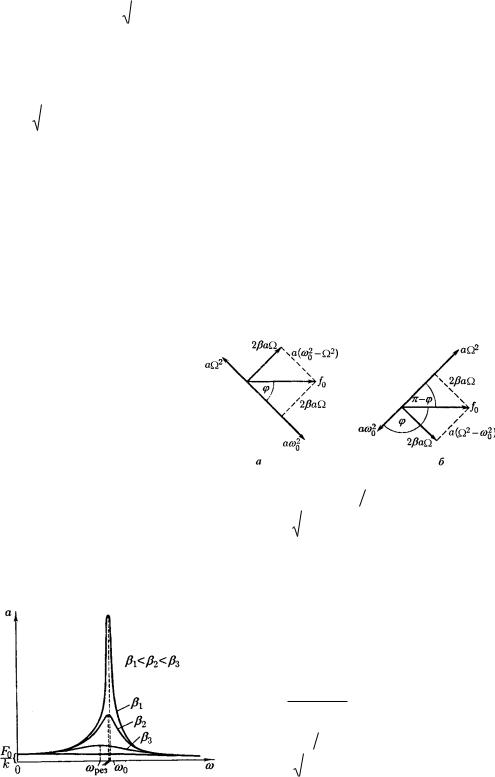
1.Вынужденные колебания. Резонанс
Вслучае, когда вынуждающая сила изменяется по гармоническому закону, колебания описываются дифференциальным уравнением следующего вида:
x 2 x 0 x f0 cos( t) (1) |
||
|
|
2 |
Здесь - коэффициент затухания, 0 – собственная частота системы, f0=F0/m (F0 - амплитуда вынуждающей силы), - частота вынуждающей силы.
Т.к. уравнение вынужденных колебаний является неоднородным, то его решение состоит из суммы общего и частного решения. Общее решение нам известно:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x(t) e t a |
0 |
cos( |
2 2 t ) |
|
|
|
|
|
|
|||||||
|
|
|
|
|
0 |
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Частное же решение будет выглядеть так: |
|
|
|
|
|
|||||||||||
x÷àñò |
a cos( t ) |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
f0 |
|
|
|
|
|
|
2 |
|
|
|
|
x |
|
|
|
|
|
|
|
|
t arctg |
|
|
|
||||
|
|
|
|
|
|
|
cos |
2 |
|
2 |
|
|
||||
|
|
|
2 |
|
|
|
||||||||||
|
|
|
02 2 4 2 2 |
|
|
|
|
|
0 |
|
|
|
. |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Частное решение можно получить с помощью векторной диаграммы. Предположим частное решение
имеет вид x=acos( t- ), тогда:
x a sin( t ) a cos( t  2)x 2a cos( t ) 2a cos( t )
2)x 2a cos( t ) 2a cos( t )
Подставляя полученное в исходное уравнение (1) получаем:
2 a cos( t ) 2 a cos( t  2) 02 a cos( t )
2) 02 a cos( t )
f 0 cos( t)
Ввиде векторных диаграмм это будет выглядеть так ( случай а) - < 0; случай б) - > 0):
f 02 a 2 ( 02 2 ) 4 a 2 2
Из данных векторных диаграмм следует, что : |
|
|
|
|||
a |
|
|
|
F0 |
m |
|
|
|
|
|
|
|
|
2 |
2 |
2 4 2 2 |
|
|||
|
|
|
||||
|
|
0 |
|
|
|
|
tg |
|
2 |
|
|
||
|
|
|
|
|
||
|
2 |
2 |
|
|
||
|
|
|
|
|
||
|
|
0 |
|
|
|
|
Зависимость амплитуды вынужденных колебаний от частоты вынуждающей силы приводит к тому, что при некоторой определенной для системы частоте амплитуда колебаний достигает максимального значения. Это явление называется резонансом, а соответствующая частота – резонансной частотой.
РЕЗ 
 20 2 2
20 2 2
aРЕЗ |
|
F0 m |
|
||
|
|
|
|
|
|
2 |
|
2 |
2 |
|
|
|
|
0 |
|
|
|
Изображенная на рисунке совокупность графиков функций, соответствующих различным значениям параметра , называется резонансными кривыми.

По поводу резонансных кривых можно сделать еще следующие замечания: при стремлении к нулю все кривые приходят к одному и тому же, отличному от нуля предельному значению, равному F0 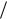 (m 20 ) т.е. F0/k.
(m 20 ) т.е. F0/k.
Зависимость от при разных значениях показан графически на графике (слева). Частоте 0 соответствует = /2. Резонансная частота меньше собственной. Следовательно в момент резонанса
< /2. При слабом затухании рез 0, и значение при резонансе можно считать равным /2.
2. Работа Газа при адиабатическом процессе
Если известна для некоторого обратимого процесса зависимость давления газа от объема, т.е.
функция p=f(V) работа, совершаемая в ходе этого процесса, вычисляется путем интегрирования:
V2
A12 |
|
p(V )dV |
(1.54) |
Здесь V1 |
и V2 — объем газа в начальном и конечном состояниях. Чтобы |
|
|
|
|
||||
|
V1 |
|
|
|
|
|
произвести интегрирование, нужно выразить р через V. Для этого воспользуемся связью между р и V |
||||||
при различных процессах. |
|
|
||||
Уравнение политропы |
идеального газа pVn=const можно написать |
следующим образом: pV |
||||
n=p1V1n=p2V2n, где р1V1 |
и р2,V2 |
— значения давления и объема газа |
соответственно в первом |
|||
(начальном) и втором (конечном) состояниях, р и V — давление и объем в любом промежуточном
состоянии. Выразим в соответствии с этим соотношением давление газа через его объем и значения параметров в начальном состоянии: p=p1V1n/Vn
|
|
A12 p1V n VV2 |
|
dV |
|
|
(1.55) |
|
|
||||||||||||||
Подстановка этого выражении в (1.54) дает: |
|
V |
|
|
Рассмотрим сначала случай |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
V2 dV |
|
|
1 |
|
|
1 |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|||
n 1: тогда интеграл в (1.55) равен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
n 1 |
|
n 1 |
|
|
|
|
|
|
|
|
|||||||||
V |
V n 1 |
|
|
|
|
|
|
Подставив это значение интеграла в |
|||||||||||||||
|
1 |
V1 |
V2 |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p V |
|
|
V |
n 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
1 1 |
1 |
|
1 |
|
(1.56) |
|
||||
(1.55) и произведя несложные преобразования, получим |
|
|
Полученное |
||||||||||||||||||||
12 |
|
|
|
n 1 |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
выражение можно преобразовать, воспользовавшись тем, что, какой бы процесс ни происходил с идеальным газом, его параметры связаны уравнением состояния. В частности, это справедливо и для
начального состояния: p1V1=(m/M)RT1 |
(1.57). Приняв во внимание (1.57), напишем выражение |
|||||||||||
|
|
m |
|
RT |
|
V |
n 1 |
|
|
|
||
|
A |
|
1 |
|
1 |
|
1 |
|
|
(1.58) |
|
|
(1.56) в виде |
|
|
|
|
|
Выражения (1.56) и (1.58) дают работу, |
||||||
12 |
M n 1 |
|
|
|
|
|
||||||
|
|
V2 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
совершаемую идеальным газом при любом политропическом процессе, кроме изотермического |
|||||||
(соответствующего n=1). В частности, при адиабатическом процессе |
|||||||
|
p V |
|
V |
|
1 |
|
|
A |
1 1 |
1 |
|
1 |
|
|
(1.59) èëè |
|
|
|
|||||
12 |
1 |
|
|
|
|
|
|
|
V2 |
|
|
||||
|
|
|
|
|
|
|
|
3. Агрегатное состояние вещества. Теплоѐмкость кристаллов. Закон Дюлонга-Пти.
Теплоемкость кристалла. Зная У(Г), находим, что теплоемкость единицы объема кристалла
Введем так называемую характеристическую температуру Дебая θ, определяемую условием
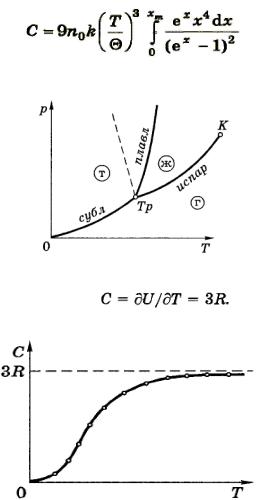
а также пешую переменную х — hv /kT. Тогда выражение для теплоемкости примет вид
где хт = hv /kT = θ/T. Выражение называют формулой Дебая
Отметим еще, что дебаевская температура θ указывает для каждого твердого тела область температур (T<θ), где становится
существенным квантование энергии колебаний.
В основе классической теории теплоѐмкости твѐрдых тел лежит закон равно распределения энергии по степеням свободы. Твѐрдое тело рассматривается как систему N независимых друг от друга атомов, имеющих по три колебательных степени свободы. На каждую из них приходиться в среднем энергии kT (kT/2
кинетической и kT/2 потенциальной). Имея в виду, что число колебательных степеней свободы 3N, получим, что внутренняя
энергия одного моля атомов U= 3NАkT = 3RT отсюда молярная теплоѐмкость:
В этом суть закона Дюлонга-Пти, который утверждает, что молярная теплоѐмкость всех химически простых твѐрдых тел одинакова и равна 3R. Этот закон выполняется достаточно хорошо только при сравнительно высоких температурах. Опыт показывает что при низких температурах теплоѐмкость убывает, стремясь к нулю при Т -> 0, по закону C~T^3.
