
- •1. Протонно-нейтронная теория строения атомного ядра. Изотопы, изобары
- •2. Распределение электронов в атомах элементов. Принцип Паули. Правило Гунда. Принцип наименьшей энергии. Напишите электронные формулы атомов элементов с порядковыми номерами 22 и 35.
- •4. Относительные атомные и молекулярные массы. Молярная масса. Моль как мера количества вещества. Закон Авогадро. Молярный объем газа при нормальных условиях.
- •5. Основные законы химии. Закон сохранения массы и энергии, закон постоянства состава, закон Авогадро, закон эквивалентов.
- •6. Эквивалент, молярная масса эквивалента. Закон эквивалентов. Определение эквивалентов и молярных масс эквивалентов элементов, оксидов, гидроксидов, кислот и солей. Приведите примеры расчетов
- •7. Структура периодической системы д.И.Менделеева. Энергия ионизации, сродство к электрону, электроотрицательность. Изменение химических свойств элементов в периодах и группах.
- •10. Типы химической связи: ионная, ковалентная, водородная, металлическая связь. Приведите примеры.
- •11. Типы химической связи. Ковалентная химическая связь. Ее свойства: насыщаемость, направленность, поляризуемость. Приведите примеры.
- •13. Экзотермические и эндотермические химические реакции. Закон термохимии Гесса. Расчеты теплового эффекта химических реакций. Энтальпия. Понятие об изобарно-изотермическом потенциале и энтропии.
- •14. Скорость химических реакций. Факторы, влияющие на скорость реакции. Закон действующих масс. Правило Вант-Гоффа. Константа скорости реакции
- •15. Обратимые химические реакции. Химическое равновесие, константа химического равновесия. Смещение химического равновесия. Принцип Ле Шателье.
- •17. Вода как электролит. Ионное произведение воды. Водородный показатель. Шкала рН для нейтрального, кислого и щелочного растворов.
- •18. Слабые электролиты. Степень диссоциации и константа диссоциации. Закон разбавления Оствальда. Влияние добавления одноименного иона на диссоциацию слабого электролита.
- •1. Водород. Строение атома и степени окисления. Гидриды. На основании электронных уравнений расставьте коэффициенты в реакции:
- •3. Магний. Строение атома и степени окисления. Оксид, гидроксид, соли. Отношение к кислотам. Закончите уравнение реакции и уравняйте его методом электронного баланса:
- •6. Углерод. Строение атома и степени окисления. Оксиды, водородные соединения. Угольная кислота и ее соли. Жесткость воды и методы ее устранения.
- •7. Азот. Строение атома и его степени окисления. Соединения азота с водородом. Синтез аммиака. Применение. Составьте электронные уравнения и расставьте коэффициенты в реакции:
- •10. Кислород. Строение атома и степени окисления. Перекись водорода и ее свойства. Расставьте коэффициенты в реакции, используя метод электронного баланса:
- •11. Сера. Строение атома и степени окисления. Сероводород и сероводородная кислота, ее соли. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, протекающей по схеме:
- •15. Галогены. Строение атомов и степени окисления. Водородные и кислородные соединения галогенов на примере хлора. На основании электронных уравнений расставьте коэффициенты в реакции:
- •17. Подгруппа инертных элементов. Строение атомов и степени окисления. На основании электронных уравнений расставьте коэффициенты в реакции:
- •18. Подгруппа меди. Строение атомов и степени окисления. Отношение к кислотам. Оксиды, гидроксиды. Закончите уравнения реакций и расставьте коэффициенты, используя метод электронного баланса:
- •20. Алюминий. Строение атомов и степени окисления. Оксид и гидроксид. Закончите уравнение реакции и напишите его в ионной форме:
6. Углерод. Строение атома и степени окисления. Оксиды, водородные соединения. Угольная кислота и ее соли. Жесткость воды и методы ее устранения.
C: 1s2 2s2 2p2. Атомы углерода в соединениях имеют степени окисления 4, 3, 2, 1, -1, -2, -4.
Оксид углерода II – СO – угарный газ
Оксид углерода IV - CO2 – углекислый газ
Угольная кислота- cлабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ – H2CO3
Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
CaCl2 + Na2CO3 → CaCO3↓ + NaCl
MgSO4 + Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2↑ + Na2SO4
7. Азот. Строение атома и его степени окисления. Соединения азота с водородом. Синтез аммиака. Применение. Составьте электронные уравнения и расставьте коэффициенты в реакции:
NH4NO3 = N2O + 2H2O
N-III - 4 e- → NI (окисление)
NV + 4 e- → NI (восстановле́ние)
N: 1s2 2s2 2p3. Атомы азота в соединениях имеют степени окисления 5, 4, 3, 2, 1, 0, -1, -2, -3.
нитрид водорода H3N
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты (контактным методом), соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
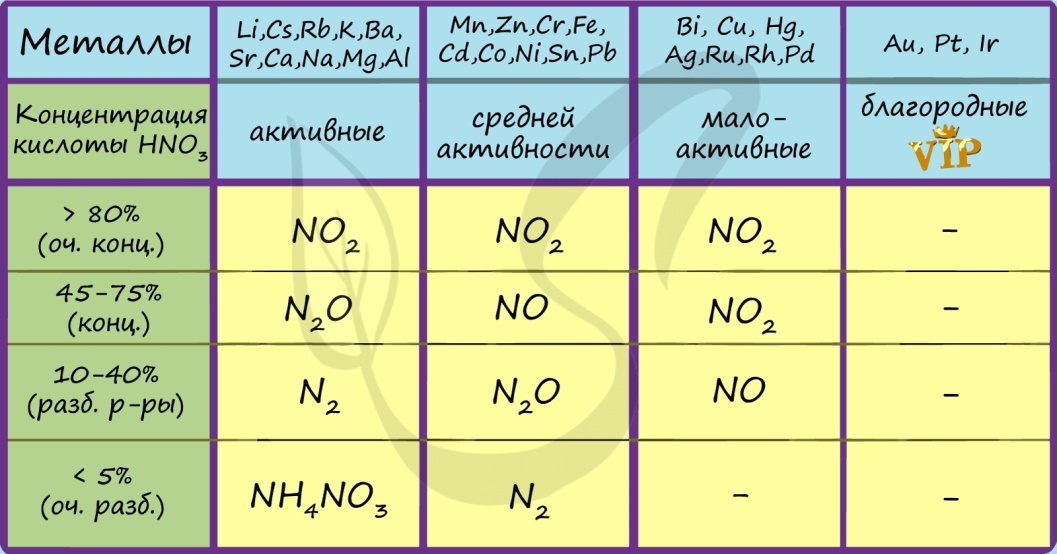
8. Азот. Строение атома и степени окисления. Оксиды, кислоты. Азотная кислота. Строение молекулы. Кислотные и окислительные свойства. Действие азотной кислоты на металлы и неметаллы. Закончите уравнения реакций и расставьте коэффициенты, используя метод электронного баланса:
3Ag + 4HNO3(разб.) 2 H2O + NO + 3 AgNO3
3 Ag0 - 3 e- → 3 AgI (окисление)
NV + 3 e- → NII (восстановле́ние)
Cu + HNO3(конц.) 2 H2O + 2 NO2 + Cu(NO3)2
Cu0 - 2 e- → CuII (окисление)
2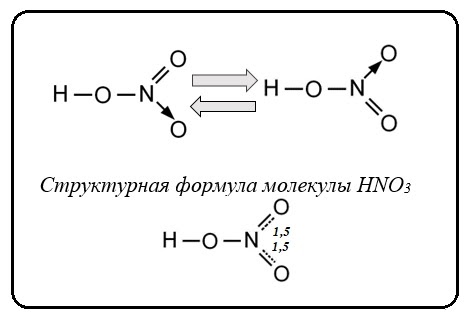 NV + 2 e- → 2 NIV (восстановле́ние)
NV + 2 e- → 2 NIV (восстановле́ние)
Оксид азота I - N2O
Оксид азота II – NO
Оксид азота III - N2O3
Оксид азота IV - NO2
Для азотной кислоты характерны свойства: общие с другими кислотами и специфические.
ХИМИЧЕСКИЕ СВОЙСТВА ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ
1. Очень сильная кислота.
Индикаторы в её растворе изменяют цвет на красный.
Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3-
2. Реагирует с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
3. Реагирует с основаниями
HNO3 + NaOH → NaNO3 + H2O
4. Реагирует с солями, вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
9. Фосфор. Строение атома и степени окисления. Соединения с водородом, оксиды, фосфорные кислоты и их соли. Фосфорные удобрения. На основе метода электронного баланса расставьте коэффициенты в уравнении реакции:
3P + 3HNO3 + 2H2O 3H3PO4 + 5NO
3 P0 - 15 e- → 3 PV (окисление)
5 NV + 15 e- → 5 NII (восстановле́ние)
P: 1s2 2s2 2p6 3s2 3p3. Атомы фосфора в соединениях имеют степени окисления 5, 4, 3, 2, 1, 0, -1, -2, -3.
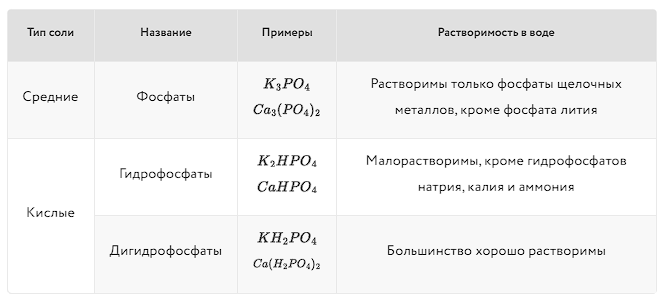
Существует несколько кислородсодержащих фосфорных кислот:
Ортофосфорная кислота - H3PO4 (трехосновная кислота, соли - фосфаты PO43-)
Метафосфорная кислота - HPO3 (одноосновная кислота, соли - метафосфаты PO3-)
Фосфористая - H3PO3 (двухосновная кислота, соли - фосфиты HPO32-)
Фосфорноватистая - H3PO2 (одноосновная кислота, соли гипофосфиты - H2PO2- )
Фосфорные удобрения – это минеральные вещества, основу которых составляет фосфор в доступной для растений форме. Производятся эти удобрения в основном из природных руд – апатита и фосфорита, которыми богата наша страна.
Фосфорные удобрения делятся на 2 группы:
водорастворимые – простой и двойной суперфосфат;
нерастворимые в воде – костяная мука, фосфоритная мука, термофосфаты, томасшлак и так далее
