
- •1. Протонно-нейтронная теория строения атомного ядра. Изотопы, изобары
- •2. Распределение электронов в атомах элементов. Принцип Паули. Правило Гунда. Принцип наименьшей энергии. Напишите электронные формулы атомов элементов с порядковыми номерами 22 и 35.
- •4. Относительные атомные и молекулярные массы. Молярная масса. Моль как мера количества вещества. Закон Авогадро. Молярный объем газа при нормальных условиях.
- •5. Основные законы химии. Закон сохранения массы и энергии, закон постоянства состава, закон Авогадро, закон эквивалентов.
- •6. Эквивалент, молярная масса эквивалента. Закон эквивалентов. Определение эквивалентов и молярных масс эквивалентов элементов, оксидов, гидроксидов, кислот и солей. Приведите примеры расчетов
- •7. Структура периодической системы д.И.Менделеева. Энергия ионизации, сродство к электрону, электроотрицательность. Изменение химических свойств элементов в периодах и группах.
- •10. Типы химической связи: ионная, ковалентная, водородная, металлическая связь. Приведите примеры.
- •11. Типы химической связи. Ковалентная химическая связь. Ее свойства: насыщаемость, направленность, поляризуемость. Приведите примеры.
- •13. Экзотермические и эндотермические химические реакции. Закон термохимии Гесса. Расчеты теплового эффекта химических реакций. Энтальпия. Понятие об изобарно-изотермическом потенциале и энтропии.
- •14. Скорость химических реакций. Факторы, влияющие на скорость реакции. Закон действующих масс. Правило Вант-Гоффа. Константа скорости реакции
- •15. Обратимые химические реакции. Химическое равновесие, константа химического равновесия. Смещение химического равновесия. Принцип Ле Шателье.
- •17. Вода как электролит. Ионное произведение воды. Водородный показатель. Шкала рН для нейтрального, кислого и щелочного растворов.
- •18. Слабые электролиты. Степень диссоциации и константа диссоциации. Закон разбавления Оствальда. Влияние добавления одноименного иона на диссоциацию слабого электролита.
- •1. Водород. Строение атома и степени окисления. Гидриды. На основании электронных уравнений расставьте коэффициенты в реакции:
- •3. Магний. Строение атома и степени окисления. Оксид, гидроксид, соли. Отношение к кислотам. Закончите уравнение реакции и уравняйте его методом электронного баланса:
- •6. Углерод. Строение атома и степени окисления. Оксиды, водородные соединения. Угольная кислота и ее соли. Жесткость воды и методы ее устранения.
- •7. Азот. Строение атома и его степени окисления. Соединения азота с водородом. Синтез аммиака. Применение. Составьте электронные уравнения и расставьте коэффициенты в реакции:
- •10. Кислород. Строение атома и степени окисления. Перекись водорода и ее свойства. Расставьте коэффициенты в реакции, используя метод электронного баланса:
- •11. Сера. Строение атома и степени окисления. Сероводород и сероводородная кислота, ее соли. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, протекающей по схеме:
- •15. Галогены. Строение атомов и степени окисления. Водородные и кислородные соединения галогенов на примере хлора. На основании электронных уравнений расставьте коэффициенты в реакции:
- •17. Подгруппа инертных элементов. Строение атомов и степени окисления. На основании электронных уравнений расставьте коэффициенты в реакции:
- •18. Подгруппа меди. Строение атомов и степени окисления. Отношение к кислотам. Оксиды, гидроксиды. Закончите уравнения реакций и расставьте коэффициенты, используя метод электронного баланса:
- •20. Алюминий. Строение атомов и степени окисления. Оксид и гидроксид. Закончите уравнение реакции и напишите его в ионной форме:
17. Вода как электролит. Ионное произведение воды. Водородный показатель. Шкала рН для нейтрального, кислого и щелочного растворов.
Вода является слабым амфотерным электролитом и диссоциирует с образованием протонов и анионов гидроксила H₂O 5 H+ + OH. Произведение концентраций этих ионов является постоянной величиной и называется ионным произведением воды Кв [H+].[OH] = = 10-14. Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода: рН = -lg[H+].
Поскольку концентрации ионов [H+] и [ОН], возникающих при диссоциации воды равны, то концентрация ионов водорода в чистой воде [H+] = 10-7, a рН=7. В кислой среде концентрация протонов [H+] растет, поэтому в кислых растворах pH < 7. В щелочной среде концентрация протонов [H+] падает, поэтому в щелочных растворах рН >7.
18. Слабые электролиты. Степень диссоциации и константа диссоциации. Закон разбавления Оствальда. Влияние добавления одноименного иона на диссоциацию слабого электролита.
Слабые электролиты: α < 30%: AB A+ + B-
HNO2, NH4OH, H3BO3, HCOOH, H2SO3, H₂S, HCN H2CO3, CH3COOH, H3PO4, HF, HCIO
Степень диссоциации увеличивается при разбавлении, повышении температуры и с увеличением полярности растворителя (самым полярным является вода).
Диссоциация слабых электролитов - процесс обратимый; одновременно с распадом молекул на ионы в растворе происходит соединение их в молекулы (ассоциация), например: CH3COOH ↔ CH3COO- + H+
Равновесие в растворах слабых электролитов, согласно закону действия масс, характеризуется константой равновесия, которая в данном случае называется константой диссоциации (Кд ). Величина Кд зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора; чем выше значение Кд , тем легче диссоциирует электролит.
Зависимость
между степенью диссоциации и константой
диссоциации слабого электролита,
диссоциирующего на два иона, выражается
законом разбавления Оствальда: При
разбавлении степень диссоциации слабого
электролита увеличивается:
Добавление одноименных ионов уменьшает степень диссоциации, что также согласуется с принципом Ле Шателье. Прибавление одноименных ионов уменьшает степень диссоциации.
19. Гидролиз солей. Факторы, влияющие на гидролиз. Случаи гидролиза различных типов солей. Приведите примеры гидролиза по катиону и по аниону. Изменение рН раствора при гидролизе. Протолитические равновесия. Константы кислотности и основности.
Гидролиз солей – это взаимодействие ионов солей с водой, приводящее к образованию слабого электролита и к изменению концентрации ионов водорода (рH раствора). Гидролизу подвергаются только те соли, в состав которых входят анионы слабой кислоты (PO4 3- , SO3 2- , CH3COO- , S 2- , CN- ) или/и катионы слабого основания (NH4 + , Zn2+ , Fe2+ , Cr3+ , Al3+). Катионы сильных оснований (К+ , Са2+, Ва2+ и т.п.) и анионы сильных кислот (SO4 2- , Cl- , NO3 - ) с ионами воды не образуют малодиссоциированных или малорастворимых соединений и поэтому соли, образованные сильными кислотами и основаниями, гидролизу не подвергаются; реакция среды нейтральная, рН=7.
1. Гидролиз солей, образованных катионом сильного основания и анионом слабой кислоты (CH3COONa, K2CO3 , Na2 S и др.), идет по аниону, связывая ион водорода из воды, с накоплением в растворе ионов гидроксила, что обуславливает щелочную среду раствора (pH > 7).
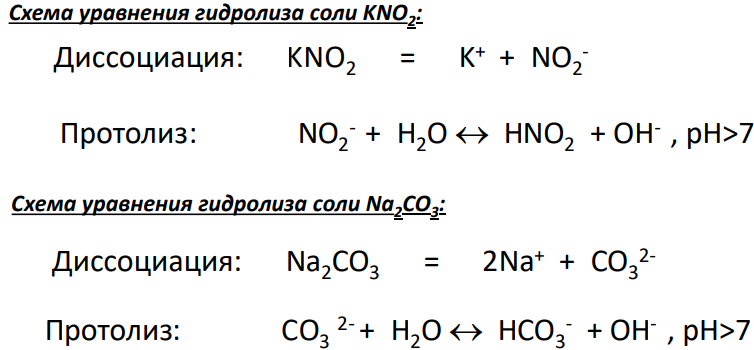
2. Гидролиз солей, образованных катионом слабого основания и анионом сильной кислоты (CuCl2 , NH4Cl, FeSO4 и др.), идет по катиону, связывая ионы гидроксила воды, с накоплением в растворе ионов водорода, что обуславливает кислую среду раствора, рН < 7.

Реакцию среды обуславливают ионы, которые накапливаются в избытке: Н+ (рН < 7); ОН- (рН > 7).
Равновесия, устанавливающиеся в растворах между кислотами и сопряженными основаниями, называют протолитическими.
Константа протолитического равновесия, определяющая полноту протекания протолиза слабой кислоты при данной температуре, называется константой кислотности.
СН3СООН + Н2О ↔ Н3О+ + СН3СОО–
Кк = |
[H3O+][CH3COO–] [CH3COOH] |
Аналогично для протолиза слабого основания
NH3·HOH ↔ NH4+ + OH–
существует константа основности, определяющая полноту протекания протолиза слабого основания при данной температуре
Кo = |
[NH4+][OH–] [NH3 · HOH] |
20. Жесткость воды. Временная и постоянная жесткость. Методы ее устранения.
Жесткость воды обусловливается содержанием в ней растворимых солей, преимущественно гидрокарбонатов, сульфатов, хлоридов кальция, магния, железа (II) и др., которые делают воду непригодной для многих технологических процессов.
В зависимости от того, какие соли присутствуют в воде, различают два вида жесткости: карбонатную (временную) Жв и некарбонатную (постоянную) Жп.
Карбонатную жесткость воде придают гидрокарбонаты кальция, магния и железа (II): Ca(HCO3)2, Mg(HCO3)2, Fe(HCO3)2 и др. При кипячении карбонатная жесткость устраняется за счет разложения гидрокарбонатов, при этом выпадает осадок в виде накипи:
Ca(HCO3)2![]() CaCO3
+ CO2
+ H2O
CaCO3
+ CO2
+ H2O
Mg(HCO3)2 MgCO3 + CO2 + H2O
Разложение гидрокарбоната магния сопровождается гидролизом образующегося карбоната с образованием осадков (MgOH)2CO3 и Mg(OH)2:
3MgCO3 + 2H2O (MgOH)2CO3 + Mg(OH)2 + 2CO2
Разложение гидрокарбоната железа (II) сопровождается полным его гидролизом до Fe(OH)2 с одновременным окислением в Fe(OH)3:
4Fe(HCO3)2 + O2 +2H2O = 4Fe(OH)3 + 8CO2.
Карбонатную жесткость можно устранить также добавлением в виде щелочи (обычно гидроксида кальция), например:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O.
Некарбонатную жесткость воде придают хлориды и сульфаты кальция и магния: CaCl2, MgCl2, CaSO4, MgSO4 и др. Эти соли при кипячении воды остаются в растворе, поэтому некарбонатную жесткость нельзя устранить кипячением воды. Ее устраняют химическим путем, например добавлением карбоната натрия (соды) Na2CO3, фосфата натрия (Na3PO4) или гидроксида кальция (гашеной извести) Са(ОН)2.
21. Окислительно-восстановительные реакции (ОВР). Степень окисления и ее определение. Классификация ОВР. Сильные окислители и восстановители. Электронный баланс и электронно-ионные уравнения полуреакций.
ОВР протекают с изменением степеней окисления атомов, входящих в состав молекул реагирующих веществ.
Классификация ОВР
1. Межмолекулярные – окислитель и восстановитель находятся в разных веществах Mg(0) + H2 (+1)SO4 → Mg(+2) SO4+ H2 (0)
2. Внутримолекулярные – окислитель и восстановитель в одном веществе
2KCl(+5)O3 (-2) → 2KCl(-1) + 3O2 (0)
3. Дисмутация (диспропорционирование)
Au(+1)F = Au(+3)F3 + 2Au0
2NO2 + H2O = HNO2 + HNO3
4. Конмутация (синпропорционирование)
N(-3)H4N(+3)O2 = N0 2 + 2H2O
2H2 S (-2) + S(+4)O2 = 3S0 + 2H2O
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону, чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона, чтобы окислить его до нейтрального атома.
Вещества, являющиеся окислителями во многих реакциях, представляют собой типичные (сильные) окислители. К ним относятся F2, Cl2, O2, KClO3, H2SO4, HNO3, KMnO4, MnO2, K2Cr2O7, PbO2 и др. Типичными (сильными) восстановителями являются H2, C (графит), Zn, Al, Ca, KI, HCl (конц.), H2S, CO и др.
Электронный баланс - число ē, отдаваемых восстановителем, равно числу ē, принимаемых окислителем.

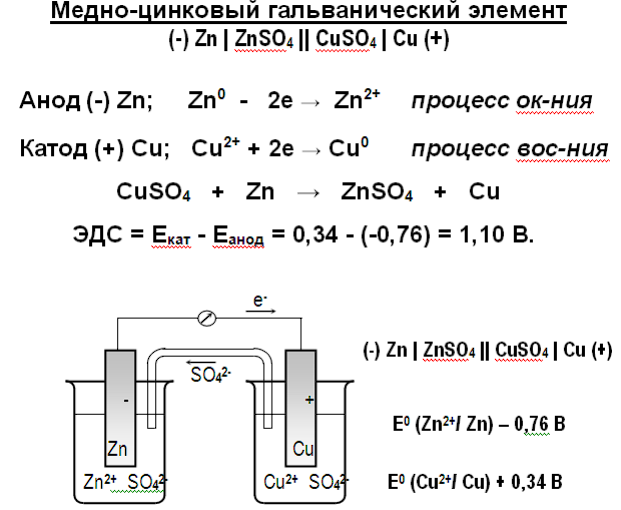
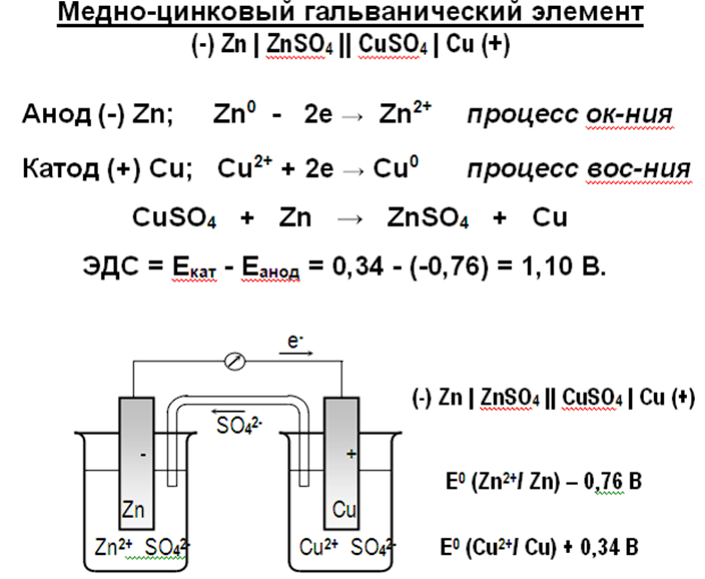
22. Понятие об электродных потенциалах. Направление ОВР. Ряд напряжений металлов. Медно-цинковый гальванический элемент. Электронные уравнения катодного и анодного процессов. ЭДС гальванического элемента. Уравнение Нернста.
![]()
Стандартный электродный потенциал φо ок.ф./вст. ф измеряют по отношению к стандартному водородному электроду:
2Н+ (р) + 2ē ⇆ Н2 (г) ; φо (2H +/H2 ) = 0 В
Δ G° 298 = -nF (° ок – ° вс
Критерий протекания ОВР в стандартных условиях • ОВР протекает в прямом направлении в стандартных условиях, если Δ° = °(Ок) – °(Вс) > 0 В
ОВР протекает в обратном направлении в стандартных условиях, если Δ ° = °(Ок) – °(Вс) < 0 В



23. Коррозия металлов. Химическая и электрохимическая коррозия. Процессы, происходящие на электродах микрогальванического элемента при коррозии технического цинка в кислой среде. Защита металлов от коррозии.
Химическая коррозия — это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены.
Электрохимическая коррозия – взаимодействие металла с коррозионной средой, при котором ионизация металла и восстановление окислителя протекают раздельно, но являются сопряженными процессами, сопровождающимися протеканием электрического тока.
Методы защиты металлов от коррозии
1) Легирование. Применяется для изменения или улучшения физических и химических свойств металлов, сплавов. В особенности, для придания металлам и сплавам повышенной коррозионной стойкости. Металл, подвергшийся легированию, называется легированным.
2) Наиболее распространены неметаллические защитные покрытия –эмали, лаки, краски, пластмассы, различные смолы, полимеры. Защитное действие этих покрытий сводится в основном к изоляции металлов от окружающей среды.
3) Металлические защитные покрытия. Классифицируя металлопокрытия по способу защиты основного металла, их обычно подразделяют на катодные и анодные.
