- •1. Протонно-нейтронная теория строения атомного ядра. Изотопы, изобары
- •2. Распределение электронов в атомах элементов. Принцип Паули. Правило Гунда. Принцип наименьшей энергии. Напишите электронные формулы атомов элементов с порядковыми номерами 22 и 35.
- •4. Относительные атомные и молекулярные массы. Молярная масса. Моль как мера количества вещества. Закон Авогадро. Молярный объем газа при нормальных условиях.
- •5. Основные законы химии. Закон сохранения массы и энергии, закон постоянства состава, закон Авогадро, закон эквивалентов.
- •6. Эквивалент, молярная масса эквивалента. Закон эквивалентов. Определение эквивалентов и молярных масс эквивалентов элементов, оксидов, гидроксидов, кислот и солей. Приведите примеры расчетов
- •7. Структура периодической системы д.И.Менделеева. Энергия ионизации, сродство к электрону, электроотрицательность. Изменение химических свойств элементов в периодах и группах.
- •10. Типы химической связи: ионная, ковалентная, водородная, металлическая связь. Приведите примеры.
- •11. Типы химической связи. Ковалентная химическая связь. Ее свойства: насыщаемость, направленность, поляризуемость. Приведите примеры.
- •13. Экзотермические и эндотермические химические реакции. Закон термохимии Гесса. Расчеты теплового эффекта химических реакций. Энтальпия. Понятие об изобарно-изотермическом потенциале и энтропии.
- •14. Скорость химических реакций. Факторы, влияющие на скорость реакции. Закон действующих масс. Правило Вант-Гоффа. Константа скорости реакции
- •15. Обратимые химические реакции. Химическое равновесие, константа химического равновесия. Смещение химического равновесия. Принцип Ле Шателье.
- •17. Вода как электролит. Ионное произведение воды. Водородный показатель. Шкала рН для нейтрального, кислого и щелочного растворов.
- •18. Слабые электролиты. Степень диссоциации и константа диссоциации. Закон разбавления Оствальда. Влияние добавления одноименного иона на диссоциацию слабого электролита.
- •1. Водород. Строение атома и степени окисления. Гидриды. На основании электронных уравнений расставьте коэффициенты в реакции:
- •3. Магний. Строение атома и степени окисления. Оксид, гидроксид, соли. Отношение к кислотам. Закончите уравнение реакции и уравняйте его методом электронного баланса:
- •6. Углерод. Строение атома и степени окисления. Оксиды, водородные соединения. Угольная кислота и ее соли. Жесткость воды и методы ее устранения.
- •7. Азот. Строение атома и его степени окисления. Соединения азота с водородом. Синтез аммиака. Применение. Составьте электронные уравнения и расставьте коэффициенты в реакции:
- •10. Кислород. Строение атома и степени окисления. Перекись водорода и ее свойства. Расставьте коэффициенты в реакции, используя метод электронного баланса:
- •11. Сера. Строение атома и степени окисления. Сероводород и сероводородная кислота, ее соли. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, протекающей по схеме:
- •15. Галогены. Строение атомов и степени окисления. Водородные и кислородные соединения галогенов на примере хлора. На основании электронных уравнений расставьте коэффициенты в реакции:
- •17. Подгруппа инертных элементов. Строение атомов и степени окисления. На основании электронных уравнений расставьте коэффициенты в реакции:
- •18. Подгруппа меди. Строение атомов и степени окисления. Отношение к кислотам. Оксиды, гидроксиды. Закончите уравнения реакций и расставьте коэффициенты, используя метод электронного баланса:
- •20. Алюминий. Строение атомов и степени окисления. Оксид и гидроксид. Закончите уравнение реакции и напишите его в ионной форме:
6. Эквивалент, молярная масса эквивалента. Закон эквивалентов. Определение эквивалентов и молярных масс эквивалентов элементов, оксидов, гидроксидов, кислот и солей. Приведите примеры расчетов
Закон эквивалентов (Рихтер, Венцель, 1873) Массы реагирующих веществ m1 и m2 прямо пропорциональны эквивалентным массам МЭ1 и МЭ2 этих веществ: m1 /m2 = МЭ1 /МЭ2 . Объемы взаимодействующих газообразных веществ прямо пропорциональны их эквивалентным объемам: V1 /V2 =VЭ1 /VЭ2 . Если первое вещество является твердым или жидким, а второе – газом, то закон эквивалентов можно записать в следующем виде: m1 /V2 = МЭ1 /VЭ2 . Для реакций, протекающих в растворах, выполняется следующее соотношение: Сн1 V1 = Сн2 V2 , где Сн1 и Сн2 – молярные концентрации эквивалента веществ в растворах, моль/л; V1 и V2 – объемы растворов веществ.
Эквивалент элемента (Э) – это такое его количество (моль), которое соединяется с одним моль атомов водорода или замещает один моль атомов водорода в химических реакциях. Масса одного эквивалента элемента или сложного вещества называется молярной массой его эквивалента Мэ (эквивалентной массой), выражается в г/моль и равна произведению молярной массы на величину эквивалента: Мэ = М×Э Для газообразных веществ используется понятие эквивалентного объема – объема, занимаемого одним эквивалентом газа при нормальных условиях. Эквивалентные объемы газообразных водорода и кислорода при н.у. равны, соответственно, 11,2 и 5,6 л.

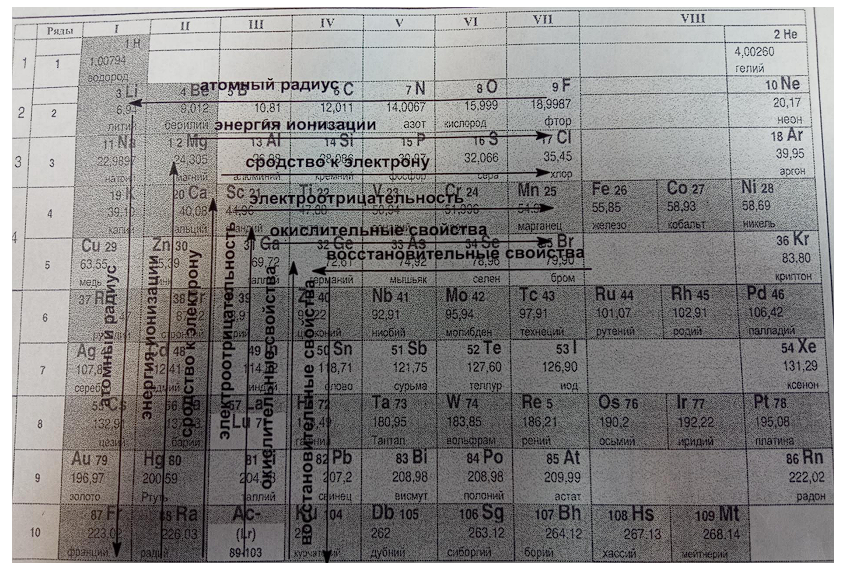
7. Структура периодической системы д.И.Менделеева. Энергия ионизации, сродство к электрону, электроотрицательность. Изменение химических свойств элементов в периодах и группах.
Химические элементы по структуре невозбужденных атомов подразделяются на естественные совокупности, что отражено в периодической системе в виде горизонтальных и вертикальных рядов — периодов и групп.
Периодическая система (естественная классификация элементов по электронным структурам их атомов) - Свойства элементов и их соединений находятся в периодической зависимости от величины заряда ядра атомов.
Хим. св-ва элемента обусловлены его способностью терять или приобретать ё. Меры этой способности:
энергия ионизации (ЭИ) (мера металлич. и восстановит. св-в элемента) - энергия, необходимая для отщепления е от ато- ма с образованием катиона.
сродство к электрону (ЭС) (мера неметаплич. и окислит. св-в) - энергия процесса присоединения ё к атому с образованием аниона.
Электроотрицательность (по Малликену - (ЭИ+ЭС)/2 - способность атома притягивать ё.
Изменение св-в элементов и их соединений по группам и периодам.
- металлич. св-ва возрастают вниз по группам (увелич радиус; уменьш. ЭИ) и снижаются вдоль периода (увелич. ЭИ);
- неметаллич. св- а снижаются вниз по группам (увелич. радиус, ЭИ, снижается ЭС ЭО) и возрастают вдоль периода (увеличивается Э. и ЭО)
8. Современная формулировка периодического закона Д.И.Менделеева. Сущность периодического закона в свете современной теории строения атома. Электронные семейства: s-, p-, d- и f-элементы. Их краткая характеристика. Приведите примеры.
«Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер атомов элементов».
Во-первых, начало каждого периода совпадает с началом заполнения нового энергетического уровня в атоме. Значение номера этого уровня (n) равно номеру периода. В этом заключается физический смысл номера периода.
Во-вторых, число электронов на внешней электронной оболочке атома А-группы равно номеру группы, в которой размещён соответствующий этому атому химический элемент. В этом заключается физический смысл номера группы. Максимальное число электронов на внешней электронной оболочке атомов не превышает восьми (табл. 6).
Электронные семейства или блоки элементов включают s-, p-, d- и f-элементы.
- s-элементы находятся в первом блоке периодической системы и имеют последнюю заполненную электронную оболочку s-типа. Они характеризуются высокой химической активностью и образуют ионы с положительным зарядом. s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Валентными являются s-электроны внешнего уровня. Примеры: литий (Li), натрий (Na), калий (K).
- p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I и VII). Валентными являются s- и p- электроны внешнего уровня. Примеры: кислород (O), фтор (F), хлор (Cl).
- d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона (y 46Pd – нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s – и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи). Примеры: железо (Fe), медь (Cu), цинк (Zn).
- f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6 – м (4f – элементы) и 7 – м (5f – элементы) периодах периодической системы. 4f – элементы объединяют в семейство лантаноидов, а 5f – элементы – семейство актиноидов. Примеры: уран (U), плутоний (Pu), америций (Am).
9. Периодический закон Д.И.Менделеева. Строение периодической системы. Изменение металлических и неметаллических свойств элементов по периодам и группам. S-, p-, d- и f-электронные семейства, их характеристика. Приведите примеры.
См бил. 8