
- •1. Протонно-нейтронная теория строения атомного ядра. Изотопы, изобары
- •2. Распределение электронов в атомах элементов. Принцип Паули. Правило Гунда. Принцип наименьшей энергии. Напишите электронные формулы атомов элементов с порядковыми номерами 22 и 35.
- •4. Относительные атомные и молекулярные массы. Молярная масса. Моль как мера количества вещества. Закон Авогадро. Молярный объем газа при нормальных условиях.
- •5. Основные законы химии. Закон сохранения массы и энергии, закон постоянства состава, закон Авогадро, закон эквивалентов.
- •6. Эквивалент, молярная масса эквивалента. Закон эквивалентов. Определение эквивалентов и молярных масс эквивалентов элементов, оксидов, гидроксидов, кислот и солей. Приведите примеры расчетов
- •7. Структура периодической системы д.И.Менделеева. Энергия ионизации, сродство к электрону, электроотрицательность. Изменение химических свойств элементов в периодах и группах.
- •10. Типы химической связи: ионная, ковалентная, водородная, металлическая связь. Приведите примеры.
- •11. Типы химической связи. Ковалентная химическая связь. Ее свойства: насыщаемость, направленность, поляризуемость. Приведите примеры.
- •13. Экзотермические и эндотермические химические реакции. Закон термохимии Гесса. Расчеты теплового эффекта химических реакций. Энтальпия. Понятие об изобарно-изотермическом потенциале и энтропии.
- •14. Скорость химических реакций. Факторы, влияющие на скорость реакции. Закон действующих масс. Правило Вант-Гоффа. Константа скорости реакции
- •15. Обратимые химические реакции. Химическое равновесие, константа химического равновесия. Смещение химического равновесия. Принцип Ле Шателье.
- •17. Вода как электролит. Ионное произведение воды. Водородный показатель. Шкала рН для нейтрального, кислого и щелочного растворов.
- •18. Слабые электролиты. Степень диссоциации и константа диссоциации. Закон разбавления Оствальда. Влияние добавления одноименного иона на диссоциацию слабого электролита.
- •1. Водород. Строение атома и степени окисления. Гидриды. На основании электронных уравнений расставьте коэффициенты в реакции:
- •3. Магний. Строение атома и степени окисления. Оксид, гидроксид, соли. Отношение к кислотам. Закончите уравнение реакции и уравняйте его методом электронного баланса:
- •6. Углерод. Строение атома и степени окисления. Оксиды, водородные соединения. Угольная кислота и ее соли. Жесткость воды и методы ее устранения.
- •7. Азот. Строение атома и его степени окисления. Соединения азота с водородом. Синтез аммиака. Применение. Составьте электронные уравнения и расставьте коэффициенты в реакции:
- •10. Кислород. Строение атома и степени окисления. Перекись водорода и ее свойства. Расставьте коэффициенты в реакции, используя метод электронного баланса:
- •11. Сера. Строение атома и степени окисления. Сероводород и сероводородная кислота, ее соли. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, протекающей по схеме:
- •15. Галогены. Строение атомов и степени окисления. Водородные и кислородные соединения галогенов на примере хлора. На основании электронных уравнений расставьте коэффициенты в реакции:
- •17. Подгруппа инертных элементов. Строение атомов и степени окисления. На основании электронных уравнений расставьте коэффициенты в реакции:
- •18. Подгруппа меди. Строение атомов и степени окисления. Отношение к кислотам. Оксиды, гидроксиды. Закончите уравнения реакций и расставьте коэффициенты, используя метод электронного баланса:
- •20. Алюминий. Строение атомов и степени окисления. Оксид и гидроксид. Закончите уравнение реакции и напишите его в ионной форме:
15. Галогены. Строение атомов и степени окисления. Водородные и кислородные соединения галогенов на примере хлора. На основании электронных уравнений расставьте коэффициенты в реакции:
3Cl2 + 6KOH(горячий раствор) 5KCl + KClO3 + 3H2O
5 Cl0 + 5 e- → 5 Cl-I (восстановле́ние)
Cl0 - 5 e- → ClV (окисление)
Cl: 1s2 2s2 2p6 3s2 3p5. Атомы хлора в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1.
HF - фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
HCl - хлороводород (газ), соляная кислота (жидкость)
HBr - бромоводород, бромоводородная кислота
HI - йодоводород, йодоводородная кислота
HAt - астатоводород, астатоводородная кислота
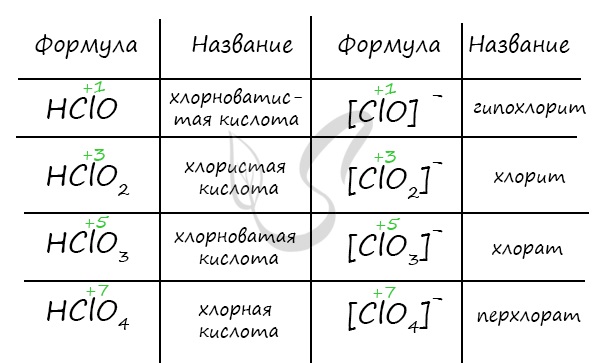
16. Бром и иод. Строение атомов и степени окисления. Галогенводородные кислоты и их соли, получение и применение. Оксиды и кислородсодержащие кислоты. На основании электронных уравнений расставьте коэффициенты в реакции:
I2 + H2S = S + 2HI
S-II - 2 e- → S0 (окисление)
2 I0 + 2 e- → 2 I-I (восстановле́ние)
Br: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5. Атомы брома в соединениях имеют степени окисления 7, 5, 4, 3, 1, 0, -1.
Бромоводород HBr - ядовитый бесцветный газ с резким запахом, дымящий на воздухе из-за взаимодействия с парами воды. Хорошо растворим в воде: при 0° C в одном объеме воды растворяется 612 объемов бромоводорода. Раствор - сильная одноосновная бромоводородная кислота. Соли - бромиды бесцветные кристаллы, хорошо растворимые в воде (нерастворим AgBr, бледно-желтого цвета). Оксид брома(I) Br2O., газ коричневого цвета. Образуется при действии брома на HgO в CCl4. Свойства ... Бромноватистая кислота HBrO- сильный окислитель. Образуется при растворении брома в воде, под действием света разлагается на HBr и кислород; обладает слабыми кислотными свойствами, существует только в растворе. Соли - гипобромиты, KBrO, NaBrO - получены в свободном состоянии в виде кристаллогидратов. Все они очень неустойчивы, при нагревании (или подкислении растворов) распадаются на бромид и бромат: 3КВrO = 2KBr + KBrO3 Бромиты, соли неизвестной даже в растворе бромистой кислоты HBrO2 - образуются при окислении гипобромитов бромом в щелочной среде: Ba(BrO)2 + 2Br2 + 4KOH = Ba(BrO2)2 + 4KBr + 2H2O Бромноватая кислота, HBrO3 - концентрированный раствор представляет собой бесцветную сиропоообразную жидкость. Соли - броматы. Бромноватая кислота и броматы являются сильными окислителями: 2S + 2NaBrO3 = Na2SO4 + Br2+ SO2 Бромная кислота HBrO4 существует в водных растворах с концентрацией, не превышающей 6 моль/л. Несмотря на то, что HBrO4 - самый сильный окислитель среди кислородных кислот брома, реакции с ее участием протекают очень медленно.
I: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5. Атомы иода в соединениях имеют степени окисления 7, 5, 3, 1, 0, -1.
Йодоводород, газ, очень похож по своим свойствам на хлороводород, но отличается более выраженными восстановительными свойствами. Очень хорошо растворим в воде (425:1), концентрированный раствор йодоводорода дымит вследствие выделения HI, образующего с водяными парами туман. В водном растворе принадлежит к числу наиболее сильных кислот. Иодоводород уже при комнатной температуре постепенно окисляется кислородом воздуха, причем под действием света реакция сильно ускоряется: 4HI + O2 = 2I2 + 2H2O Восстановительные свойства иодоводорода заметно проявляются при взаимодействии с концентрированной серной кислотой, которая при этом восстанавливается до свободной серы или даже до H2S. Поэтому HI невозможно получить действием серной кислоты на иодиды. Обычно иодоводород получают действием воды на соединения иода с фосфором - РI3. Последний подвергается при этом полному гидролизу, образуя фосфористую кислоту и йодоводород: РI3 + ЗН2О = Н3РО3 + 3HI Раствор иодоводорода (вплоть до 50%-ной концентрации) можно также получить, пропуская H2S в водную суспензию иода. Иодиды, соли иодоводородной кислоты. Иодид калия применяют в медицине - в частности, при заболеваниях эндокринной системы, фотореактивы. Иодноватистая кислота - HOI является амфотерным соединением, у которого основные свойства несколько преобладают над кислотными. Может быть получена в растворе взаимодействием йода с водой I2 + Н2О = НI + НОI Иодноватая кислота - НIO3 может быть получена окислением йодной воды хлором: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl Бесцветные кристаллы, вполне устойчивые при комнатной температуре. Сильная кислота, энергичный окислитель. Соли - иодаты, сильные окислители в кислой среде. Оксид йода(V), иодноватый ангидрид, может быть получен при осторожном нагревании НIO3 до 200°С, порошок. При нагревании выше 300°С распадается на иод и кислород, проявляет окислительные свойства, в частности используется для поглощения CO в анализе: 5СО + I2O5 = I2 + 5CO2 Иодная кислота - HIO4 и ее соли (периодаты) хорошо изучены. Сама кислота может быть получена действием НСlO4 на иод: 2НСIО4 + I2=2НIO4 + Сl2 или электролизом раствора НIO3: НIO3+Н2О = Н2 (катод) + НIO4 (анод) Из раствора иодная кислота выделяется в виде бесцветных кристаллов, имеющих состав НIO4 ·2Н2О. Этот гидрат следует рассматривать как пятиосновную кислоту H5IO6 (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag5IO6). Иодная кислота - слабая, но более сильный окислитель, чем НСlO4. Оксид иода (VII) I2О7 не получен.
