
Lekcii_po_TekhnichTermodinamike
.pdf5
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
Сибирский государственный аэрокосмический университет имени академика М. Ф. Решетнева
(СибГАУ)
Д. А. ЖУЙКОВ
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Конспект лекций для студентов специальности 160302 «Ракетные двигатели»
Красноярск - 2011
6
ОГЛАВЛЕНИЕ
Лекция 1........................................................................................................................ |
8 |
Введение................................................................................................................... |
8 |
Основные понятия и исходные положения термодинамики .............................. |
8 |
ЛЕКЦИЯ 2.................................................................................................................. |
10 |
Основные параметры состояния рабочего тела ................................................. |
10 |
Уравнения состояния идеального газа ................................................................ |
11 |
Термодинамический процесс ............................................................................... |
12 |
ЛЕКЦИЯ 3.................................................................................................................. |
14 |
Газовые смеси ........................................................................................................ |
14 |
Теплоемкость газовых смесей.............................................................................. |
15 |
ЛЕКЦИЯ 4.................................................................................................................. |
18 |
Работа и рабочая диаграмма................................................................................. |
18 |
Внутренняя энергия и теплота ............................................................................. |
20 |
Энтальпия............................................................................................................... |
20 |
Обратимые и необратимые процессы ................................................................. |
21 |
Лекция 5...................................................................................................................... |
22 |
Первый закон термодинамики ............................................................................. |
22 |
Второй закон термодинамики. Энтропия ........................................................... |
23 |
Общая формулировка второго закона термодинамики.................................... |
25 |
ЛЕКЦИЯ 6.................................................................................................................. |
26 |
Круговой цикл ....................................................................................................... |
26 |
Прямой цикл Карно............................................................................................... |
27 |
Обратный цикл Карно........................................................................................... |
29 |
Лекция 7...................................................................................................................... |
30 |
Статистическое толкование второго закона термодинамики........................... |
30 |
Третий закон термодинамики .............................................................................. |
30 |
Основные термодинамические процессы и их................................................... |
32 |
изображение в р,v и T,S координатах ................................................................. |
32 |
Лекция 8...................................................................................................................... |
37 |
Реальные газы ........................................................................................................ |
37 |
Лекция 9...................................................................................................................... |
45 |
Водяной пар и его свойства.................................................................................. |
45 |
Изменение агрегатного состояния вещества ...................................................... |
48 |
ЛЕКЦИЯ 10................................................................................................................ |
50 |
Параметры состояния жидкости и пара .............................................................. |
50 |
Ts-диаграмма пара ................................................................................................. |
54 |
hs-диаграмма пара ................................................................................................. |
56 |
ЛЕКЦИЯ 11................................................................................................................ |
61 |
Течение газов .Основные уравнения истечения ................................................ |
61 |
Сопло и диффузор ................................................................................................. |
63 |
Истечение из суживающегося сопла ................................................................... |
64 |
ЛЕКЦИЯ 12................................................................................................................ |
70 |
Основные закономерности течения газа в соплах и диффузорах .................... |
70 |
Комбинированное сопло (сопло Лаваля) ............................................................ |
72 |
Лекция 13.................................................................................................................... |
74 |
7 |
|
Дросселирование газов и паров ........................................................................... |
74 |
Лекция 14.................................................................................................................... |
77 |
Компрессоры.......................................................................................................... |
77 |
Диаграмма работы поршневого компрессора .................................................... |
77 |
Реальный компрессор ........................................................................................... |
79 |
Многоступенчатый компрессор........................................................................... |
82 |
ЛЕКЦИЯ 15................................................................................................................ |
83 |
Циклы холодильных машин................................................................................. |
83 |
Цикл воздушной холодильной установки .......................................................... |
83 |
Цикл парокомпрессионной холодильной установки......................................... |
87 |
Тепловой насос ...................................................................................................... |
90 |
ЛЕКЦИЯ 16................................................................................................................ |
91 |
Циклы газовых двигателей................................................................................... |
91 |
Схема устройства и работы двигателя внутреннего.......................................... |
91 |
сгорания.................................................................................................................. |
91 |
Идеальные циклы двигателя внутреннего сгорания ........................................ |
94 |
Цикл со смешанным подводом теплоты (цикл Тринклера)............................ |
99 |
Цикл с подводом теплоты при постоянном объеме (цикл Отто) ................... |
101 |
Цикл стирлинга.................................................................................................... |
103 |
лекция 17 .................................................................................................................. |
106 |
Циклы газотурбинных установок ...................................................................... |
106 |
Цикл гту с подводом теплоты при p=const (цикл Брайтона).......................... |
106 |
Регенеративные циклы........................................................................................ |
111 |
лекция 18 .................................................................................................................. |
113 |
Циклы Реактивных Двигателей ......................................................................... |
113 |
Бескомпрессорные воздушно-реактивные двигатели ..................................... |
113 |
Компрессорные турбореактивные двигатели................................................... |
115 |
лекция 19 .................................................................................................................. |
118 |
Цикл жидкостно-реактивного двигателя .......................................................... |
118 |
Лекция 20.................................................................................................................. |
121 |
Циклы паросиловых установок.......................................................................... |
121 |
Цикл ранкина ....................................................................................................... |
121 |
Лекция 21.................................................................................................................. |
124 |
Первый закон термодинамики и его применение к химическим процессам 124
Аналитическое выражение первого закона термодинамики .......................... |
124 |
Теплоты реакций ................................................................................................. |
125 |
Закон Гесса........................................................................................................... |
128 |
Закон Кирхгофа ................................................................................................... |
128 |
Закон Нернста ...................................................................................................... |
133 |
Расчет абсолютной энтропии ............................................................................. |
133 |
Библиографический список.................................................................................... |
138 |
8
ЛЕКЦИЯ 1
Введение
Все виды энергии имеют огромное значение в жизни человека, и поэтому законы их взаимопревращения требуют тщательного изучения. В быту и производстве человек постоянно сталкивается с работающими механизмами, процесс их работы сопровождается выделением и распространением тепла. Это определяет роль теплотехники - общеинженерной дисциплины, изучающей методы получения, преобразования, передачи и использования теплоты и связанных с этим аппаратов и устройств.
Теплотехника включает в себя основы технической термодинамики и теории тепло- и массообмена. В этой последовательности и будет прочитан курс лекций для студентов специальностей 160302 «Ракетные двигатели»
.
Основные понятия и исходные положения термодинамики
Термодинамика изучает законы взаимопреобразования и передачи энергии в различных процессах. Следовательно, термодинамика в наиболее общем смысле представляет науку об энергии. Исторически термодинамика возникла в результате изучения превращения теплоты и работы в тепловых машинах; сейчас этот раздел называется технической термодинамикой. Изучением химических процессов с термодинамической точки зрения занимается химическая термодинамика.
В качестве объекта изучения берется термодинамическая система - совокупность материальных тел, находящихся в механическом и тепловом взаимодействии друг с другом и с внешней средой. Если система не обменивается с окружающей средой энергией в форме теплоты, то такую систему называют адиабатной.
Термодинамика основывается на двух основных законах (или началах) термодинамики:
I закон - закон сохранения и превращения энергии и отражает связь между теплом и работой, т. е. их количественные соотношения.
II закон характеризует направление протекания процессов.
Основная задача термодинамики - обоснование теории тепловых двигателей.
Тепловой двигатель - это устройство, в котором происходит превращение тепла, выделившегося при сгорании топлива, в механическую энергию или работу. Преобразование тепла в работу обычно осуществляется при помощи так называемого рабочего тела.
Рабочее тело - тело, способное воспринимать тепло, расширяться при этом и совершать полезную работу. Обычно в качестве рабочих тел используют газ и пар, т.к. они обладают большим коэффициентом объѐмного расширения и могут при нагревании совершать гораздо большую работу, чем жидкости или твердые тела. В двигателе внутреннего сгорания, например, рабочим телом
9
является приготовленная в карбюраторе рабочая смесь, состоящая из воздуха и паров бензина.

10
ЛЕКЦИЯ 2
Основные параметры состояния рабочего тела
Для определения запаса энергии рабочего тела используются следующие основные параметры состояния:
p - удельное давление; T - температура;
v - удельный объѐм.
Между ними существует определѐнная связь, определяемая опытным путем. В общем виде это зависимость типа:
f(p,T,v ) = 0.
Если принять два из параметров за независимые, то третий из них будет являться функцией первых двух, например:
P = f1(v,T); v = f2(T,p); T = f3(p,v).
Рассмотрим эти параметры.
Температура T - мера средней кинетической энергии движения молекул газа. Характеризует степень нагретости тела. Измеряется в градусах Кельвина по абсолютной шкале Кельвина (T, K) и по шкале Цельсия (t , C).
Связь между ними: Т = 273,15 + t.
В Англии, США и некоторых других странах для измерения температуры принята шкала Фаренгейта ( F), за 0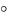 принята температура таяния смеси льда с поваренной солью, а температура кипения воды равна 212 F; при этом температура таяния льда по этой шкале получается равной 32 F, таким образом,
принята температура таяния смеси льда с поваренной солью, а температура кипения воды равна 212 F; при этом температура таяния льда по этой шкале получается равной 32 F, таким образом,
1 F=5/9 C.
Можно записать формулу пересчѐта температур из одной шкалы в другую: t[ C] = 5/9t[ F]-32;
t[ F] = 9/5t[ C]+32.
В промышленных и лабораторных условиях температуру измеряют с помощью жидкостных термометров (спиртовые, ртутные), пирометров, термопар, терморезисторов, пружинных датчиков и других приборов.
Удельный объѐм v - это объѐм единицы массы вещества. В системе СИ это объѐм 1кг вещества выраженный в м3. Если однородное тело массой М
занимает объѐм V, то по определению v = V/M. |
|
Между удельным объѐмом v и плотностью |
существует очевидное |
соотношение: v = 1/ .
Давление p - численно равно силе, действующей по нормали к поверхности тела и отнесѐнной к единице площади поверхности.
В Международной системе единиц (СИ) давление выражается в Паскалях. Паскаль - это давление, вызываемое силой в 1Н, равномерно
распределѐнной по нормальной к ней поверхности площадью 1м2, или: 1Па = 1Н/1м2.
Единицами давления служат также кратные и дольные от Паскаля: 103Па = 1кПа (килоПаскаль); 106Па = 1МПа (мегаПаскаль); 10-3Па = 1мПа (миллиПаскаль); 105Па = 1бар.

11
На практике применяются единицы технической системы и внесистемные
(бар).
Особенно часто в инженерной практике приходится сталкиваться с понятием атмосфера техническая и атмосфера физическая:
1 |
1 |
кг |
9,8 105 Па 735 мм.рт.ст.; |
|
|||
ат(техн) |
|
см2 |
|
|
|
|
|
1 |
1,013 105 Па 1,03кг 760 мм. рт.ст. |
||
ат(физич) |
|
|
|
Различают давление абсолютное, отсчитываемое от абсолютного 0 или вакуума, и избыточное, отсчитываемое от давления окружающей среды, или от
барометрического давления pбар.
В случае, если давление в сосуде pизб > pбар, то абсолютное давление запишется:
pабс = pбар + pизб.
Если давление в сосуде меньше давления окружающей среды (из сосуда откачивается газ, сосуд вакуумируется), то тогда:
pабс = pбар - pвак.
Приборы для измерения давления ниже атмосферного pвак. называются вакуумметрами.
Давление измеряется с помощью манометров (пружинных, ртутных), барометров и приборов, использующих упругую деформацию чувствительных элементов. Дифференциальные манометры предназначены для измерения перепадов давления.
Следует помнить, что манометры измеряют избыточное давление, а параметром состояния является абсолютное давление. Именно абсолютное давление входит в термодинамические уравнения. Поэтому проводя лабораторные измерения с избыточным давлением, в расчетные формулы нужно подставлять pабс, используя приведенные для pабс формулы.
Для сравнения величин, характеризующих системы в одинаковом состоянии, вводится понятие ―нормальные физические условия‖ (НФУ):
p = 760 мм рт.ст. = 1,013 105 Па; Т = 273,15 0К = 0 0С.
При НФУ 1кмоль любого газа занимает объѐм 22,4 м3.
В разных отраслях техники и разных странах вводят свои, несколько отличные от приведенных ―нормальные условия‖, например, ―нормальные технические условия‖ (НТУ): р = 1кг/см2 = 735мм рт.ст., t = 15 С. В дальнейшем будем использовать нормальные физические условия.
Уравнения состояния идеального газа
Уже отмечалось, что основные параметры состояния р, v, и Т связаны между собой зависимостью: f(р,v,Т) = 0.
Наиболее простой вид имеет уравнение состояния идеального газа. Под идеальным газом условно представляется газ, у которого отсутствуют силы взаимодействия между молекулами, а сами молекулы рассматриваются как лишѐнные собственного объѐма, хотя они являются материальными частицами.

12
Уравнение состояния идеального газа впервые получено Клапейроном путѐм объединения уравнений, характеризующих газовые законы БойляМариотта и Гей-Люссака и обычно даѐтся в виде:
р v = R T. (1)
Уравнение (1) - уравнение Клапейрона, записано для массы газа 1кг. Через R обозначена газовая постоянная. В системе СИ единица измерения газовой постоянной определяется следующим образом:
R |
p v |
|
н м3 |
|
Дж |
|
|
|
|
|
|
. |
|
T |
|
м2 кг К |
кг К |
|||
R - это работа, выраженная в Джоулях, которую совершает 1кг газа при повышении его температуры на 1 К при р = const.
Если уравнение (1) умножить на М- произвольную массу газа, то
р v М = M R T, но т.к. v |
|
V |
|
, то: |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
M |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
p |
V |
М |
|
M |
R T , т.е. p V = M R T |
|
|
|
|
|
|
(2) |
||||||||||||||
М |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уравнение (2) - уравнение состояния для произвольной массы газа М. |
||||||||||||||||||||||||
|
|
Если уравнение (1) умножить на молярную массу , то: |
||||||||||||||||||||||||
|
|
р v |
= |
|
R T. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Так как v |
= V - молярный объѐм газа, то: |
|
|
|||||||||||||||||||||
|
|
p V = |
|
R T. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
Из физики известно, что при нормальных физических условиях молярный |
||||||||||||||||||||||||
объѐм любого газа V = 22,4 м3/кмоль. Тогда можно найти значение выражения |
||||||||||||||||||||||||||
R при НФУ: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
pV |
1,013 105 |
|
22,4 |
|
|
|
|
|
Дж |
|
|
|
|||||||||
|
|
|
R |
|
|
|
|
|
|
|
|
8314 |
|
|
|
. |
|
|
|
|||||||
|
|
|
|
T |
273,15 |
|
|
кмоль К |
|
|
|
|||||||||||||||
|
|
Выражение |
|
R |
R |
8314 |
|
Дж |
|
|
. называется универсальной газовой |
|||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
кмоль К |
||||||||||||||||||||||
постоянной. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Таким образом, уравнение состояния для 1кмоля идеального газа |
||||||||||||||||||||||||
запишется: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
р V = 8314 Т |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(3) |
|||||||||
|
|
(3) - уравнение Клапейрона-Менделеева. |
|
|
|
|||||||||||||||||||||
|
|
Используя выражение R = 8314, можно найти газовую постоянную |
||||||||||||||||||||||||
любого газа, зная его молярную массу: |
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
R |
|
8314 |
, например, для азота: RN |
|
|
8314 |
|
296,8 |
Дж |
. |
||||||||||||||
|
|
|
|
|
28 |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
кмоль К |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Термодинамический процесс
Изменение состояния термодинамической системы во времени называется термодинамическим процессом. Все процессы можно разделить на равновесные и неравновесные.
Равновесными называются такие процессы, в которых система проходит ряд последовательных равновесных состояний (т.е. таких, когда по всей массе наблюдаются одинаковые давление и температура). В равновесных процессах
13
параметры системы меняются достаточно медленно, что даѐт возможность использовать уравнение состояния идеального газа.
Если эти условия не выполняются, то процесс будет неравновесным, различные части системы имеют различную температуру, давление и т.д., применять уравнения состояния для системы невозможно.
Втермодинамике чаще всего процессы изображают в р, v координатах.
Втакой системе координат состояние термодинамической системы изображается точкой, а термодинамический процесс - линией р(v).
К основным термодинамическим процессам относятся: изотермический (T = const);
изобарный (p = const);
изохорный (v = const);
адиабатный (pvk = const, dq = 0).
Их изображения в р, v координатах:
P P P P
|
|
|
|
p=const |
|
V |
|
V=const |
|
V |
|
pvk=const |
|
V |
T=const |
|
V |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 1.1. Графическое изображение различных термодинамических процессов
В качестве обобщающего процесса в термодинамике рассматривается политропный процесс pvn = const (n - показатель политропы). Более подробно мы рассмотрим его в дальнейшем.

14
ЛЕКЦИЯ 3
Газовые смеси
На практике чаще приходится сталкиваться не с чистыми газами, а с их механическими смесями. Одной из самых важных смесей является воздух. Каждый газ, входящий в состав смеси, независим от других.
Его давление, называемое парциальным, может быть определено по объѐму V и Т смеси из уравнения состояния:
p1 V = M1 R1 T,
где V,T - параметры смеси;
р1 - парциальное давление компонента смеси; М1, R1 - масса и газовая постоянная компонента.
Парциальным называется давление, которое оказывает компонент смеси на стенки сосуда, если поместить его отдельно в объѐм, занимаемый смесью, при той же температуре.
Парциальные давления подчиняются закону Дальтона:
n
p  pi ,
pi ,
i 1
где рi - парциальное давление компонентов; р - давление смеси.
Зная состав смеси (а он может быть задан массовыми долями, объѐмными и мольными), можно находить Rcм, рсм и т. п. Этот раздел, касающийся газовых смесей, даѐтся на самостоятельное изучение.
Состав смеси задается объемными, массовыми и мольными долями, которые определяются соответственно по следующим формулам:
r1
g1 r1′
=V1 / Vсм ; r2 = V2 / Vсм ; … rn = Vn / Vсм , (2.15)
=m1 / mсм ; g2 = m2 / mсм ; … gn = mn / mсм , (2.16)
=ν1 / νсм ; r2′ = ν2 / νсм ; … rn′ = νn / νсм , (2.17)
где V1 ; V2 ; … Vn ; Vсм –объемы компонентов и смеси; m1 ; m2 ; … mn ; mсм – массы компонентов и смеси;
ν1 ; ν2 ; … νn ; νсм – количество вещества (киломолей) компонентов и смеси.
Для идеального газа по закону Дальтона:
r1 = r1′ ; r2 = r2′ ; … rn = rn′ . (2.18)
Так как V1 +V2 + … + Vn = Vсм и m1 + m2 + … + mn = mсм ,
то r1 + r2 + … + rn = 1 , (2.19) g1 + g2 + … + gn = 1. (2.20)
Связь между объемными и массовыми долями следующее:
g1 = r1∙μ1/μсм ; g2 = r2∙μ2 /μсм ; … gn = rn∙μn /μсм , (2.21)
где: μ1 , μ2 , … μn , μсм – молекулярные массы компонентов и смеси. Молекулярная масса смеси:
μсм = μ1 r1 + r2 μ2+ … + rn μn . (2.22)
Газовая постоянная смеси:
Rсм = g1 R1
=Rμ (g1/μ1
=1 / (r1/R1
+g2 R2 + … + gn Rn =
+g2/μ2+ … + gn/μn ) =
+r2/R2+ … + rn/Rn) . (2.23)
Удельные массовые теплоемкости смеси:
