
Опера о чуме (учебник)
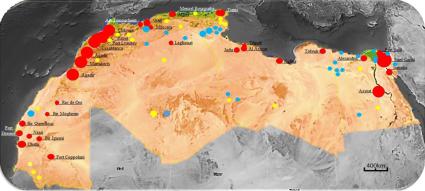
штаммы (1.ORI2iii), выделяющиеся в очагах Марокко, тогда как в Ливии выделяются штаммы геноварианта 1.ANT, занесённые во время первой пандемии, а последняя вспышка произошла в 2009 году в районе города Тобрук. Носители – африканская песчанка (Meriones shawi), дневная песчан-
ка (Psammomys obesus), карликовая песчанка (Gerbillus gerbillus), египетская песчанка (Gerbillus Pyramidum), белуджистанская песчанка (Gerbillus nanus),
египетский тушканчик (Jaculus jaculus), серая крыса (Rattus norvegicus; север Марокко и портовые города), чёрная крыса (Rattus rattus rattus на севере Марокко и Rattus rattus alexandrinus на юге Марокко), домовая мышь (Mus musculus), алжирская мышь (Mus spretus), европейская мышь (Apodemus sylvaticus), обыкновенная белозубка (Crocidura russula), краснохвостая пес-
чанка (Meriones libycus). Переносчики – Xenopsylla cheopis, Synosternus cleopatrae, Xenopsylla ramesis (в основном в Алжире), Leptopsylla segnis, Nosopsyllus fasciatus, Xenopsylla taractes, Pulex irritans.
В Северо-Западной Африке природные очаги располагаются на территории исторической области Рио-де-Оро и Мавритании, что подтверждается спонтанными эпизоотиями на грызунах и заболеваемостью среди верблюдов. Как и в случае Северной Африки, очаги располагаются в прибрежной зоне, где чумной микроб обнаруживается в виде L-форм. Носители – карликовая песчанка (Gerbillus gerbillus), египетская песчанка (Gerbillus Pyramidum), белуджистанская песчанка (Gerbillus nanus). Переносчики –
Xenopsylla ramesis, Xenopsylla nubica, Synosternüs cleopatrae, Xenopsylla cheopis (в
прибрежных городах).
Обзорная карта природных очагов Северной и Северо-Западной Африки
(по M. A. Malek, 2017): зоны солёной воды обозначены синим, пресной – жёлтым, зоны эпизоотий – красным
560
ВЗападной Африке природные очаги расположены в Сенегале, на территорию которого чумной микроб был занесён в апреле 1914 года на корабле, прибывшем из города Касабланка (Марокко), а также на территории Ганы и Нигерии, куда он проник из Сенегала. Выделяются штаммы основного подвида (1.ORI2iii). Носители – натальская мышь (Mastomys natalensis), травяная мышь (Arvicanthis niloticus), гамбийская крыса (Cricetomys gambianus), пёстрая травяная мышь (Lemniscomys griselda). Редко в эпизоотии вовлекаются полосатая земляная белка (Xerus erythropus) и белозубка африканская гигантская (Crocidura olivieri). Переносчики –
Xenopsylla cheopis, Xenopsylla astia, Xenopsylla brasiliensis.
ВЦентральную Африку чумной микроб попал двумя путями – во время первой пандемии из Египта и во время третьей – из Южной Африки. Пересечением этих путей стала Замбия, в очагах на территории которой выделяют штаммы основного подвида как геноварианта 1.ANT, так и геновариантов 1.ORI2iv и 1.ORI2vii. Помимо Замбии энзоотичная зона включает Заир, Уганду, Кению, Танзанию и Малавию, распространившись на 2200 км с юга на север и на 1000 км с востока на запад. При этом наибольший очаг расположен в Уганде, на северо-западе страны, в так называемом регионе Западного Нила, где на ряду с «мышиными» очагами присутствуют «крысиные», возникшие во время строительства Угандской железной дороги в 1896–1908 годах. Вполне вероятно, что тогда же произошёл завоз штаммов геноварианта 1.ORI2 (которые затем проникли в Замбию), которые, однако, не смогли укорениться, поэтому в настоящее время выделяются только штаммы геноварианта 1.ANT. Носители – натальская мышь
(Mastomys natalensis), чёрная крыса (Rattus rattus). Переносчики – Xenopsylla cheopis, Xenopsylla brasiliensis. В Кении природные очаги приурочены к са-
ваннам. Носителями здесь выступают болотная крыса (Otomys angoniensis),
травяная мышь (Arvicanthis abyssinicus), полосатая мышь (Rhabdomys pumilio),
ручьевая крыса (Pelomys fallax), пёстрая мышь (Lemniscomys stratus), песчанка
(Tatera robusta). Переносчики – Dinopsyllus lypusus, Xenopsylla brasiliensis, Xenopsylla cheopis. В Заире природные очаги располагаются на границе с Угандой около озёр Альберт и Эдуард. Похожая ситуация в Танзании, где очаги расположены у озера Виктория, а также на склонах гор Килиманджаро и Паре. Носителями тут являются многососковая крыса (Mastomys natalensis),травяная мышь (Arvicanthis abyssinicus), хомяковидная крыса (Cricetomys gambianus), кустарниковая крыса (Grammomys dolichurus), косматая крыса (Grammomus dryas). Переносчики – Dinopsyllus lypusus, Xenopsylla brasiliensis, Xenopsylla cheopis.
ВЮжную Африку чумной микроб был занесён в 1900 году, когда из-за второй англо-бурской войны в город Кейптаун из южноамериканских портов пришлось импортировать большого количество корма. Оттуда
561
чума распространилась в порты южного побережья и далее вглубь континента, закрепившись между бассейнами рек Конго и Замбези, где обнаруживаются штаммы основного подвида (1.ORI2iv и 1.ORI2vii), хотя их эпизоотическая активность минимальна. Общая площадь энзоотичной зоны – 3,6–4 млн км2. Сравнительно большую активность проявляют очаги в пустыне Калахари, районах южнее реки реки Лимпопо и междуречье рек Кванза и Оранжевая. В ЮАР очаги чумы расположены на территории Капской провинции, Оранжевой республики и Трансвааля. На территории Анголы расположено четыре очага чумы: на севере (не активен с 1934 года), округ Бенгвела (не активен с 1950 года), трансграничный, расположившийся от реки Кубанго до Овамболенде (Намибия), и на юге (к востоку от реки Кубанго). Считается, что именно здесь был впервые обнаружен ангольский подвид (0.PE3), отличающийся отсутствием капсулообразования (при наличии плазмиды pFra). Помимо обозначенного трансграничного очага, в Намибии расположились очаги на плато Дамараленд и на правом берегу нижнего течения реки Оранжевой. В Замбии очаги расположены в западной и восточной частях страны. Интересно, что хотя чума известна в этой стране с 1937 года, к настоящему времени не выделено ни одной культуры возбудителя (все диагнозы поставлены с помощью ПЦР). На севере Ботсваны известны четыре мезоочага: два – в районе пересохшего озера Нгоми и западнее низовий Окаванго (Нгамиленд), два – между протоком Ботлетле, соединяющим озеро Макарикари с бассейном Окаванго и восточным и северовосточным краями дельты Окаванго. Носители – песчанка Шинца (Tatera schinzi), песчанка намаква (Desmodillus auricularis),
многососковая мышь (Mastomys coucha), натальская мышь (Mastomys natalensis), полосатая мышь (Rhabdomys pumilio), болотная крыса (Otomys irroratus). Переносчики – Xenopsylla piriei, Xenopsylla philoxera, Xenopsylla brasiliensis, Dinopsyllus ellobius.
На Ближнем востоке чума впервые появилась в Палестине в конце Первой мировой войны, после чего не регистрировалась с 1925 по 1940 годы. Только в 1941 и 1947 годах она вновь появилась в городе Хайфе, что, вероятно, явилось следствием заноса из зоны Суэцкого канала. В дальнейшем эпизоотическая активность не регистрировалась, из чего можно заключить, что чумной микроб не закрепился на данной территории, чего не скажешь о Саудовской Аравии и Йемене, на территории которых расположился трансграничный Саудовско-Йеменский пустынный (нагорно-
равнинный) очаг. Его историческая территория включает юго-западную часть Аравийского полуострова (районы Эль-Асир и Ховран). На территории очага выделяются штаммы основного подвида (2.MED1). Носители – королевская песчанка (Meriones rex), чернохвостая песчанка (Gerbillus famulus), алжирская песчанка (Gerbillus garamantis), домашняя мышь (Mus
562
musculus), чёрная крыса (Rattus rattus). Данные о переносчиках отсутствуют
(вероятно, Xenopsylla cheopis, Xenopsylla piriei).
На территории Сирии, Ирана и, вероятно, Кувейта располагается Си-
рийско-Месопотамский (плоскогорно-равнинный) очаг, историческая террито-
рия которого распространяется на равнины Тигра и Ефрата. На территории очага выделяются штаммы основного подвида (2.MED1). Носители – индийская песчанка (Tatera indica), ливийская песчанка (Tatera lybicus). Пе-
реносчики – Pulex irritans.
На территории Ирана располагается два трансграничных очага. Ирано-
Афганский низкогорный (пустынный) очаг включает восточную часть Ирана и
Афганистан. На его территории выделяются штаммы основного подвида (2.MED1). Основные носители – большая песчанка (Rhombomys opimas), ливийская песчанка (Tatera lybicus), персидская песчанка (Meriones persicus). Второстепенные – песчанка Виноградова (Meriones vinogradovi), переднеази-
атская песчанка (Meriones tristrami). Переносчики – Xenopsylla buxtoni, Stenoponia tripectinata. Курдо-Иранский (Курдо-Каспийский) горно-степной очаг
включает западную часть Иранского нагорья, юго-восточную часть Турции и северо-восточные районы Ирака. Вполне вероятно, что этот очаг связан с закавказскими очагами стран СНГ. На его территории выделяются штаммы основного подвида (2.MED1). Основные носители – персидская песчан-
ка (Meriones persicus), казвинская полёвка (Microtus qazvinensis). Носители – ливийская песчанка (Tatera lybicus), песчанка Виноградова (Meriones vinogradovi), переднеазиатская песчанка (Meriones blackleri), индийская пес-
чанка (Tatera indica). Переносчики – Xenopsylla buxtoni, Stenoponia tripectinata insperata.
На территории Южной Азии циркулируют штаммы, занесённые во время первой и третьей пандемий. В Индии на юге, на Деканском плоскогорье, расположено три очага (штаты Андхара-Прадеш, Майсур, Мадрас, Махараштра), один очаг в центральной части страны (штат МадхьяПрадеш), и ещё три очага не севере, у подножья Гималаев (штаты Пенджаб, Уттар-Прадеш, Бихар). На территории очагов выделяются штаммы основного подвида (1.ORI1, 1.ORI2 и 1.ANT1). Причём геновариант 1.ANT1 встречается на севере страны. Носители в центральной части и на севере – индийская песчанка (Tatera indica), мягкошёрстная крыса (Millardia meltada); «вторые носители» – серая крыса (Rattus norvegicus), чёрная крыса (Rattus rattus). Отличительной особенностью этих очагов является двойная цепочка носителей, то есть заражение человека осуществляется после последовательного заражения носителей и крыс. Носители в южной части – бенгаль-
ская бандикота (Bandicota bengalensis), индийская бандикота (Bandicota indica).
Второстепенные – индийская песчанка (Tatera indica), серая крыса (Rattus
563

norvegicus), чёрная крыса (Rattus rattus). Переносчики – Xenopsylla cheopis, Xenopsylla astia, Xenopsylla brasiliensis, Nosopsyllus fasciatus.
В Европе, за исключением описанных ранее, располагающихся на территории СНГ, природные очаги отсутствуют, поскольку по прошествии трёх пандемий закрепления возбудителя не произошло.
На территории Непала заболевание впервые зарегистрировано в 1967– 1968 и 1971 годах в провинции Сетли, однако очаг к настоящему времени не изучен. Выделенный в 1967 году во время вспышки лёгочной чумы штамм Y. pestis Nepal516 оказался непигментирующим и относился основному подвиду (1.ANT1). Основным носителем, вероятно, является гималай-
ский сурок (Marmota himalayana).
В страны Юго-Восточной Азии чумной микроб был завезён во время третьей пандемии из Китая, поэтому выделяются в основном штаммы геноварианта 1.ORI2ii. Будучи завезённой через порты в городские районы, чума закрепилась в местной популяции грызунов, образовав очаги. В Тайланде они расположены в южной и северной частях страны. Основной носитель – гигантская белозубка (Suncus murinus). В Индонезии очаг располагается в центральной части острова Ява. Носителями здесь являются дикоживущие малая крыса (Rattus exulan), серебристобрюхая крыса (Rattus argentiventer) и малазийская домашняя крыса (Rattus rattus diardiine).
На территории Мьянмы очаги расположены в центральных и северных районах страны, где носителями являются серая крыса (Rattus norvegicus), чёрная крыса (Rattus rattus), малая крыса (Rattus exulans), гималайская крыса (Rattus nitidus), бирманская бандикота (Bandicota savilei). Эти же носители обитают в очагах южной части Вьетнама, в котором с 2005 года возбудитель не выделяется1. Капсульный антиген выделялся от краснощёкой белки
(Dremomys rufigenis), белки Бербмора (Menetes berdmorei), краснобрюхой белки (Callosciurus erythraeus), гималайской полосатой белки (Tamiops macclellandi), крысы Бовера (Berylmys bowersii), крысы Эдвардса (Leopoldamys edwardsi), плоскошёрстной мыши (Mus platythrix) и индийской бандикоты
(Bandicota indica). Переносчик (вероятно, единственный) – Xenopsylla cheopis.
Вочагах обеих стран выделяются штаммы геноварианта 1.ORI2ix.
ВЮжную Америку чумной микроб попал в 1899 году, когда в уругвайский город Монтевидео из города Роттердама (Нидерланды) прибыл корабль с индийским рисом (первая вспышка заболевания произошла уже в 1901 году). Затем груз на пароходе отправился в аргентинские порты Бу- энос-Айрес и Ла-Плата, а оттуда в город Асунсьон (Парагвай). Так в Латин-
1 По этой причине некоторыми исследователями оспаривается факт существования во Вьетнаме именно природных очагов.
564
ской Америке появились штаммы геноварианта 1.ORI2viii. При этом в настоящее время, помимо данного геноварианта, выделяются также штаммы геноварианта 1.ORI2v. В Аргентине и Перу очаги расположены в центральной и северной частях страны, в Боливии – восточнее центрального массива Центральных Анд, в Бразилии – в северо-восточных частях страны, на Эквадоре – в центральной, южной и западной частях, а в Венесуэле – в северной части. Основные носители – бразильская свинка (Cavia aperea), южная горная свинка (Microcavia australis), желтозубая морская свинка (Galea musteloides), серо-жёлтый хомячок (Phyllotis griseoflavus), горная вискаша (Lagidium viscaccia), домовый опоссум (Monodelphis domestica), рисовые хомяки Oryzomys andinas (в Перу) и Oryzomys subflavus (в Бразилии).
Второстепенные – мелкие хомяки родов Akodon (Akodon mollis в Эквадоре), Holochilus, Eligmodontia, Phyllotis, а также бразильский кролик (Sylvilagus brasiliensis) и заяц-русак (Lepus europaeus). Переносчики – Polygenis platensis cisandinus, Polygenis byturus, Panallius galeanus, Delostichus talis, Hectopsylla eskeyi
(в Перу).
В Северную Америку чумной микроб был занесён из города Гонконга (Китай) на корабле, что в 1899 году прибыл в город Гонолулу (Гавайи), а оттуда в порт Сан-Франциско (США). На Гавайях эпидемия бушевала около десяти лет, распространившись на все острова. Эпизоотии продолжались вплоть до 1949 года. Большинство исследователей сходятся во мнении, что из-за большого количества осадков и тропического пассатного климата природный очаг здесь так и не сформировался, чего не скажешь о США, где природные очаги сформировались в 15 штатах (западнее 98° западной долготы). В них выделяют штаммы основного подвида (1.ORI1). В тихоокеанской зоне, полупустынях и пустынях Среднего Запада основными носителями являются суслик Ричардсона (Spermophilus richardsoni), колумбийский суслик (Spermophilus columbianus), уинтский суслик
(Spermophilus armatus), суслик Белдинга (Spermophilus beldingi), калифорний-
ский суслик (Otospermophilus beecheyi). В сухих степях Среднего Запада, полупустынях и пустынях центральных и юго-восточных частей Межгорного плато основными носителями являются луговые собачки рода Cynomys и хомяки рода Neotoma. В Калифорнийском очаге эту роль играет калифорнийская полёвка (Microtus californicus) и хомячки рода Peromyscus. Второстепенными носителями являются малый бурундук (Tamias minimus), колорад-
ский бурундук (Tamias quadrivittatus), бурундук Таунсенда (Tamias townsendi),
северная летяга (Glaucomys sabrinus), желтобрюхий сурок (Marmota flaviventris), калифорнийский заяц (Lepus californicus), а также домашняя кошка (Felis catus) и собака (Canis familiaris). Переносчики – Diamanus montanus, Oropsylla idahoensis, Thrassis bacchi, Thrassis pandorae, Hoplopsyllus anomalus, Opisocrostis hirsutus, Orchopeas sexdentatus, Malaraeus telchinus, Hystrichopsylla linsdalei, Megabothris clantoni.
565

ВКанаду занос возбудителя ожидался в 1938 году, поэтому в западной части страны было проведено обследование диких грызунов, однако чумной микроб не был обнаружен. Лишь на следующий год была зафиксирована эпизоотия в степной зоне юго-восточной части провинции Альберта,
ак 1946 году энзоотичные зоны распространись до провинции Саскачеван. Носители – суслик Ричардсона (Citellus richardsoni) и желтобрюхий сурок
(Marmota flaviventris).
ВМексике очаги расположены в пустынной части страны (штат Коахвила), где носителями являются мексиканские луговые собачки (Cynomys mexicanas).
Япония, как пишет Китасато Сибасабуро, «не знала о чуме до тех пор, пока в 1896 году болезнь не была впервые привезена на одном из торговых кораблей». Речь идёт о завозе на остров Формоза (ныне – Тайвань), который по результатам Японо-китайской войны (1894–1995) отошёл японцам (дальше острова инфекция не распространилась). Затем в 1899 году чумной микроб был завезён в город Кобе (сообщается, что источником инфекции был привезённый хлопок, от которого заразились портовые крысы), с которого началась первая в истории Японии эпидемия1. Второй завоз инфекции был в 1902 году (город Иокогама), третий – в 1905 году (город Токио). В дальнейшем вспышки заболевания регистрировались в портовых городах префектур Киго, Осака, Миэ и Канагава. С 1929 года случаев инфицирования не зарегистрировано.
1 Ранее много раз было показано, как чумной микроб повлиял на культуру Японии (вспомните святилище чумы, ёкая Амабиэ и т. д.), что вступает в противоречие со словами Китасато Сибасабуро. Дело в том, что традиционно инфекции из японских легенд ассоциируют с чумой, однако можно видеть, что, например, «водное» происхождение Амабиэ больше указывает на холеру (более того, «культ» этого ёкая распространился в итоге и на неё). Все выделенные на сегодняшний день на японских островах штаммы чумного микроба относятся к биовару orientalis, поэтому нет достоверных доказательств присутствия чумного микроба до третьей пандемии, однако некоторые специалисты, основываясь на данных исторических хроник, не исключают возможности её более раннего заноса, например, со стороны Корейского полуострова в результате торговых отношений.
566

Первая страница рукописи Китасато Сибасабуро
(«Вспышки и искоренение чумы в Японии»), любезно предоставленная Мемориальным музеем Образовательной корпорации Института Китасато
567
Прописи (рецептуры) некоторых питательных сред, применяемых для работы с возбудителем чумы
Среда Кери – Блэра (транспортная)
В 1000 мл дистиллированной воды суспендировать 1,1 г гидроортофосфата натрия, 1,5 г тиогликолята натрия, 5 г хлорида натрия и 5 г агара, после чего нагреть до полного растворения и охладить до 50°С. Добавить 9 мл 1%-ного водного раствора хлорида кальция; при необходимости довести рН до 8,4. Разлить по маленьким флаконам с завинчивающейся крышкой для предотвращения высыхания.
Низкий окислительно-восстановительный потенциал среды способствует длительному выживанию бактерий. Чумной микроб сохраняется в течение 75 суток.
Консервант Берлина и Бащевой
Смешивают вазелиновое масло и парафин в соотношении 3:1 или чистый вазелин, вазелиновое масло и безводный ланолин в соотношении 1:2:1.
Чумной микроб сохраняется в течение месяца.
Жидкость Брокэ для хранения кусочков органов
В 80 мл дистиллированной воды добавляют 20 мл глицерина и 2 г карбоната кальция. Разливают в ёмкости по 5–10 мл. Кусочки органов и фрагменты бедренной кости сохраняются в течение нескольких дней.
Бульон Хоттингера
Говяжье мясо очистить от жира, сухожилий и плёнок, нарезать кусочками толщиной около 1 см и длиной 3–4 см, опустить в кипящую воду в пропорции 1 кг мяса на 2 литра воды. Кипятить 20 минут, после чего выловить кусочки мяса и пропустить через мясорубку. Затем опустить в остуженную до 50°С воду (в которой кипело мясо) и добавить 3 мл/л карбоната натрия, 20–30 мл хлороформа и 100 г панкреатической железы, предварительно очищенной от плёнок и жира и пропущенной через мясорубку. Все ингредиенты заготовить заранее, чтобы в результате произведённых манипуляций вода не остыла. Посуду закрыть плотной бумагой во избежание испарения хлороформа и держать полтора суток при 45–50°С, когда вместо мяса на дне останется только незначительный тиноподобный осадок (переваривание окончено), а над ним – жидкость жёлтого цвета. Переваривать, хорошо перемешивая, каждые сутки при 37°С в течение 7–8 суток с ежедневным определением аминного азота. Манипуляции закончить, когда содержание аминного азота прекратит расти. Затем фильтровать и
568

добавить 20–30 мл/л хлороформа. Развести дистиллированной водой до содержания 100 мг% аминного азота, добавить 5 г/л хлорида натрия и кипятить 10–20 минут. Фильтровать и автоклавировать полчаса при 110°С.
Агар Хоттингера
Кипятить бульон Хоттингера, после чего добавить 2,3% предварительно замоченного агара и 1,2 г/л гидроортофосфата натрия до осветления1. Автоклавировать 40 минут при 115°С, после чего для осаждения оставляют на 18–20 часов при 60–70°С. Фильтровать надосадочную жидкость, после чего автоклавировать полтора часа при 100°С.
Для выращивания чумного микроба в бульон или агар добавить необходимые аминокислоты (см. Табл. 30.1 и 30.2). Для получения культуры, богатой капсульным антигеном, добавить среду 199 (3 мл добавки на 100 мл питательной среды).
Бульон Мартена
Неразрезанные свежие желудки, очищенные от жира и плёнок, промыть водой снаружи. Затем разрезать, очистить от внутреннего содержимого, не снимая слизь с внутренней стенки (работать осторожно, чтобы не удалить пепсин). Нарезать на большие куски и перемолоть. В литр воды, нагретой до 54°С, положить 200 г перемолотых желудков и добавить 10 мл соляной кислоты. Хорошо перемешать и оставить на сутки при 45–50°С (иногда перемешивая). Через сутки, когда на дне вместо мяса останется только незначительный тиноподобный осадок (переваривание окончено), автоклавировать 5 минут при 80–85°С (перемещать осторожно, чтобы не баламутить осадок). Далее остудить, фильтровать, подогреть до 80°С и добавить 20%-ный раствор гидроксида натрия (до рН 7), после чего кипятить 10 минут, фильтровать и смешать с равным объёмом профильтрованной мясной воды. Далее кипятить 30–40 минут и добавить 20%-ный раствор гидроксида натрия (до рН7,8). Автоклавировать 20 минут при 120°С (рН может несколько снизиться).
Следует учесть, что некоторые рецептуры предполагают добавление 1%-ного раствора хлорида натрия, однако при работе с возбудителем чумы это запрещено!
Агар Мартена
К бульону Мартена добавить 20%-ный раствор гидроксида натрия (до рН 8) и 2,3% предварительно замоченного на 10–15 минут агара. Автокла-
1 Осветлять можно яичным белком, для чего сваренный агар остудить до 50 °С и влить в него, помешивая, яичный белок, в равных долях смешанный с дистиллированной водой (20–30 мл на 1 литр).
569
