
Опера о чуме (учебник)

Рис. 34.5. Процесс патологоанатомического исследования лабораторного животного (мыши)
461
У животных, погибших от чумы при накожном или подкожном заражении (а также погибших от бубонной формы чумы в результате естественного заражения), в месте введения материала (в месте заражения) обнаруживаются полнокровие, серозное пропитывание тканей, возможны нагноение и некроз. Возможен слизистый отёк подкожной клетчатки, чаще локализующийся только в месте подкожного введения. Паховый лимфатический узел (реже оба) увеличен, гиперемирован, плотный или размягчённый, пропитан студневидной серозно-геморрагической жидкостью. Крайне редко поражён ипсилатеральный (т. е. располагающийся на этой же стороне) подмышечный лимфатический узел (Рис. 7.12). При внутрибрюшинном заражении в брюшной полости обнаруживается сли- зисто-гнойный экссудат, увеличение и уплотнение мезентериальных и парааортальных лимфатических узлов. При интраокулярном заражении в первую очередь поражаются шейные лимфатические узлы.
При всех способах заражения в селезёнке, печени и лёгких обнаруживаются узелки серовато-белого цвета, размер которых может варьироваться от еле заметных до крупных. Количество их также непостоянно (Рис. 34.6). Помимо этого, в печени могут обнаруживаться участки дегенеративного перерождения желтоватого цвета (глинистая печень). Органы увеличены, местами обнаруживаются участки некроза, в лёгких могут быть очаги кровоизлияния с уплотнениями. Сердце может быть увеличено, а его сосуды – резко инъецированы. То же и с сосудами брюшной полости (особенно брыжейки). Крайне редко в брюшной полости обнаруживается мягкий экссудат.
Для посевов на плотные питательные среды и отпечатков на стекле (с целью последующих окраски и микроскопирования) используют селезёнку, печень, сердце (кровь), лёгкие и реже головной и костный мозг. Для этого используют предварительно фламбированные и тщательно остуженные пинцет и ножницы: от удерживаемого пинцетом органа отрезается ножницами фрагмент и свежим срезом делается несколько отпечатков по агару или стеклу. На агар, разделённый на сектора, обычно делают по два-три отпечатка с последующим рассеиванием. На стекло делают один отпечаток печени, два отпечатка лёгких, три отпечатка селезёнки, четыре отпе-
462

Рис. 34.6. Патологические изменения внутренних органов мыши (слева) и морской свинки (справа, заражение бесфракционным штаммом).
Стрелкой отмечен лимфатический узел, в нижнем квадрате – селезёнка. Обратите внимание на еле различимые узелки на селезёнке мыши и огромные узлы на селезёнке морской свинки (изображение слева по Вагайская А. С., 2021, справа любезно предоставлено Татьяной Евгеньевной Арсеньевой)
чатка лимфатического узла и кровь отпечатывают одной полосой, по-
сле чего помещают стёкла в фиксирующую жидкость на полчаса и окрашивают1 (Рис. 34.7).
1 Помимо способов окраски, рассмотренных в Главе 30, можно применить окраску, предложенную российским и советским врачом Сергеем Николаевичем Муромцевым (1898–1960). Разработанная в рамках диагностики бешенства у животных (окрашивания мазков-отпечатков головного мозга), по утверждению Николая Ивановича Розанова, она удобна для исследования мазков-отпечатков органов биопробных животных при бактериальных инфекциях, поскольку позволяет отчётливо визуализировать биполярность и капсулы. Для этого мазки полчаса фиксируют в растворе этилового спирта с формалином в концентрации 8:2, после чего окрашивают заранее приготовленной краской через фильтровальную бумагу 30 секунд и обильно промывают дистиллированной водой. Фон препарата окрашивается в розовый цвет, а ткани и микробные клетки в оттенки синего. Для приготовления краски смешивают два раствора (раствор 1: к 20 мл 96%-ного раствора этилового спирта добавить 0,15 г четырёхводного фуксина (фуксина основного) и 10 г кристаллической карболовой кислоты; раствор 2: к 200 мл дистиллированной воды добавить 2,5 г метиленового синего), после чего смесь профильтровывают через двойной бумажный фильтр.
463

Рис. 34.7. Мазки-отпечатки печени (а), селезёнки (b) и лимфатического узла (c). Сравните их с гистологическими срезами этих органов,
приведёнными в Главах 7, 8, 11–14
В том случае, если при прямом посеве материала нет роста культуры чумного микроба, а биопробное животное погибло, из его органов делают суспензию, которую сеют на питательные среды и вводят второму животному. Патологоанатомическое исследование второго животного проводят аналогично исследованию первого.
После завершения исследования при помощи пинцета ватные диски помещают на животное, снимают фиксаторы с конечностей и заворачивают углы салфетки конвертиком. В этот важный момент будет не лишним ненадолго задержаться, чтобы мысленно поблагодарить животное, погибшее ради спасения человеческих жизней.
Затем обёрнутое в салфетку животное с помощью пинцета помещается в контейнер для последующего обеззараживания и сжигания в крематории. Салфеткой, смоченной в растворе дезинфектанта, обрабатывается подложка (с обеих сторон) и поверхность стола, на которой она размещалась.
Следует заметить, что в очаге, особенно когда необходимо вскрыть достаточное количество животных, прибегают к сокращённому методу вскрытия: укладывают мышь на правый бок, разреза-
ют кожу и брюшную стенку по дуге и извлекают селезёнку для оценки её состояния и дальнейшего изучения (Рис. 34.8).
Для ускоренной постановки диагноза одновременно заражают несколько мышей и морских свинок, последовательно умерщвляя по одному животному на первые, вторые и третьи сутки, производя патологоанатомическое исследование. Посевы осуществляют на две
464
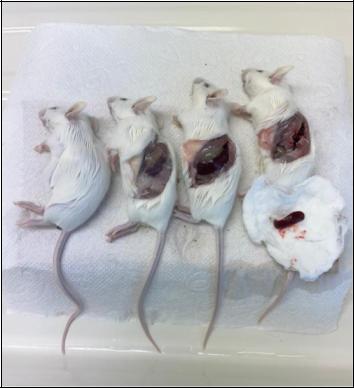
Рис. 34.8. Последовательность патологоанатомического исследования в сокращённом виде (слева направо)
плотные питательные среды, чтобы на одной из них поставить пробы с бактериофагом. Особое внимание уделяют посевам из лимфатических узлов.
Помимо этого, ускорить постановку диагноза может снижение резистентности животных к чуме, для чего применяют эмульсию желтка куриного яйца (один желток разводится в 8 мл физиологического раствора), вводимую одновременно с исследуемым материалом из расчета 0,5 мл для мыши и 1 мл для морской свинки, а также гидрокортизон (5 мг на 0,5 мл физиологического раствора), который вводят подкожно в область бедра.
Ускорить постановку диагноза можно и методом антигенурии, при котором прижизненно (примерно на вторые-третьи сутки)
465

животным определяют содержание капсульного антигена в моче с помощью реакций гемагглютинации, описанных в предыдущей главе. Для этого животному в рацион добавляют морковь и капусту, а на дно клетки выстилается два листа фильтрровальной бумаги, которые ежедневно меняются. Участки с пятнами мочи вырезаются и заливаются 4–6 мл фосфатного буфера (0,1 моль/л) с 2%-ным раствором формалина. Через сутки содержимое уплотняется и надосадочная жидкость передаётся на исследование.
35 АНТИБИОТИКОЧУВСТВИТЕЛЬНОСТЬ
Определение чувствительности к антибиотикам выделенной культуры является важным этапом лабораторной диагностики, поскольку позволяет назначить рациональную этиотропную терапию, а также, в случае угрожающей эпидемической обстановки, быть готовым к лечению и профилактике. Особенную важность этому этапу придёт существование антибиотикорезистентных штаммов чумного микроба, о которых много говорилось ранее.
В начале 1960-х годов прошлого века Альфред Бáуэр1, Уи льям Ки рби2, Джон éррис3 и Мáрвин Тёрк4 разработали5 метод определения чувствительности бактерий к антибиотикам, основанный на способности антибиотиков диффундировать из бумажного носителя (диска) в твёрдую питательную среду (Рис. 35.1), подавляя рост посеянной бактериальной культуры. И хотя похожие методы
1 Alfred W. Bauer, 1926–1998; германский и американский врач, бактериолог. В годы Второй мировой войны был нацистским солдатом, после чего, закончив институт в Германии, переехал в С А для обучения в аспирантуре.
2William M. M. Kirby, 1914–1997; американский врач, бактериолог.
3John Charles Sherris; 1921–2021; британский и американский врач, бактериолог.
4Marvin Turck, р. 1934; американский врач, инфекционист, бактериолог. Автор работ по инфекциям мочевыводящих путей и антибиотикорезистентности у гра-
мотрицательных бактерий.
5 Bauer A. W., Kirby W. M. M., Sherris J. C., Turck M. Antibiotic susceptibility testing by a standardized single disk method. Am J Clin Pathol. 1966; 36:493–496.
466

▲Рис. 35.1. Схема процесса дифундирования антибиотика из диска
втолщу питательной среды
▼Рис. 35.2. Рисунок чашки Петри, в которой Александр Флеминг проверял
антибиотические свойства открытого им пенициллина (по Fleming A., 1929; публикуется по лицензии Всемирной организации здравоохранения)
были известны со времён открытия пенициллина (Рис. 35.2), имен-
но этот, названный диско-диффузионным (disk diffusion test) или ме-
тодом Кирби – Бауэра (Kirby-Bauer test), является первым стандартизованным Всемирной организацией здравоохранения и наиболее распространённым ввиду своей простоты и гибкости (возможность исследования широкого спектра антибиотиков, в любых комбинациях).
Суть метода заключается в нанесении дисков с антибиотиками на агар, куда предварительно была засеяна тестируемая культура «сплошным газоном». Для этого предварительно автоклавированный и остуженный до 48–50°С питательный агар разливают по
467

25 мл в чашки Петри диаметром 100 мм или по 20 мл в чашки диаметром 90 мм, чтобы толщина агара составляла примерно 4 мм, после чего оставляют для застывания при комнатной температуре. После высушивания чашки рекомендуется использовать немедленно или в течение суток, при условии хранения при 4–8°С. Непосредственно перед работой их подсушивают в течение 15 минут при 37°С, чтобы избежать образования конденсата.
В качестве среды чаще всего используют агар Мюллера – Хинтон (Mueller – Hinton agar), разработанный1 в 1941 году Джóном Мюллером2 и Джейн Хинтон3 и принятый в качестве «золотого стандарта» для этого метода. Также используют агар Хоттингера (1,2–1,4 г/л аминного азота, рН 7,0–7,4) и Гивенталя – Ведьминой (рН 7,2–7,6). Последний был разработан 4 в 1980 году Наумом Иосифовичем Гивентáлем5 и Еленой Алексеевной Вéдьминой6 (с колл.). Для исследования чувствительности к ингибиторам системы секреции III типа (например, имидокарба дипропионату) предложено 7 использовать магний-оксалат агар (MOX, от англ. magnesium oxalate agar).
Диски с антибиотиками используются коммерческого производства и хранятся при −18°С (используемые в работе обычно хранят при 4–8°С). За час до работы флаконы с дисками вытаскивают из холодильника, чтобы не допустить попадания влаги из-за резкой смены температур во время открытия. Суспензию из суточной
1 Mueller J. H., Hinton J. A Protein-Free Medium for Primary Isolation of the Gonococcus and Meningococcus. Experimental Biology and Medicine. 1941; 48(1): 330–333; DOI: 10.3181/00379727-48-13311.
2John Howard Mueller, 1891–1954; американский биохимик, бактериолог. Член Национальной академии наук С А (1945). Автор работ по бактериальному метаболизму,
3Jane Hinton, 1919–2003; американский ветеринарный врач (одна из первых афроамериканок). Во время разработки агара работала лаборантом в Гарвардском
университете.
4 Гивенталь Н. И., Ведьмина Е. А., и др. Об унификации методов определения чувствительности микроорганизмов к антибиотикам. Полуколичественная и количественная оценка результатов диффузионного теста. Антибиотики. 1980; 6:420–424.
51923–?; советский врач, бактериолог.
6Советский врач, бактериолог.
7Prashar S., Guemes M. P., et al. Novel disk diffusion assay on magnesium oxalate agar to evaluate the susceptibility of Yersinia pestis to type III secretion system inhibitors. Microbiol Spectr. 2021;
9(1):e0000521; DOI: 10.1128/Spectrum.00005-21.
468

культуры чумного микроба в 0,85%-ном изотоническом растворе хлорида натрия (5 х 108 м. к./мл) по 2 мл наносят на агар и равномерно распределяют шпателем. Через 10–15 минут, когда агар подсохнет, с помощью пинцета 1 или автоматического диспенсера (Рис. 35.3) накладывают диски с антибиотиками на расстоянии не менее 15–20 мм между дисками и краями чашки (обычно не более 6 дисков на чашку диаметром 100 мм), слегка придавливая диски к агару. Чашку с дисками, а также засеянную чашку без дисков (контроль роста культуры) инкубируют при 28°С. Предварительный учёт результатов проводят через 24 часа, а окончательный – через 48 часов, при учёте характерного роста культуры на контрольной чашке.
Учёт результатов осуществляют путём измерения диаметра зон ингибирования (Рис. 35.4) и сравнения их с пограничными значениями, приведёнными в Табл. 35.1. Для этого чашки помещают на тёмную поверхность вверх дном, направляя луч света под углом 45°.
Появление небольших колоний в зоне ингибирования может свидетельствовать как о присутствии посторонней микрофлоры (контаминации), так и о гетерогенности исследуемой культуры (наличие в колонии чувствительных и нечувствительных клеток). В этой ситуации повторяют исследование с чистой культурой (контроль чистоты) и с выросшими в зоне ингибирования колониями.
Следует добавить, что перед использованием новой партии диски проверяют с помощью референс-штаммов2 (Табл. 35.2) на среде Мюллера – Хинтон, поскольку диски, дающие меньшие или большие диаметры зон ингибирования, чем это установлено для рефе- ренс-штаммов, подлежат выбраковыванию (их использование может привести к получению невалидных результатов). Особенно опасна ситуация, когда бракованный диск даёт большую зону ин-
1После нанесения каждого диска его следует несколько утопить в среде, а пинцет – фламбировать, чтобы не допустить вынос культуры из чашки.
2В качестве референс-штаммов (тест-штаммов) используют типичные штаммы с хорошо изученными свойствами, отличающиеся генетической стабильностью. В случае определения чувствительности к антибиотикам используют штамм Y. pestis EV НИИЭГ, а также для внутреннего контроля качества определения антибиотикограммы – штамм E. coli ATCC 25922.
469
