
Опера о чуме (учебник)

социации на 6–8 мономеров, не проявляющих антительной активности (при этом IgG резистентны к действию вещества). Далее, постановка реакций гемагглютинации с сывороткой, обработанной 2- меркаптоэтанолом, и сывороткой, не обработанной им (парные сыворотки), позволяет определить суммарное количество антител и уточнить их класс. Это важно в первую очередь потому, что, как мы помним, в первые дни инфекционного процесса в крови обнаруживаются IgM и только потом IgG, поэтому обнаружение в исследуемой сыворотке IgM свидетельствует о незначительном времени, прошедшем со дня контакта животного с возбудителем чумы, и даёт основания для его выделения бактериологическим методом1.
34 |
СТИВЕН |
|
|
Посвящается Стивену – благородной мыши, пожертвовавшей собой ради того, чтобы автор отработал навыки работы с лабораторными животными
Постановка биологической пробы, то есть заражение лабораторного (биопробного) животного, является обязательной частью лабораторной диагностики особо опасных бактериальных инфекций, без которой порой невозможно выделить возбудитель и поставить верный диагноз. Хорошим примером здесь служит рассмотренный в Главе 20 случай менингеальной чумы у военнослужащего.
Содержатся лабораторные животные в экспериментально-
биологических клиниках (вивариях), которые размещаются в отдель-
ных зданиях либо в изолированных помещениях лабораторного корпуса, имеют отдельный вход и автономную систему вентиля-
1 При обнаружении IgG выделение культуры чумного микроба маловероятно.
450

ции. При этом если виварий размещается не на первом этаже, то для него оборудуется отдельный лифт или лестница.
Как и в случае лаборатории, помещения вивария разделяются на две зоны: «чистую» и «грязную»1. Однако в отличие от лаборатории это разделение указывает только на «чистый» и «грязный» характер проводимых работ. Так, в «чистой» зоне располагаются помещения приёма, карантина и адаптации вновь поступивших из питомника чистых животных, помещения хранения чистого инвентаря (клеток, поилок, посуды) и кормов, помещения манипуляционной (например, для иммунизации), операционной и диагностический ветеринарный кабинет, тогда как в «заразной» зоне – помещения изоляторов, предназначенные для содержания подозрительных на заражение (или заражённых) животных, холодильное помещение для хранения трупов животных и иных отходов, помещение для мойки и дезинфекции оборудования и инвентаря, а также помещение для эвтаназии. При этом последние помещения располагаются на границе зон для обеспечения поточности. Чаще всего разграничение потоков обеспечивается двухкоридорной планировкой, при которой помещения вивария оказываются между двумя коридорами, однако возможна и однокоридорная планировка, при которой «чистые» и «заразные» зоны располагаются в разных концах коридора, а его использование регламентировано по времени.
Помещения, в которых содержатся животные, оборудуются приточно-вытяжной вентиляцией и клетками, обеспечивается контроль микроклимата, рацион кормления и график уборки, то есть создаются условия, обеспечивающие их комфортное содержание
(Табл. 34.1).
Непосредственно работу с животными и пробами зоологопаразитологического материала выполняют уже в блоке для работы с инфицированными животными, который располагают в «грязной» зоне вивария или «заразной» зоне лаборатории, отделяя от остальных помещений зоны предбоксом (двери блока дополнительно оборудуются порогом не менее 30 см).
1 Обратите внимание на чёткую разницу в терминологии: «заразная» зона в случае лаборатории, но «грязная» – в случае вивария!
451
Табл. 34.1. Основные параметры условий для содержания лабораторных животных
|
|
Параметр |
|
||
Вид живот- |
Температура, |
Относительная |
Площадь |
Высота |
|
ного |
клетки, |
клетки, |
|||
°С |
влажность, % |
||||
|
см2 |
см |
|||
|
|
|
|||
Мыши |
|
|
31–76 |
13 |
|
Крысы |
|
|
110–390 |
18 |
|
Хомяки |
18–26 |
30–70 |
65–105 |
16 |
|
Морские |
|
390–650 |
18 |
||
|
|
||||
свинки |
|
|
|||
|
|
|
|
||
Кролики |
16–22 |
|
1500–4000 |
36 |
|
В состав блока входят помещения для приёма животных из вивария и доставленных из очагов в виде трупов (при отсутствии вивария сюда же доставляют живых животных), помещения для заражения, содержания и вскрытия животных, а также помещения для обеззараживания инвентаря. Несложно догадаться, что, как и в случае лаборатории, блок подразделяют на уровни безопасности животных (ABSL; Animal Biosafety level). Работу с животными,
заражёнными (подозрительными на заражение) возбудителями особо опасных инфекций, выполняют в блоке не ниже уровня 3 (ABSL-3), соблюдая принцип парности, в костюме I типа, дополненном высокими сапогами, прорезиненным фартуком и нарукавники. Помещения блока этого уровня оборудуются БМБ открытого типа для заражения, что позволяет операторам располагаться друг напротив друга, а также ламинарными станциями для ухода за животными и чисткой клеток. Заражённых животных содержат в помещениях, оборудованных вентиляционными системами с HEPA-фильтрами, чаще в виде стеллажей с клетками, подключенных к общей системе вентиляции блока.
Для работ с чумным микробом чаще всего используют белых мышей (Mus albus officinarum) или морских свинок (Cavia porcellus),
при этом последние наиболее чувствительны к данной инфекции и поэтому предпочтительнее. Однако при выборе животного следует помнить, об избирательной вирулентности чумного микроба. Так, например, а л т а й с к и е ш т а м м ы являются слабовирулент-
452

ными для морских свинок, тогда как для мышей они высоковирулентны. То же относится и к некоторым бесфракционным штаммам, которые, более того, будучи высоковирулентными для больших песчанок (Rhombomys opimus), оказываются слабовирулентными для краснохвостых (Meriones libycus) и гребенщиковых (Meriones tamariscinus) песчанок. Особенно показателен в этой связи опыт 1 иммунизации песчанки, которая погибла через 252 дня после заражения, при этом из её лёгких была выделена вирулентная культура, а из околопочечного абсцесса – слабовирулентная. Причины этого явления до конца не изучены, хотя среди возможных, например, выделяют некоторую атипичность плазмиды pCad у кавказских штаммов. Сходство некоторых её генов c генами аналогичной плазмиды Y. enterocolitica могут косвенно свидетельствовать о способности вносить изменения в процесс взаимодействия с организмом животного, приближая его к таковому у энтеропатогенных йерсиний.
В блок животные должны поступать подготовленными для соответствующей манипуляции: взвешенными, с выбритыми при необходимости участками тела.
Заражение производят в БМБ над подносом, в котором располагают салфетку, смоченную раствором дезинфектанта. Для снижения риска аварий (повреждения кожного покрова иглой) работу осуществляют два специалиста: один фиксирует (держит) животное, а другой заражает. Справа от заражающего в БМБ располагают контейнер с раствором дезинфектанта, а слева – необходимый инвентарь (поднос со шприцем, стакан с пинцетом, тампоны).
Важную роль во время заражения животного играет правильная его фиксация. Достают животное из клетки руками или корнцангом в зависимости от вида. Так, мышь достают за хвост, быстро ставя её лапками на поверхность для последующей фиксации. При этом не рекомендуется долго удерживать мышь за хвост (вниз головой), поскольку она может подтянуться и укусить. Крысу обычно берут со стороны спины, фиксируя рукой передние лапы. Похожим образом достают морскую свинку, но делают это аккуратно,
1 Хрусцелевский В. П., Хрусцелевская Н. М. О роли штаммов чумного микроба разной вирулентности в энзоотии чумы. Проблемы особо опасных инфекций. 1968; 4:186–193.
453
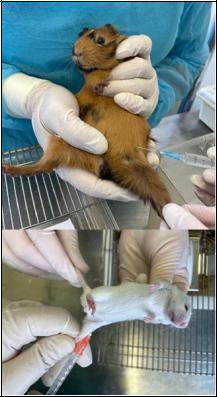

вы). Для заражения у животного выбривается часть тела (у мышей участок 1 х 2 см, у морских свинок участок 2 х 3 см) и смачивается физиологическим раствором. Использовать раствор дезинфектанта строго запрещается, поскольку это может привести как к гибели микроорганизма, так и к лишнему стрессированию животного.
При данном виде заражения крайне важно подавать животное строго горизонтально, чтобы исключить риск падения (скатывания) капель материала и его разбрызгивание. В зависимости от консистенции материал наносится на заранее скарифицированную кожу пипет-
кой, пинцетом или скальпелем, после чего аккуратно втирается плавными движениями тупой стороной скальпеля под прикрытием чашки Петри. Если наносимый материал является кусочком органа, то на кожу наносится либо его суспензия в физиологическом растворе, либо делается несколько отпечатков. Затем животное помещается обратно в клетку, а использованный инструментарий сбрасывается в контейнер с раствором дезинфектанта.
Подкожное заражение чаще всего осуществляют в паховую область. Для этого материал заранее набирают в шприц. Для удаления попавших пузырьков воздуха аккуратно двигают поршнем вперёд-назад, чтобы они переместились в район подыгольного конуса, после чего пинцетом на иглу накалывают небольшой стерильный бумажный пакетик с ватой или марлей, в который выгоняют воздух. Запрещается постукивать по цилиндру шприца или «спускать» воздух в контейнер с раствором дезинфектанта. Непосредственно перед заражением, когда мышь уже фиксирована напарником, пакетик снимают пинцетом и опускают в контейнер с раствором дезинфектанта. Этим же пинцетом берут тампон, смоченный физиологическим раствором, и протирают место инъек-
455

ции, после чего кладут его на руку напарника, чтобы после заражения не производить лишних движений. Защипывают пинцетом кожу животного в районе паха (в проекции лимфатического узла) и несколько оттягивают (приподнимают вверх) до образования треугольной складки (Рис. 34.3).
приц с материалом удерживают горизонтально и, не меняя положения, вводят иглу в центр складки, после чего надавливают на поршень шприца, вводя содержимое. Далее пинцетом берут тампон, накрывают им место инъекции и вытаскивают иглу из кожи. Животное помещают обратно в клетку, а в шприц набирают раствор дезинфектанта и сбрасывают его в контейнер.
Внутрибрюшинное заражение применяют для ускорения протекания инфекционного процесса, для чего животное, удерживаемое двумя руками, подаётся головой вниз, чтобы органы брюшной полости сместились к диафрагме. Обработав кожу тампоном, смоченным физиологическим раствором1, защипывают пинцетом кожу животного в правой нижней стороне брюшка, отступая примерно 0,5–0,8 см от белой линии живота, и несколько оттягивают (приподнимают вверх) до образования треугольной складки.
приц с материалом удерживают горизонтально и, не меняя положения, вводят иглу в основание складки, при этом ощущая прокол кожи и брюшины (ощущение провала иглы в пустоту). Далее надавливают на поршень шприца, вводя содержимое, после чего пинцетом берут тампон, накрывают им место инъекции и вытаскивают иглу из кожи. Животное помещают обратно в клетку, а в шприц набирают раствор дезинфектанта и сбрасывают его в контейнер.
В практике лабораторной диагностики чумы используются эти три метода. При этом чаще всего используется подкожное введение, тогда как внутрибрюшинно заражают для ускорения гибели, а накожно – когда имеется подозрение на содержание значительного
1 В большинстве руководств указывается на необходимость обработки кожи спиртовым раствором, однако на практике целесообразнее использовать физиологический раствор, поскольку животные чистые и риск развития негативных последствий из-за пренебрежения правил асептики минимален, тогда как риск развития негативной реакции со стороны животного на запах спирта весьма велик, что может привести к его беспокойству и, как следствие, аварии.
456

Рис. 34.3. Подкожное заражение мыши
количества посторонней микрофлоры. При подкожном методе заражения вводится 0,2 мл мышам и 0,5 мл – морским свинкам, а при внутрибрюшинном – 0,3–0,5 мл мышам и 0,5–1 мл морским свинкам. Если подозревают незначительное содержание возбудителя в материале, заражающую дозу увеличивают до 0,5–1 мл для мышей и 1,5–2 мл для морских свинок подкожно. Как правило, животные гибнут на 5–7 сутки. Если этого не произошло, их подвергают эвтаназии гуманным способом (чаще всего помещают в камеру с CO2 или хлороформом).
Далее рассмотрим методы заражения, применяемые в исследовательской практике.
Внутривенное заражение. Для этого способа используют хвостовую (мышь), ушную (морская свинка), ярёмную (кошка, собака, морская свинка), бедренную (кошка, собака) вену или краевую вену уха (кролик). Место введения тщательно обрабатывают тампоном, смоченным физиологическим раствором, чтобы вызвать набухание вены, а в случае хвостовой вены некоторое время прогревают животное под лампой.
457
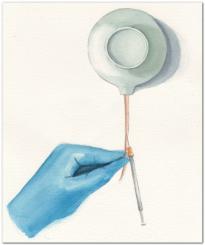
|
Фиксируют животное |
спе- |
|
|
циальным |
приспособлением, |
|
|
либо, в случае мыши, накры- |
||
|
вают тиглем таким образом, |
||
|
чтобы вне |
него располагался |
|
|
только хвост, который слегка |
||
|
натягивают (Рис. 34.4). Данный |
||
|
метод требует весьма точного |
||
|
попадания в вену, и редко у |
||
|
кого на этапе отработки навы- |
||
|
ков получается с первого раза. |
||
|
Если материал вводится мимо |
||
|
вены, область хвоста побеле- |
||
|
ет – в этой ситуации следует |
||
Рис. 34.4. Внутривенное заражение |
несколько |
подтащить |
иглу |
мыши |
шприца на себя и «войти» в |
||
вену заново.
Внутрикожное заражение. Для данного метода заранее выбривают кожу и протирают место инъекции тампоном, смоченным физиологическим раствором. Иглу скосом наружу вводят под углом 10° в толщу поверхностного слоя кожи на несколько миллиметров. Материал вводят до тех пор, пока на коже в месте введения не появится бугорок.
Интраокулярное заражение (в конъюнктиву глаза). Жёстко фиксируют голову животного таким образом, чтобы глаз, в который предполагается осуществлять заражение, располагался строго горизонтально. Пинцетом аккуратно оттягивают нижнее веко у внутреннего угла глаза и с помощью пинцета на расстоянии не выше одного сантиметра над уровнем глаза наносят маленькую каплю на конъюнктиву глаза. Возвращают веко на место, а выступившие излишки материала промакивают тампоном, после чего его погружают в раствор дезинфектанта.
Размеры игл и максимально допустимые объёмы вводимой жидкости приведены в Табл. 34.2.
458
Табл. 34.2. Размеры игл и максимально допустимые объёмы вводимой
|
жидкости в зависимости от вида лабораторного животного |
|||
|
|
|
|
|
Вид животного |
|
Метод введения |
|
|
внутривенно |
внутрибрюшинно |
подкожно |
||
|
||||
мышь |
<25 G |
<23 G |
<23 G |
|
0,2–0,5 мл |
0,5 мл |
0,5 мл |
||
|
||||
крыса |
<23 G |
<23 G |
<23 G |
|
0,5–2,5 мл |
5 мл |
5 мл |
||
|
||||
хомячок |
<25 G |
<23 G |
<23 G |
|
1 мл |
3 мл |
1–2 мл |
||
|
||||
морская свинка |
<23 G |
<21 G |
<23 G |
|
2,5 мл |
2,5 мл |
5 мл |
||
|
||||
кролик |
<23 G |
<20 G |
<20 G |
|
до 30 мл |
30 мл |
30 мл |
||
|
||||
Павшие и подвергнутые эвтаназии животные подлежат паталогоанатомическому исследованию (вскрытию), которое проводят в соответствующем помещении блока – вскрывочной (секционной).
Для вскрытия подготавливают подложку (чаще деревянную), на которой размещают салфетку, обильно смоченную раствором дезинфектанта, ватные шарики (3 штуки), иглы для фиксации животного, ёмкость (стакан) с 97%-ным раствором спирта, в которой помещаются ножницы и анатомический пинцет (хирургический может рвать нежные ткани органов), а также спиртовку, корнцанг и контейнер с раствором дезинфектанта. Перед началом работы следует особое внимание уделить ножницам, которые должны быть острыми и иметь закруглённые бранши, поскольку от этого зависит качество выполняемой работы.
Процесс вскрытия лабораторного животного (мыши) показан на схеме (Рис. 34.5), для наглядности дополненной фотографиями, и сводится к следующим этапам (номер этапа совпадает с номером на схеме и фотографиях):
459
