
Опера о чуме (учебник)

пользования образцов клинического материала (кровь, бронхоальвеолярная жидкость) чувствительность снижается до 104–105 м. к./мл или 0,01–0,1 мкг/мл для капсульного антигена (Рис. 33.1).
Ранее мы говорили о существовании так называемых бесфракционных штаммов чумного микроба, которые, как несложно догадаться, не могут быть идентифицированы данным методом. Поэтому в настоящее время разрабатываются1 тест-системы ИХА, содержащие моноклональные антитела к капсульному антигену и LcrV (соответственно результат учитывается по трём полоскам). Чувствительность такой тест-системы составляет 0,001–0,002 мкг/мл.
Рис. 33.1. Анализ чувствительности панели для чумного микроба (а) и капсульного антигена (b). Можно видеть наличие слабой полоски положительного
результата в случае 103 м. к./мл и 4 нг/мл, т. е. 0,004 мкг/мл (Hsu H.-L., 2018)
Для исследования образца2 на содержание специфичных к капсульному антигену антител (IgG) используют ИХА-тесты, представляющие собой полоску из нитроцеллюлозы шириной 5 мм. Вместо антител тестовая часть содержит адсорбированный очищенный антиген (капсульный антиген или совместно с LcrV), а контрольная – бычий сывороточный альбумин. Исследуемый образец впитывается в нижнюю часть полоски и поднимается вверх, последовательно взаимодействуя с антигеном и альбумином. В итоге, если проба содержит антитело, происходит его связывание с антигеном,
анеспецифичные антитела поднимаются выше и взаимодействуют
1Hau D., Wade B., et al. Development of a dual antigen lateral flow immunoassay for detecting Yersinia pestis. PLoS Negl Trop Dis. 2022; 16(3):e0010287; DOI: 10.1371/journal.pntd.
0010287.
2 Чаще всего сыворотки крови, разведённой фосфатным буфером с 0,5%-ным Твин-80 в количестве 1:100.
430

с альбумином. Оба взаимодействия приводят к образованию полос розового цвета.
Можно видеть, что все эти тесты основаны на специфической реакции между антигеном и антителом, поэтому их также называют серологическими реакциями. Независимо друг от друга в начале 70-х годов прошлого столетия Евой Энгвалл1 и Пéтером Перельмáном2, а также Бáуке ван Вéменом3 и Антóном у рсом4, был создан5
ещё один метод – иммуноферментный анализ (ИФА, ELISA, от англ. enzyme-linked immunosorbent assay), который позволяет выявить комплекс «антиген – антитело» с помощью субстрата, расщепляемого ферментом, в результате чего происходит окрашивание. И поскольку за счёт каталитических свойств ферментов для достижения окрашивания требуется меньшее количество комплексов, ИФА отличается высокой чувствительностью, хотя и сложнее в выполнении, чем ИХА.
К настоящему времени разработаны различные методы ИФА, однако для детекции чумного микроба чаще всего применяют ва-
риант непрямого неконкурентного гетерогенного ИФА, именуемый
«сéндвич». По принципу действия данный вариант похож на прямой ИХА, который, как мы помним, также именуется «сендвич». Суть метода «сендвич» ИФА состоит в том, что на твёрдый носитель (чаще дно лунки планшета) с иммобилизованными (т. е. прикреплёнными) антителами (Ат) добавляют исследуемую пробу (аналит), содержащую антиген (Аг). При инкубации этот антиген связывается с антителами, а непрореагировавшие компоненты реакции удаляются отмывочным раствором. Далее вносят конъюгат, представляющий собой специфические антитела (Ат*), меченные ферментом и способные связываться с антигеном (Аг). Непрореагировав-
1Eva Engvall, р. 1940; шведский биохимик.
2Peter Perelmann, 1919–2005; чехословацкий и шведский биохимик. Эмигрировал
ввецию во время немецкой оккупации Судетской области в Чехословакии.
3Bauke van Weemen, 1873–1936; нидерландский врач.
4Anton Schuurs, нидерландский врач.
5Engvall E., Perelmann P. Enzyme-Linked Immunosorbent Assay, Elisa: III. Quantitation of Specific Antibodies by Enzyme-Labeled Anti-Immunoglobulin in Antigen-Coated Tubes. J Immunol.
1972; 109(1):129–135; DOI: 10.4049/jimmunol.109.1.129; Van Weemen B. K., Schuurs A. H. W. M. Immunoassay using antigen-enzyme conjugates. FEBS Letters. 1971; 15(3):232–236; DOI: 10.1016/0014-5793(71)80319-8.
431
шие компоненты снова удаляются промывкой. В итоге, если проба (аналит) содержит антиген, он оказывается как бы зажат между иммобилизованными антителами и конъюгатом, образуя «сен-
двич»: Ат – Аг – Ат*.
В качестве конъюгата используют мноклональные антитела, меченные пероксидазой хрена или иной пероксидазой коммерческого производства. Для визуализации «сендвича» используют суб- страт-индикаторный раствор, состоящий из перекеси водорода и вещества, окисляющегося при взаимодействии с пероксидазой и перекисью водорода, что приводит к окрашиванию раствора, которое оценивается визуально и фотометрически. В качестве такого вещества применяют, например, ABTS (2,2'-азино-бис-(3- этилбензтиозолин-6-сульфокислоты) диаммониевая соль), окрашивающую раствор в зелёно-голубой цвет (длина волны 405–420 нм), и TMB (3,3’,5,5’-тетраметилбензидин), окрашивающий раствор в синий цвет (длина волны 370–650 нм). Для остановки реакции используют серную или ортофосфорную кислоты.
Чувствительность тест-системы в случае чумного микроба составляет 106 м. к./мл (при отсутствии положительного результата с другими микроорганизмами в концентрации 109 м. к./мл), а в случае капсульного антигена – 0,004 мкг/мл. Как и в случае ИХА, разрабатываются тест-системы ИФА для диагностики бесфракционных штаммов, содержащие моноклональные антитела к капсульному антигену и LcrV.
Методом ИФА исследуют ткани и органы, а также сыворотку крови. Пробоподготовка включает в себя обеззараживание (инактивацию) мертиолятом натрия до конечной концентрации 1:10000 (0,01%) с прогреванием полчаса при 56°С. Некоторые специалисты для обеззараживания используют формалин, добавляя его в пробы до конечной концентрации 1% с последующей экспозицией не менее 3 часов или 2% с экспозицией час, после чего прогревают полчаса при 72°С. Далее 100 мкл пробы отбирают в пробирку объёмом 1,5 мл и добавляют лизирующий раствор, приготовленный на основе 6М гуанидинизотиоцианата, или раствор коммерческого производства, после чего инкубируют в течение 15 минут при 65°С. Далее пробу можно центрифугировать для осаждения осадка
432

(600 об/мин в течение 2–3 минут) и отбирать надосадочную жидкость на границе фаз.
Если исследуются погадки птиц, то при помощи 1%-ного раствора формалина на фосфатно-солевом буфере концентрацией 0,1 моль/л готовятся их суспензии, которые можно объединить в одну пробу, которую отстаивают, исследуют надосадочную жидкость. Экскременты хищников растирают с 1%-ным раствором формалина и через сутки исследуют. Костные остатки исследуют чаще индивидуально (допускается объединение до 20–25 штук), измельчая и заливая десятью объёмами 1%-ным раствором формалина с физиологическим раствором.
Если культура на чашке заросла посторонней микрофлорой, то её выдерживают сутки в термостате при 37°С (чтобы наработать капсульный антиген), после чего переносят на чашку с 3–4 мл 2%- ного раствора формалина для обеззараживания. Через сутки жидкость исследуют. Существует и иной способ. Готовят суспензию культуры, снятой из разных секторов чашки, в физиологическом растворе, после чего добавляют формалин до конечной концентрации 2% и исследуют через сутки.
В качестве более дешёвой альтернативы применяют точечный твёрдофазный иммуноферментный анализ или дот-ИФА (ДИА, dotELISA), предложенный1 в 1982 году. Суть этого метода заключается в том, что вместо лунок микропланшета используют нитроцеллюлозную подложку с нанесённым на неё в виде точек антителом (антигеном), помеченным цветной меткой. В результате реакции образуются цветные пятна, легко различимые на белом фоне, что исключает необходимость использования фотометра.
Разработанные2 тест-системы с коллоидным серебром в качестве метки имеют чувствительность в случае чумного микроба 5 х 104 м.к./мл, а в случае капсульного антигена – 0,0048 мкг/мл.
1Hawkes R., Niday E. A dot-immunobinding assay for monoclonal and other antibodies. Anal Biochem. 1982; 119(1):142–147; DOI: 10.1016/0003-2697(82)90677-7.
2Носкова О. А., Загоскина Т. Ю., и др. Применение ДОТ-иммуноанализа для выявления антигенов чумного микроба в полевом материале. Проблемы особо опасных ин-
фекций. 2014; 3:69–71
433

В1949 году Эрья н Оухтерлóни1 опубликовал статью2, в которой, резюмируя собственный опыт изучения дифтерийного токсина3 и наблюдения других учёных (в частности, Гéнриха Беххóльда4 ещё в 1905 году5), предложил метод идентификации антигена и антитела, основанный на уже известной нам реакции антиген – антитело, путём измерения градиентов диффузии в геле, получивший назва-
ние реакция диффузной преципитации по Оухтерлони.
Вобщем виде преципитация (от лат. praecipitatio – «падаю вниз») это химическая реакция, в результате которой образуется осадок. Так, например, если взять узкую пробирку и на 0,3 мл иммунной сыворотки (т. е. сыворотки, содержащей антитела) аккуратно по стеночке прилить равное количество образца, содержащего антиген, то в результате их взаимодействия образуется тонкое непрозрачное кольцо комплекса «антиген – антитело», именуемое преципитатом. Если при этом образец является экстрактом ткани
иоргана (1–2 г), предварительно залитой физиологическим раствором (5–10 мл) и прокипячённой полчаса, то такую реакцию назы-
вают термопреципитация или преципитация по Асколи, в честь Альбéрто Аскóли6, предложившего её в 1911 году для обнаружения антигенов возбудителя сибирской язвы7.
Сложность реакции по Асколи состоит в том, что порой кольцо бывает сложно визуализируемым, а также, если прилить образец быстро, оно и вовсе не образуется. Поэтому поистине революционная идея Эрьяна Оухтерлони состояла в том, чтобы «перенести» эту реакцию из пробирки на чашку Петри. Для постановки реакции
1 Örjan Thomas Ouchterlony, 1914–2004; шведский врач, бактериолог. Член ведской Академии наук (1968).
2Ouchterlony Ö. Antigen – antibody reactions in gels. Acta Pathol Microbiol Scand. 1949; 26(4):507–515; DOI: 10.1111/j.1699-0463.1949.tb00751.x.
3Ouchterlony Ö. In vitro method for testing the toxin-producing capacity of Diphtheria bacteria.
Acta Pathol Microbiol Scand. 1949; 26(4):507–515; DOI: 10.1111/j.1699-
0463.1948.tb00655.x.
4 Heinrich Jakob Bechhold, 1866–1937; германский химик, автор работ по коллоидной химии в медицине. Член Немецкой Академии естествоиспытателей Леополь-
дина (1932).
5Bechhold H. Strukturbildung in Gallerten. Zeitschrift für Physikalische Chemie. 1905;
52U(1):185–199; DOI: 10.1515/zpch-1905-5210.
6Alberto Ascoli, 1877–1957; итальянский химик, гигиенист.
7Ascoli A. Die Präzipitindiagnose bei Milzbrand. Centralbl Bakt Parasit Infeckt. 1911; 58:63–70.
434

1,5%-ный агарозный гель тонким слоем выливают на чашку и после затвердевания осторожно вырезают в нём лунки, в которые помещают исследуемую пробу и антиген или антитело, в зависимости от того, на что исследуют пробу. Помещённые в лунки антиген и антитело диффундируют друг к другу, в результате чего между лунками образуется тонкая полоска преципитата. При этом у многокомпонентных систем между лунками с антигенами и антителами появляется несколько линий преципитации: у идентичных антигенов линии преципитации сливаются, а у различных – пересекаются (Рис. 33.2).
Данный метод чаще всего применяется для качественного анализа, однако его можно использовать полуколичественно, если использовать разведения исследуемой пробы. Для количественной оценки антигена также применяют радиальную иммунодиффузию по Манчини, разработанную Джулиáной Манчини1 в 1964 году2. Суть этого метода состоит в том, что моноспецифичную сыворотку, содержащую антитело, заранее диспергируют в геле. Тогда, после внесения пробы в лунку, вокруг неё образуется кольцо преципитации, по диаметру которого и оценивают количество антигена в пробе.
Рис. 33.2.
Реакция диффузной преципитации по Оухтерлони культуры чумного микроба:
общий вид (слева), пересечение (а) и сливание (b) линий преципитации
1Giuliana Mancini, 1934–?; итальянский врач.
2Mancini G., Carbonara A. O., et al. Immunochemical quantitation of antigens by single radial
immunodiffusion. Immunocemistry. 1965; 2(3):235–254; DOI: 10.1016/0019-2791(65) 90004-2.
435
Ещё одним простым способом обнаружения антигена является реакция агглютинации (РА), при которой под действием антител происходит склеивание (образование агглютината) и выпадение в осадок корпускулярных антигенов, то есть бактерий, а также частиц с адсорбированными на них антигенами. Проводят данную реакцию на стекле и в пробирках.
В первом варианте на обезжиренное стекло, лежащее в чашке Петри, наносят три капли физиологического раствора и в две из них добавляют по капле специфической (адсорбированной) сыворотки или неадсорбированной сыворотки, предварительно разведённой в соотношении 1:25–1:5. Затем петлёй рядом с каплей физиологического раствора наносят инкубированную при 30°С суточную культуру, плавными круговыми движениями растирают её и вносят сначала в каплю физиологического раствора, а затем в близлежащую каплю сыворотки, размешивая в каждой капле до образования гомогенной взвеси. При этом капля физиологического раствора является контролем культуры, а капля с сывороткой, куда не вносилась культура, – контролем сыворотки. Контроли нужны для того, чтобы исключить спонтанную агглютинацию культуры и сыворотки. При положительной реакции в капле сыворотки через 5–10 минут образуется хлопьевидный осадок (Рис. 33.3). Следует отметить, что для удобства некоторые специалисты проводят эту реакцию непосредственно в чашке Петри.
Описанный метод принято считать ориентировочным. Развернутый метод был предложен Евгенией Ильиничной Коробковой и заключается в постановке реакции с цельной сывороткой и её разведениями 1:2, 1:4, 1:8 и так далее до 1:128.
Примечательно, что до развития молекулярно-генетических методов исследования данный вариант использовался для подтверждения идентичности штамма в очаге. Для этого в качестве сыворотки использовали сыворотку крови от первого больного. В том случае, если выделенный от какого-то больного штамм микроорганизма агглютинировался сывороткой от первого больного, можно было говорить, что этот больной инфицирован тем же штаммом.
436

Рис. 33.3. Реакция агглютинации на стекле: положительная реакция (в середине), а также контроль сыворотки (слева)
и культуры (справа)
Во втором варианте, предложенном1 Рубéном Кáном2 в 1922 году и также считающимся развёрнутым, в одинаковые пробирки вносят по 1 мл физиологического раствора. Затем 0,1 мл рабочего разведения сыворотки (например, 1:50) добавляют в отдельную пробирку (контроль) и первую пробирку с физиологическим раствором (1:100), после чего титруют последовательным переносом из пробирок с физиологическим раствором по 1 мл (т. е. получают разведения сыворотки 1:200, 1:400, 1:800 и т. д.). Во все пробирки (кроме контрольной) добавляют по 0,1 мл (две капли) культуры, а также в отдельную пробирку с 1 мл физиологического раствора (контроль). Далее пробирки аккуратно встряхивают и инкубируют при 28°С. Учёт результатов осуществляют предварительно через 2 часа и окончательно через сутки.
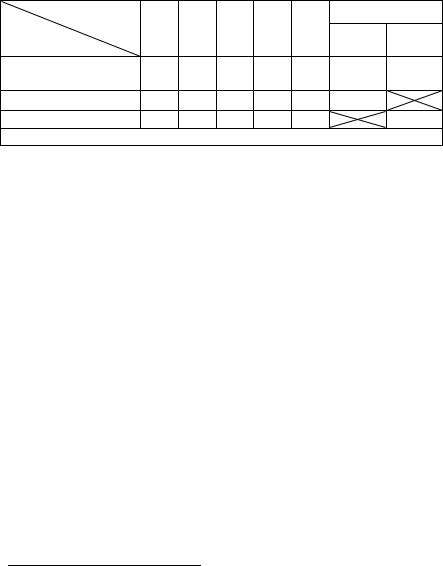
Схема метода приведена в Табл. 33.1. «Читают» её, как и Табл. 31.3, сверху вниз по строчкам. Стрелка «→» указывает на перенос указанного над ней объёма (в данном случае 1 мл) в следующую пробирку, стрелка «↑» – на удаление указанного рядом с ней объёма (в данном случае 1 мл) из пробирки в раствор дезинфектанта. Цифра без стрелки обозначает вносимый объём. Аналогичным образом «читают» все приведённые далее схемы.
1Khan R. L. A simple quantitative precipitation reaction for syphilis. Arch Derm Syphilol. 1922; 5(5):570–578; DOI: 10.1001/archderm.1922.02350300011003.
2Reuben Leon Khan, 1887–1979; американский военный врач литовского происхождения. Родился в литовском городе Свире (тогда – Российская Империя), но в
возрасте 12 лет был перевезён родителями в С А. Один из основателей иммунологии, автор работ по серологическим реакциям.
437
|
|
Табл.33.1. Схема постановки РА (по Р. Кану) |
||||||
Пробирки |
|
|
|
|
|
Контроль |
||
|
1 |
2 |
3 |
4 |
5 |
Сыво- |
Куль- |
|
|
|
|
|
|
|
|||
Реактивы |
|
|
|
|
|
ротки |
туры |
|
|
|
|
|
|
|
|||
Физиологический |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
раствор, мл |
||||||||
|
|
|
|
|
|
|
||
Сыворотка, мл |
1 |
|
|
|
1 ↑ |
1 |
|
|
Культура, мл |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
|
0,1 |
|
|
Инкубация при 28°С |
|
|
|
||||
Уже в 1925 году Арлéйл Нóбл1 предложила2 модификацию этого метода, применяемую в лабораторной диагностике чумы и основанную на том, что если первую стадию агглютинации (соединение антигена с антителом) провести при больших концентрациях, результат реакции можно получить быстрее. Для постановки используют 8 пробирок. В пробирки со 2 по 8 вносят по 0,1 мл физиологического раствора, а в пробирку 1 – 0,2 мл цельной сыворотки. Затем из первой пробирки во вторую переносят 0,1 мл сыворотки (разведение 1:2) и далее титруют до восьмой пробирки (1:128), после чего в каждую пробирку добавляют по 0,1 мл (две капли) культуры и тщательно встряхивают в течение 3–5 минут. После этого во все пробирки добавляют по 0,8 мл физиологического раствора, благодаря чему достигается конечная концентрация 1:10, 1:20 и так далее. Схема метода приведена в Табл. 33.2. Учёт результатов осуществляют предварительно сразу и окончательно через 15 минут.
Как и многим бактериям, патогенным йерсиниям присуща спонтанная агрегация в жидкой среде (аутоагглютинация). У
Y. pseudotuberculosis и Y. enterocolitica аутоагглютинация проявляется только при 37°С и обусловлена действием YadA, тогда как у чумного микроба аутоагглютинацию обеспечивает выделенный 3 в
1Arlyl Noble, 1887–1981; американский врач, первая женщина-бактериолог в
СА.
2Noble A. A rapid method for the macroscopic agglutination test. J Bacteriol. 1927; 14(5):287– 300; DOI: 10.1128/jb.14.5.287-300.1927 (метод был представлен на собрании Общест-
ва американских бактериологов 29–31 декабря 1925 года).
3 Рыкова В. А. Характеристика фактора аутоагглютинации возбудителя чумы. Дис. …
кандидата биологических наук. Ростов-на-Дону, 2010, 141 с.
438

2010 году фактор агглютинации, представляющий собой комплекс белка молекулярной массой 17,5 кДа с низкомолекулярным компонентом. В качестве контроля аутоагглютинации используют две пробирки с 0,9 мл физиологического раствора, в одну из которых добавляют 0,1 мл (две капли) культуры, а в другую – 0,1 мл цельной сыворотки.
|
|
Табл. 33.2. Схема постановки РА (по А. Нобл) |
||||||
Пробирки |
|
|
|
|
|
Контроль |
||
|
1 |
2 |
3 |
… |
8 |
Сыво- |
Куль- |
|
|
|
|
|
|
|
|||
Реактивы |
|
|
|
|
|
ротки |
туры |
|
|
|
|
|
|
|
|||
Физиологический |
0,1 |
0,1 |
0,1 |
… |
0,1 |
0,9 |
0,9 |
|
раствор, мл |
||||||||
|
|
|
|
|
|
|
||
Сыворотка, мл |
0,2 |
|
|
… |
0,1 ↑ |
0,1 |
|
|
Культура, мл |
0,1 |
0,1 |
0,1 |
… |
0,1 |
|
0,1 |
|
|
Встряхивать 3–5 минут |
|
|
|
||||
Физиологический |
0,8 |
0,8 |
0,8 |
… |
0,8 |
|
|
|
раствор, мл |
|
|
||||||
|
|
|
|
|
|
|
||
Оценку результатов проводят по системе четырёх крестов: |
||||||||
|
|
раствор прозрачный, имеется |
|
4+ |
++++ |
выраженный осадок |
|
|
|
(результат положительный) |
|
|
|
раствор немного мутный (отсутствует полное |
|
3+ |
+++ |
просветление), осадок имеется |
|
|
|
(результат положительный) |
|
2+ |
++ |
раствор мутный, осадок незначительный |
|
(результат сомнительный) |
|||
|
|
||
1+ |
+ |
раствор мутный, осадок отсутствует |
|
(результат отрицательный) |
|||
|
|
Контроль
раствор прозрачный
сыворотки
Контроль
раствор равномерно мутный
антигена
439
