
Опера о чуме (учебник)
ментирует, но ферментируют другие бактерии рода Yersinia, что приводит к окрашиванию их колоний от зелёного до жёлтого цвета. Другие бактерии либо растут в иной цветовой гамме, либо ингибируются. Забегая несколько вперёд, отметим, что эта среда может давать ложноотрицательный результат в случае штаммов неосновного подвида.
В качестве жидких питательных сред используют бульоны Хоттингера, Мартена, с сердечномозговым экстрактом, триптика- зо-соевый и LB (от англ. lysogeny broth) с добавлением генцианвиолета. Александр Йерсен выращивал культуру чумного микроба в пептонной воде.
Для выделения культуры («золотой стандарт»), материал сеют на жидкие (бульоны), полутвёрдые (0,08–0,7% агара) и твёрдые (1,5–2% агара) питательные среды в зависимости от вида материала.
Жидкие и полужидкие разливают в пробирки (последние в виде столбика с ровным или скошенным краем), а твёрдые – в чашки Петри. Посевы проводят в БМБ II класса над лотком, содержащим салфетку, смоченную раствором дезинфектанта. Ёмкости, в которые будут засевать материал, заранее подписывают, а все манипуляции производят сосредоточенно, не торопясь, чтобы избежать аварий. Чаще всего в лабораторию материал доставляется в пробирке (флаконе), поэтому рассмотрим технику посева из неё.
Большим, указательным и средним пальцами левой руки берут пробирку, при этом ладонь размещают под ней (допускается безымянным пальцем и мизинцем придерживать её снизу). Некоторые специалисты предпочитают размещать ладонь сверху, но это неудобно, поскольку закрывает обзор содержимого пробирки и создаёт аварийную ситуацию. В правую руку берут петлю или пипетку (дозатор), используя большой, указательный и средний пальцы. Безымянным пальцем и мизинцем, прижимая к ладони,
370

захватывают пробку пробирки и над пламенем горелки (спиртовки) аккуратно вынимают её. Затем быстро обжигают горлышко пробирки в пламени горелки. Стерильной петлёй (одноразовой или предварительно обожжённой1) берут материал на кончик петли и извлекают её, не касаясь стенок пробирки (либо всасывают в кончик пипетки).
С этого момента рука должна оставаться неподвижной (надёжнее всего зафиксировать её на локте). Петля располагается параллельно салфетке, а пипетка – таким образом, чтобы её кончик находился как можно ближе к салфетке. Далее закрывают пробирку пробкой (левой рукой вдевают на пробку) и отставляют в сторону2. Берут ёмкость, в которую будет осуществляться посев материала, открывают её, сеют материал, закрывают и отставляют в сторону. Затем одноразовую петлю или пипетку погружают в контейнер с раствором дезинфектанта (который располагается в «грязной» зоне бокса). В случае пипетки сначала погружается её носик, в полость набирается раствор дезинфектанта, и только после этого она погружается полностью. Если погрузить пипетку сразу, то она будет плавать в растворе незаполненная. В случае многоразовой петли её вносят в пламя горелки, начиная с петледержателя, медленно продвигаясь к кольцу с остатками материала, который подсушивают, после чего её снова вводят в пламя горелки (в этот раз со стороны кольца) и прокалывают докрасна. Если внести петлю сразу, то обугленный материал, не будучи обеззараженным, может либо разлететься на кусочки (авария с разбрызгиванием), либо в виде огарка упасть на столешницу (авария без разбрызгивания).
В качестве ёмкости, куда засевают материал, могут использоваться пробирка или чашка Петри. В случае пробирки удобнее всего её взять вместе с пробиркой с материалом. Тогда можно открыть их одновременно, что значительно сократит время пребыва-
1Предварительный обжиг петли осуществляется последовательным внесением в пламя горелки (3–4 раза) всей длины петли для прогрева с последующим медленным прокаливанием докрасна. При этом проверяется целостность кольца петли. При заборе материала петлю остужают о внутреннюю стенку ёмкости, из которой осуществляют забор.
2Особенно ловкие специалисты предпочитают захватывать пробирку большим пальцем, безымянным и мизинцем, чтобы указательным и средним обхватывать пробку для её извлечения.
371

Рис. 30.2. Расположение пробирки и чашки Петри в руке (верхний ряд) и техника посева культуры (нижний ряд; движения петли обозначены синим). Посев осуществляется в жидкий (b) и полужидкий (а, с) агар, а также на чашки (во всех случаях, кроме нижнего правого, действия выполняются без обжига петли; на верхней правой чашке – посев «площадкой»)
ния материала на петле вне ёмкостей и, следовательно, снизит риск аварий. Материал вносится либо проколом в толщу агара (для этого можно использовать иглу 1 ), либо на поверхность скошенной части агара («косяка»), не касаясь стекла пробирки. В случае жидкого агара (бульона), культуру вносят на стенку пробирки у самой кромки бульона и аккуратными круговыми движениями смывают в бульон. Удобнее всего держать пробирку под углом 45° к поверхности, над которой осуществляют работу (Рис. 30.2).
1 Некоторые специалисты заранее загибают кончик петли под 90°.
372

В случае чашки Петри её под- |
|
|
|
сушивают (чтобы избежать кон- |
|
|
|
денсата1), после чего располагают |
|
|
|
на ладони левой руки, придержи- |
|
|
|
вая крышку большим и указа- |
|
|
|
тельным пальцами (Рис. 30.2). |
|
|
|
Для посева материала крышка |
|
|
|
немного приоткрывается (можно |
|
|
|
зафиксировать крышку и при- |
|
|
|
опустить дно чашки), чтобы обра- |
|
|
|
зовавшаяся щель была достаточ- |
|
|
|
Рис. 30.3. Пример агрессивного |
|||
ной для свободного прохода пет- |
|||
ли, которая не должна касаться |
посева на плохо просушенный агар, |
||
при котором изолированная колония |
|||
краёв чашки (касание является |
|||
«расползается» по прорези на агаре, |
|||
|
|||
аварией без разбрызгивания). Во |
оставленной петлёй |
||
время посева петля плавно скользит по поверхности агара, без нажима, не царапая его поверхности
и не касаясь бортов чашки (Рис. 30.3). Важно разнести материал по поверхности агара таким образом, чтобы получились так называемые изолированные колонии – визуально круглые скопления бактерий, произошедшие из одной бактериальной клетки. Если материал вносится пипеткой, то удобнее положить чашку на салфетку и, приоткрыв её, аккуратно внести материал, чтобы не было брызг (брызги являются аварией с разбрызгиванием). Далее внесённый материал разносится по поверхности агара петлёй или шпателем (так называемый «сплошной газон»)2.
Пунктат из бубона вносят на поверхность агара петлёй или пипеткой, после чего рассеивается штрихами петлёй или растирается шпателем. Дополнительно 0,1 мл материала вносят в пробирку с
1Если на крыше уже имеется конденсат, то её аккуратно меняют на сухую. Относительно действий в том случае, когда конденсат образовался уже после инкубации, существуют различные мнения. Наиболее целесообразным видится положить такую чашку (дном вверх) на салфетку, обильно смоченную раствором дезинфектанта, а рядом расположить чистую чашку в таком же положении. Далее аккуратно поменять местами дно чашки, чтобы над крышкой с конденсатом оказалось дно чистой чашки, после чего чашку следует аккуратно поместить в контейнер с раствором дезинфектанта.
2Ряд специалистов предпочитает «раскатывать» каплю по чашке путём её аккуратного покачивания, но данный способ требует определённой сноровки.
373

бульоном, а остатки материала используют для заражения лабораторных животных (об этом далее). Если материала доставлено недостаточно, то его следует развести в 0,3–0,5 мл бульона.
Материал из вскрывшегося бубона (язвы, карбункула) засевают на агар с генцианвиолетом1 и сульфитом натрия или лизированной кровью.
Слизистое отделяемое ротовой полости и зева зондом (тупфером) засевают на агар с генцианвиолетом, а затем помещают в пробирку с 2 мл бульона Хоттингера, Мартена или LB с добавлением генцианвиолета, тщательно отжимая о её стенки. Далее полученной взвесью заражают биопробных животных.
Мокрота, которая может быть с примесями крови, вносится на поверхность агара петлёй (2–3 раза) или пипеткой (10 мкл), после чего рассеивается штрихами петлёй или растирается шпателем. Остатки материала на петле или шпателе без обжига (!) переносят на второй и третий агар. Если мокрота вязкая, то её комочек стерильным пинцетом 2 или большой петлёй переносят на поверхность агара, после чего рассеивают штрихами петлёй или растирают шпателем, перенося остатки материала (без обжига) на второй агар.
Кровь в виде сгустка осторожно переносят на чашку, где стерильными иглами нарушают его целостность, максимально высвобождая жидкую кровь от фибрина. Затем 0,1 мл крови вносят на поверхность агара, растирая шпателем, а также вносят в пробирку с бульоном. Остатки крови используют для заражения биопробных животных.
Фрагменты органов гомогенизируют с добавлением физиологического раствора. Возможно растирание в ступке со стерильным песком с добавлением до 2 мл физиологического раствора. Допускается для одной суспензии объединять органы не более чем от
1В концентрации 1 : 100000; рекомендуется также засеивать агар без генцианвиолета, чтобы избежать вероятности потери культуры.
2Поскольку пинцет, как и любой металлический инструментарий, невозможно прокалить докрасна, его рабочую часть (концы) опускают в 95%-ный раствор этилового спирта и обжигают в пламени горелки (спирт держат на расстоянии во избежание воспламенения), после чего дают остыть.
374

10 мелких животных и от 5 крупных. В случае птиц, домашних и сельскохозяйственных животных, а также человека допускается объединять только фрагменты одного органа (например. фрагменты левого и правого лёгких). Одну каплю полученной суспензии (гомогенизата) вносят петлёй на поверхность агара и рассеивают частыми штрихами. Если исследуются органы верблюда, то суспензия от каждого органа высевается на отдельную чашку с добавлением 100 мкг/мл фосфомицина.
Параллельно с этим при патологоанатомическом вскрытии целесообразно производить посев отпечатками органов. Для этого предварительно обожжёнными (и остуженными) ножницами отрезают фрагмент органа, после чего пинцетом (также предварительно обожжённым и остуженным) берут отрезанный фрагмент и прислоняют его несколько раз отрезанной поверхностью (отпечатывают) к поверхности агара. Допускается на одной чашке делать отпечатки нескольких органов, а также сеять материал от двух животных (при этом чашка делится на сектора и каждый сектор подписывается).
Эктопаразитов (кроме блох), счёсанных с носителей, а также собранных в их норах и жилищах людей, промывают один раз 95%- ным раствором этилового спирта, дважды – физиологическим раствором и гомогенизируют с добавлением физиологического раствора. Возможно растирание в ступке. Одну каплю полученной суспензии (гомогенизата) вносят петлёй на поверхность агара и рассеивают частыми штрихами. В один пул берутся эктопаразиты, сгруппированные по виду, месту и объекту сбора, упитанности и фазе развития. Клещей в один пул берут голодных не более 30 самок и 50 нимф, напившихся – не более 3 самок, 15 нимф и 30 личинок. Перед гомогенизацией самок целесообразно разрезать ножницами (предварительно обожжёнными и остуженными), а при растирании в ступке – прикрыть её крышкой от чашки, чтобы избежать аварии с разбрызгиванием. Вшей берут в один пул до 50 экземпляров.
Блох перед гомогенизацией не промывают, но усыпляют эфиром и гомогенизируют1 с добавлением физиологического раствора.
1 Иногда аккуратно пинцетом извлекают пищевод и исследуют его.
375

Одну каплю надосадочной жидкости вносят петлёй на поверхность агара и рассеивают частыми штрихами. В один пул берутся блохи с одного животного или одной норы (жилища), но не более 20– 30 насекомых одного вида. При их обилии допускается брать в один пул до 50 блох. Собранные с трупов или больных животных (имеющих патологоанатомические изменения) блохи исследуются индивидуально.
Почву нор, погадки птиц и остатки пищи в количестве 50–100 г гомогенизируют с физиологическим раствором до получения 15– 20 мл суспензии, которую аккуратно перемешивают 5–10 минут и отстаивают 3–5 минут. Отбирают надосадочную жидкость, фильтруют или центрифугируют (2–3 минуты при 5000 об/мин). Отбирают супернатант, снова центрифугируют (15 минут при 12000 об/мин) и осадок суспендируют в физиологическом растворе. Одну каплю полученной суспензии вносят петлёй на поверхность агара и рассеивают частыми штрихами.
Воду центрифугируют (15 минут при 9000 об/мин) и полученный осадок суспендируют в физиологическом растворе. Одну каплю полученной суспензии вносят петлёй на поверхность агара и рассеивают частыми штрихами (рекомендуется осуществлять посев на агар с сердечно-мозговым экстрактом на случай присутствия некультивируемых форм, о чём подробнее скажем далее). Если вода включала примеси (например, ил), то её следует предварительно профильтровать (размер пор фильтра не менее 0,45 нм).
Все посевы (чашки Петри вверх дном) помещают в термостат. Оптимальной температурой для инкубирования (т. е. выращивания) является 28°С, поскольку, если инкубировать при привычных 37°С, колонии образуются вязкие, и их труднее снимать с агара (Рис. 30.4), что, как мы помним, помогло Александру Йерсену получить чистую культуру1. Однако в ряде случаев, о которых погово-
1 Морфологический анализ показывает, что коллекционные штаммы, выращенные при 28°С, характеризуются наличием однородных по морфологии клеток (вариация линейных размеров менее 10%) с шероховатостью 25 ± 5 нм, что обусловлено длительным хранением и многочисленным пассивированием. При повышении температуры до 30°С объём клеток таких штаммов увеличивается в среднем в 1,7 раза (шероховатость увеличивается на 5 нм за счёт синтеза капсулы и увеличения плотности липополисахарида), а при снижении до 4°С – уменьшается в 2,1 раза
376

рим далее, инкубируют и при |
|
37°С 1 . Вынимают засеянные |
|
чашки из термостата в положе- |
|
нии, параллельном поверхности |
|
стола (пола). Переворачивать их |
|
не рекомендуется из-за опасно- |
|
сти возможного вытекания кон- |
|
денсационной воды. Если её |
|
много, крышку помещают в |
|
контейнер с раствором дезин- |
|
фектанта, аккуратно заменив на |
Рис. 30.4. Культура чумного микроба, |
новую. |
тянущаяся за палочкой |
Морфология колоний чумного микроба несколько различается в зависимости от питательной среды (Рис. 30.5), но по мере инкубации все они проходят общие стадии. Если просматривать культуры под микроскопом, то через 8–12 часов можно наблюдать прозрачные микроколонии, называемые «битое стекло» (Рис. 30.6-а), а к 18– 24 часам – в виде плоских фестончатых образований, называемых «кружевные платочки» (Рис. 30.6-b). В косопроходящем пучке света колонии чумного микроба имеют песочный оттенок, шероховатые, с неровными краями (Рис. 30.7). Следует отметить, что изолированная колония – это уже сформировавшийся биологический организм, в котором клетки разделяются на доминирующий и субдоминирующий кластеры, поэтому при пересеве они способны вос-
(формируются клетки коккоподобной формы с шероховатостью 20 ± 5 нм). Природные штаммы, напротив, характеризуются гетерогенностью популяции на клеточном уровне (вариации более 10%), что повышает выживаемость. Наряду с типичными присутствуют более вытянутые клетки (шероховатость 22 ± 5 нм). В то же время закономерности изменения морфологии клеток совпадают: при повышении температуры до 30°С объём клеток таких штаммов увеличивается в среднем в 1,9 раза (шероховатость увеличивается до 48 ± 11 нм), а при снижении до 4°С – увеличивается в 1,9 раза (формируются уплотнённые клетки с шероховатостью 18 ± 3 нм), что, вероятно, обусловлено присутствием более вытянутых клеток.
1 Следует помнить, что для получения культуры, богатой капсульным антигеном (фракцией I), необходимо не только инкубировать посевы при 37°С, но и использовать богатые питательные среды, такие как LB-агар или агар Хоттингера, обогащённый питательными компонентами (например, средой 199 из расчёта 3 мл добавки на 100 мл питательной среды).
377

Рис. 30.5. Колонии Y. pestis, выращенные на SBA-агаре (а),
агаре МакКонки (b – через 48 часов, с – через 72 часа), шоколадном агаре (d), а также селективных SIN-агаре (е) и HEK-агаре (f)
производить свою уникальную архитектонику. Такое «разделение ролей» и приводит к образованию уникальных форм, видимых при незначительном увеличении. Обратите внимание, как визуально похожие на чашках колонии разных представителей семейства Yersinia уникальны в косопроходящем пучке света, хотя иногда эта уникальность заметна только специалисту с большим опытом (Рис. 30.6 – 30.8)! Именно поэтому на практике не полагаются только на визуальные методы, но об этом позже.
К 48 часу чумной микроб формирует типичные, диаметром до 2 мм, жёлто-коричневые колонии R-типа с выпуклым более тёмным мелкозернистым центром и плоским волнистым фестончатым краем. Именно их пересевают на чашки для дифференциальной диагностики и в пробирки со скошенным агаром для подтверждения чистоты культуры, её накопления и хранения. По мере старения, к 72 часу, центр колоний становится более грубым, непрозрачным, приобретает серовато-коричневый оттенок (Рис. 30.9). На скошенном агаре чумной микроб растёт в виде сочного сероватобелого налёта (Рис. 30.10).
378
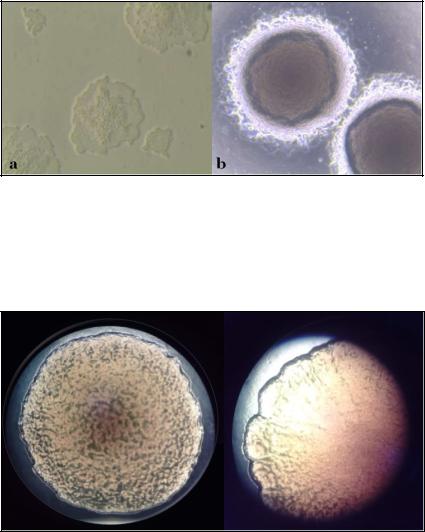
Рис. 30.6. Колонии чумного микроба стадии «битое стекло»
(а; ув.100х, агар МакКонки) и «кружевные платочки» (b; ув. 20х, МакКонки). Александр Йерсен писал, что «их края при рассмотрении кажутся радужными», а Китасато Сибасабуро видел их голубоватыми.
Рис. 30.7. Колония чумного микроба в косопроходящем пучке света
379
