
- •Анаэробное дыхание – без участия кислорода.
- •Аэробное дыхание – участвует кислород. По типу дыхания бактерии делят на 3 группы:
- •Рост большинства аэробных бактерий прекращается при концентрации кислорода в 40-50 % и выше, в то же время в атмосфере чистого кислорода не способны развиваться никакие прокариоты.
- •Основные особенности бактерий, способных к анаэробному дыханию:
- •Физические
- •Химические
- •Биологические
- •Какие условия необходимы:
- •Изучаемые свойства:
- •Схемы выделения чистых культур:
Химические
Метод Аристовского Материал, исследуемый на наличие анаэробов, засевают на среду в чашки Петри и помещают их в эксикатор, на дно которого кладут химический поглотитель кислорода: гидросульфит натрия или пирогаллол. В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор помещают в термостат при температуре 37 °С на 24-48 часов.
Эксикатор, на котором помещается один из поглотителей кислорода, например пирогалол. Крышка плотно притерта.
Пробирка Бюхнера с шаровидным расширением и шейкой внизу, куда также помещается поглотитель О2, а над шейкой устанавливается косячок с посевом. Пробка резиновая.
Биологические
В почве, воде, человеческом и животном организме анаэробы постоянно встречаются с аэробами. При этом аэробы, поглощая необходимый для их жизни кислород, создают условия, благоприятствующие развитию анаэробных микроорганизмов. Тот же принцип лежит в основе биологических методов культивирования анаэробов в лабораторной обстановке. Для этого используют метод Фортнера. В чашку Петри наливают толстым слоем питательный агар. Когда агар застынет посредине чашки стерильным скальпелем вырезают бороздку шириной 1-1,5 см. Затем одну половину среды засевают культурой аэроба, а другую - анаэробной культурой. Щель между дном и крышкой чашки промазывают вакуумной смазкой или заливают парафином. Затем чашку помещают в термостат. Быстрорастущие аэробы поглощают находящийся в чашке кислород и создают тем самым благоприятные условия для роста анаэробов.
Протеолитическая активность аэробов и анаэробов
Протеолитическая активность микробов направлена на расщепление белков до промежуточных (пептоны, полипептиды, аминокислоты) или конечных (сероводород, индол, аммиак) продуктов. Действие протеолитических ферментов изучают на средах с желатином, молоком, сывороткой, пептоном.
Методики:
Для определения способности МКО ферментировать углеводы (сахаролитические свойства) используют короткий и длинный «пестрый» ряд. К первому относятся жидкие питательные среды Гисса с моно- и дисахаридами: глюкозой, лактозой, мальтозой и с 6-атомным спиртом - маннитом. В длинный пестрый ряд наряду с этими углеводами вводят среды с разнообразными моносахаридами (арабиноза, ксилоза), полисах. (инулин, крахмал) и спиртами (глицерин, инозит). В качестве индикатора ко всем средам добавляют индикатор – реактив Андреде или ВР. Чистую культуру засевают петлей в среды «пестрого» ряда. Инкубируют при темп. 37 град. в течении 18-24 ч. Если бактерии ферментируют углеводы до образования кислых прод., наблюдается изменение цвета среды; при разложении до кислоты и газа помимо изменения цвета появляется пузырек газа в поплавке. Если используются среды с полужидким агаром, то образование газа регистрируется по разрыву столбика. Т.к бактерии ферментируют не все, а только определенные для каждого вида углеводы, входящие в состав среды Гисса, наблюдается довольно пестрая картина, отсюда и название. Для определения протеолитических ферментов производят посев культуры бактерий уколом в столбик 10-20% желатина, пептонную воду. Посевы в желатине инкубируют при температуре 20-22 град. в теч. нескольких дней. При наличии протеолитич. ферментов бактерии разжижают желатин, образую фигуру, напоминающую воронку или елочку.
Реакция на аммиак. Узкую полоску лакмусовой бумаги укрепляют под пробкой так, чтобы она не соприкасалась с питат. средой. Посинение бумаги свидет. об образовании аммиака.
Реакция на индол. Способ Эрлиха: в пробирку с культурой бактерий прибавляют 2-3 мл эфира, содержимое перемешивают и добаляют несколько капель реактива Эрлиха (спиртовой раствор парадиметиламидобензальегида с хлороводородной кислотой). В присутствии индола наблюдается розовое окрашивание, при осторожном наслаивании образуетсяся розовое кольцо.
Реакция на сероводород. Делают посев культуры бакт. уколом в столбик с питательной средой, содержащей реактивы для выявления сероводорода (смесь солей: сульфат железа, тиосульфат натрия, сульфат натрия). При наличии сероводорода происходи почернение агара.
Обнаружение каталазы. На предметное стекло наносят каплю 1-2% р-ра пероксида водорода и вносят в нее петлю с бактеиальной культурой. Каталаза разлагает перекись на кислород и воду. Выделение пузырьков кислорода свидететельствует о наличии каталазы.
Тест на растворение свертка казеина. Культуру засевают на обезжиренное молоко. Культура расщепляет молочный сахар (лактозу) и за счет закисления среды наблюдается свертывание молочного белка (казеина). При выделении протеолитических ферментов казеин постепенно растворяется – пептонизируется, в результате чего молоко просветляется и приобретает легкий кремовый оттенок, а на дне пробирки формируется осадок.
Тест на свернутой кровяной сыворотке. Культуру исследуемых аэробных микробов засевают на чашки, анаэробных — уколом в столбик свернутой лошадиной сыворотки, инкубируют в термостате при 37 °С. Штаммы, продуцирующие протеолитические ферменты, разжижая питательную среду, образуют углубления вокруг колоний или на поверхности столбика среды.
Рост и размножение бактерий.
Рост бактерий - это упорядоченное увеличение количества и размеров всех компонентов клетки при условии наличия всех необходимых химических элементов, что приводит к увеличению ее массы. Питательные субстраты должны содержать эти элементы в метаболически доступной форме.Рост клетки не беспределен. После достижения критических размеров клетка подвергается делению или размножению.
Большинство бактерий делится поперечным бинарным делением или цитокинезом. У большинства грамположительных бактерий деление происходит путем синтеза поперечной перегородки, идущей от периферии к центру.
Клетки большинства грамотрицательных бактерий делятся путем перетяжки.
Процесс деления повторяется через приблизительно равные промежутки времени (от нескольких минут до нескольких суток), что является индивидуальной генетической характеристикой микробного вида. В результате размножения резко увеличивается количество клеток в популяции.
Размножение характеризуется временем генерации (интервал времени, за который число клеток удваивается) и таким понятием, как концентрация бактерий (число клеток в 1 мл).
При внесении бактерий в питательную среду они растут и размножаются до тех пор, пока содержание какого-нибудь из необходимых компонентов среды не достигнет минимума, после чего рост и размножение прекращаются.
Если на протяжении всего этого времени не прибавлять питательных веществ и не удалять конечных продуктов обмена, то получаем статическую бактериальную культуру, которая ведет себя как многоклеточный организм, с генетическим ограничением роста.
Кривая роста бактерий в питательной среде. На этой кривой можно различить несколько фаз, сменяющих друг друга в определенной последовательности
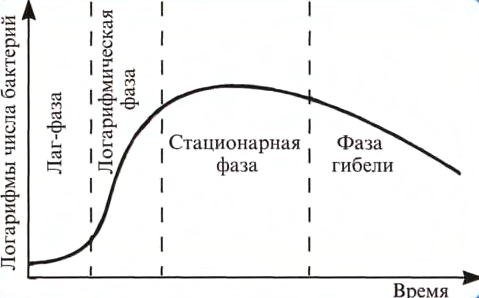
1. Начальная — лаг-фаза. Охватывает промежуток времени между посевом бактерий и началом размножения. Ее продолжительность составляет в среднем 2—5 ч и зависит от состава питательной среды, от возраста засеваемой культуры. Во время лаг-фазы происходит адаптация бактериальных клеток к новым условиям культивирования, идет синтез индуцибельных ферментов рибосом.
2. Экспоненциальная (логарифмическая) фаза. Характеризуется постоянной максимальной скоростью деления клеток, фаза геометрического роста с резким ростом численности популяции микроорганизмов (2 в степеии). Скорость размножения зависит от вида бактерий и питательной среды. Время удвоения клеток называется временем генерации, которое варьирует от вида бактериальной культуры. Бактериальная культура в этой фазе состоит из стандартных клеток.
3. Стационарная фаза(фаза равновесия размножения и гибели микробных клеток). Наступает тогда, когда число клеток перестает увеличиваться. Так как скорость роста зависит от концентрации питательных веществ, то при уменьшении содержания последних в питательной среде уменьшается и скорость роста. Снижение скорости роста происходит также из-за большой плотности бактериальных клеток, снижения парциального давления кислорода, накопления токсических продуктов обмена. Продолжительность стационарной фазы составляет несколько часов и зависит от вида бактерий и особенностей их культивирования.
4. Фаза отмирания или гибели - уменьшение численности популяции в связи с уменьшением и отсутствием условий для размножения микроорганизмов. Наступает вследствие накопления кислых продуктов обмена или в результате аутолиза под влиянием собственных ферментов. Продолжительность этой фазы колеблется от десятка часов до нескольких недель.
Данная динамика характерна для периодических культур с постепенным истощением запаса питательных веществ и накоплением метаболитов. Постоянное нахождение бактериальной популяции в логарифмической фазе роста наблюдается в непрерывной культуре, что достигается постепенным дозированием поступления питательных веществ, контролем плотности бактериальной суспензии и удалением метаболитов. Такой процесс выращивания микроорганизмов называется проточным культивированием (непрерывная культура). Рост в непрерывной культуре позволяет получать большие массы бактерий при проточном культивировании в специальных устройствах (хемостатах и турбидистатах) и используется при производстве вакцин, а также в биотехнологии для получения различных биологически активных веществ, продуцируемых микроорганизмами.
Основные принципы культивирования бактерий.
Универсальным инструментом для производства посевов является бактериальная петля. Кроме нее, для посева уколом применяют специальную бактериальную иглу, а для посевов на чашках Петри — металлические или стеклянные шпатели. Для посевов жидких материалов наряду с петлей используют пастеровские и градуированные пипетки. Первые предварительно изготовляют из стерильных легкоплавких стеклянных трубочек, которые вытягивают на пламени в виде капилляров. Конец капилляра сразу же запаивают для сохранения стерильности. У пастеровских и градуированных пипеток широкий конец закрывают ватой, после чего их помещают в специальные пеналы или обертывают бумагой и стерилизуют.

Методика посева петлёй на скошенный агар:
При пересеве бактериальной культуры берут пробирку в левую руку, а правой, обхватив ватную пробку IV и V пальцами, вынимают ее, пронося над пламенем горелки. Удерживая другими пальцами той же руки петлю, набирают ею посевной материал, после чего закрывают пробирку пробкой. Затем в пробирку со скошенным агаром вносят петлю с посевным материалом, опуская ее до конденсата в нижней части среды, и зигзагообразным движением распределяют материал по скошенной поверхности агара. Вынув петлю, обжигают край пробирки и закрывают ее пробкой. Петлю стерилизуют в пламени горелки и ставят в штатив. Пробирки с посевами подписывают, указывая дату посева и характер посевного материала (номер исследования или название культуры).

Посев «газоном» шпателем:
Производят шпателем на питательный агар в чашке Петри. Для этого, приоткрыв левой рукой крышку, петлей или пипеткой наносят посевной материал на поверхность питательного агара. Затем проводят шпатель через пламя горелки, остужают его о внутреннюю сторону крышки и растирают материал по всей поверхности среды. После инкубации посева появляется равномерный сплошной рост бактерий.
Для того чтобы культура микроорганизмов могла нормально расти, размножаться и осуществлять биосинтез какого-либо вещества, необходимы благоприятные условия окружающей среды. При неблагоприятных условиях изменяются свойства микроорганизмов, подавляется их жизнедеятельность или происходит гибель. При неблагоприятных условиях изменяются свойства микроорганизмов, подавляется их жизнедеятельность или происходит гибель.
