
- •Ответы Ферменты Общие сведенья
- •Свойства витаминов
- •Ферментопатии
- •Класификация
- •Строение ферментов
- •Изоферменты
- •Специфичность
- •Кинетика ферментативных реакций
- •Механизм действия ферментов
- •Энергетический барьер реакции и энергия активации
- •Влияние активаторов и ингибиторов на скорость ферментативных реакций
- •Углеводы анаэробное окисление глюкозы
- •Аэробное окисление глюкозы
- •Гормональная регуляция глюкозы
- •Челночные механизмы
- •Глицеролфосфатный челночный механизм:
- •Малат-аспартатный челночный механизм
- •Глюконеогенез общие сведенья
- •Глюконеогенез
- •Цикл Кори (Глюкозо-Лактатный цикл)
- •Глюкозо-аланиновый цикл
- •Пентозофосфатный путь
- •Агликогенозы
- •Метаболизм Понятие о метаболизме
- •Окислительное декарбоксилирование пирувата
- •Регуляция пируватдегидрогеназного комплекса
- •Цикл трикарбоновых кислот (цикл Кребса, лимоннокислый цикл).
- •Последовательность реакций цитратного цикла:
- •Пути утилизации энергии в организме
- •Механизмы синтеза атф
- •Биологическое окисление
- •Пиридиновые дегидрогеназы
- •2. Флавиновые дегидрогеназы
- •3. СоQ или убихинон;
- •4. Цитохромная система
- •5. Железо-серные белки (железо-серные комплексы)
- •Структурно-функциональная организация компонентов дыхательной цепи в митохондриях
- •Механизм окислительного фосфорилирования и дыхательной цепи
- •Роль о2
- •Окислительное фосфорилирование и его теория.
- •Разобщение окисления и фосфорилирования
- •Ингибирование ферментов дыхательной цепи
- •Липиды Липиды в крации
- •Переваривание липидов
- •Ресинтез таг
- •Ресинтез фосфолипидов
- •Нарушение синтезу фосфоліпідів та його можливі наслідки.
- •Дисфункция клеточных мембран:
- •Воспалительные процессы:
- •Заболевания печени:
- •Катаболизм таг
- •Гормональная регуляция таг
- •Липотропные факторы
- •Окисление жирных кислот (β-окисление)
- •Расчет энергии бета-окисления
- •Глицерол и его энергия
- •Кетогенез
- •Синтез жк
- •Синтеза жирных кислот
- •Холестерин: строение и биороль
- •Синтез холестерола
- •Регуляция синтеза холестерина
- •Липопротеиды
Энергетический барьер реакции и энергия активации
Как известно, в химическую реакцию могут вступить лишь те молекулы, которые имеют определенный запас энергии. Уровень энергии молекул, необходимый для протекания данной химической реакции, называется энергетическим барьером Та избыточная энергия, которая необходима для перевода всех молекул одного моля вещества в активированное состояние для достижения или превышения энергетического барьера при обычной температуре, называется энергией активации Энергия активации зависит от природы реагирующих веществ, их внутреннего строения. Источником энергии активации служит тепловое движение молекул. При участии фермента реакция осуществляется в обход энергетического барьера.

Рівняння швидкості ферментативної реакції
Уравнение Михаэлиса-Ментен – основное уравнение ферментативной кинетики, описывает зависимость скорости катализируемой реакции ферментом, от концентрации субстрата и фермент/

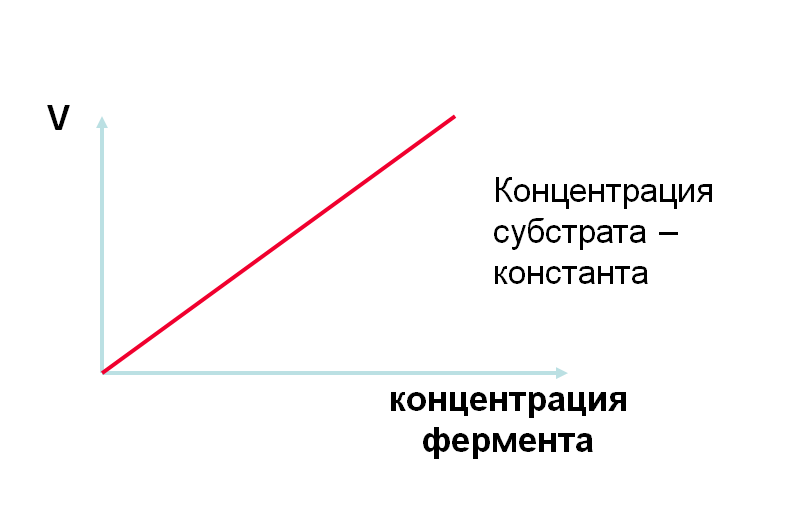
Зависимость скорости реакции от концентрации фермента
В подавляющем большинстве случаев в начальный период реакции, при условии избытка фермента и небольшого количества продукта скорость реакции (V) прямо пропорциональна его концентрации и носит линейный характер. Но со временем количество продукта растет и появляется возможность для протекания обратной реакции, вследствие чего линейная зависимость теряется.
Зависимость скорости реакции от концентрации субстрата

Vmax – это такая V ферментативной реакции, при которой достигается полное насыщение фермента субстратом, т.е. когда все активные центры фермента связаны с субстратом.
KM – константа Михаэлиса:
1) KM численно равна концентрации субстрата, при которой скорость реакции равна ½ Vmax.
2) KM показывает сродство E к S. Чем меньше KM, тем больше сродство и наоборот.
Зависимость от температуры.
Зависимость активности ферментов (скорости реакции) от температуры описывается колоколообразной кривой с максимумом скорости при значениях оптимальной температуры для данного фермента. В пределах до 55-60°С, работает закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С.

Зависимость от рН.
График зависимости от рН имеет колоколообразную форму. Значение рН, при котором активность фермента максимальна, называется рН-оптимумом фермента. Значения рН-оптимума для различных ферментов колеблются в широких пределах.
-
Фермент
рН-оптимум
Пепсин
1,5
Фосфатаза
5,8
Уреаза
6,7
Трипсин
7,7
Каталаза
7,6
Аргиназа
9,7

Влияние активаторов и ингибиторов на скорость ферментативных реакций
Ингибиторы – это вещества полностью или частично подавляющие активность ферментов. Контролируют ферментальную активность для лечения болезней.
Лечение болезней: Ингибиторы широко используются для лечения заболеваний, таких как ингибиторы протеаз для лечения ВИЧ, антикоагулянты для профилактики тромбоза.
Типы ингибиторов |
|||
СПЕЦИФИЧЕСКОЕ -- связано с механизмами ферментативного катализа |
НЕСПЕЦИФИЧЕСКОЕ -- денатурация белка |
||
НЕОБРАТИМОЕ -- вещества, связывающие функциональные группы активного центра, например цианиды |
ОБРАТИМОЕ
|
||
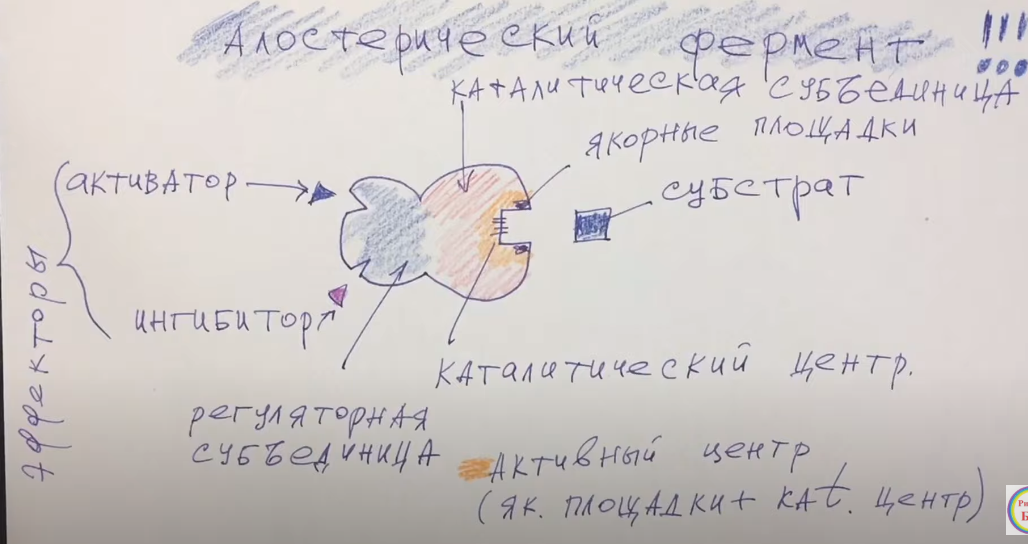
Регуляция активности ферментов. Алостерическая.
Алостерическая регуляция возможна у алостерических ферментов (пример на картинке)
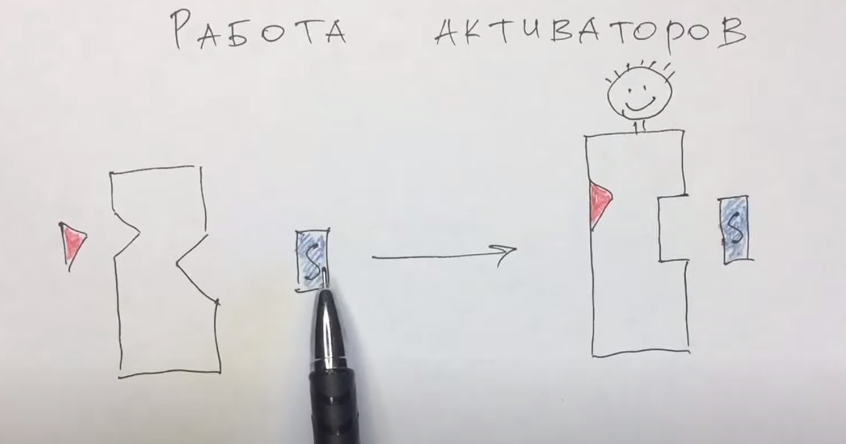
Активатор
так меняет комформацию, что субстрат
может присоединиться к ферменту, который
по природе не должен бы этого делать. У
ингибиторов наоборот.

Регуляция активности ферментов. Ретроторможение.
Ретроторможение
= принцип отрицательной обратной связи.
Есть какой-то путь синтеза продукта в
клетке. Если продукта много, клетка
тормозит синтез, если мало активирует
его.

Регуляция активности ферментов. Ковалентная (химическая) модификация
Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы.
Регуляция активности ферментов. Аденилатциклазная система
Аденилатциклаза (АЦ) Гликопротеин с массой от 120 до 150 кДа, имеет 8 изоформ, ключевой фермент аденилатциклазной системы, с Mg2+ катализирует образование вторичного посредника цАМФ из АТФ. АЦ содержит 2 –SH группы, одна для взаимодействия с G-белком, другая для катализа. АЦ содержит несколько аллостерических центров: для Mg2+, Mn 2+ , Ca2+ , аденозина и форсколина. Есть во всех клетках, располагается на внутренней стороне клеточной мембраны. Активность АЦ контролируется: 1) внеклеточными регуляторами - гормонами, эйкозаноидами, биогенными аминами через G-белки; 2) внутриклеточным регулятором Са2+ (4 Са2+ -зависимые изоформы АЦ активируются Са2+).
Аденилатциклазная
система: рецептор
серпантинного типа, образующий 7 завитков,
пронзающих мембрану, G-белок с 3
субъединицами (альфа (связанна с ГДФ),
бета, гамма) и АЦ (фермент)
ФДЭ (фосфодиэстераза ) ингибирует цАМФ, превращая ее в АМФ, а значит про (а) ПК-А можно забыть
